Презентация образование ДС.pptx
- Количество слайдов: 29

ОБРАЗОВАНИЕ ЛИОФИЛЬНЫХ И ЛИОФОБНЫХ ДИСПЕРСНЫХ СИСТЕМ Диспергационные методы измельчение крупных образцов вещества до частиц дисперсных размеров; появление новой фазы происходит при пересыщении среды; химический состав и агрегатное состояние вещества не меняется; затрачивается внешняя работа. Конденсационные методы основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют затраты внешней работы; появление новой фазы происходит при пересыщении среды. 1

Макс Фольмер (Max Volmer) (1885 -1965)

Прирост энтропии при образовании ДС при диспергировании - количество частиц ДФ - моль частиц ДФ N 2 - моль растворителя В реальной ДС N 1/N 2 « 1 Тогда ln(l + N 1/N 2) ≈ N 1/N 2 где k=R/ NA (константа Больцмана)

Общее изменение свободной энергии при образовании ДС в процессе диспергирования Для несферических частиц α - коэффициент формы Зависимость ∆G от размера частиц при малых значениях σ d – линейный размер частицы в случае несферичности
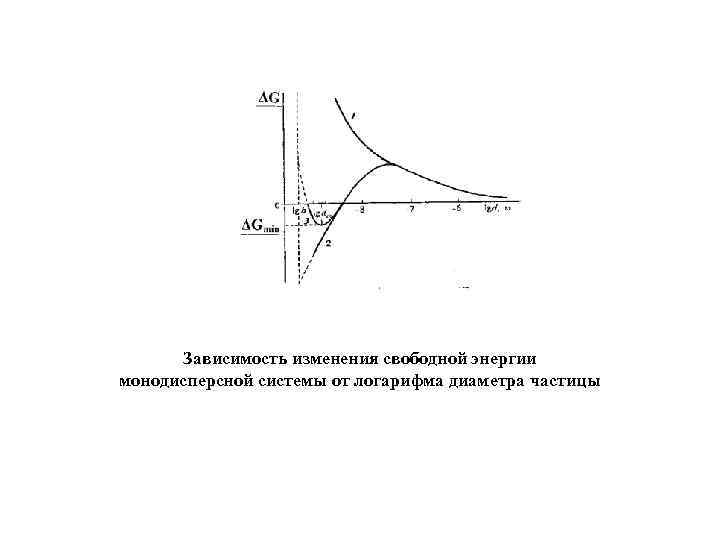
Зависимость изменения свободной энергии монодисперсной системы от логарифма диаметра частицы

При постоянном составе фаз условие термодинамической выгодности образования ДС из макрофазы имеет вид: 4πr 2σ < βk. T Критерий самопроизвольного образования лиофильной коллоидной системы из макрофазы (Ребиндера –Щукина)

Мицеллообразование в растворах ПАВ
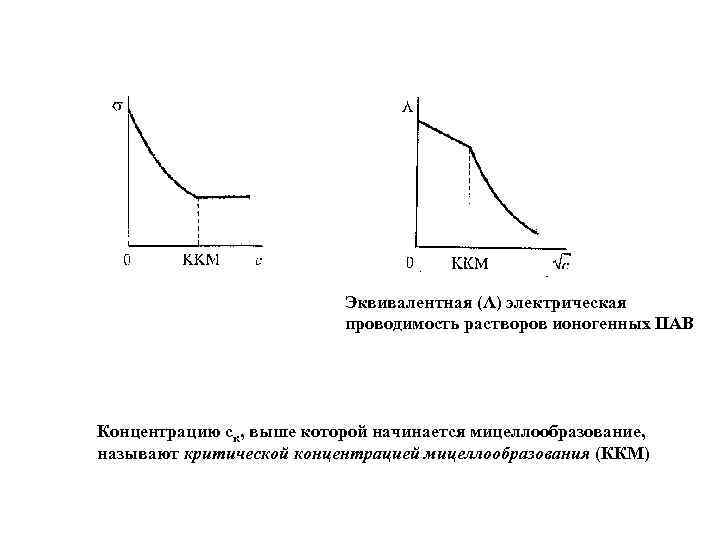
Эквивалентная (Λ) электрическая проводимость растворов ионогенных ПАВ Концентрацию ск, выше которой начинается мицеллообразование, называют критической концентрацией мицеллообразования (ККМ)
![m[ПАВ]⇆ (ПАВm) смиц = Kмицсmм Kмиц - константа равновесия процесса мицеллообразования m[ПАВ]⇆ (ПАВm) смиц = Kмицсmм Kмиц - константа равновесия процесса мицеллообразования](https://present5.com/presentation/1/99634156_430817127.pdf-img/99634156_430817127.pdf-9.jpg)
m[ПАВ]⇆ (ПАВm) смиц = Kмицсmм Kмиц - константа равновесия процесса мицеллообразования

Мицеллообразование может происходить только выше некоторой температуры Тк, называемой точкой Крафта

Полиморфизм мицелл

СОЛЮБИЛИЗАЦИЯ Солюбилизация - способность мицеллярных дисперсий ПАВ растворять вещества, нерастворимые в дисперсионной среде данной мицеллярной системы. Схематическое изображение локализации молекул солюбилизата s = Nсол /Nмиц величина относительной солюбилизации Nсол - число молей солюбилизированного вещества Nмиц - число молей ПАВ, находящегося в мицеллярном состоянии

Зависимость относительной солюбилизации октана (1) и циклогексана (2) от концентрации олеата калия выше ККМ

Практическая значимость солюбилизации 1. Солюбилизация лежит в основе нового направления химической кинетики - мицеллярного катализа. 2. Солюбилизация мономеров в мицеллах ПАВ-эмульгаторов позволяет синтезировать коллоидные дисперсии полимеров – латексы (эмульсионная полимеризация). 3. Солюбилизация жировых загрязнений - один из факторов моющего действия мыл. 4. В мицеллах синтезируют наночастицы различных материалов. 5. Солюбилизация жиров - один из этапов сложного процесса ассимиляции их в водной среде организма человека и животных.

МИКРОЭМУЛЬСИИ

Конденсационное образование лиофобных дисперсных систем (конденсация пересыщенного пара, кристаллизация из раствора или из расплава) Термодинамические основы гомогенного образования (по Гиббсу-Фольмеру) Зародыш сферической формы из одного компонента, молярный объем - Vm 4πr 2 → 4πr 2 σ μст - μн → 4/3πr 3 (μст - μн)/Vm Работа образования зародыша новой фазы Размер частицы rс (критический зародыш новой фазы), можно найти из условия равенства нулю производной по радиусу d. W(r)/dr = 0 (1)

(2) Исключим μст – μн, используя соотношение (1): Wc = 1/3σsc sc - поверхность критического зародыша Аналогично, исключая σ из уравнения (2): Wc = 1/2 (μст - μн) Vc/Vm Выражение будет использовано при рассмотрении гетерогенного образования зародыша

Конденсация пересыщенного пара где ∆μ, , приращение химпотенциала в паре Работа образования критического зародыша при конденсации пересыщенного пара - степень пересыщения пара

Кристаллизация (конденсация) из раствора Пересыщение раствора α = с/со, где с и со – концентрация пересыщенного и насыщенного растворов.

Кристаллизация из расплава Пересыщение исходной фазы достигается переохлаждением расплава Применяя уравнение Гиббса-Гельмгольца Тогда: Интегрируя от температуры плавления Тпл , при которой (μст - μн)= 0, до температуры Т: = где ΔT= Тпл – T ˃ 0 степень переохлаждения

Работа образования критического зародыша в расплаве

ГЕТЕРОГЕННОЕ ОБРАЗОВАНИЕ НОВОЙ ФАЗЫ где σ13, σ 23 и σ 12 - удельные свободные поверхностные энергии поверхностей раздела соответствующих фаз (1 - исходная фаза, 2 - зародыш новой фазы, 3 включение). Н= r(1 - cos θ) r 1 = rcosθ V=1/3πH 2(3 r-H) - объем шарового сегмента

Объем гетерогенного зародыша V(r) = 1/3πr 3(l-cosθ)2(2+cosθ) = 4/3πr 3 f(θ) где f(θ) =1/4(l - cosθ)2(2 + cosθ) - отношение объемов усеченного сферического и полного сферического зародышей с одинаковым радиусом кривизны поверхности, f(θ) убывает от 1 до 0 при изменении θ от 180 до 0° Работа образования гетерогенного зародыша – пропорциональна его объему

Влияние шереховатости на величину работы образования критического зародыша

Физико-химические явления в процессах деформации и разрушения твердых тел. Эффект Ребиндера.

где Е - модуль Юнга

Уравнение Гриффитса

Зависимость напряжения от деформации монокристаллов цинка при 4000 С: 1 - на воздухе; 2 – в расплаве олова.

Для облегчения диспергирования используют понизители твердости (ПАВ, эмульсии и др. ) Понизители твердости составляют 0, 1 % от общей массы измельчаемых веществ и при этом снижают энергозатраты на получение дисперсных систем более чем в два раза. 29
Презентация образование ДС.pptx