доп к лекц 17-18 Обмен соединений азота.ppt
- Количество слайдов: 54

Обмен соединений азота 1

Синтрофию азота в биосфере • выражает схема к занятию 16 нашего учебно-методического пособия. Там же дана дополнительная литература по теме и описан парадокс между инертной молекулой азота и универсальной потребностью организмов в его атомах для: биосинтеза аминокислот, белков, нуклеиновых кислот, порфиринов и прочих низкомолекулярных веществ, часть которых объединяют термином витамины. • Эту задачу решили nif-гены, ответственные за экспрессию Е восстановления азота и главный из них – нитрогеназу. Они широко распространены у прокариот-азотфиксаторов, включая архебактерии, Сyanobacter и Azotobacter. • Так как у эукариот nif-гены отсутствуют, то переводя N 2 атмосферы в доступный другим таксонам NH 4+, азотфиксаторы делают его вслед за углеродом, основой синтрофии = совместного питания организмов. • Подробней об азотфиксаторах – в курсе микробиологии, а об их симбиотических клетках-продуцентах – в курсе физиологии растений. 2

Азотистый обмен в клетках и организмах консументов включил • лишь часть способностей продуцентов. • Поэтому основной для них источник азота - пищевые белки, доступней и чаще растительные. Поедая растения, животные получают 10 аминокислот и витамины: биотин = Н, никотинамид = РР = В 5, тиамин = В 1, рибофлавин = В 2, пиридоксин = В 6, фолевую к-ту = В 9 и коррины = В 12, как незаменимые соединения азота. • Важно учитывать, что: 1. В стеблях белка мало. 2. Эффективно разрушать полисахаридные оболочки клеток растений, могут лишь жвачные. 3. Белки злаков бедны: лизином, триптофаном и метионином. 4. Фибриллярные белки животных плохо растворимы в воде и с трудом перевариваются, лишь после частичного гидролиза. Самый доступный из них – коллаген, составляет 10 -20 % массы мяса. Он беден ароматическими, диамино- и серусодержащими аминокислотами. 3

Таким образом, 1. Круговорот азота в природе - важнейшее звено в биогеохимических циклах Земли. 2. Все пластические нужды биоты лимитируют соединения азота, форма усвоения которого зависит от положения клетки или таксона в пищевых цепях. 3. Основная форма потребления азота клетками-консументами – аминокислоты. 4. Витамины – вещества, чаще азотсодержащие, синтезируемые продуцентами и незаменимые в метаболизме консументов. 4

Макс Рубнер (1854 — 1932). Германский физиолог и гигиенист. Доказал применимость к биоте закона сохранения энергии. • Создал представления о вариантах азотистого баланса у организмов и популяций. • Установил нормы потребления азота для взрослых людей: 16 -20 г N 2/сут. , что в пересчете на эмпирический коэффициент 6, 25, дает 100 -120 г пищевых белков. • Т. к. 8 -10 дней голодовки вызывают у людей отрицательный азотистый баланс с распадом 23, 2 г белка или 530 мг азота/сутки на кг массы тела назвал эту константу: коэффициентом износа. 5

Одинаковые нормы питания рядовых и офицеров в армиях Европы и США • вводят с конца XVIII в. Чтобы еды хватало всем, сержанты и офицеры едят после солдат, а командир – последним. • Сравните с нашей армией, где и сейчас разные нормы и порядок питания рядовых, офицеров и генералов. • Из мемуаров гл. редактора «Красной звезды» генерала Д. И. Ортенберга. «Сорок второй» . 1990. Зима 1941 -1942 гг. Оборона Москвы. В 4 -х армиях Калининского фронта потери от дистрофии больше, чем от действий противника!!! Комиссия Маленкова нашла причину в таблице заменителей. Ссылаясь на эту справку, интенданты без лишних хлопот кормят людей яичным порошком, поступавшим из США по ленд-лизу. Но заметить признаки развития дистрофии некому, т. к. командующий фронтом, армиями и т. д. , вместе с политработниками и чекистами питались совсем по другим нормам! 6

К сожалению, ученики М. Рубнера • привели нормы белкового питания и санитарии в соответствие с расовой теорией нацизма, чем вызвали гибель миллионов военнопленных и жителей оккупированных территорий. За это Германия до сих пор и расплачивается. • Понятно, что в обоих случаях, как Германия, так и СССР подтвердили правоту президента США Авраама Линкольна (1809 -1865): «Нет плохих вещей. Бывают злоупотребления хорошими вещами» ! 7

С позиций диетологии: • 20 протеиногенных аминокислот обычно делят на 2 равных группы: заменимых и незаменимых. Отсюда понятия полноценных и неполноценных белковых продуктов, с предпочтением бобовых и производных молока. • Переваривание белков пищи и всасывание аминокислот мы уже разбирали. Все это освоить самостоятельно, по учебникам биохимии и физиологии. Важно, что раннее отнятие от груди с переводом детей на растительную пищу, снижает интеллект, вплоть до маразма = слабоумия и вызывает дистрофию до кахексии = квашиоркор. 8
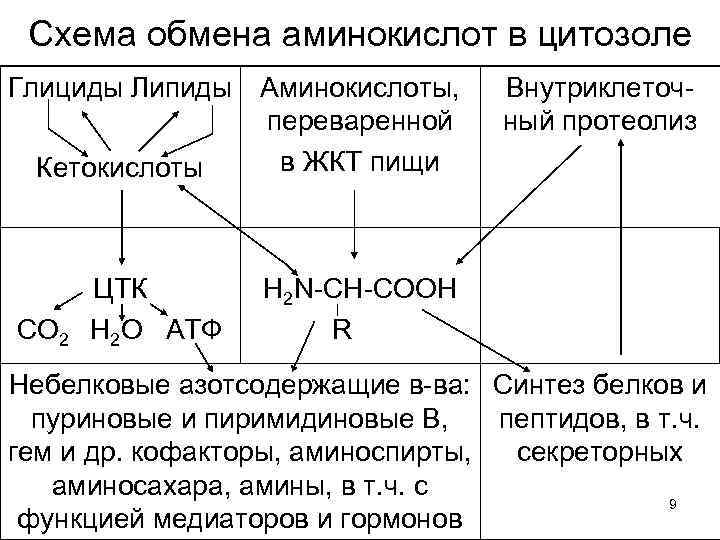
Схема обмена аминокислот в цитозоле Глициды Липиды Кетокислоты СО 2 ЦТК Н 2 О АТФ Аминокислоты, переваренной в ЖКТ пищи Внутриклеточный протеолиз H 2 N-CH-COOH R Небелковые азотсодержащие в-ва: Синтез белков и пуриновые и пиримидиновые В, пептидов, в т. ч. гем и др. кофакторы, аминоспирты, секреторных аминосахара, амины, в т. ч. с 9 функцией медиаторов и гормонов

Обмен > 50 типов малых азотистых молекул сложен и разнообразен, но: О протеолизе говорили в лекциях по пищеварению. Кроме пептидгидролаз ЖКТ, упоминали их эволюционных предшественников – катепсины лизосом и фаголизосом, завершающих эндоцитоз и внутриклеточное пищеварение. Они очень активны в гранулоцитах. См. курсы цитологии и гистологии. 3. Наконец протеасомы, в которых с участием АТФ и убиквитина происходит гидролиз собственных, «изношенных» белков цитозоля: 10
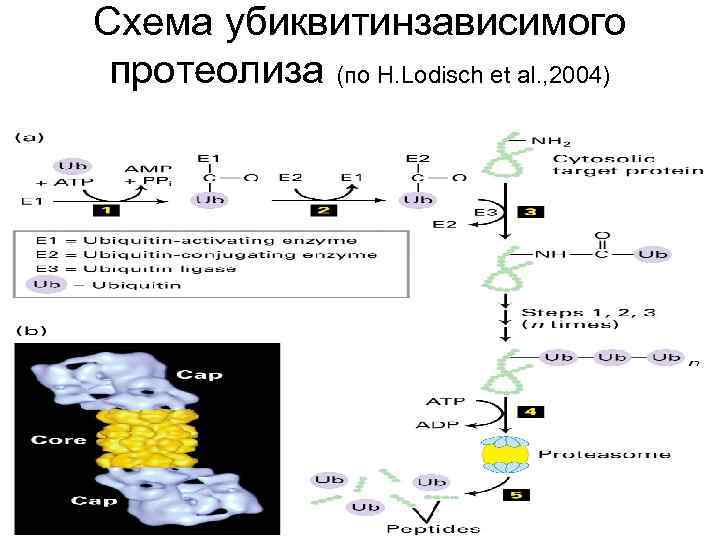
Схема убиквитинзависимого протеолиза (по H. Lodisch et al. , 2004) 11

Также, в разделе «Матричные биосинтезы» уже рассматривали: • Транскрипцию, трансляцию и варианты фолдинга полипептидов. • Даже обмен кетокислот обсуждали в лекции по метаболону ЦТК. • Т. е. пока не затронули: 1. Обмен аминогрупп. 2. Использование NH 3. 3. Обмен небелковых азотсодержащих веществ: медиаторов, нуклеотидов и гема. 6 способов дезаминирования = распада аминокислот: 1. http: //orgchem 2. city. tomsk. net/n_met/ornitin. htm 2. В учебниках биохимии Т. Т. Березова и Б. В. Коровкина для мединститутов. 3. В курсе микробиологии. 12

Принципиально важны для клеток эукариот: 1. Непрямое дезаминирование = переили трансаминирование, когда аминогруппа переносится с аминок-ты на кеток-ту, с образованием новых кетои аминокислоты. 2. Прямое окислительное дезаминирование, с выделением кетокислоты и NH 3, дающим в водной среде NH 4+. 13

Александр Евсеевич Браунштейн (1902 -1986). • Открыл и всю жизнь изучал химию и биологическую роль переаминирования аминокислот. • Вместе с М. М. Шемякиным разработал общую теорию пиридоксалевых кофакторов и Е. • Академик АМН (1945) и АН СССР (1964). 14

АКП аминотрансфераз • Установили в ин-те биоорганической химии в Москве, под руководством уже академика АН СССР Ю. А. Овчинникова. • Для 70 -х гг. прошлого века – работа мирового класса. 15

Аминотрансферазы: Имеют 2 активных центра с пиридоксалевыми кофакторами производными пиридоксина = витамина В 6. В одном из них кофактор находится в форме пиридоксаль. Ф = ПАЛФ, а в другом – пиридоксамин. Ф = ПАМФ. Соответственно, первый реагирует с любой аминокислотой, амином или амидом. Параллельно, в другом АЦ ПАМФ взаимодействует с ПВК, ЩУК, но чаще всего с 2 -кетоглутаратом = α-КГ. 16
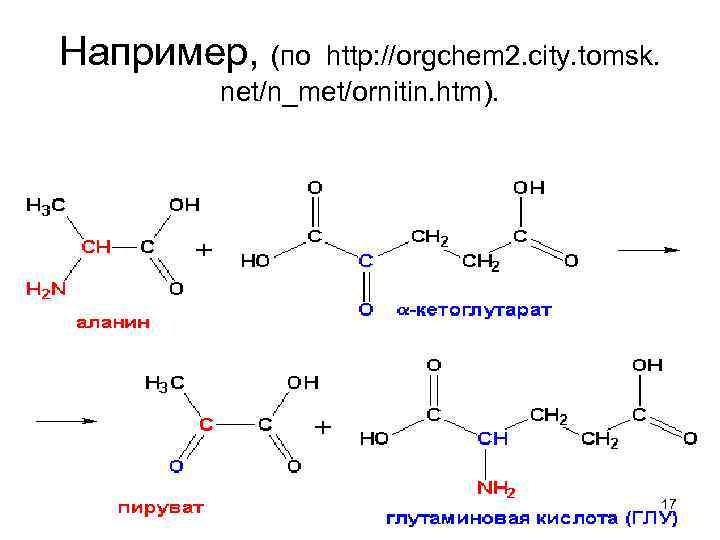
Например, (по http: //orgchem 2. city. tomsk. net/n_met/ornitin. htm). 17

Смысл переаминирования • в том, что аминогруппы, собранные с полусотни разных веществ, концентрируются в глутаминовой кислоте, как центре азотистого обмена. • Соответственно, возникшие из бывших азотистых соединений кетокислоты, могут превращаться в углеводы и липиды, а потом – окисляться в ЦТК. Либо, при нужде, переаминируясь с Глу, кетокислоты снова 18 превращаются в заменимые аминокислоты.
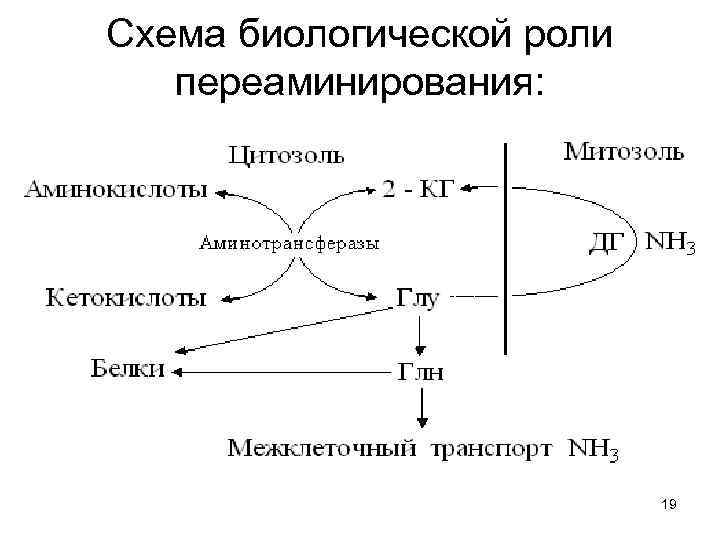
Схема биологической роли переаминирования: 19

Аминогруппы, собранные с десятков разных веществ, 1. Концентрируются в глутаминовой кислоте, как центре азотистого обмена. 2. Кетокислоты, возникшие из бывших аминосоединений могут превращаться в углеводы и липиды, а потом – окисляться в ЦТК. Либо, при нужде, переаминируясь с Глу, кетокислоты снова превращаются в заменимые аминокислоты. 3. Глу, с помощью АТФ и Глн-синтазы превращается в Глн и обе аминок-ты могут включаться в белки. 4. Избыток Глу, поступая в митозоль окисляется с образованием NH 3 и дает НАДН 2 в дыхательную цепь. 20
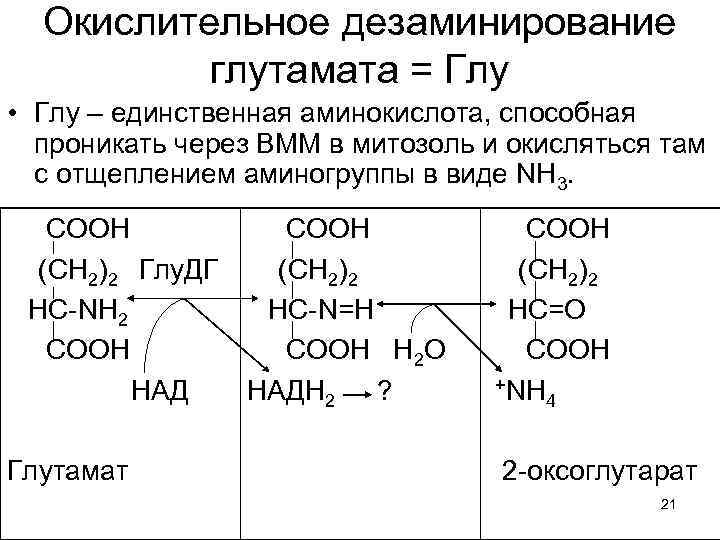
Окислительное дезаминирование глутамата = Глу • Глу – единственная аминокислота, способная проникать через ВММ в митозоль и окисляться там с отщеплением аминогруппы в виде NH 3. СООН (СН 2)2 Глу. ДГ НС-NH 2 CООН НАД Глутамат СООН (СН 2)2 НС-N=H CООН Н 2 О НАДН 2 ? СООН (СН 2)2 НС=О CООН +NH 4 2 -оксоглутарат 21
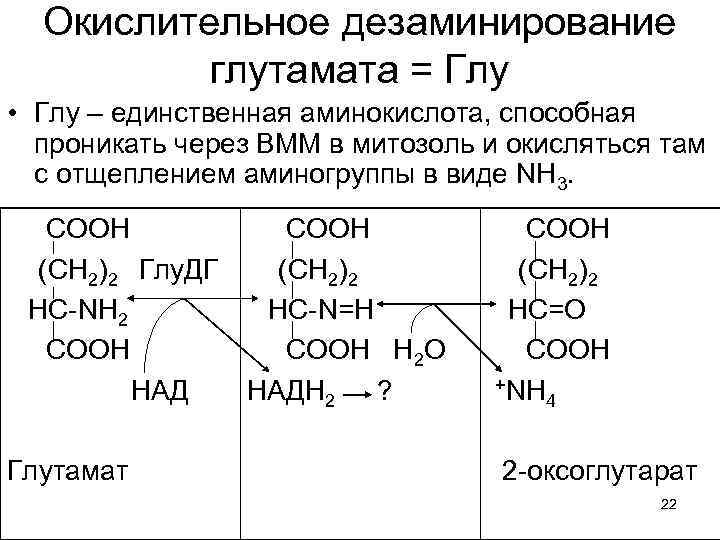
Окислительное дезаминирование глутамата = Глу • Глу – единственная аминокислота, способная проникать через ВММ в митозоль и окисляться там с отщеплением аминогруппы в виде NH 3. СООН (СН 2)2 Глу. ДГ НС-NH 2 CООН НАД Глутамат СООН (СН 2)2 НС-N=H CООН Н 2 О НАДН 2 ? СООН (СН 2)2 НС=О CООН +NH 4 2 -оксоглутарат 22

2 -оксоглутарат: 1. Может окисляться в ЦТК, давая клетке до 10 -15 % энергии. 2. Свободно проходит ВММ в направлении изнутри - наружу, вновь используясь в реакциях трансаминирования в цитозоле. Т. е. он образует еще один челночный механизм, обеспечивающий транспорт аминогрупп. 23

Та же реакция возможна и в обратном направлении: Глутаматдегидрогеназа α-КГ +NH Глу 4 Н 2 О НАДФН 2 НАДФ Процесс восстановительного аминирования кетокислот широко распространен в клетках-продуцентах. У животных - ограничен биосинтезом Глу. 24
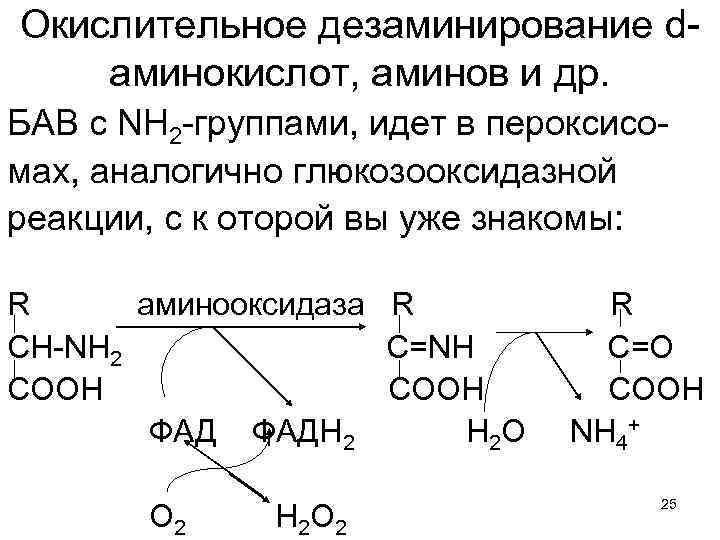
Окислительное дезаминирование dаминокислот, аминов и др. БАВ с NH 2 -группами, идет в пероксисомах, аналогично глюкозооксидазной реакции, с к оторой вы уже знакомы: R аминооксидаза R CH-NH 2 C=NH COOH ФАДН 2 Н 2 О О 2 Н 2 О 2 R C=O COOH NH 4+ 25

Свойства аммиака = NH 3 (по Ю. В. Карякин, И. И. Ангелов. Чистые химические вещества. М. «Химия» , 1974). • Малая молекула - 17 Да, tпл. -80 С, tкип. -36 С. • Газ с сильным характерным запахом и хорошей растворимостью в воде, где находится в виде гидрата: NH 3. Н 2 О. • В природе образуется при разложении азотсодержащих органических в-в. • Врачи XIX в. называли судорожным ядом. • Вызывает раздражение слизистых, слезотечение, головокружение, удушье, боли в 26 желудке от сокращения мышц.

NH 4+ легко проходит биомембраны по градиенту концентрации. Нейтрализуя все множество кислот, от Фн до сахарофосфатов, ВЖК и кетокислот, блокирует ЦТК, а значит и работу ДЦ с окислительным фосфорилированием! • Первыми на энергетический голод отвечают нейроны – мышечными судорогами. 27

Основной, но далеко не единственный источник NH 3 - 1. Окислительное дезаминирование глутамата в митозоле. 2. Также, окислительное дезаминирование d-аминокислот и аминов в пероксисомах и азотистых В нуклеотидов. 3. Наконец, микробное дезаминирование в толстом кишечнике. Т. о. ежесуточно, на кг массы тела у людей возникает ~ 60 мг этого опасного вещества. • Продуценты способны к синтезу всех нужных кетокислот, а затем используют NH 3 для их восстановительного аминирования. • Отмечая обратимость глутаматдегидрогеназной реакции, мы уже говорили, что она единственная, позволяющая консументам связывать аммиак, образуя Глу. Затем, в реакциях переаминирования, из Глу и кетокислот могут 28 возникать другие заменимые аминокислоты.

У водных одноклеточных животных • часть аммиака идет для биосинтеза Глу и других азотсодержащих веществ. • Его избыток в виде солей аммония диффундирует в окружающую среду, позволяя регулировать р. Н. • Риск лишь в том, что NH 4+ привлекает хищников. • Опасность отравления NH 3 появилась у многоклеточных организмов и, многократно возросла при их выходе на сушу. • Проблему решили, требующие затрат АТФ биосинтезы электронейтральных: 1. Глн и 2. мочевины. 29
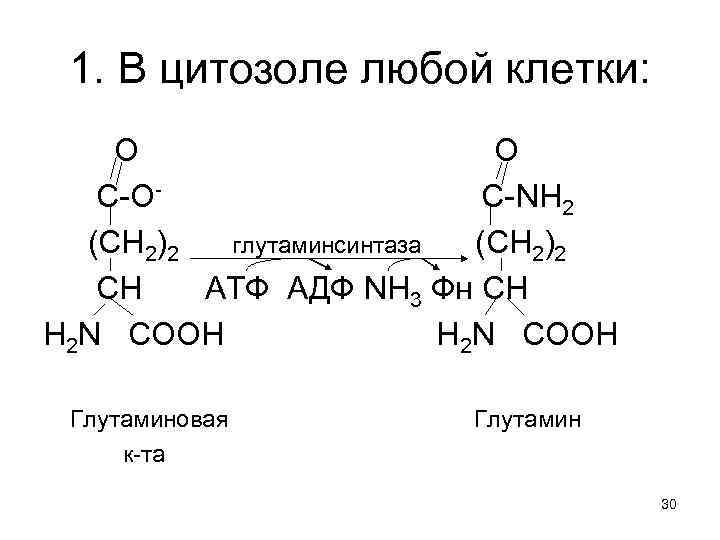
1. В цитозоле любой клетки: О О С-ОС-NH 2 (CН 2)2 глутаминсинтаза (CН 2)2 СН АТФ АДФ NH 3 Фн СН Н 2 N CООН Глутаминовая к-та Глутамин 30

Электронейтральный глутамин, • Как и другие аминокислоты используется в клетках для биосинтеза белка. • Его избыток – диффундирует в плазму крови, откуда поступает в гепатоциты. 31
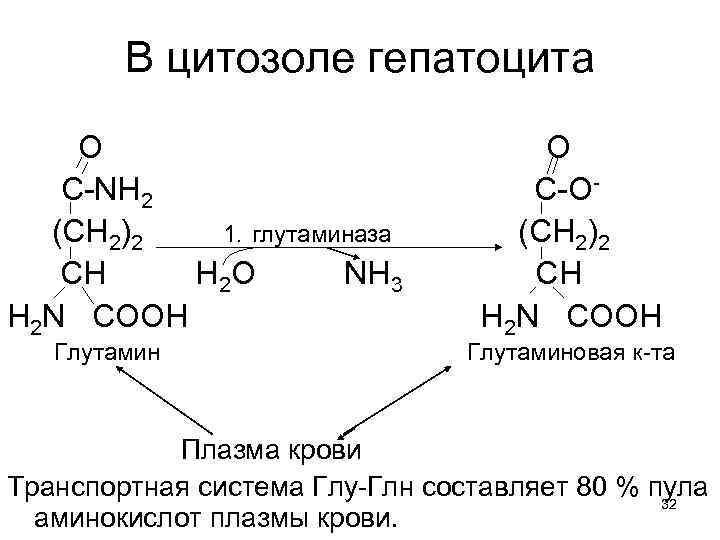
В цитозоле гепатоцита О С-NH 2 (CН 2)2 1. глутаминаза СН Н 2 О NH 3 Н 2 N CООН Глутамин О С-О(CН 2)2 СН Н 2 N CООН Глутаминовая к-та Плазма крови Транспортная система Глу-Глн составляет 80 % пула 32 аминокислот плазмы крови.
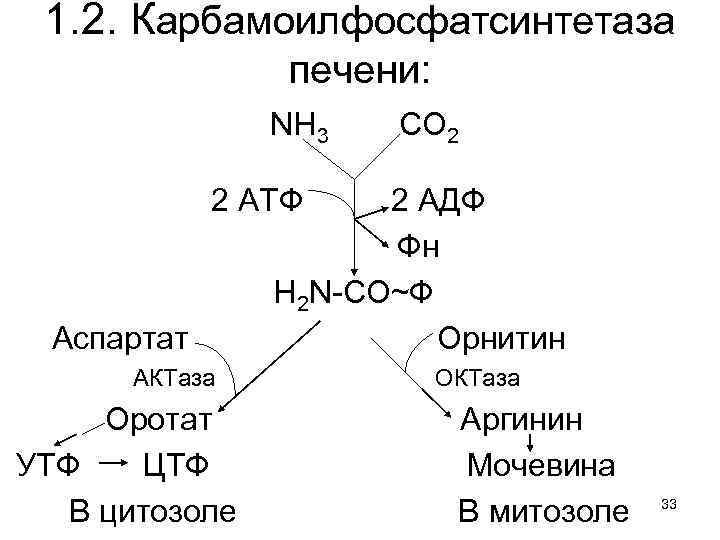
1. 2. Карбамоилфосфатсинтетаза печени: NH 3 СО 2 2 АТФ Аспартат АКТаза Оротат УТФ ЦТФ В цитозоле 2 АДФ Фн Н 2 N-СО~Ф Орнитин ОКТаза Аргинин Мочевина В митозоле 33

Реакции орнитинового цикла Кребса освоить по учебнику самостоятельно, обратив внимание на: 1. Его индукцию у земноводных при метаморфозе. 2. Электронейтральная мочевина H 2 N-C-NH 2, О как конечный метаболит почти идеальна, т. к. при массе 60 Да, содержит 28 Да N. Прекрасно растворима в воде и легко выводится из организма. Но развитие земноводных и птиц происходит в замкнутой системе яйца. Поэтому вместо мочевины они синтезируют мочевую кислоту, откладывая это труднорастворимое в-во в амнионе. Сразу после вылупления птенцов, ее кристаллы можно найти в скорлупе. 34

2. Обмен мононуклеотидов детально изучен в 60 -х гг. прошлого века. См. : учебники и Дж. Дэвидсон. Биохимия нуклеиновых кислот. М. Мир. 1976. 412 с. Т. е. , возвращаясь к карбамоилфосфату отметим: 1. АКТаза ведет к биосинтезу оротовой к-ты. 2. Оротат, реагируя с активированным продуктом пентозофосфатного пути окисления глюкозы: 5 -фосфорибозил-1 -ФФ, образует УМФ. 3. Перефосфорилирование УМФ с АТФ дает УТФ, из которого возникают все пиримидиновые нуклеотиды: ЦТФ, д. ЦТФ и д. ТТФ. 4. Конечные продукты биосинтеза пиримидиновых нуклеотидов - аллостерические ингибиторы 35 АКТазы, обеспечивающие автоматизм процесса.
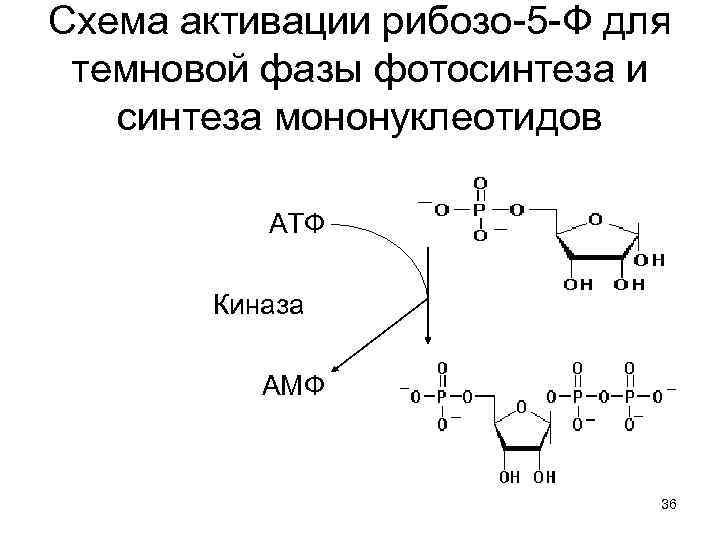
Схема активации рибозо-5 -Ф для темновой фазы фотосинтеза и синтеза мононуклеотидов АТФ Киназа АМФ 36
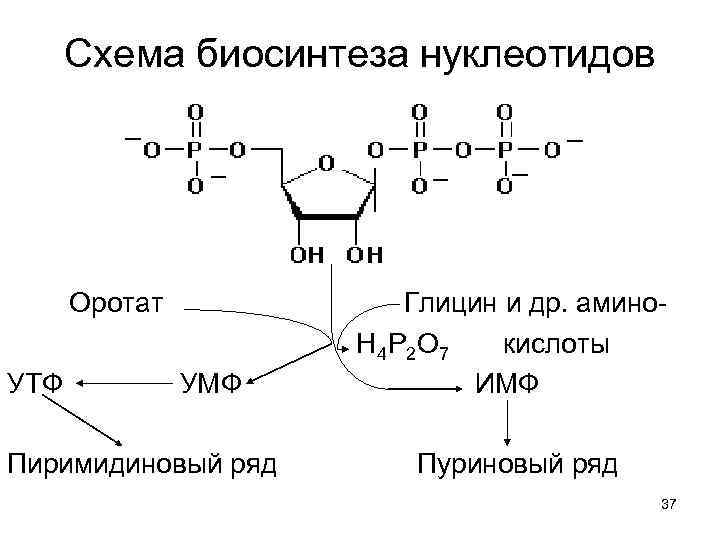
Схема биосинтеза нуклеотидов Оротат УТФ УМФ Пиримидиновый ряд Глицин и др. амино. Н 4 Р 2 О 7 кислоты ИМФ Пуриновый ряд 37
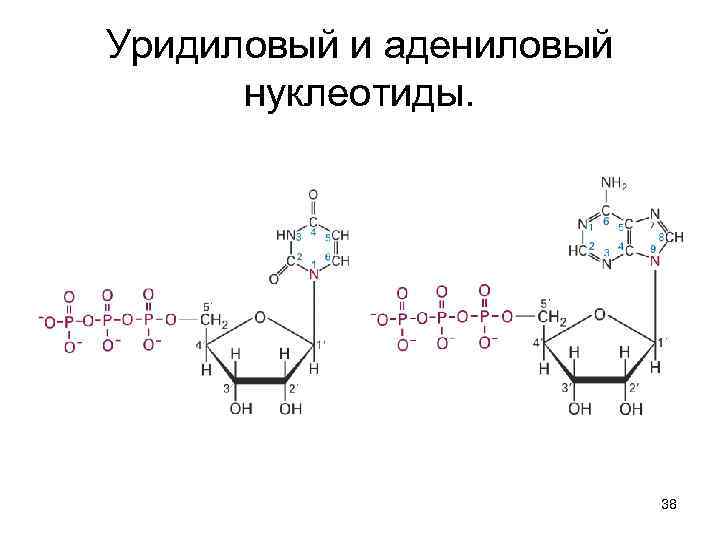
Уридиловый и адениловый нуклеотиды. 38

3. Декарбоксилирование аминокислот в α-положении Ведет к образованию аминов. Принципиально отлично от декарбоксилаз кетокислот зависимостью не от ТДФ, а от ПЛФ. R ПЛФдекарбоксилаза R CH CH 2 H 2 N COOH CO 2 NH 2 Важно сознавать что амины биоактивны, т. е. действуют в концентрациях 10 -7 – 10 -11 моль 39

Соответственно: • Из Гис возникает гистамин. • Из Три – триптамин, а после окисления – 5 гидрокситриптамин = серотонин. • Из Тир – тироидные гормоны в щитовидной железе и катехоламины = КА в нейронах и надпочечниках. • Из Глу –ГАМК. По массе – процессы ничтожны, но важны для управления межклеточными отношениями, т. к. выполняют функции гормонов и/или медиаторов = трансмиттеров. 40
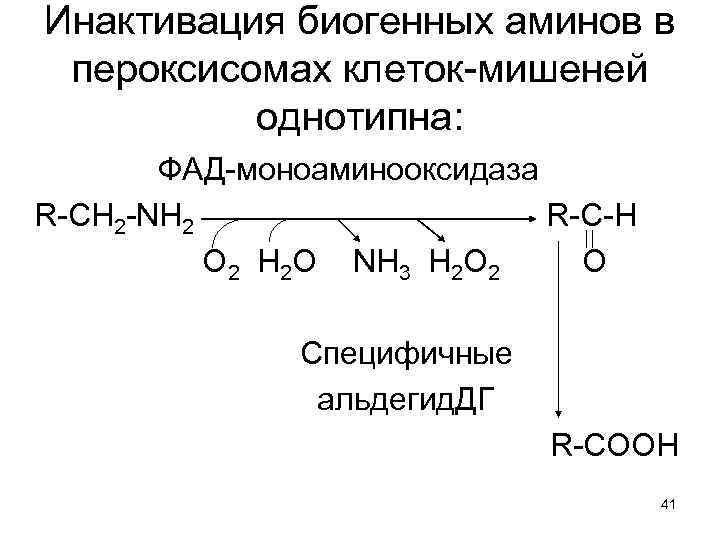
Инактивация биогенных аминов в пероксисомах клеток-мишеней однотипна: ФАД-моноаминооксидаза R-СН 2 -NH 2 R-C-H О 2 Н 2 О NH 3 Н 2 О 2 О Специфичные альдегид. ДГ R-СООН 41
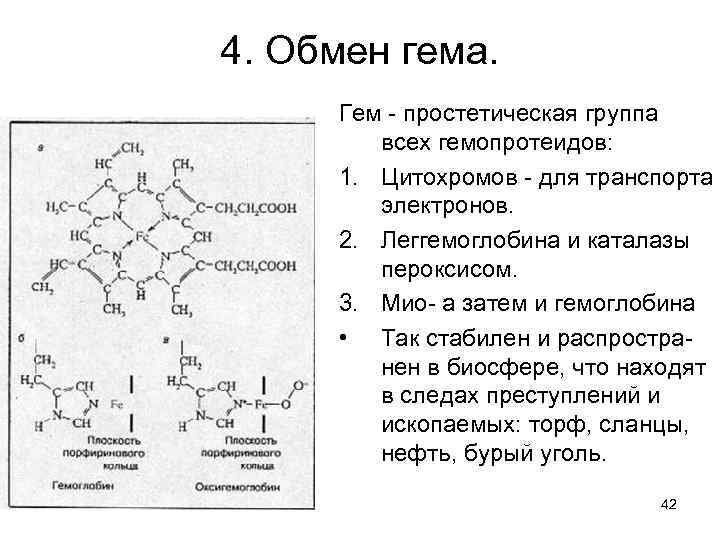
4. Обмен гема. Гем - простетическая группа всех гемопротеидов: 1. Цитохромов - для транспорта электронов. 2. Леггемоглобина и каталазы пероксисом. 3. Мио- а затем и гемоглобина • Так стабилен и распространен в биосфере, что находят в следах преступлений и ископаемых: торф, сланцы, нефть, бурый уголь. 42
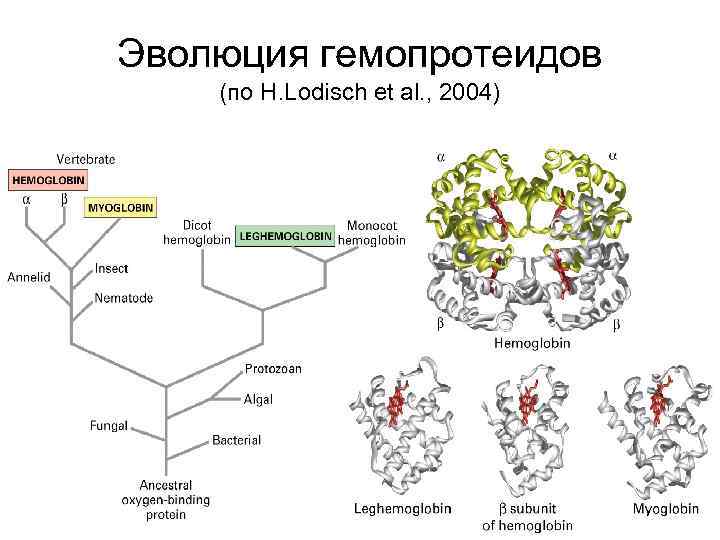
Эволюция гемопротеидов (по H. Lodisch et al. , 2004) 43
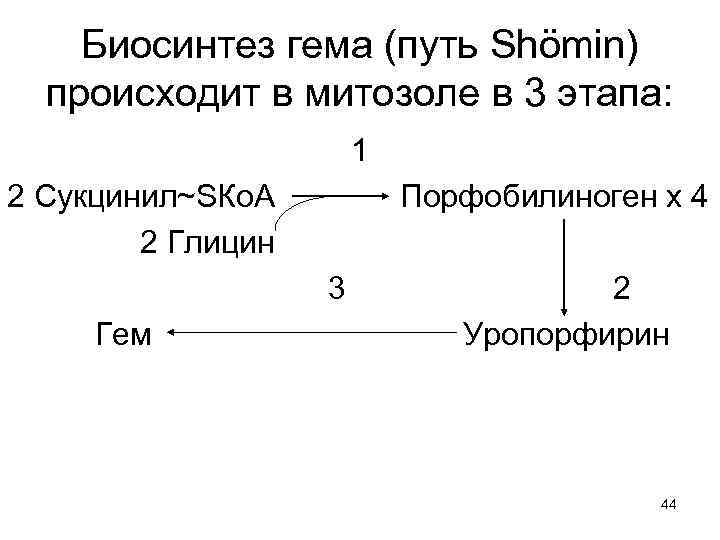
Биосинтез гема (путь Shömin) происходит в митозоле в 3 этапа: 1 2 Сукцинил~SКо. А 2 Глицин Порфобилиноген х 4 3 Гем 2 Уропорфирин 44
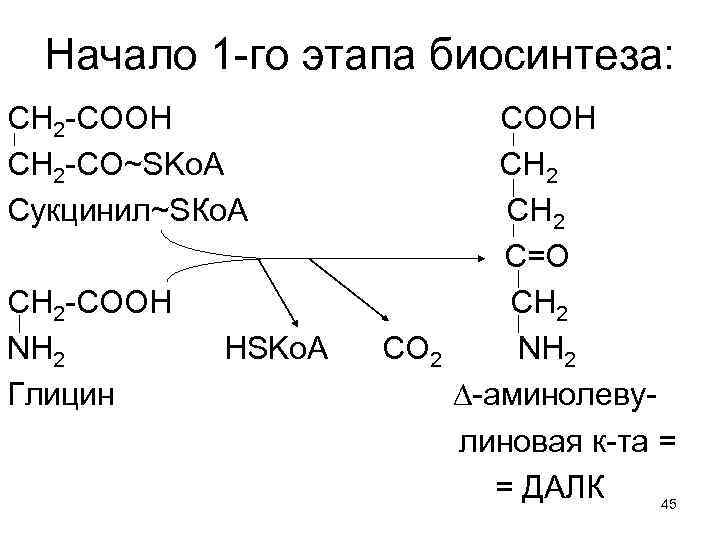
Начало 1 -го этапа биосинтеза: СН 2 -СООН СН 2 -СО~SKo. A Сукцинил~SКо. А CH 2 -COOH NH 2 Глицин HSKo. A COOH CH 2 C=O CH 2 CO 2 NH 2 ∆-аминолевулиновая к-та = = ДАЛК 45
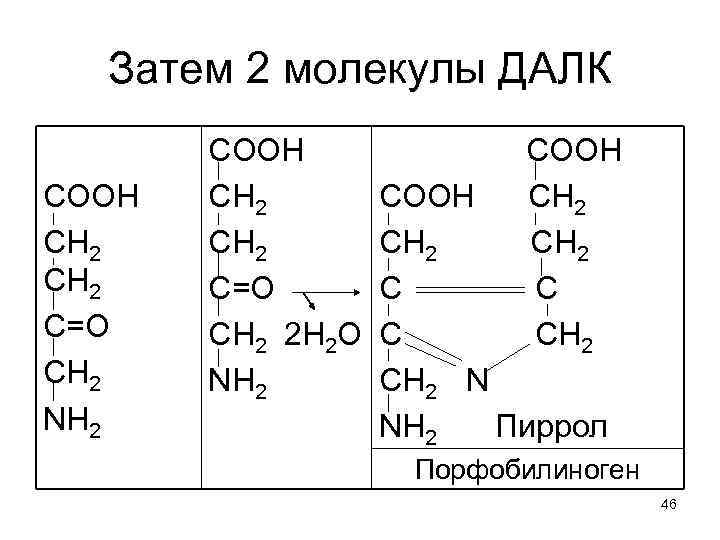
Затем 2 молекулы ДАЛК COOH CH 2 C=O CH 2 NH 2 COOH CH 2 C=O CH 2 2 Н 2 О NH 2 СООН СН 2 С СН 2 COOH CH 2 C C CH 2 N NH 2 Пиррол Порфобилиноген 46

2 этап биосинтеза гема: 4 молекулы порфобилиногена, теряя 4 NH 2, через метиленовые мостики замыкаются в макроцикл уропорфирин = тетрапиррол с соответствующими R. 47
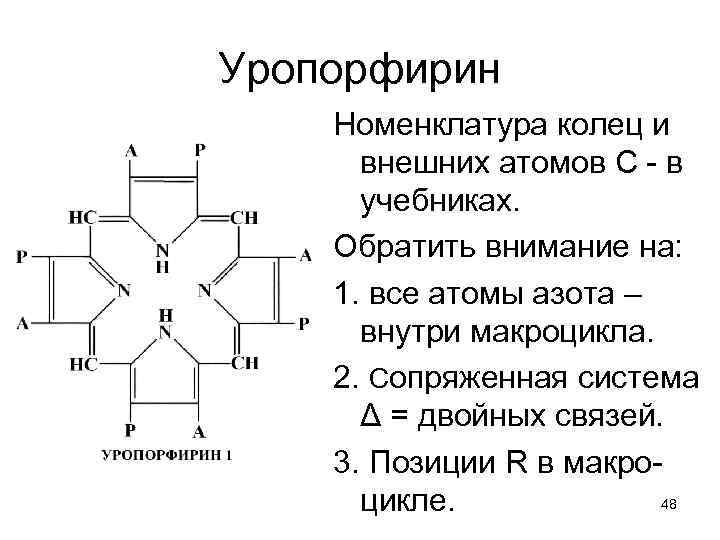
Уропорфирин Номенклатура колец и внешних атомов С - в учебниках. Обратить внимание на: 1. все атомы азота – внутри макроцикла. 2. Сопряженная система Δ = двойных связей. 3. Позиции R в макро 48 цикле.

Т. о. , 3 -й этап биосинтеза гема: Сводится к: 1. Преобразованиям R. 2. Включению атома железа в плоскость макроцикла. 3. Соединению гема с полипептидом, придающим соответствующий редокспотенциал. 49

Соответственно времени полужизни = τ1/2 любого гемопротеида, • В макрофагах проходит 1 -я фаза распада гема: МОГ-окисление СН 2 -мостика между А и В пирролами гема. • Но и после удаления из гема СО, тетрапиррол остается свернутым, т. к. его фиксируют атом Fe и полипептид. • Лишь после связывания Fe с ферритином и протеолиза апобелка до аминокислот, возникает ярко желтый линейный тетрапиррол - билирубин. 50
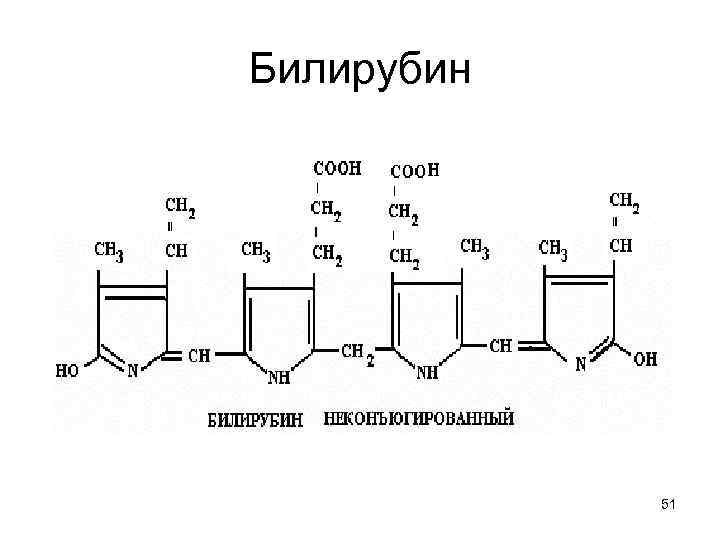
Билирубин 51
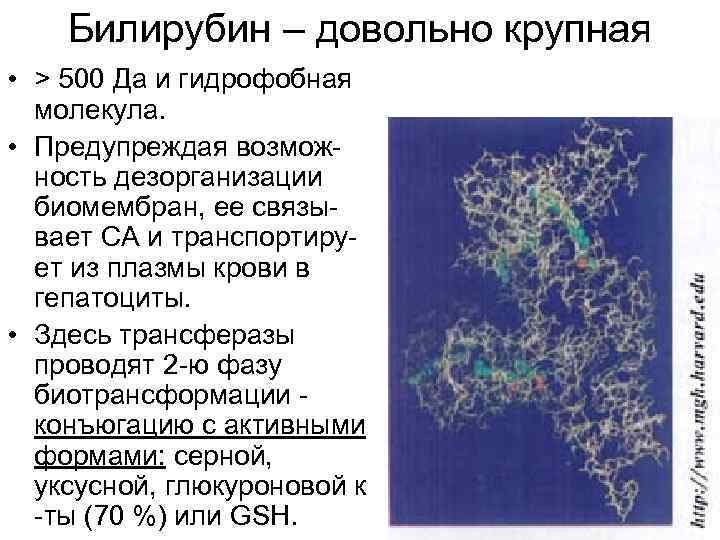
Билирубин – довольно крупная • > 500 Да и гидрофобная молекула. • Предупреждая возможность дезорганизации биомембран, ее связывает СА и транспортирует из плазмы крови в гепатоциты. • Здесь трансферазы проводят 2 -ю фазу биотрансформации конъюгацию с активными формами: серной, уксусной, глюкуроновой к -ты (70 %) или GSH. 52
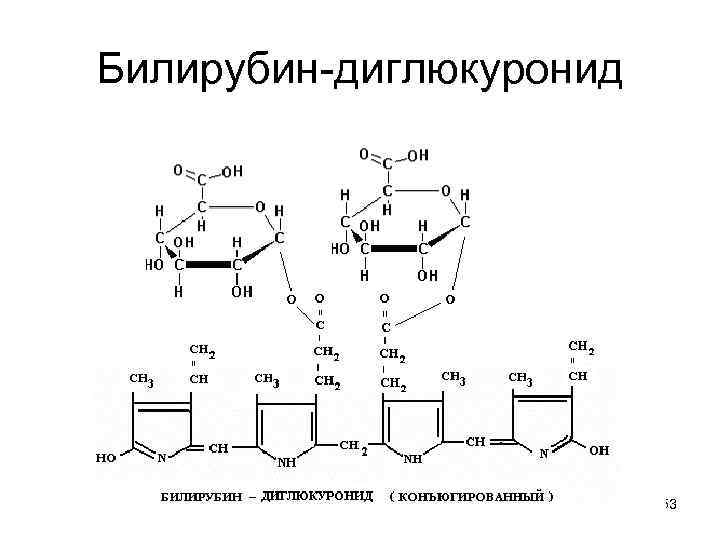
Билирубин-диглюкуронид 53

Конъюгация • резко повышает растворимость билирубина в воде, снижая его токсичность и облегчая выведение с желчью, которую вы уже видели. • Аналогична и схема биотрансформации ксенобиотиков, например лекарств, пестицидов и других поллютанов окружающей среды: 1. МОГ-окисление SH SOH 2. Трансферазы Полярные конъюгаты 54
доп к лекц 17-18 Обмен соединений азота.ppt