lection lepids 2.ppt
- Количество слайдов: 34

Обмен сложных липидов и его регуляция. Коррекция нарушений процессов обмена липидов фармацевтическими препаратами

Биосинтез фосфолипидов интенсивно происходит в печени, стенке кишечника, семенниках, яичниках, молочной железе и других тканях. Наиболее важные фосфолипиды синтезируются главным образом в эндоплазматической сети клетки. Центральную роль в биосинтезе фосфолипидов играют 1, 2 -диглицериды (в синтезе фосфатидилхолинов и фосфатидилэтаноламинов), фосфатидная кислота (в синтезе фосфатидилинозитов), сфингозин (в синтезе сфингомиелинов). Цитидинтрифосфат (ЦТФ) участвует в синтезе практически всех фосфолипидов.
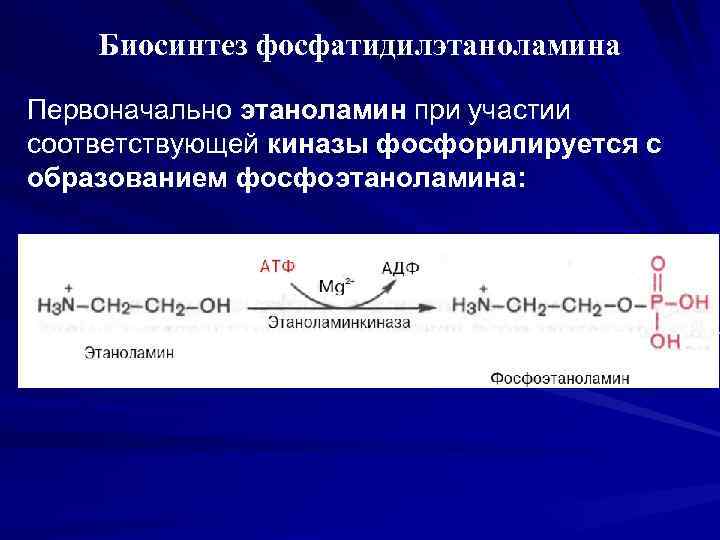
Биосинтез фосфатидилэтаноламина Первоначально этаноламин при участии соответствующей киназы фосфорилируется с образованием фосфоэтаноламина:
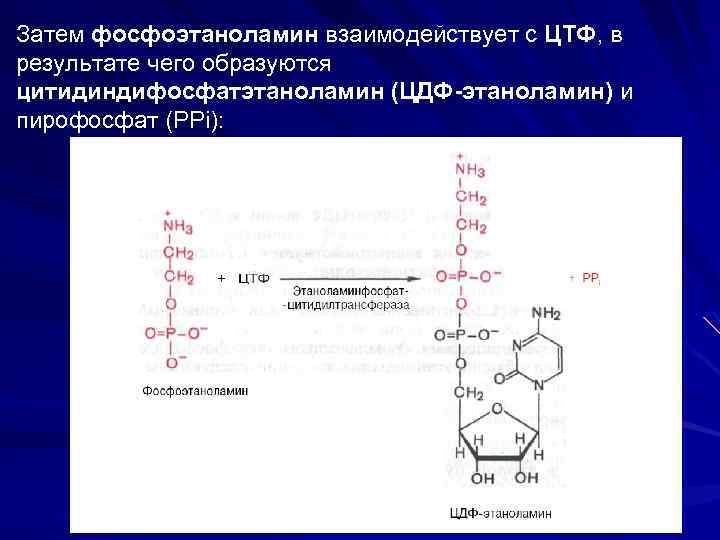
Затем фосфоэтаноламин взаимодействует с ЦТФ, в результате чего образуются цитидиндифосфатэтаноламин (ЦДФ-этаноламин) и пирофосфат (PPi):

В следующей реакции ЦДФ-этаноламин, взаимодействуя с 1, 2 -диглицеридом, образующимся при дефосфорилировании фосфатидной кислоты, превращается в фосфатидилэтаноламин. Реакция катализируется ферментом этаноламинфосфотрансферазой:

Биосинтез фосфатидилхолина (лецитина) Фосфатидилэтаноламин является предшественником фосфатидилхолина. В результате последовательного переноса трех метальных групп от трех молекул S-аденозилметионина (донор метальных групп) к аминогруппе остатка этаноламина образуется фосфатидилхолин:

Существует еще один путь синтеза фосфатидилхолина в клетках животных. В этом случае, как и при синтезе фосфатидилэтаноламина, используется ЦТФ в качестве переносчика, но уже не фосфоэтаноламина, а фосфохолина. На первом этапе синтеза свободный холин активируется под действием холинкиназы с образованием фосфохолина:

Биосинтез фосфатидилсерина У млекопитающих фосфатидилсерин образуется в реакции обмена этаноламина на серин:
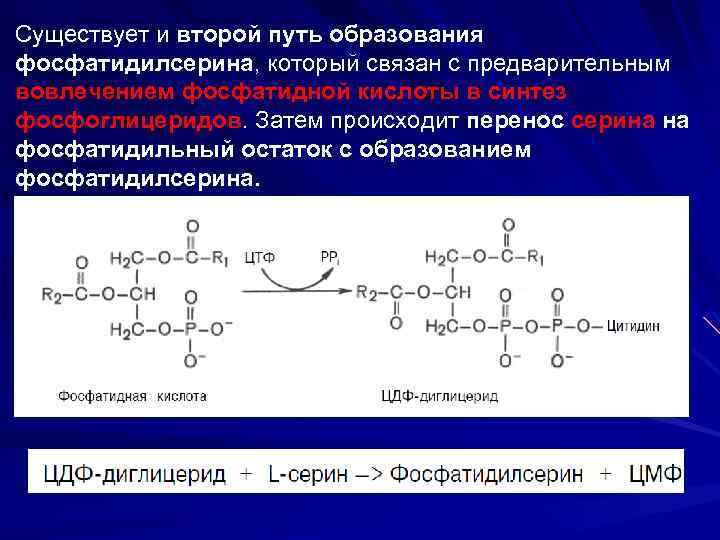
Существует и второй путь образования фосфатидилсерина, который связан с предварительным вовлечением фосфатидной кислоты в синтез фосфоглицеридов. Затем происходит перенос серина на фосфатидильный остаток с образованием фосфатидилсерина.
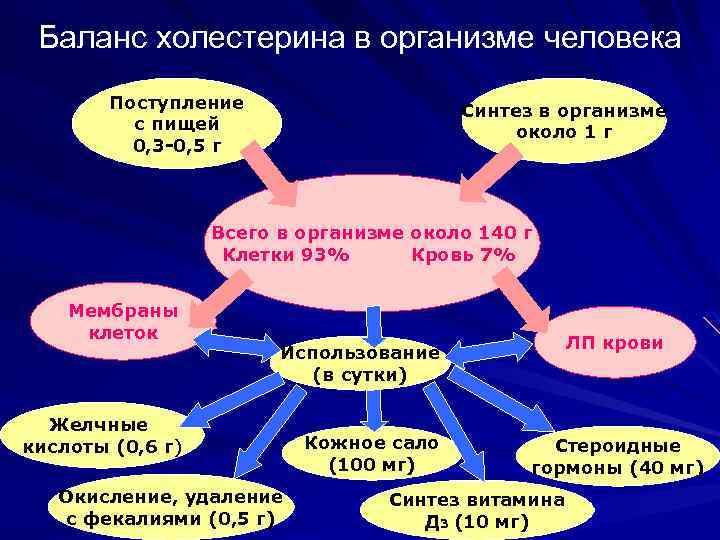
Баланс холестерина в организме человека Поступление с пищей 0, 3 -0, 5 г Синтез в организме около 1 г Всего в организме около 140 г Клетки 93% Кровь 7% Мембраны клеток ЛП крови Использование (в сутки) Желчные кислоты (0, 6 г) Окисление, удаление с фекалиями (0, 5 г) Кожное сало (100 мг) Стероидные гормоны (40 мг) Синтез витамина Д 3 (10 мг)

Синтез холестерина Половина холестерина синтезируется в печени 15 -20% синтезируется в тонком кишечнике 25 -30% - в коже, коре надпочечников, половых железах
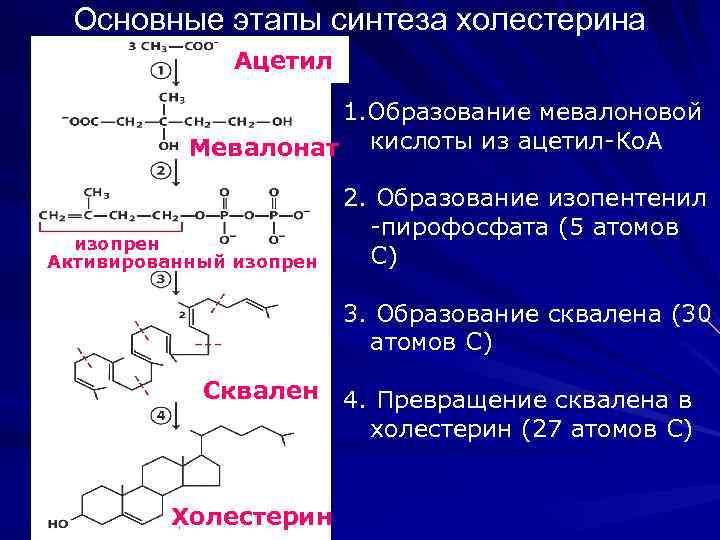
Основные этапы синтеза холестерина Ацетил 1. Образование мевалоновой Мевалонат кислоты из ацетил-Ко. А изопрен Активированный изопрен 2. Образование изопентенил -пирофосфата (5 атомов С) 3. Образование сквалена (30 атомов С) Сквален Холестерин 4. Превращение сквалена в холестерин (27 атомов С)

Схема синтеза холестерина

БИОСИНТЕЗ ХОЛЕСТЕРИНА I стадия Начальным этапом синтеза мевалоновой кислоты из ацетил-Ко. А является образование ацетоацетил-Ко. А посредством обратимой тиолазной реакции: В результате конденсации ацетоацетил-Ко. А с 3 -й молекулой ацетил. Ко. А при участии гидроксиметилглутарил-Ко. А-синтазы (ГМГ-Ко. Асинтаза) образуется β-гидрокси-β-метилглутарил-Ко. А:

β-Гидрокси-β-метилглутарил-Ко. А под действием регуляторного фермента НАДФ-зависимой гидроксиметилглутарил-Ко. А-редуктазы (ГМГ-Ко. А-редуктаза) в результате восстановления одной из карбоксильных групп и отщепления HS-Ko. A превращается в мевалоновую кислоту: ГМГ-Ко. А-редуктазная реакция – первая практически необратимая реакция в цепи биосинтеза холестерина. Активность ГМГ-редуктазы возрастает при введении инсулина и тиреоидных гормонов. Это приводит к усилению синтеза холестерина и повышению его уровня в крови. При голодании, тиреоидэктомии, введение глюкагона и глюкокортикоидов, напротив, отмечается угнетение синтеза холестерина, что прежде всего связано со снижением активности ГМГКо. А-редуктазы.
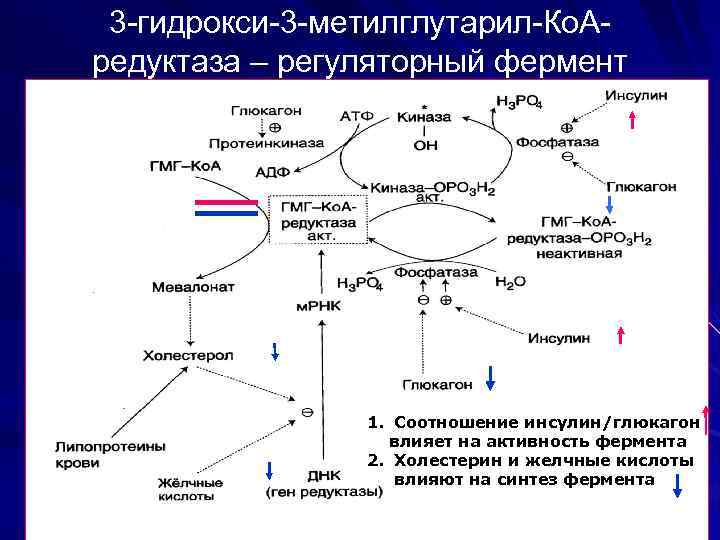
3 -гидрокси-3 -метилглутарил-Ко. Аредуктаза – регуляторный фермент 1. Соотношение инсулин/глюкагон влияет на активность фермента 2. Холестерин и желчные кислоты влияют на синтез фермента
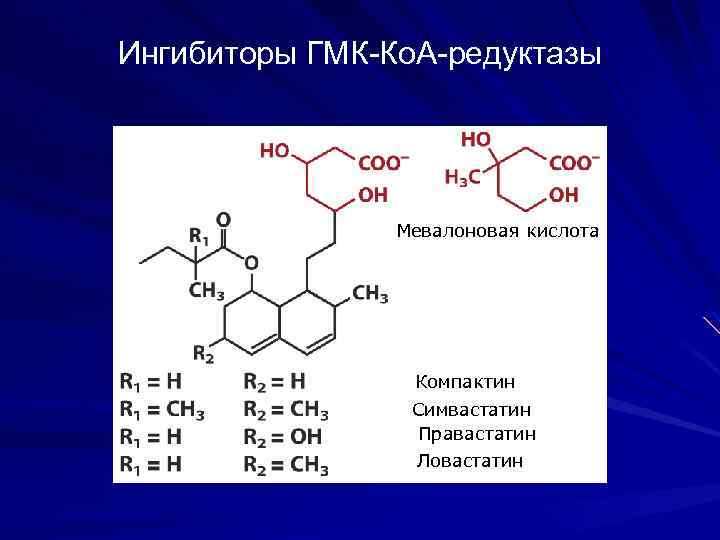
Ингибиторы ГМК-Ко. А-редуктазы Мевалоновая кислота Компактин Симвастатин Правастатин Ловастатин

Судьба холестерина, синтезируемого в печени Холестерин, синтезируемый в печени, выводится оттуда в трех формах: в виде желчных кислот, свободного холестерина желчи и эфиров холестерина Эфиры холестерина образуются под действием фермента ацил-Ко. А-холестерол ацилтрансферазы Эфиры холестерина транспортируются в виде липопротеидных частиц (липопротеиды очень низкой плотности) в другие ткани. Входящий в состав ЛПОНП Apo-CII активирует липопротеидлипазу в капиллярах адипоцитов, скелетных мышц и сердца, насыщая эти ткани свободными жирными кислотами.
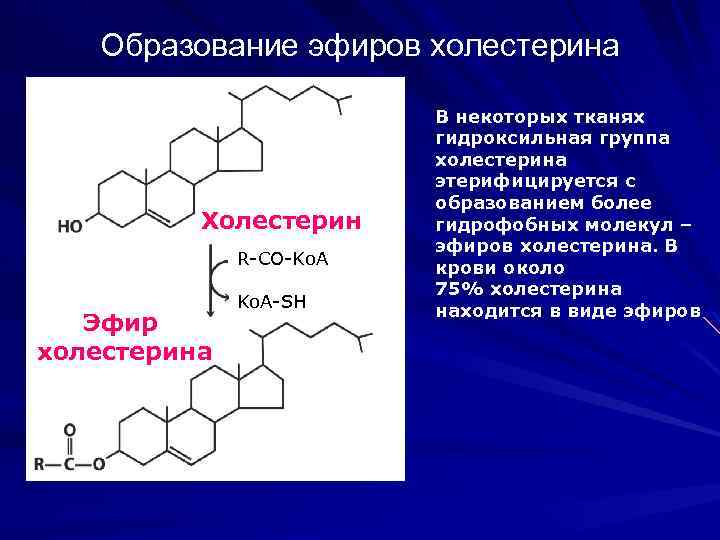
Образование эфиров холестерина Холестерин R-CO-Ko. A Эфир холестерина Ko. A-SH В некоторых тканях гидроксильная группа холестерина этерифицируется с образованием более гидрофобных молекул – эфиров холестерина. В крови около 75% холестерина находится в виде эфиров
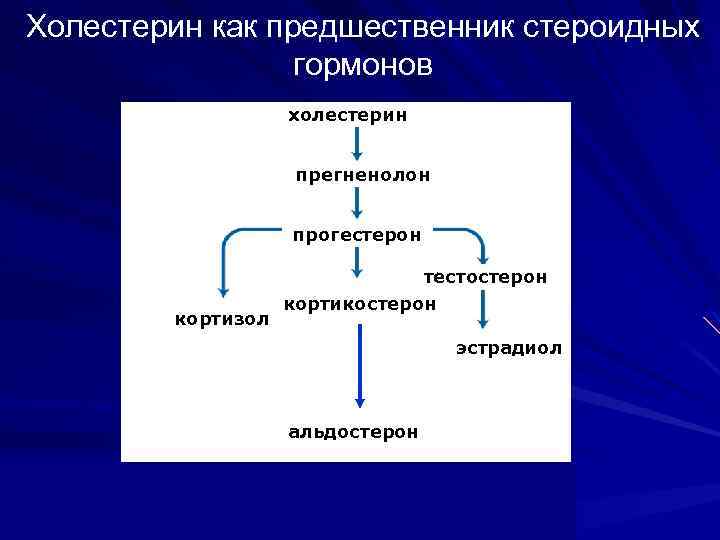
Холестерин как предшественник стероидных гормонов холестерин прегненолон прогестерон кортизол тестостерон кортикостерон эстрадиол альдостерон
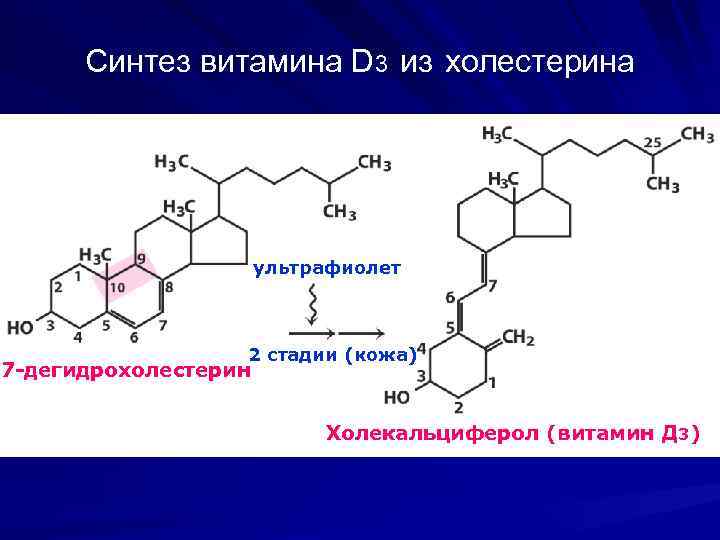
Синтез витамина D 3 из холестерина ультрафиолет 2 стадии (кожа) 7 -дегидрохолестерин Холекальциферол (витамин Д 3)
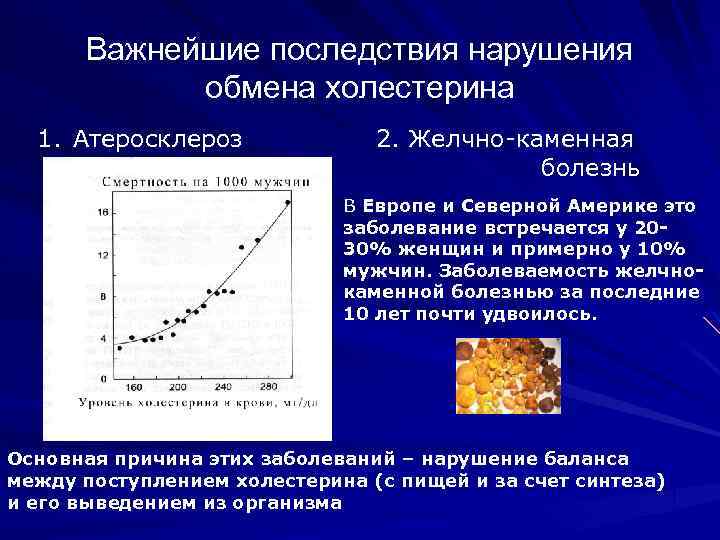
Важнейшие последствия нарушения обмена холестерина 1. Атеросклероз 2. Желчно-каменная болезнь В Европе и Северной Америке это заболевание встречается у 2030% женщин и примерно у 10% мужчин. Заболеваемость желчнокаменной болезнью за последние 10 лет почти удвоилось. Основная причина этих заболеваний – нарушение баланса между поступлением холестерина (с пищей и за счет синтеза) и его выведением из организма
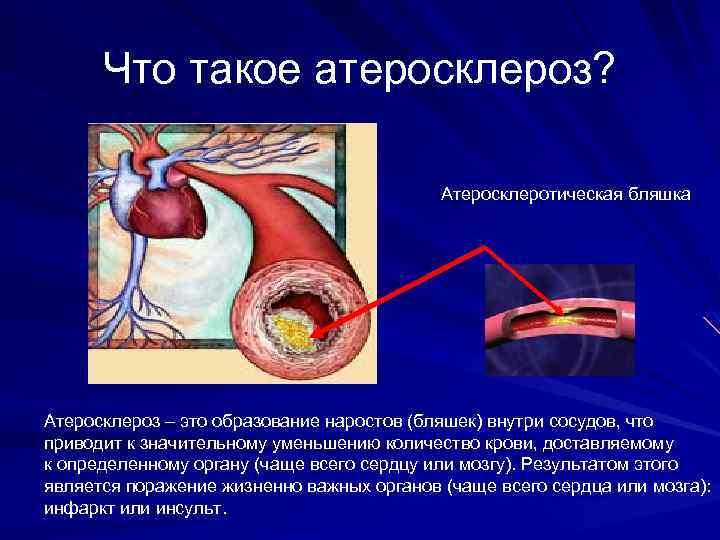
Что такое атеросклероз? Атеросклеротическая бляшка Атеросклероз – это образование наростов (бляшек) внутри сосудов, что приводит к значительному уменьшению количество крови, доставляемому к определенному органу (чаще всего сердцу или мозгу). Результатом этого является поражение жизненно важных органов (чаще всего сердца или мозга): инфаркт или инсульт.
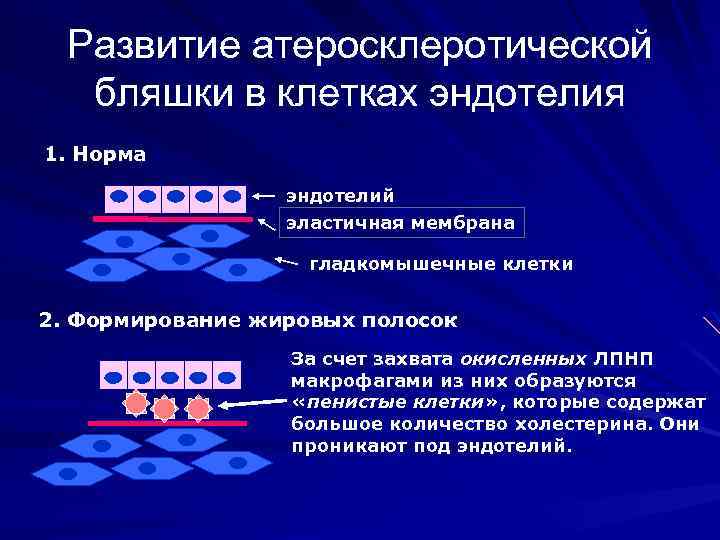
Развитие атеросклеротической бляшки в клетках эндотелия 1. Норма эндотелий эластичная мембрана гладкомышечные клетки 2. Формирование жировых полосок За счет захвата окисленных ЛПНП макрофагами из них образуются «пенистые клетки» , которые содержат большое количество холестерина. Они проникают под эндотелий.

Развитие атеросклеротической бляшки в клетках эндотелия (2) 3. Миграция ГМК в область бляшки Эндотелий повреждается, активируется агрегация тромбоцитов 4. Образование фиброзной бляшки Клетки секретируют коллаген и другие белки, образующие фиброзную оболочку, внутри которой идет некроз клеток

Развитие атеросклеротической бляшки в клетках эндотелия (3) липиды Некротические клетки 5. В бляшке накапливаются омертвевшие ткани, пропитанные холестерином. Происходит кальцификация бляшки

При лечении атеросклероза используют следующие препараты: а) путем подавления всасывания холестерина в кишечнике (применением растительных стеринов); б) статины (препараты Гемфиброзил, Фенфибрат, Ловастатин) конкурентные ингибиторы ОМГ-Ко. А-редуктазы; в) путем активации метаболизма холестерина оксигеназы смешанной функции с образованием гидроксилированных производных (препараты Фенобарбитал, Зиксорин); г) секвестранты желчных кислот (колестипол) - повышают выведение желчных кислот из организма; д) фибраты (фенофибрат) - активируют ЛП-липазу и уменьшают образование ЛПОНП; е) антиоксиданты (витамин Е, пробукол) - тормозят пероксидазную модификацию ЛП; ж) никотиновую кислоту - уменьшает образование ЛПОНП и повышает содержание антиатерогенных ЛПВП. с) путем стимулирования его экскреции из организма (применение энтеро-сорбентов - препараты квестран, Гуарем).
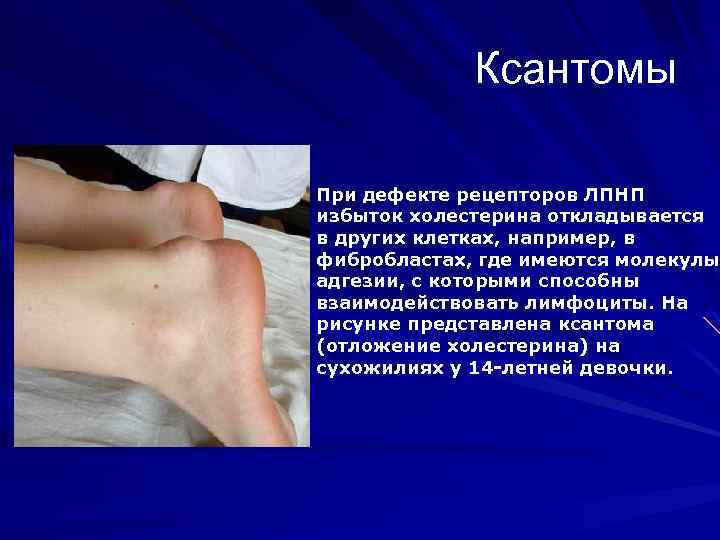
Ксантомы При дефекте рецепторов ЛПНП избыток холестерина откладывается в других клетках, например, в фибробластах, где имеются молекулы адгезии, с которыми способны взаимодействовать лимфоциты. На рисунке представлена ксантома (отложение холестерина) на сухожилиях у 14 -летней девочки.

Дислипопротеидемии

Пути снижения уровня холестерина в крови 1. Низкокалорийная диета с пониженным содержанием холестерина, твердых жиров и повышенным содержанием антиоксидантов, а также растительных стероидов (большое количество овощей и фруктов). 2. Увеличение подвижности, приводящее к «сжиганию» лишних калорий 3. Снижение уровня желчных кислот за счет их сорбции в кишечнике с последующим выведением 4. Увеличение уровня антиоксидантов (фрукты и овощи в диете) 5. Замещение твердых жиров жидкими (подсолнечное и оливковое масла), а также замещение мяса (особенно свинины) рыбой и морепродуками

Последствия пониженного уровня холестерина в крови Очень низкий уровень холестерина в крови также может вызвать различные заболевания. Холестерин крайне необходим организму, при его дефиците увеличивается количество суицидов, легче возникают депрессивные состояния, может наступить бесплодие и некоторые заболевания нервной системы, например, болезнь Паркинсона. Причины этого пока неясны, возможно, это связано с тем, что , холестерин в больших количествах входит в состав миелиновой оболочки нервов, которая обеспечивает изоляцию аксонов нервных клеток и нормальное проведение нервного импульса.

Ожирение - состояние, характеризующееся избыточным накоплением в жировой ткани триацилглицеролов. При ожирении увеличивается количество жировых клеток (адипоцитов) или их размер. Общая масса нейтральных жиров в организме человека в условиях ожирения может достигать больших количеств. Первичное ожирение происходит в результате превышения калорийности питания по сравнению с расходованием энергии. Развитию ожирения способствуют генетические причины. Например, существует ген ожирения obese gene, продуктом экспрессии которого является белок лептин (от греч. Худой). Мутации в этом гене приводят к развитию ожирения. Вторичное ожирение сопровождает другие заболевания, чаще всего эндокринные. Например, при гипофункции щитовидной железы возникает ожирение, сахарном диабете, атеросклерозе. Наиболее неблагоприятное значение в развитии ожирения имеет постоянное избыточное поступление с продуктами питания углеводов (особенно глюкозы и фруктозы) в количествах, больших, чем те, что непосредственно окисляются в клетках и могут депонироваться в виде резервов гликогена.

Повышенное преобразования простых углеводов и продуктов их метаболизма в липиды (липогенез) происходит в результате действия таких биохимических факторов: а) возможности активации синтеза высших жирных кислот из ацетил-Ко. А, образуется из глюкозы как продукт окислительного декарбоксилирования пирувата; б) использование в реакциях синтеза жирных кислот восстановленного НАДФ, одним из главных источников которого является пентозофосфатный цикл окисления глюкозы; в) использование в жировой ткани гликолитического диоксиацетонфосфату как предшественника в биосинтезе триацилглицеролов. Ожирение развивается в условиях стимулирования указанных биохимических процессов вследствие избыточного поступления в организм жиров, белков и моносахаридов (особенно на фоне ограниченной физической активности), а также при генетически детерминированных повышении ферментных систем, участвующих в липогенез или нарушении их эндокринного контроля. При тяжелых формах ожирения, особенно вызванных нарушениями гормональной регуляции липидного обмена наравне гипоталамуса, масса триацилглицеролов в жировой ткани человека может достигать 50 -80 кг.

БУДЬТЕ ЗДОРОВЫ!
lection lepids 2.ppt