Обмен белков1.ppt
- Количество слайдов: 64
Обмен нуклеопротеинов Структура, свойства, функции и обмен нуклеиновых кислот
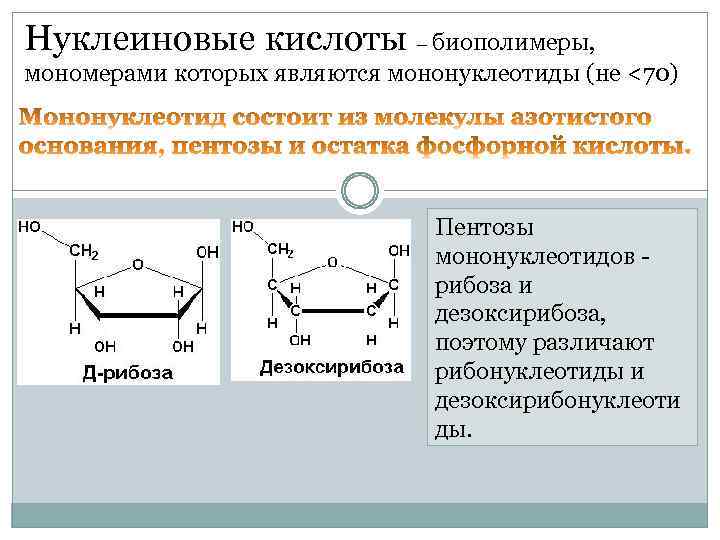
Нуклеиновые кислоты – биополимеры, мономерами которых являются мононуклеотиды (не <70) Пентозы мононуклеотидов рибоза и дезоксирибоза, поэтому различают рибонуклеотиды и дезоксирибонуклеоти ды.
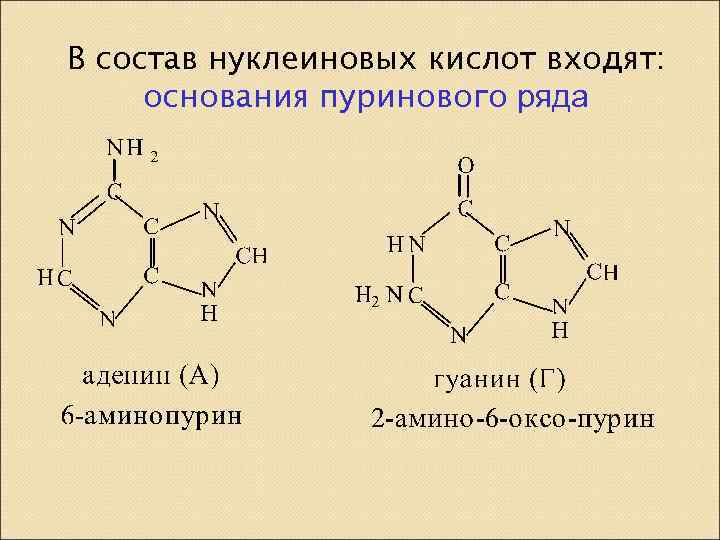
В состав нуклеиновых кислот входят: основания пуринового ряда
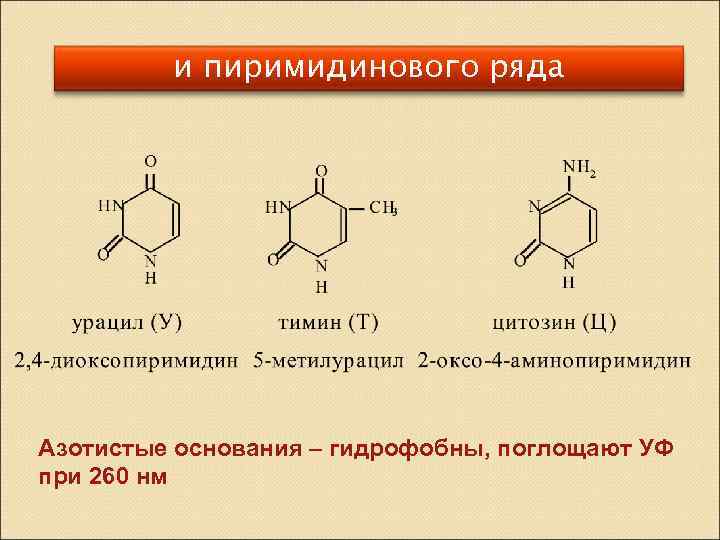
и пиримидинового ряда Азотистые основания – гидрофобны, поглощают УФ при 260 нм
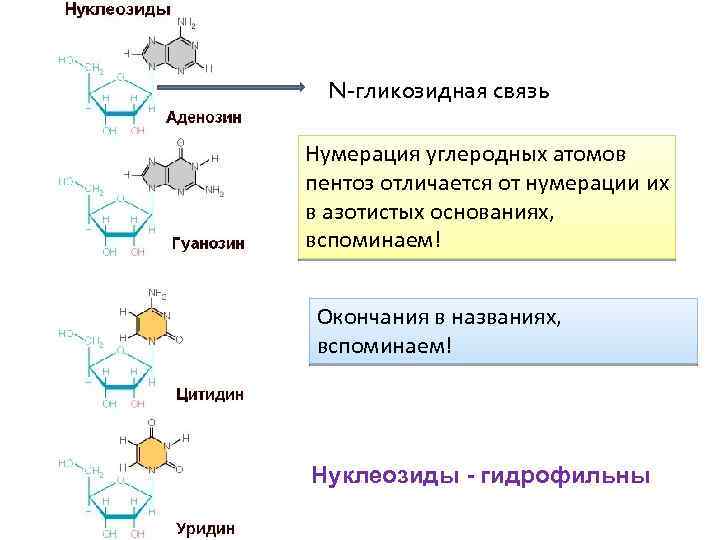
N-гликозидная связь Нумерация углеродных атомов пентоз отличается от нумерации их в азотистых основаниях, вспоминаем! Окончания в названиях, вспоминаем! Нуклеозиды - гидрофильны
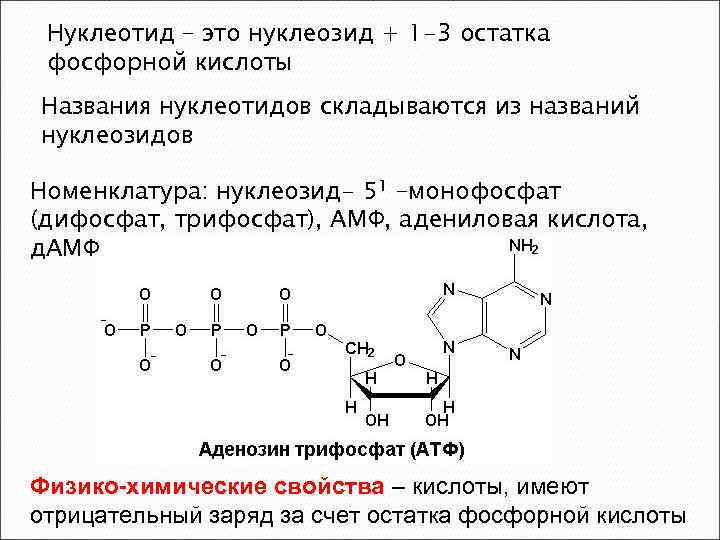
Нуклеотид – это нуклеозид + 1 -3 остатка фосфорной кислоты Названия нуклеотидов складываются из названий нуклеозидов Номенклатура: нуклеозид- 51 –монофосфат (дифосфат, трифосфат), АМФ, адениловая кислота, д. АМФ Физико-химические свойства – кислоты, имеют отрицательный заряд за счет остатка фосфорной кислоты

Биологическая роль нуклеотидов 1. Универсальный источник энергии в клетке 2. Являются активаторами и переносчиками мономеров в клетке (например, УДФ-глюкоза, ЦДФ-холин) 3. Являются аллостерическими регуляторами активности ферментов 4. Входят в состав коферментов (НАД+, НАДФ+ , ФАД, Ко. А -SH)
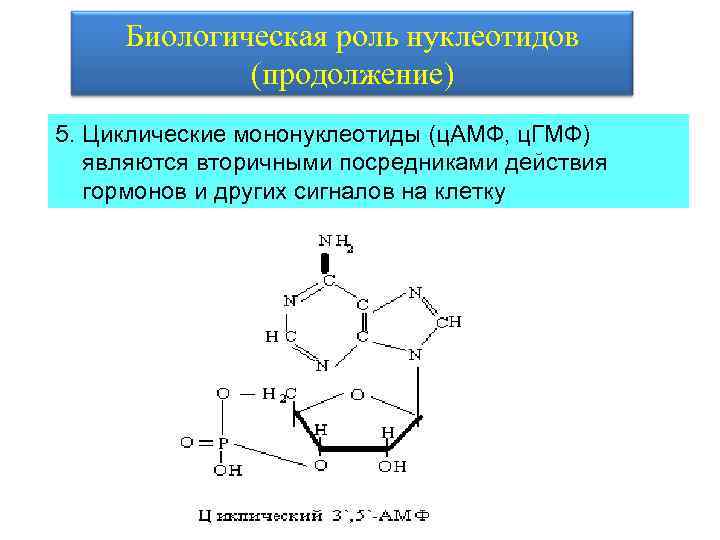
Биологическая роль нуклеотидов (продолжение) 5. Циклические мононуклеотиды (ц. АМФ, ц. ГМФ) являются вторичными посредниками действия гормонов и других сигналов на клетку
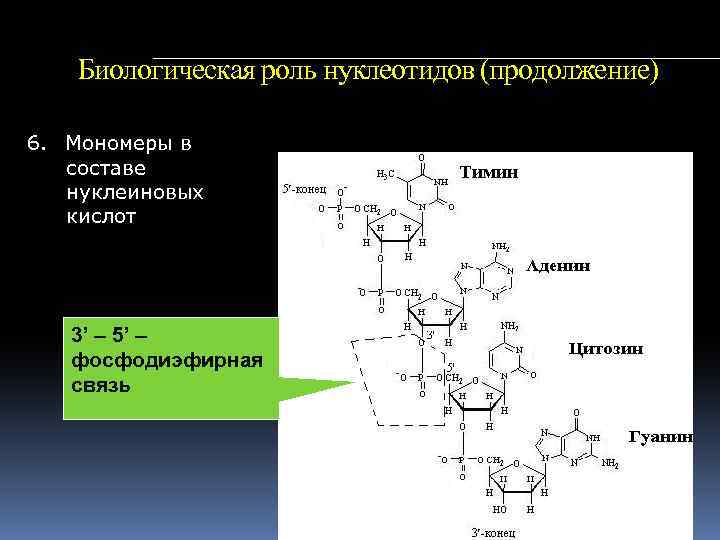
Биологическая роль нуклеотидов (продолжение) 6. Мономеры в составе нуклеиновых кислот 3’ – 5’ – фосфодиэфирная связь

Rosalind Franklin (1920 – 1958)

Вторичная структура ДНК Двойная спираль (правозакрученная) Принципы построения: Комплементарность Антипараллельность
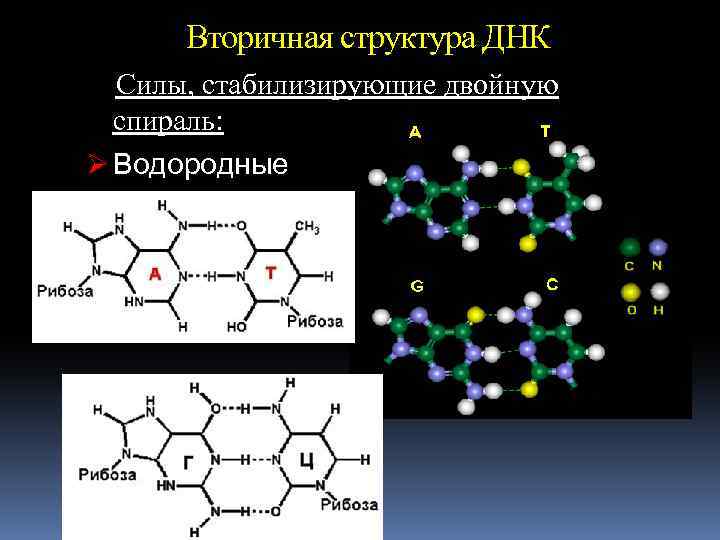
Вторичная структура ДНК Силы, стабилизирующие двойную спираль: Ø Водородные
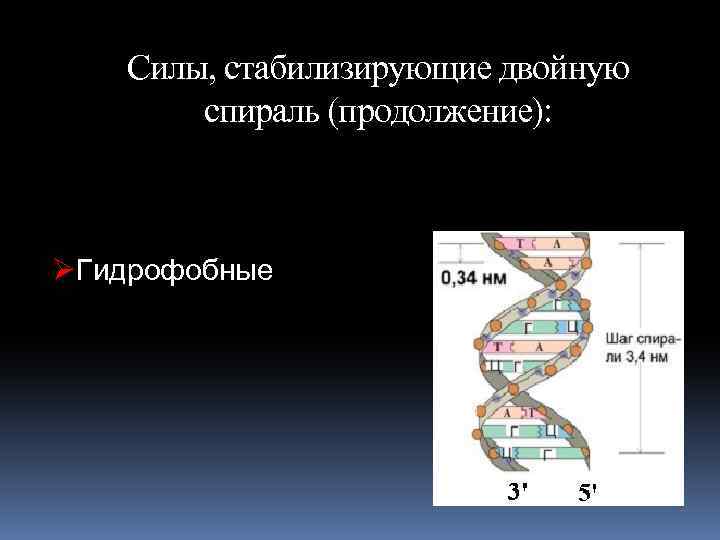
Силы, стабилизирующие двойную спираль (продолжение): ØГидрофобные

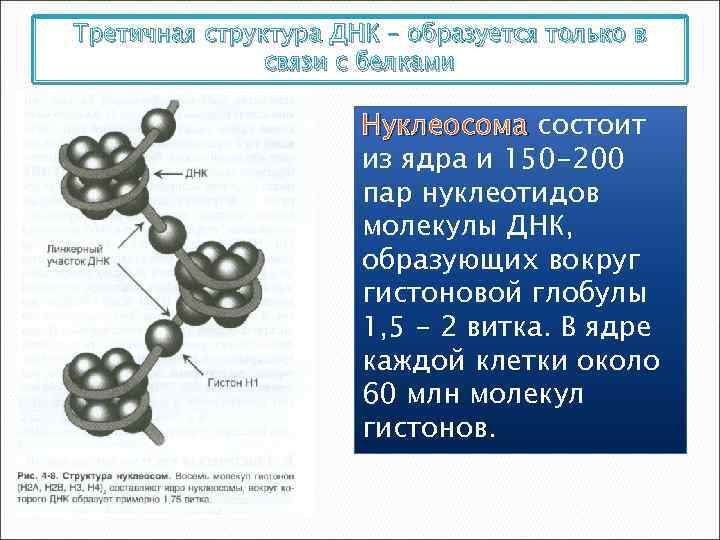
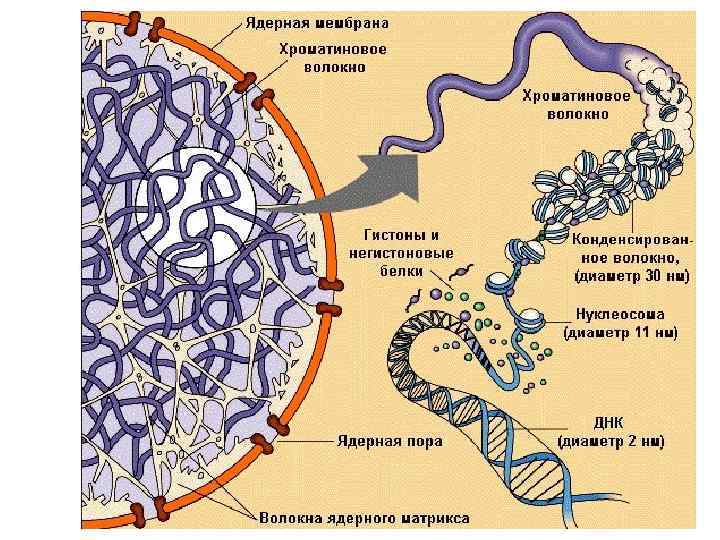
Третичная структура ДНК – образуется только в связи с белками Нуклеосома состоит из ядра и 150 -200 пар нуклеотидов молекулы ДНК, образующих вокруг гистоновой глобулы 1, 5 - 2 витка. В ядре каждой клетки около 60 млн молекул гистонов.

Гистоны 1. Содержат много арг и гис 2. Положительный заряд 3. Образуют ионные связи с отрицательно заряженными фосфатными группами на внешней стороне двойной спирали ДНК

комплементарны определенной последовательности нуклеотидов (сайт ДНК). 1. Cемейство сайт-специфических белков типа «цинковые пальцы» . Каждый «цинковый палец» узнает определенный сайт, состоящий из 5 нуклеотидных пар. 3. Ферменты репликации, транскрипции и репарации.
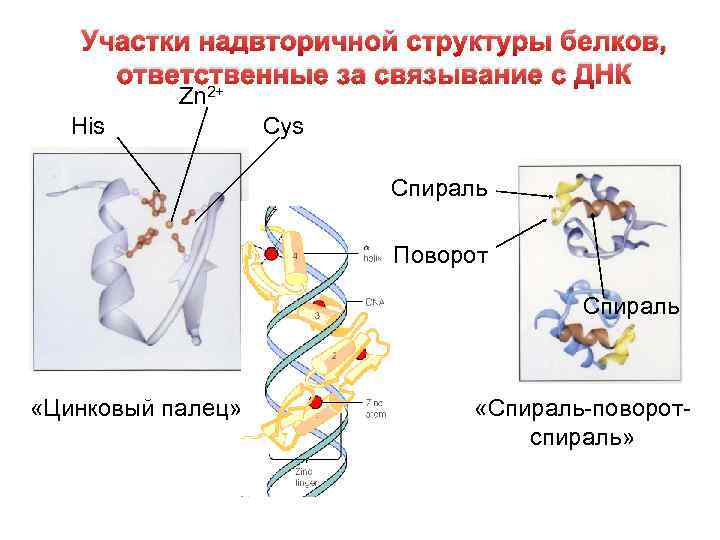
Участки надвторичной структуры белков, ответственные за связывание с ДНК Zn 2+ His Cys Спираль Поворот Спираль «Цинковый палец» «Спираль-поворотспираль»

Нуклеотидный состав и величина хромосом у различных организмов Вид число наборов хромосом число пар оснований общая длина (в мм) E. coli 1 n 14 x 10 6 1. 4 Дрожжи 2 n 322. 8 x 107 9. 2 Дрозофила 2 n 83. 4 x 108 112 Человек 2 n 467. 8 x 109 1980

Структура и функции РНК (отличия от ДНК) • Азотистые основания А У Г Ц • Сахар рибоза • Присутствуют МИНОРНЫЕ азотистые основания и нуклеозиды (псевдоуридин, дигидроуридин, риботимидин) • Размер молекулы • Разновидности р. РНК, т. РНК, и. РНК, гя. РНК, мя. РНК • Одноцепочечная • Локализация • Функции

~ 80% всей клеточной РНК находится в составе рибосом. Это рибосомная РНК. Главная функция структурная организация рибосомы. 15% РНК клетки транспортная РНК, выполняет 2 основные фунции: (1) активирование и перенос аминокислот и (2) адапторную функцию - перевод "языка" генетического кода (последовательность нуклеотидов) на "язык" структуры белковой молекулы (аминокислотная последовательность). Каждая аминокислота имеет несколько специфичных для нее транспортных РНК.

5 % всей РНК клетки - информационная РНК. Является комплементарной копией генов, кодирующих белки. Она используется как матрица на рибосоме во время сборки полипептидной цепи. Информосома – и. РНК, связанная с белками ~ гя. РНК – первичный транскрипт РНК мя. РНК – принимает участие в «созревании» РНК (сплайсинге)
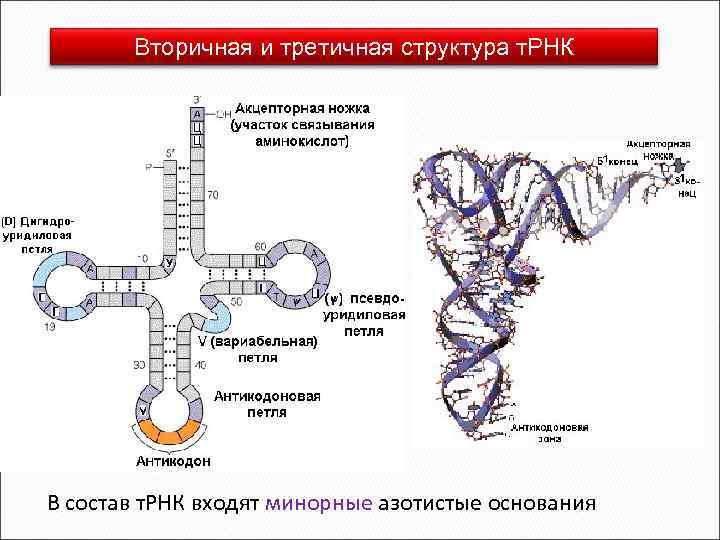
Вторичная и третичная структура т. РНК В состав т. РНК входят минорные азотистые основания
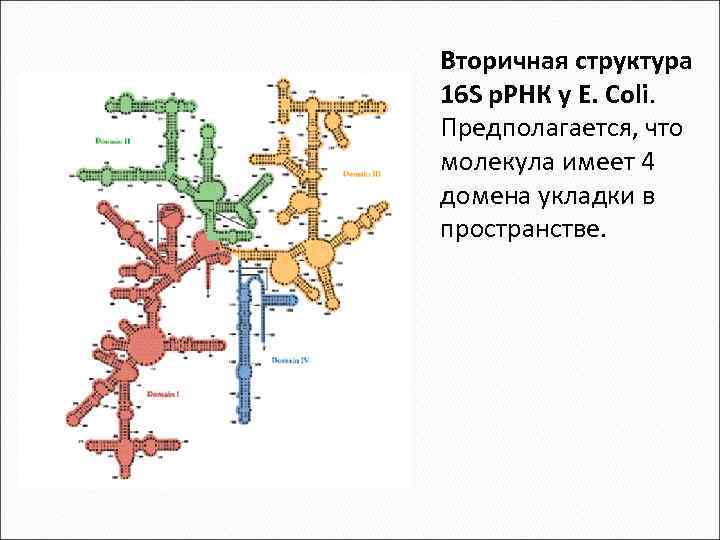
Вторичная структура 16 S р. РНК у E. Coli. Предполагается, что молекула имеет 4 домена укладки в пространстве.

В формировании третичной структуры р. РНК важную роль играют белки. При этом возникают большие внутриклеточные частицы рибосомы
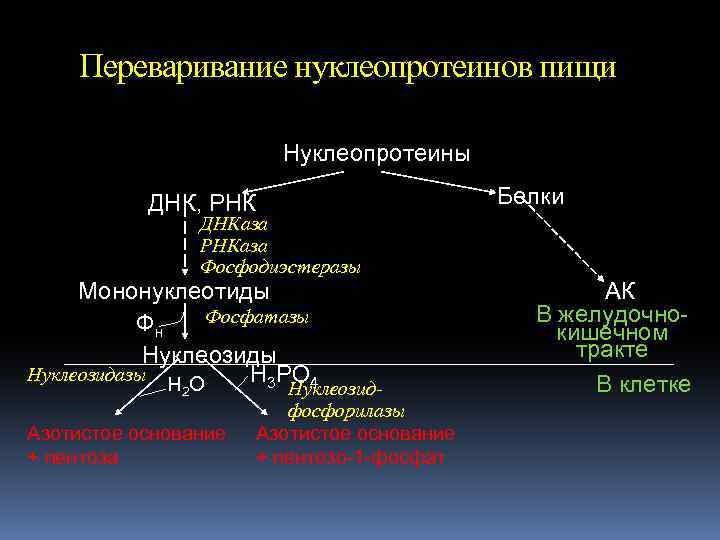
Переваривание нуклеопротеинов пищи Нуклеопротеины ДНК, РНК Белки ДНКаза РНКаза Фосфодиэстеразы Мононуклеотиды Фосфатазы Фн Нуклеозиды Нуклеозидазы Н 3 РО 4 НО 2 Азотистое основание + пентоза Нуклеозидфосфорилазы Азотистое основание + пентозо-1 -фосфат АК В желудочнокишечном тракте В клетке

Дальнейшая судьба пищевых азотистых оснований и нуклеозидов ~ 10 % Реутилизация (использование для синтеза нуклеотидов и нуклеиновых кислот в тканях) ~ 90 % Распад до конечных продуктов Конечные продукты распада пиримидинов: -аланин и -аминоизобутират, NH 4+, CO 2 (мочевина) Конечный продукт распада пуринов: мочевая кислота
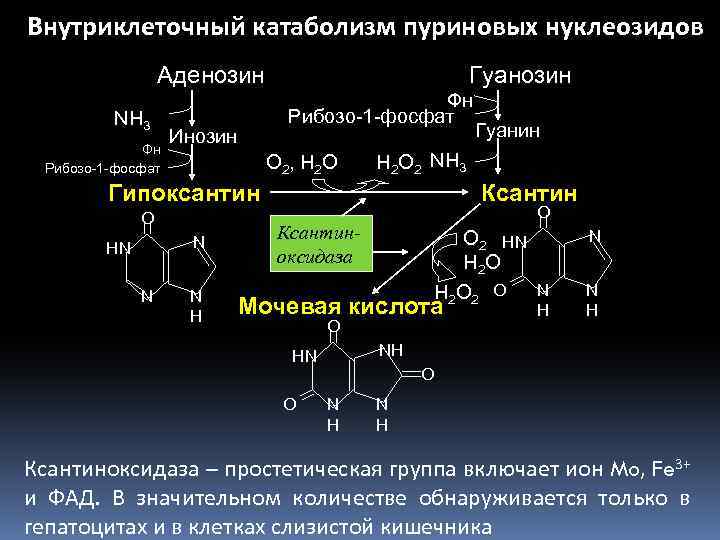
Внутриклеточный катаболизм пуриновых нуклеозидов Аденозин NH 3 Фн Рибозо-1 -фосфат Гуанозин Фн Рибозо-1 -фосфат Инозин О 2 , Н 2 О Н 2 О 2 NH 3 Гипоксантин O N HN N N H Гуанин Ксантин O Ксантиноксидаза О 2 HN Н 2 О 2 O Мочевая кислота O N H NH HN O H N O N H Ксантиноксидаза – простетическая группа включает ион Mo, Fe 3+ и ФАД. В значительном количестве обнаруживается только в гепатоцитах и в клетках слизистой кишечника

Мочевая кислота • выводится из организма с мочой. Почки активно ее реабсорбируют, поэтому ее концентрация в крови поддерживается на постоянном уровне 0. 15 -0. 50 ммоль/л. • слабая органическая кислота. Ионизированная форма мочевой кислоты (солевая) намного лучше растворяется в воде, чем ее протонированная форма (кислотная). Например, при р. Н 4. 8, когда молекула мочевой кислоты почти полностью протонирована (90%), можно растворить только одну десятую того, что растворяется при р. Н 6. 8, когда мочевая кислота на 90 % ионизирована. Так как р. Н мочи обычно ниже 5. 8, повышение уровня выводимой мочевой кислоты может привести к формированию камней в системе мочевыделения. • обладает антиоксидантными свойствами.
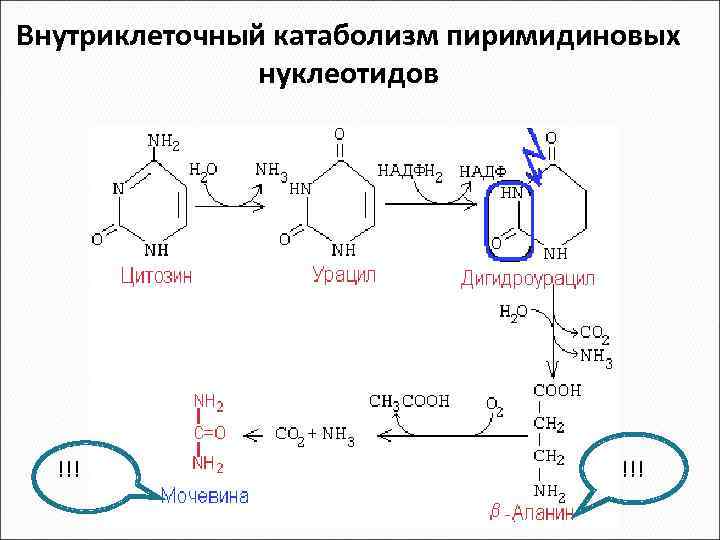
Внутриклеточный катаболизм пиримидиновых нуклеотидов !!!
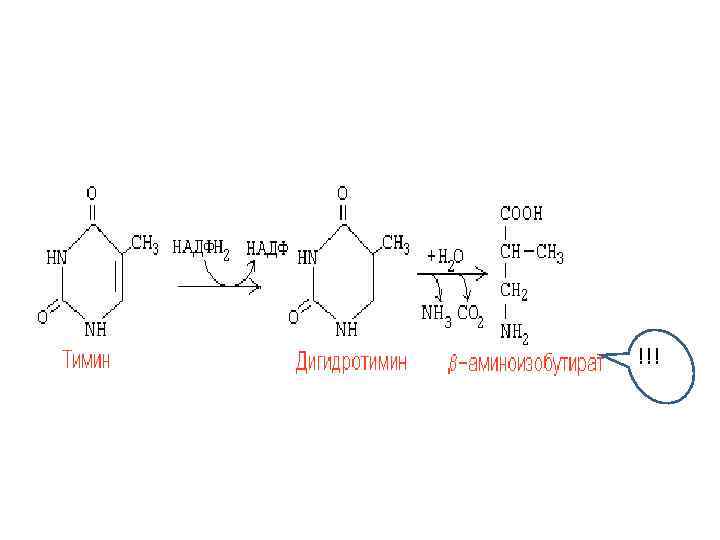
!!!

Судьба продуктов катаболизма пиримидиновых нуклеотидов Бета-аланин • используется в мышцах на образование дипептидов: карнозина и анзерина • включается в пантотеновую кислоту, которая всасывается и используется на образование Ко. А Бета-аминоизобутират • превращается в малонил-Ко. А и сукцинил-Ко. А • частично экскретируется с мочой
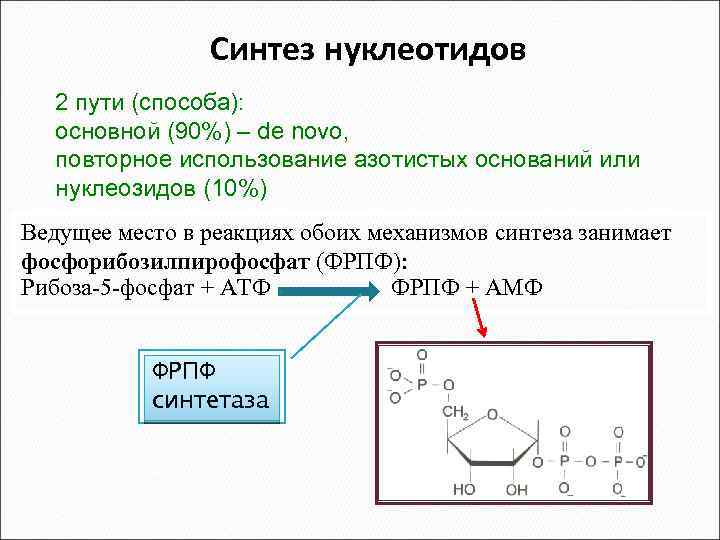
Синтез нуклеотидов 2 пути (способа): основной (90%) – de novo, повторное использование азотистых оснований или нуклеозидов (10%) Ведущее место в реакциях обоих механизмов синтеза занимает фосфорибозилпирофосфат (ФРПФ): Рибоза-5 -фосфат + АТФ ФРПФ + АМФ ФРПФ синтетаза
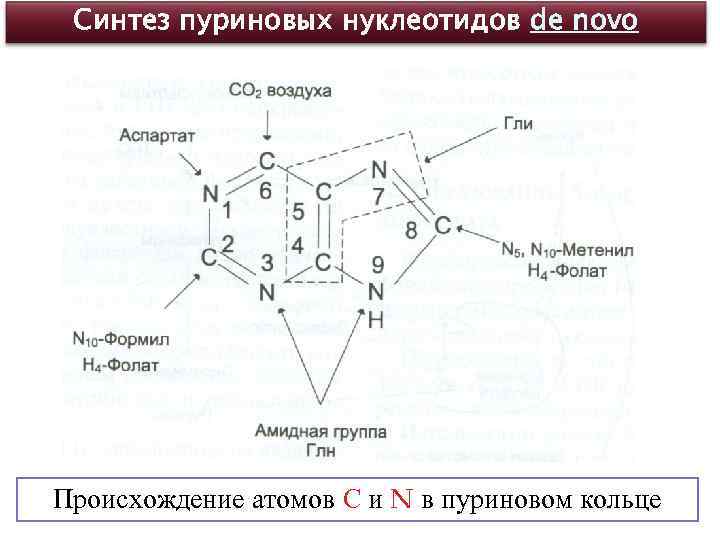
Синтез пуриновых нуклеотидов de novo Происхождение атомов С и N в пуриновом кольце
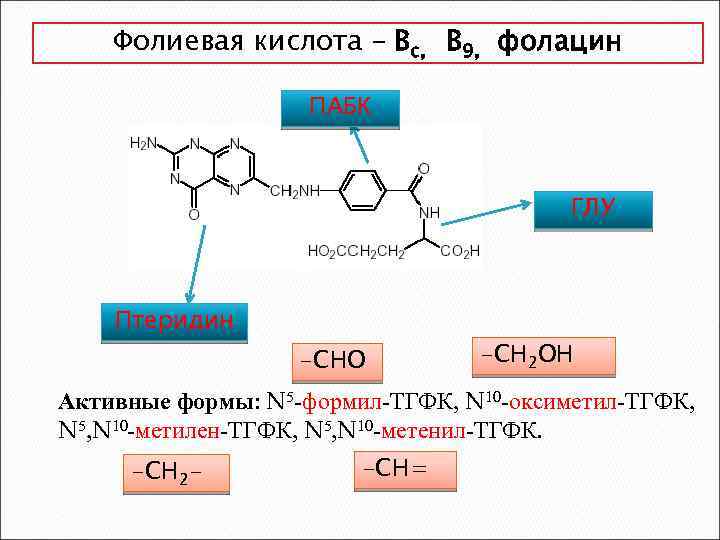
Фолиевая кислота – Вс, В 9, фолацин ПАБК ГЛУ Птеридин -СНО -СН 2 ОН Активные формы: N 5 -формил-ТГФК, N 10 -оксиметил-ТГФК, N 5, N 10 -метилен-ТГФК, N 5, N 10 -метенил-ТГФК. -СН 2 - -СН=
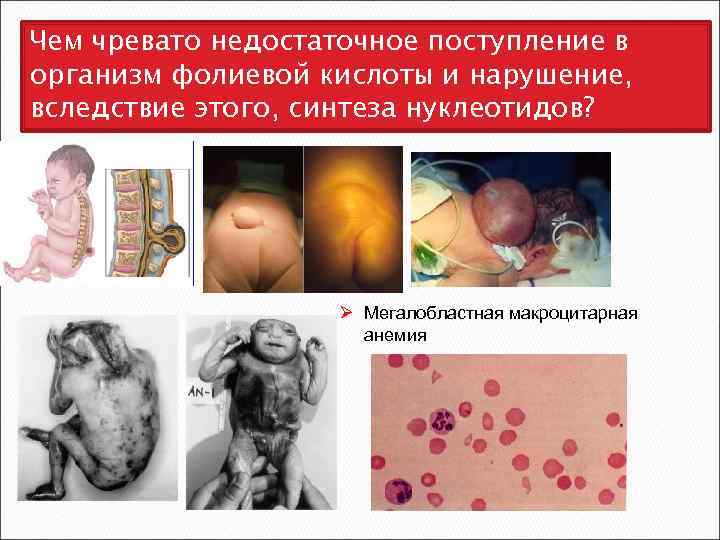
Чем чревато недостаточное поступление в организм фолиевой кислоты и нарушение, вследствие этого, синтеза нуклеотидов? Ø Мегалобластная макроцитарная анемия
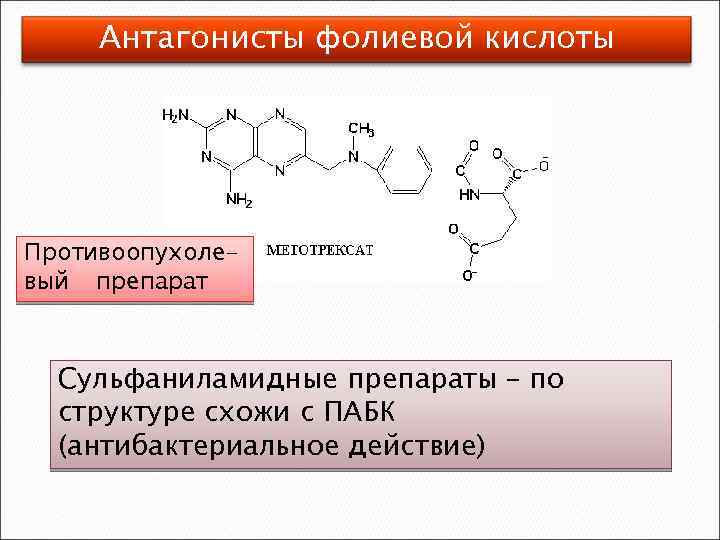
Антагонисты фолиевой кислоты Противоопухолевый препарат Сульфаниламидные препараты – по структуре схожи с ПАБК (антибактериальное действие)
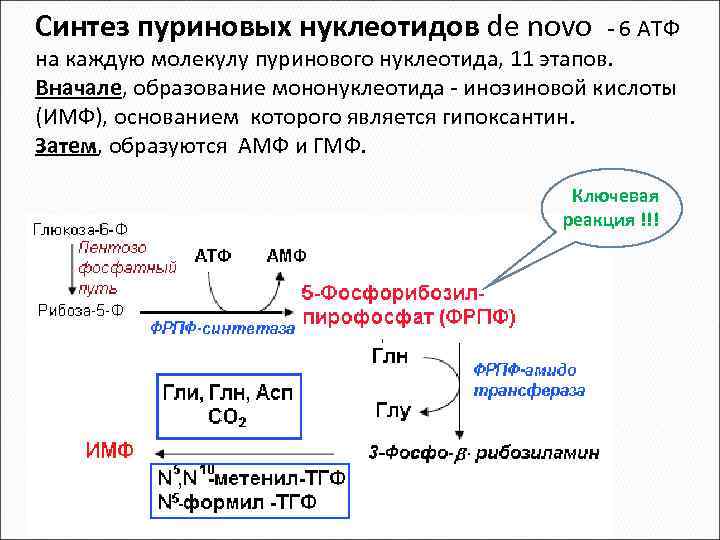
Синтез пуриновых нуклеотидов de novo - 6 АТФ на каждую молекулу пуринового нуклеотида, 11 этапов. Вначале, образование мононуклеотида - инозиновой кислоты (ИМФ), основанием которого является гипоксантин. Затем, образуются АМФ и ГМФ. Ключевая реакция !!!
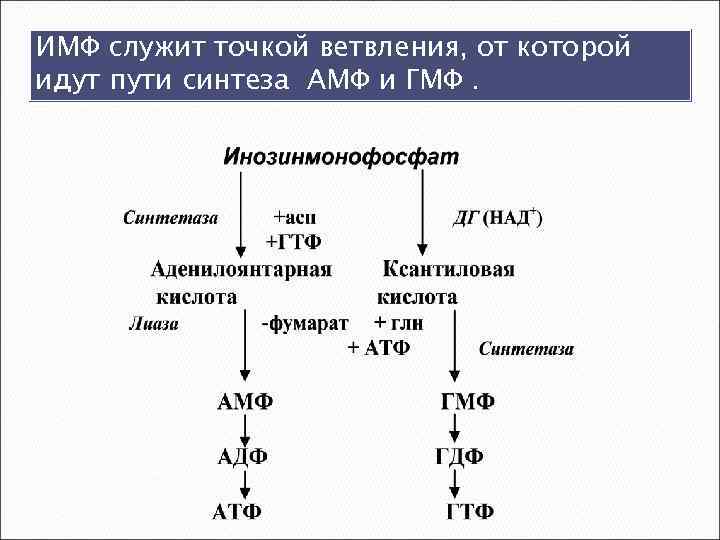
ИМФ служит точкой ветвления, от которой идут пути синтеза АМФ и ГМФ.
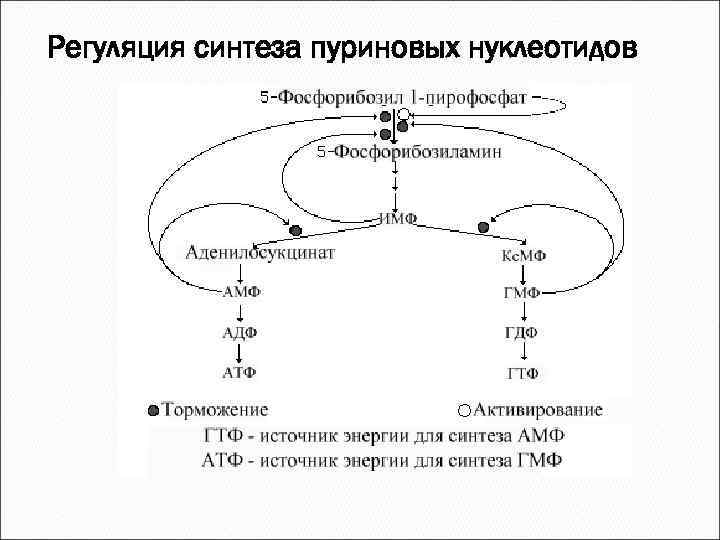
Регуляция синтеза пуриновых нуклеотидов

В отличие от синтеза пуриновых нуклеотидов синтез пиримидиновых нуклеотидов de novo начинается с образования основания, и только затем к нему присоединяется углеводная половина.
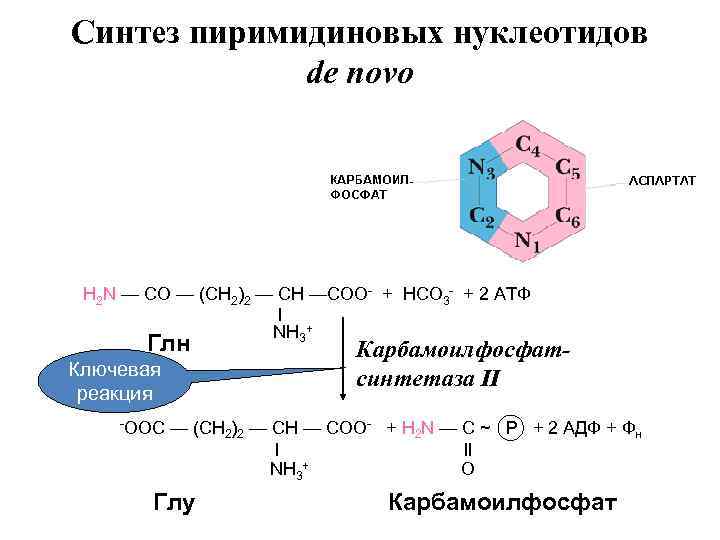
Синтез пиримидиновых нуклеотидов de novo H 2 N — CO — (CH 2)2 — CH —COO- + HCO 3 - + 2 АТФ l NH 3+ Глн Ключевая реакция -OOC Карбамоилфосфатсинтетаза II — (CH 2)2 — CH — COO- + H 2 N — C ~ P + 2 АДФ + Фн l ll NH 3+ О Глу Карбамоилфосфат
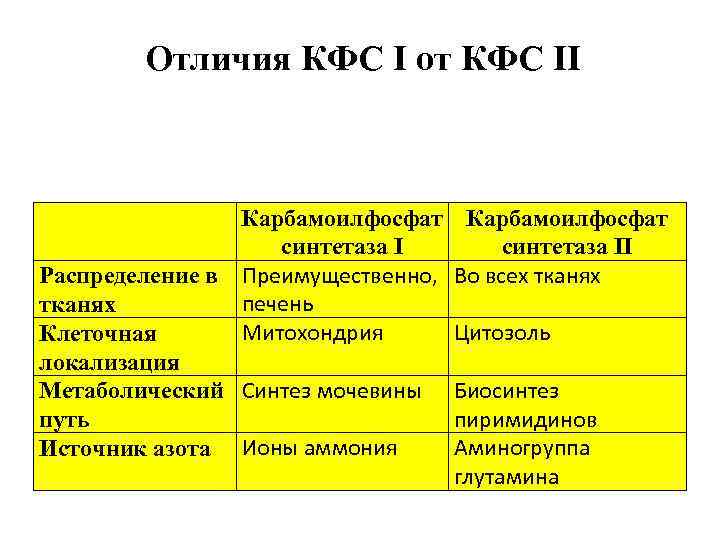
Отличия КФС I от КФС II Карбамоилфосфат синтетаза II Распределение в Преимущественно, Во всех тканях печень тканях Митохондрия Цитозоль Клеточная локализация Метаболический Синтез мочевины Биосинтез пиримидинов путь Аминогруппа Источник азота Ионы аммония глутамина

Синтез пиримидиновых нуклеотидов de novo (продолжение) Карбамоилфосфат + Аспартаткарбомоилтрансфераза Карбамоиласпартат Дигидрооротаза Н 2 О Дигидрооротовая кислота НАД+ ДГ НАДНН+ Оротовая кислота Фосфорибозилтрансфераза ФРПФ Оротидинмонофосфат СО 2 Декарбоксилаза УМФ
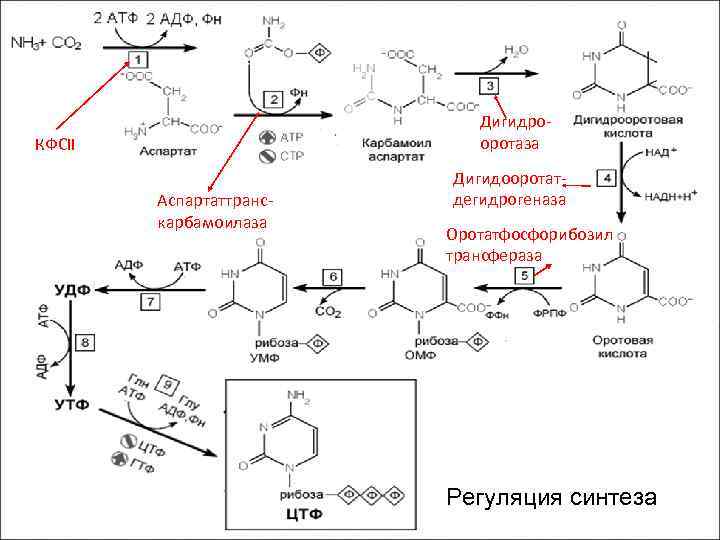
Дигидрооротаза КФСII Аспартаттранскарбамоилаза Дигидооротатдегидрогеназа Оротатфосфорибозил трансфераза Регуляция синтеза
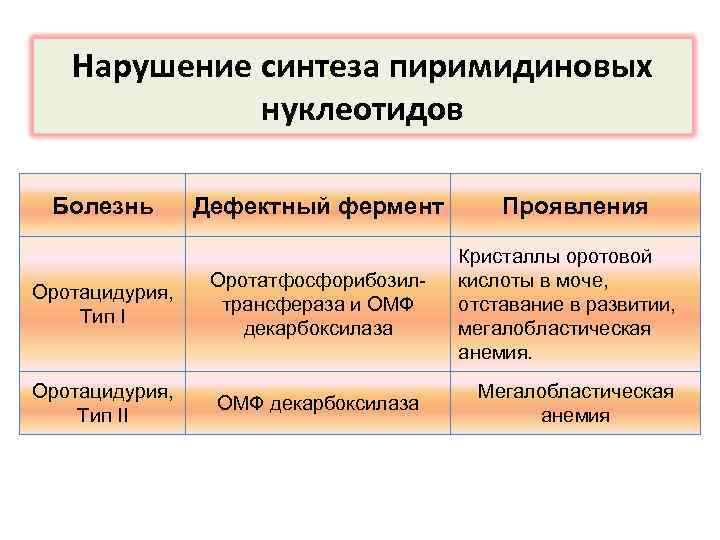
Нарушение синтеза пиримидиновых нуклеотидов Болезнь Дефектный фермент Оротацидурия, Тип I Оротатфосфорибозилтрансфераза и OMФ декарбоксилаза Оротацидурия, Тип II ОМФ декарбоксилаза Проявления Кристаллы оротовой кислоты в моче, отставание в развитии, мегалобластическая анемия. Мегалобластическая анемия
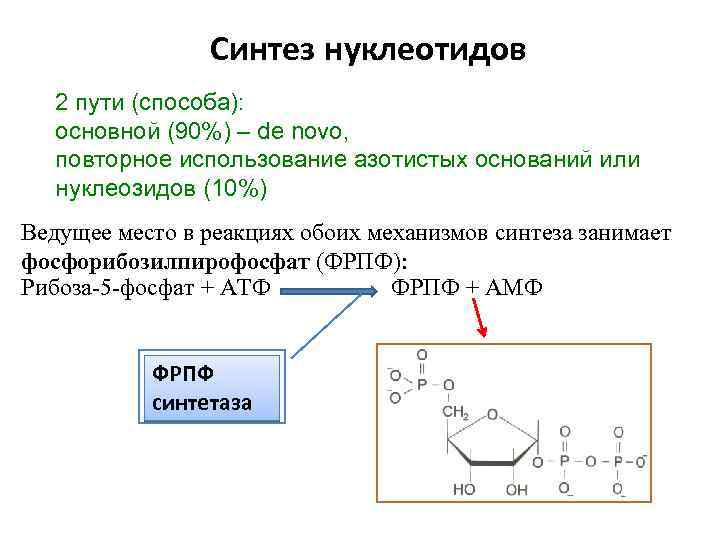
Синтез нуклеотидов 2 пути (способа): основной (90%) – de novo, повторное использование азотистых оснований или нуклеозидов (10%) Ведущее место в реакциях обоих механизмов синтеза занимает фосфорибозилпирофосфат (ФРПФ): Рибоза-5 -фосфат + АТФ ФРПФ + АМФ ФРПФ синтетаза
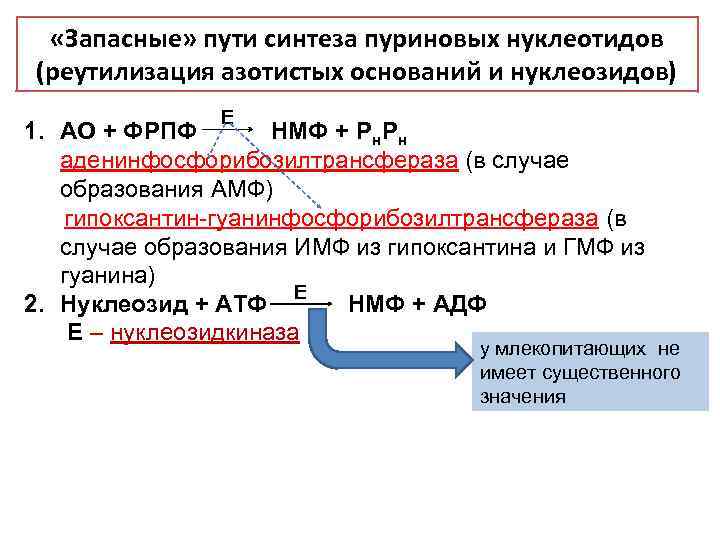
«Запасные» пути синтеза пуриновых нуклеотидов (реутилизация азотистых оснований и нуклеозидов) Е 1. АО + ФРПФ НМФ + Рн. Рн аденинфосфорибозилтрансфераза (в случае образования АМФ) гипоксантин-гуанинфосфорибозилтрансфераза (в случае образования ИМФ из гипоксантина и ГМФ из гуанина) Е 2. Нуклеозид + АТФ НМФ + АДФ Е – нуклеозидкиназа у млекопитающих не имеет существенного значения

Нарушения в работе ФРПФ синтетазы (гиперактивация) или сниженная активность гипоксантин-гуанин- или аденинфосфорибозилтрансфераз (генетические дефекты) приводят к подагре (вследствие гиперурикемии).
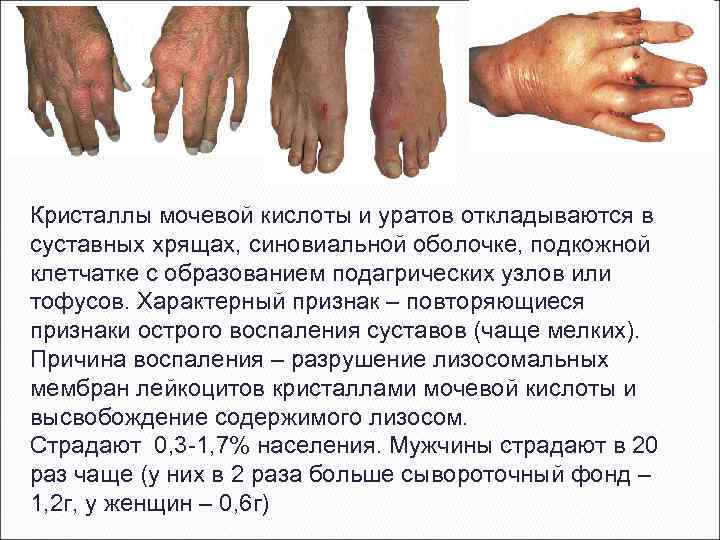
Кристаллы мочевой кислоты и уратов откладываются в суставных хрящах, синовиальной оболочке, подкожной клетчатке с образованием подагрических узлов или тофусов. Характерный признак – повторяющиеся признаки острого воспаления суставов (чаще мелких). Причина воспаления – разрушение лизосомальных мембран лейкоцитов кристаллами мочевой кислоты и высвобождение содержимого лизосом. Страдают 0, 3 -1, 7% населения. Мужчины страдают в 20 раз чаще (у них в 2 раза больше сывороточный фонд – 1, 2 г, у женщин – 0, 6 г)

Тяжелая форма гиперурикемии – синдром Лёша-Нихена. Наследуется как рецессивный признак, сцепленный с Х-хромосомой и проявляется только у мальчиков в раннем возрасте (тофусы, уратные камни в мочевыводящих путях и серьезные неврологические отклонения с нарушением речи, церебральными параличами, снижением интеллекта, склонностью к нанесению себе увечий – укусы губ, языка, пальцев). При отсутствии лечения предельный возраст – 10 лет, смерть – из-за нарушения функции почек.

Причина - полное отсутствие активности гипоксантингуанинфосфорибозилтрансферазы. Концентрация мочевой кислоты в плазме крови в 2 -3 раза превышает норму. Самый ранний симптом в первые месяцы жизни – розовые и оранжевые пятна на пеленках, вызванные присутствием в моче кристаллов мочевой кислоты
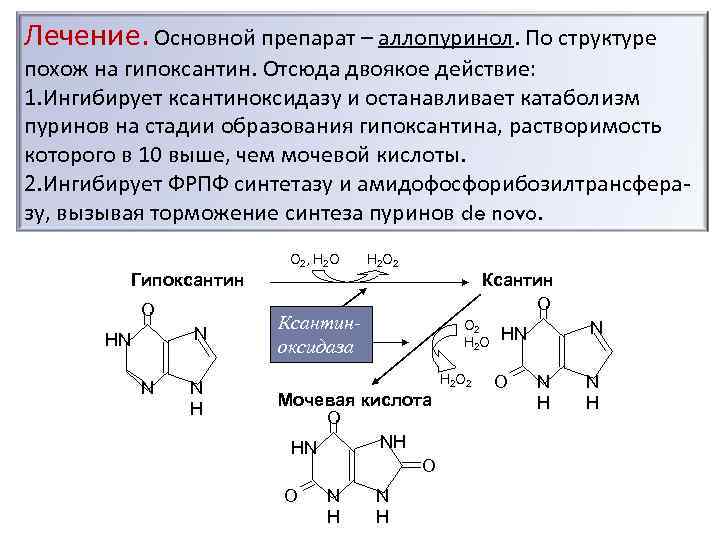
Лечение. Основной препарат – аллопуринол. По структуре похож на гипоксантин. Отсюда двоякое действие: 1. Ингибирует ксантиноксидазу и останавливает катаболизм пуринов на стадии образования гипоксантина, растворимость которого в 10 выше, чем мочевой кислоты. 2. Ингибирует ФРПФ синтетазу и амидофосфорибозилтрансферазу, вызывая торможение синтеза пуринов de novo. О 2, Н 2 О 2 Гипоксантин O N HN N N H Ксантин O Ксантиноксидаза О 2 Н 2 О 2 Мочевая кислота O NH HN O O N H N HN O N H

«Запасные» пути синтеза пиримидиновых нуклеотидов (реутилизация азотистых оснований и нуклеотидов) уридинфосфорилаза 1. Урацил + Рибоза-1 -фосфат Уридин + Н 3 РО 4 Киназа дезаминаза УМФ 2. ЦМФ + Н 2 О УМФ + NH 3
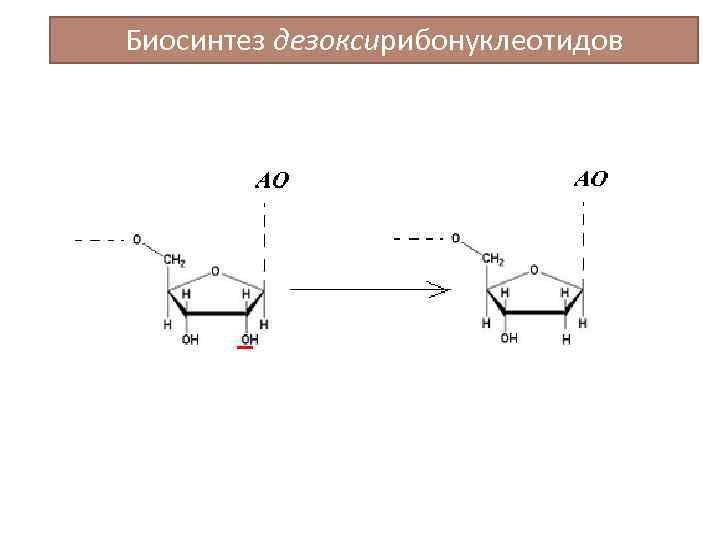
Биосинтез дезоксирибонуклеотидов
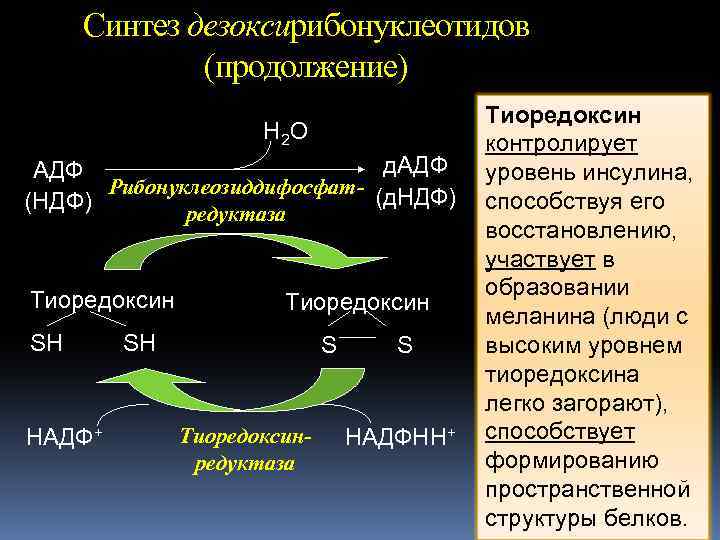
Синтез дезоксирибонуклеотидов (продолжение) H 2 O д. АДФ Рибонуклеозиддифосфат- (д. НДФ) (НДФ) редуктаза Тиоредоксин SH НАДФ+ Тиоредоксин SH S Тиоредоксинредуктаза S НАДФНН+ Тиоредоксин контролирует уровень инсулина, способствуя его восстановлению, участвует в образовании меланина (люди с высоким уровнем тиоредоксина легко загорают), способствует формированию пространственной структуры белков.

При участии РНР образуются д. АДФ, д. ГДФ, д. УДФ и д. ЦДФ, 3 из которых используются в синтезе ДНК: д. НДФ + АТФ → д. НТФ + АДФ синтез ДНК Первыми восстанавливаются пиримидиновые нуклеотиды, а последним – д. АДФ. Затем д. АДФ фосфорилируется в д. АТФ. Накопление д. АТФ полностью прекращает восстановление всех остальных рибонуклеозиддифосфатов

При недостаточности аденозиндезаминазы страдают T и Bлимфоциты, развивается тяжелый хронический иммунодефицит. Причина – накопление в клетках д. АТФ, который ингибирует рибонуклеозидредуктазу (РНР). Нарушается синтез ДНК. Для клеток нелимфоцит. ряда это не опасно, т. к. работает фосфатаза д. АТФ. При недостаточности фосфорилазы нарушается функция T клеток (там высокая активность дезоксигуанозинкиназы, накапливается д. ГТФ, что тормозит РНР), в то время как B клетки остаются нормальными. Болезнь обычно фатальна у новорожденных , если не предпринимать специальные защитные меры
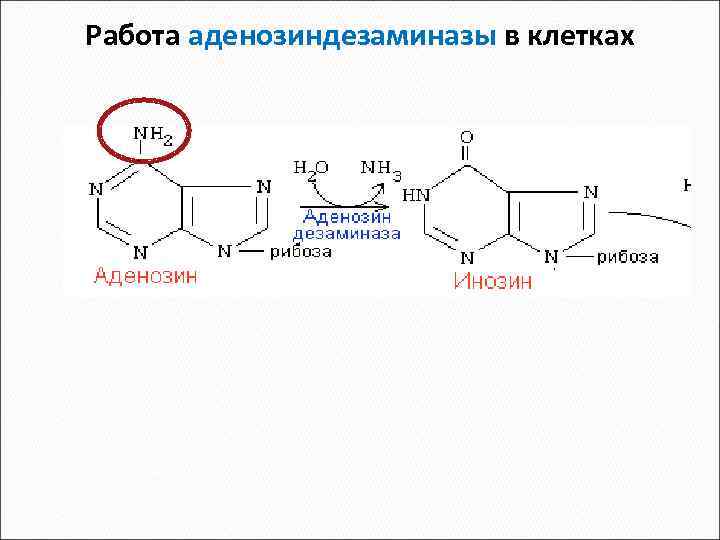
Работа аденозиндезаминазы в клетках
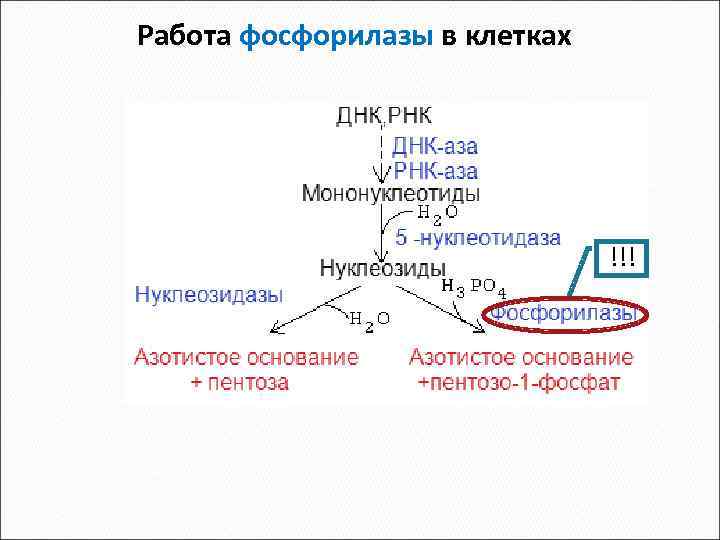
Работа фосфорилазы в клетках !!!
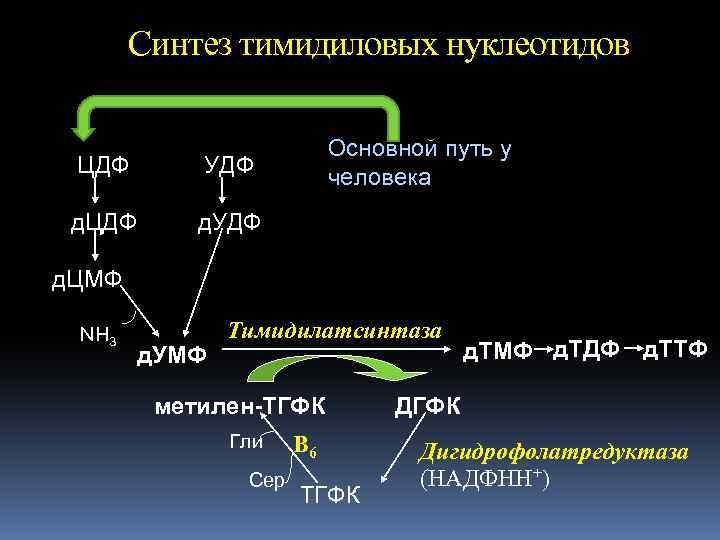
Синтез тимидиловых нуклеотидов ЦДФ УДФ д. ЦДФ Основной путь у человека д. УДФ д. ЦМФ NH 3 д. УМФ Тимидилатсинтаза метилен-ТГФК Гли Сер В 6 ТГФК д. ТМФ д. ТДФ д. ТТФ ДГФК Дигидрофолатредуктаза (НАДФНН+)

Аналоги д. НТФ, которые включаются ДНКполимеразами в ДНК и ингибируют репликацию. Мощные противоопухолевые препараты. Их действие основано на том, что 1) через «запасные» пути из них образуются нуклеотиды, которые блокируют тимидилат синтазу - 5 -фторурацил (аналог урацила), 2) тот же эффект, но путем имитации фолиевой кислоты (метотрексат, аминоптерин) или 3) ингибировать ДНКполимеразу – цитозинарабинозид (цитарабин). Антивирусные и антибактериальные препараты: азидотимидин (ретровирусная инфекция – ВИЧ), 5 -йоддезоксиуридин (вирус герпеса), азатиоприн (в организме превращается в 6 -меркаптопурин, оказывающий мощное иммуносупрессорное действие)
Обмен белков1.ppt