Обмен белков Лекция 1.pptx
- Количество слайдов: 44

Обмен белков новая версия

Незаменимость белков • Из 20 протеиногенных аминокислот – 10 незаменимы (аргинин, гистидин, метионин, фенилаланин, триптофан, лизин, треонин, изолейцин, валин) • Белковая недостаточность – патологическое состояние с нарушением функций: пластической(масса органов и тканей), каталитической, регуляторной (гормоны), появление неизвестных, необычных продуктов обмена

Динамическое состояние белков • Постоянный интенсивный синтез и распад белков: белки печени, сыворотки крови, слизистой кишечника – 10 дней обновление; антитела – 2 недели; гормоны – часы и минуты • Постоянное смешивание аминокислот из белков пищи и собственных (эндогенных) аминокислот (метаболический пул) • Тесная связь с обменом углеводов и липидов через пируват, оксалоацетат, альфакетоглутарат

Биологическая ценность белка • Суточная норма – 100 -120 г белка (возраст, климат, профессия, пол, стиль жизни, беременность, болезни и т. п. ) • Биологическая ценность – близость аминокислотного состава пищевого белка составу тела (мясо, яйца) • Степень усвоения (белки шерсти, волос не гидролизуются в ЖКТ) • Понятие азотистого баланса (положительный и отрицательный, примеры ситуаций) • Значение отдельных аминокислот (недостаток валина и лизина – остановка роста, клинические отрицательные эффекты)

Особенности • Белковых депо (резервуаров) нет • При голодании некоторые органы легко и быстро худеют (печень, мышцы, плазма крови), но не сердце и не мозг • Белки можно вводить только через ЖКТ, парентеральное введение – это сенсибилизация, анафилаксия и смерть. Причина – видовая и тканевая специфичность белков, но не аминокислот (они для всех одинаковы) • Замена белков аминокислотной смесью (при операциях на ЖКТ) не должна быть длительной, т. к. нарушается психика

Переваривание белка • Огромное разнообразие пищевых белков – это трудность для переваривания (гидролиза). Ферменты-пептидазы узнают радикалы аминокислот, т. е. свои места действия • Эндопептидазы: пепсин, гастриксин, реннин – ферменты желудка. Трипсин, химотрипсин, эластаза – из сока поджелудочной железы. При остром панкреатите уровень выхода трипсина в кровь – маркер некротического участка • Эндопептидазы: карбоксипептидаза (из поджелудочной железы) активируется трипсином в кишечнике, аминопептидазы – синтезируются в клетках слизистой кишечникка. Дипептидазы завершают в тонком кишечнике гидролиз белка до аминокислот

Ограниченный протеолиз • Протеиназы – не только ферменты для пищеварения (превращения белков в аминокислоты). Их роль более широкая • Они участвуют в системе свертывания крови, лизисе клеток, активации гормонов, превращают неактивные ферменты в активные • Сущность органического протеолиза в избирательном отщеплении коротких пептидов, прикрывающих активные центры (участки) ферментов, гормонов, что приводит к их активации (профермент – фермент)

Переваривание в желудке • Оптимальные условия: активный пепсин, необходимый р. Н 1, 5 -2, 0, свободная НCl • Роль НСl: активация пепсиногена, создание среды, содействие набуханию белков, частичная денатурация, гидролиз сложных белков, бактерицидное действие (без нее – гниение в желудке), ускорение всасывания железа, стимуляция выработки секретина • При поражениях желудка (воспаления, операции) серьезно нарушается переваривание белков и секреция НСl • Общая кислотность – 40 -60 мкмоль/л, свободная НСl – 20 -40 мкмоль/л, связанная НСl 10 -20 мкмоль/л

Превращение аминокислот в кишечнике • Это по сути – гниение. Частично этим питается микрофлора. Образуются токсичные продукты: фенол, индол, крезол, скатол, сероводород, амины, кислоты, спирты • Эти продукты попадают в печень, обезвреживаются и выделяются с мочой • Механизм детоксикации – связывание их с серной или глюкуроновой кислотой, глицином или окисление • О функции печени судят по связыванию бензойной кислоты с глицином (продукт – гиппуровая кислота – уходит в мочу)

Синтез и обезвреживание кадаверина
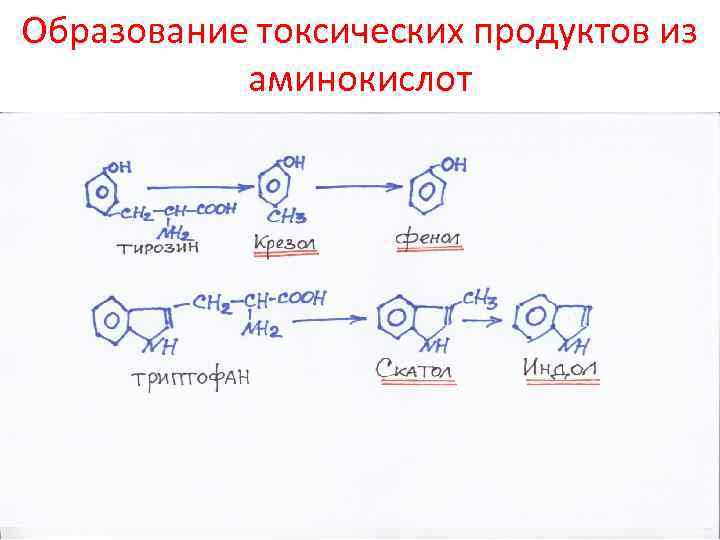
Образование токсических продуктов из аминокислот
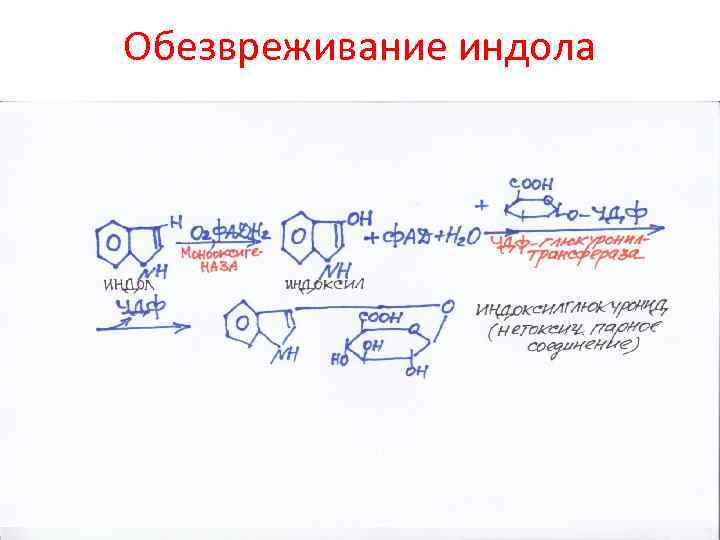
Обезвреживание индола
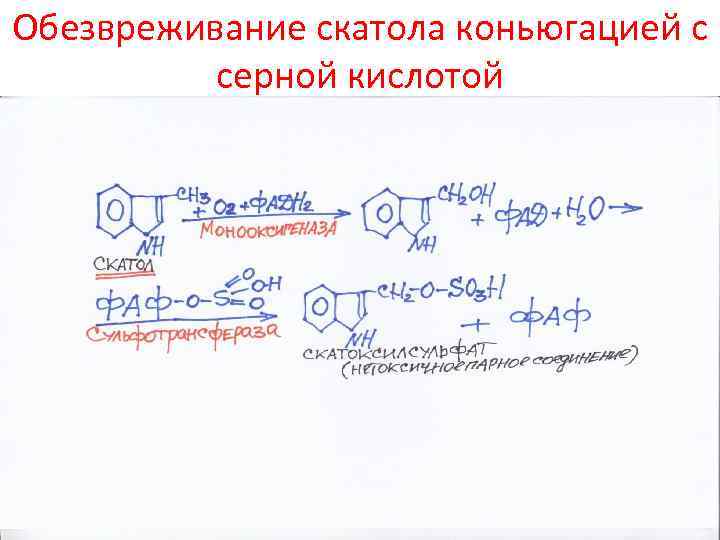
Обезвреживание скатола коньюгацией с серной кислотой

Обезвреживание бензойной кислоты. Гиппуровая кислота – тест на дезинтоксикационную функцию печени
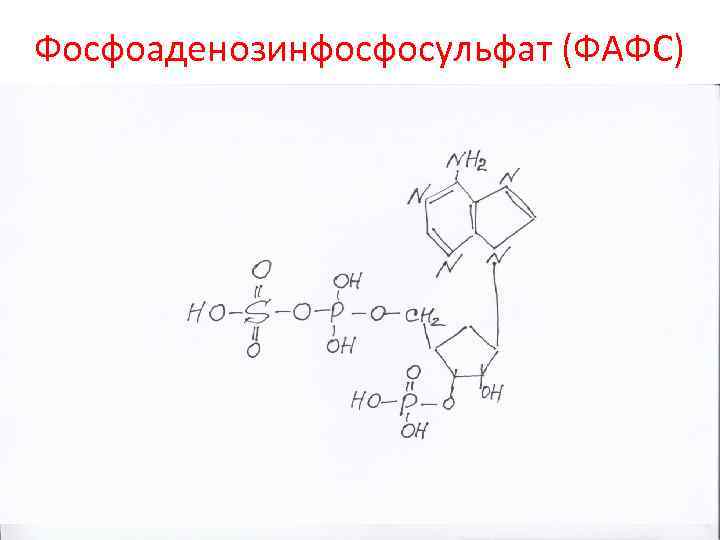
Фосфоаденозинфосфосульфат (ФАФС)
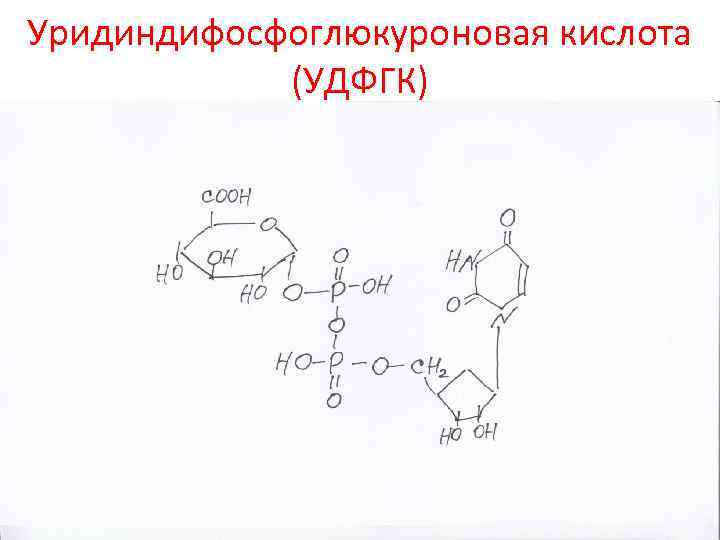
Уридиндифосфоглюкуроновая кислота (УДФГК)
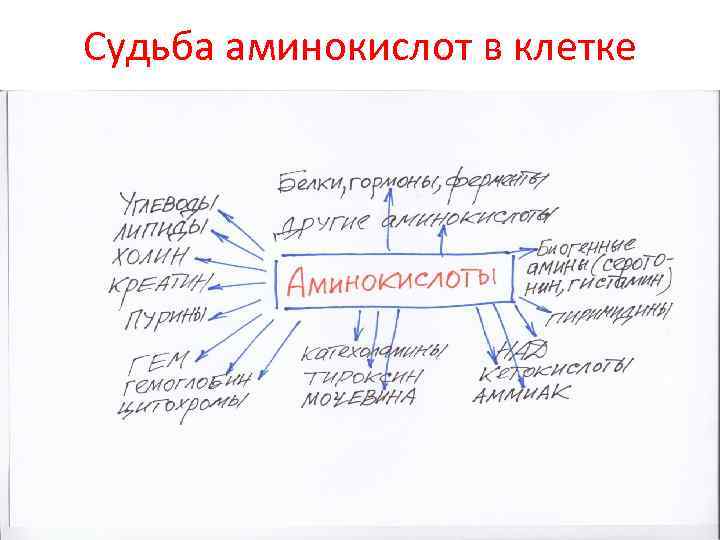
Судьба аминокислот в клетке
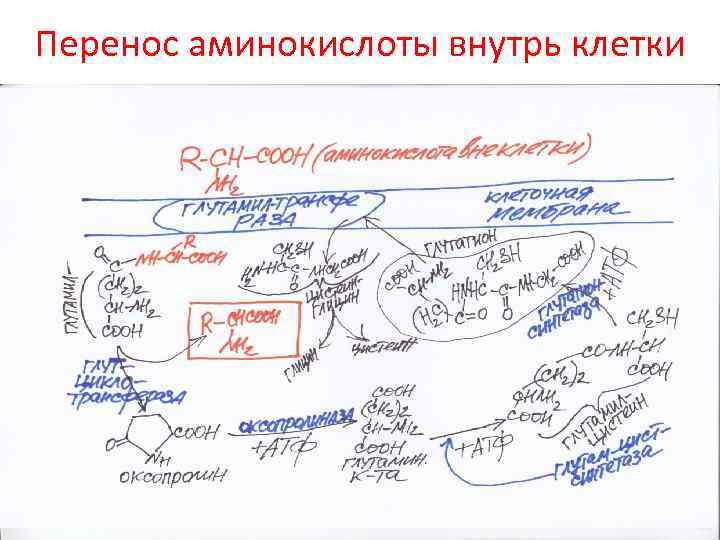
Перенос аминокислоты внутрь клетки

Протеолиз Протеиназы и пептидазы имеются не только в желудочно-кишечном тракте, но и в клетках. В активном центре таких протеиназ часто серин или цистеин. Часть ферментов заключена в лизосомы клетки, чтобы защитить белки от преждевременного расщепления. Другая часть ферментов, расщепляющих белки, содержится в протеосомах – бочковидных цитоплазматических комплексах с массой более 1 млн. Там разрушаются состарившиеся клеточные белки, молекула с ошибочной структурой. Такие молекулы предварительно связываются с небольшим белком – убиквитином, который после гидролиза белковой молекулы используется вновь.

Пути превращения аминокислот Дезаминирование кислот Общие пути превращения аминокислот – это дезаминирование, декарбоксилирование, трансаминирование, трансреанимирование и другие. Доказано 4 вида дезаминирования. Во всех случаях выделяется NH 3 (уходит аминогруппа из аминокислот). Остаются от аминокислот жирные кислоты, оксикислоты, кетокислоты. У человека преимущественно окислительный тип, а еще внутримолекулярный. Восстановительное и гидролитическое у микроорганизмов.

Окислительное дезаминирование

Внутримолекулярное (а), гидролитическое (б) и восстановительное (в) дезаминирование

Окислительное дезаминирование глутаминовой кислиты
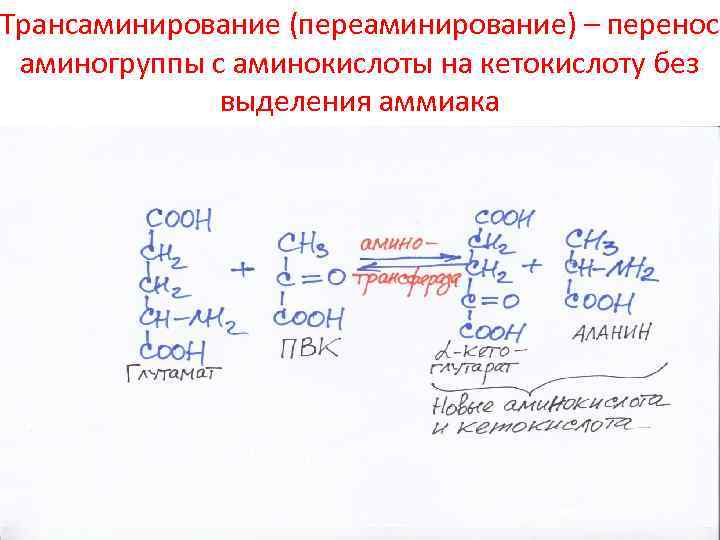
Трансаминирование (переаминирование) – перенос аминогруппы с аминокислоты на кетокислоту без выделения аммиака
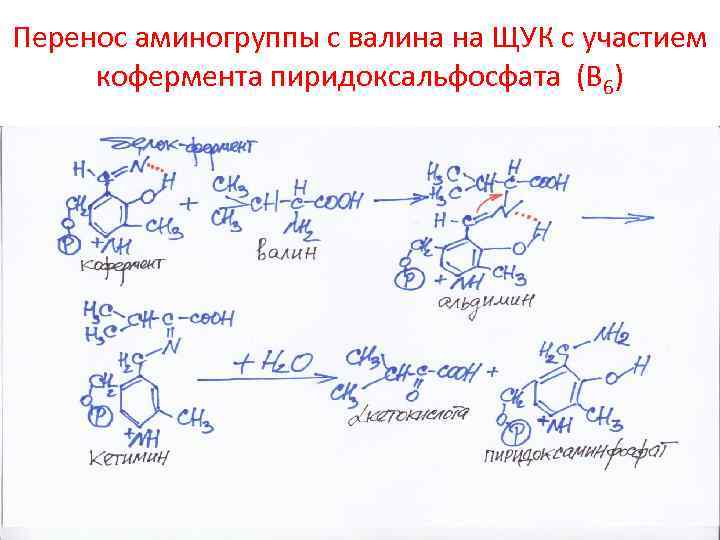
Перенос аминогруппы с валина на ЩУК с участием кофермента пиридоксальфосфата (В 6)
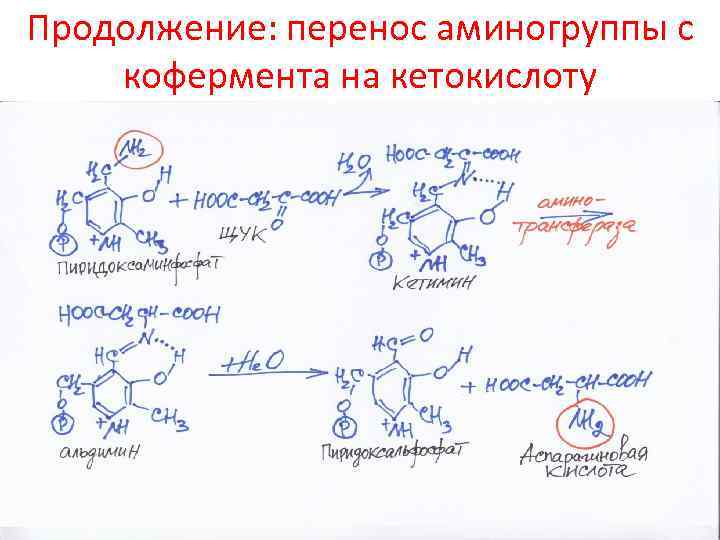
Продолжение: перенос аминогруппы с кофермента на кетокислоту
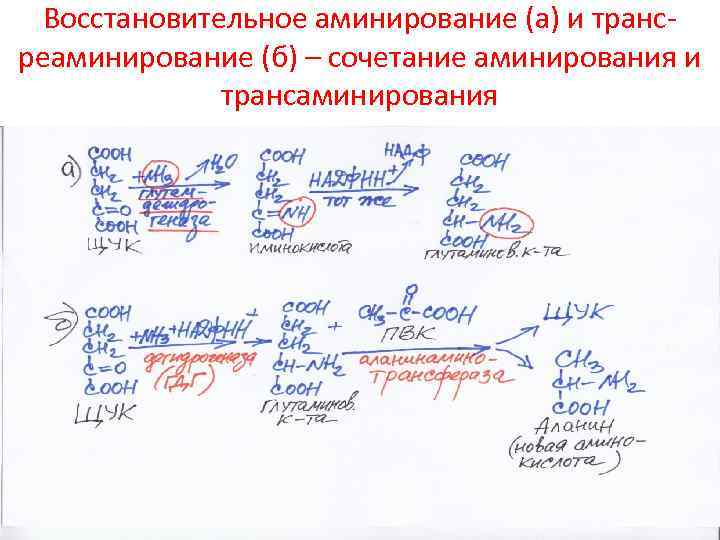
Восстановительное аминирование (а) и трансреаминирование (б) – сочетание аминирования и трансаминирования
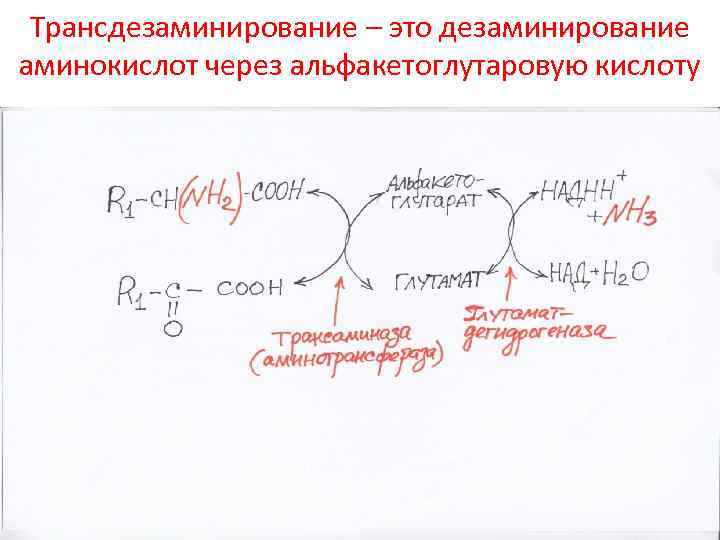
Трансдезаминирование – это дезаминирование аминокислот через альфакетоглутаровую кислоту
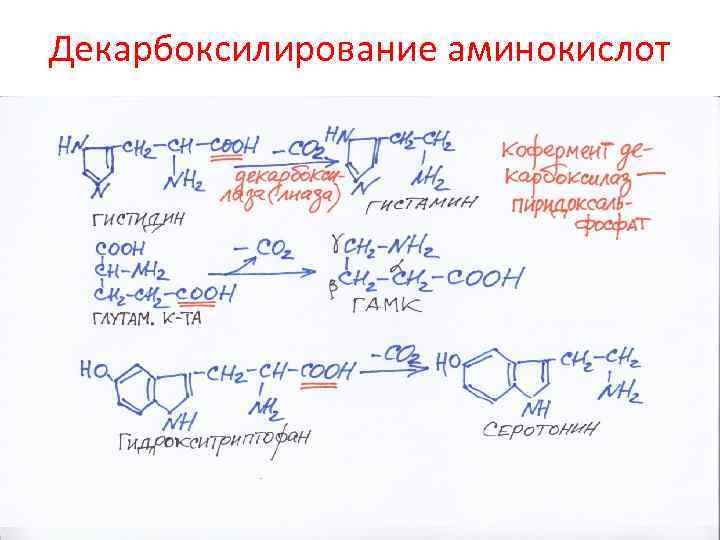
Декарбоксилирование аминокислот

Биологическое действие гистамина • Сосудорасширяющее действие • Гистамин образуется в зоне воспаления, там расширяются сосуды, растет приток лейкоцитов, возрастают защитные силы организма • Увеличивает секрецию соляной кислоты в желудке (гистаминовая проба) – тест на деятельность желудка • Медиатор боли, поэтому дают антигистаминные препараты (димедрол и др. ) • Эти же препараты применяют при повышенной чувствительности (сенсибилизации)

Биологическое действие серотонина • Высокоактивное сосудосуживающее действие • Регулирует артериальное давление, температуру, дыхание, почечную фильтрацию, медиатор нервных процессов • Серотонин причастен к развитию аллергии, токсикозу беременных • ЛСД – искусственный аналог серотонина, блокирует рецепторы (по аналогии) – нарушается обмен серотонина, что ведет к психическим заболеваниям

Синтез таурина из цистеина через декарбоксилирование

Синтез глутамина (а), аспарагина (б) и соли аммония (в)

Реакция, катализируемая глутаминазой

Распад аминокислот Продуктами распада аминокислот являются: пируват, ацетил Ко. А, фумарат, сукцинил Ко. А, оксалоацетат, альфа-кетоглутарат и другие. Конечные продукты: СО 2, аммиак, серная кислота (сульфаты), вода.

Судьба аммиака Аммиак возникает при дезаминировании аминокислот ( особенно в мышцах и печени), при распаде пуринов и пиримидинов, гидролизе глутамина, распаде гликозаминогликанов и азотсодержащих липидов, при гниении белков в кишечнике. Транспортируют аммиак глутамин и аспаргин. Обезвреживается аммиак путем синтезов мочевины, пуринов, пиримидинов, аминирования кетокислот и образования аммонийных солей в почках.
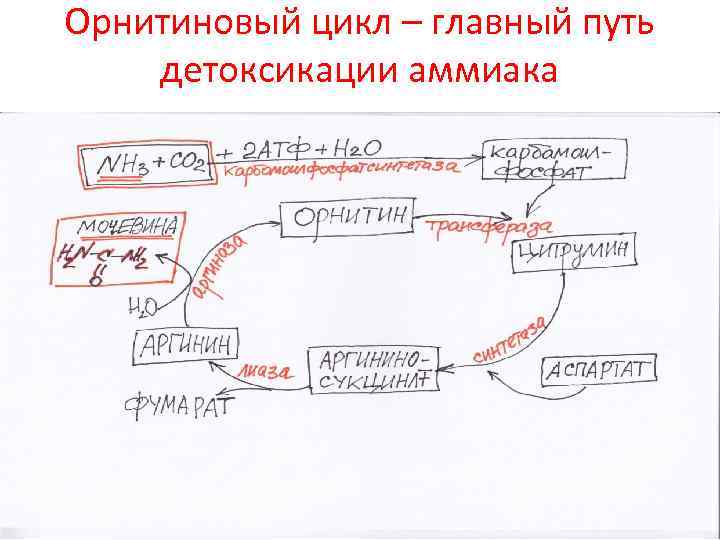
Орнитиновый цикл – главный путь детоксикации аммиака

Орнитиновый цикл (мочевинообразование)

Орнитиновый цикл (продолжение)

Происхождение атомов мочевины

Превращение (а) и катаболизм (б) глицина в тканях
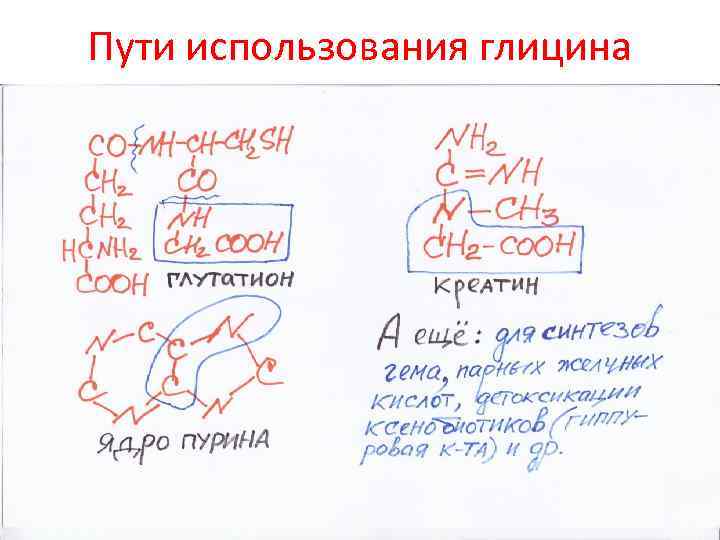
Пути использования глицина
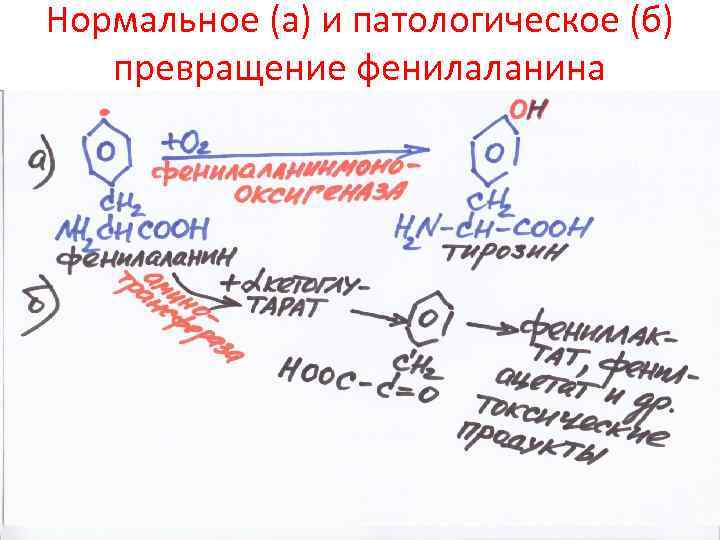
Нормальное (а) и патологическое (б) превращение фенилаланина
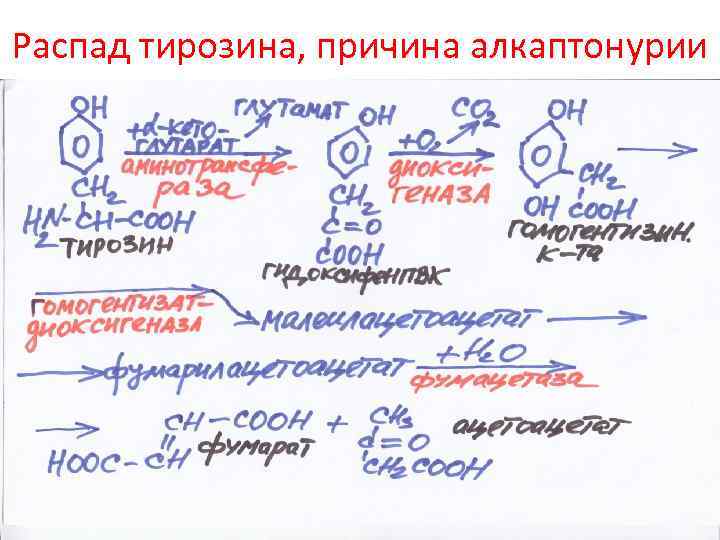
Распад тирозина, причина алкаптонурии
Обмен белков Лекция 1.pptx