Обмен белков и аминокислот.pptx
- Количество слайдов: 51

Обмен белков и аминокислот

План 1. Катаболизм аминокислот у животных, растений и бактерий. 2. Цикл мочевины. 3. Общие пути биосинтеза аминокислот.
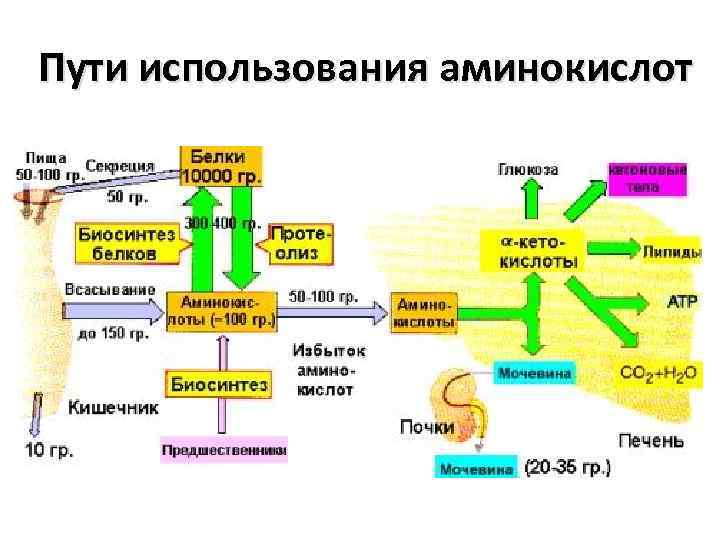
Пути использования аминокислот

ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ 1. Биосинтез аминокислот. 2. Общие пути биосинтеза аминокислот. 3. Катаболизм аминокислот у животных, растений и бактерий. 4. Цикл мочевины 5. Биосинтез аминокислот
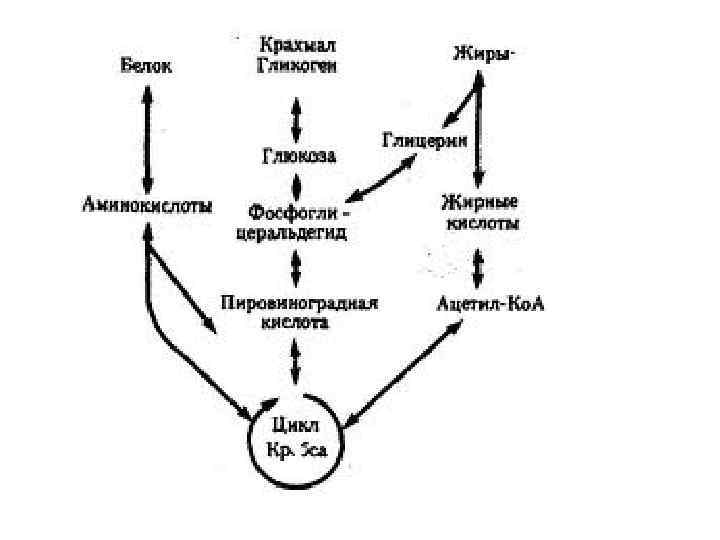
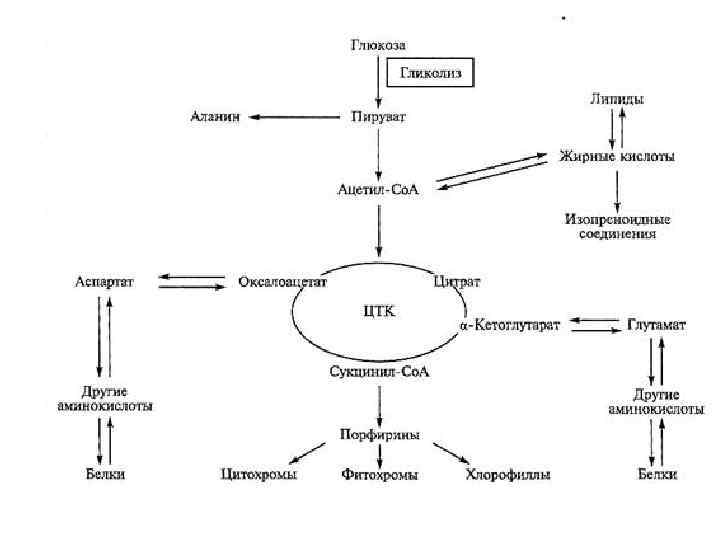
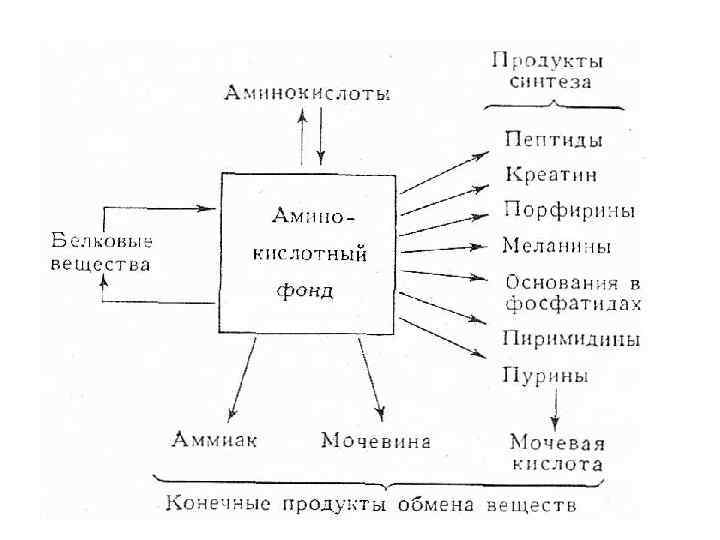
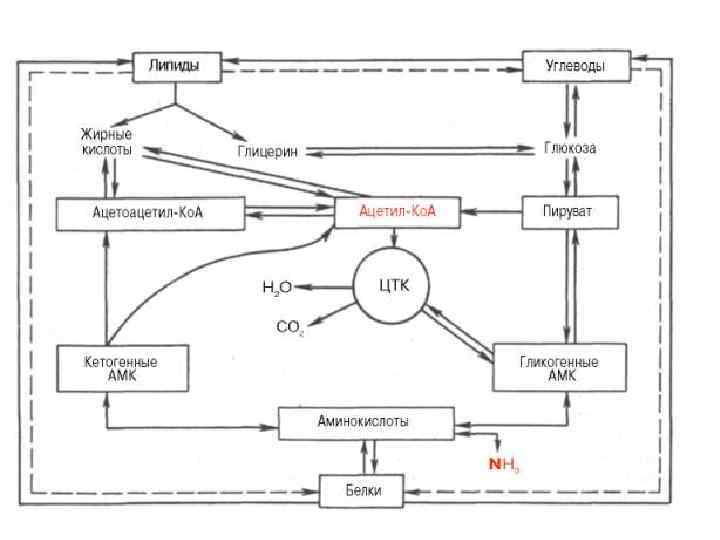

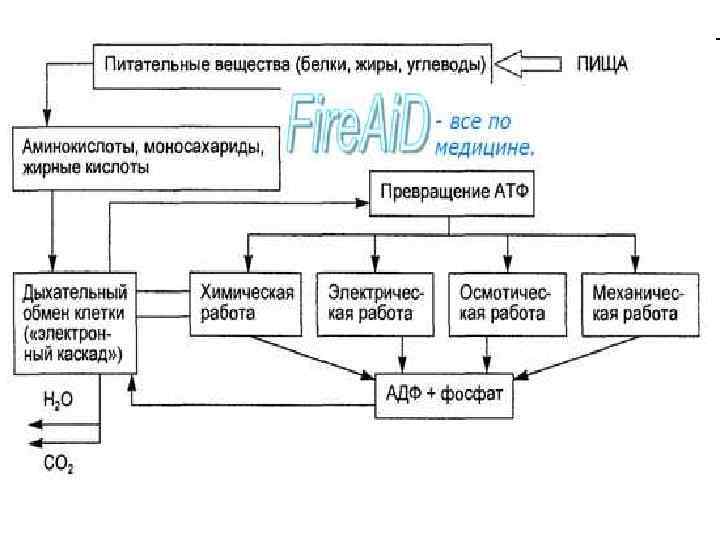

• В организме человека массой 70 кг содержится примерно 10 кг белка, большая его часть локализована в мышцах. • баланс азота в организме определяется метаболизмом белков, который регулируется, прежде всего гормонами тестостероном и кортизолом

• Полученные с пищей белки подвергаются полному гидролизу в желудочнокишечном тракте до аминокислот, которые всасываются и кровотоком распределяются в организме. • 8 (незаменимые аминокислоты из 20 белковых аминокислот не могут синтезироваться в организме человека. • Они должны поступать с пищей

• ежедневно необходимо получать с пищей не менее 30 г белка. • Аминокислоты не запасаются в организме, при избыточном поступлении аминокислот в печени окисляется или используется до 100 г аминокислот в сутки. • Содержащийся в них азот превращается в мочевину и в этой форме выделяется с мочой, • углеродный скелет используется в синтезе углеводов, липидов или окисляется с образованием АТФ.

• ежедневно разрушается до аминокислот 300400 г белка (протеолиз) • Одновременно примерно то же самое количество аминокислот включается во вновь образованные молекулы белков (белковый биосинтез).

оборот белка в организме • многие белки относительно недолговечны: они начинают обновляться спустя несколько часов после синтеза, а биохимический полупериод составляет 2 -8 дней. • Еще более короткоживущими оказываются ключевые ферменты промежуточного обмена. Они обновляются спустя несколько часов после синтеза. • постоянное разрушение и ресинтез позволяют клеткам быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов.


• • • Катаболизм аминокислот 1. Трансаминирование 2. Дезаминирование 3. Декарбоксилирование 4. Окислительное расщепление
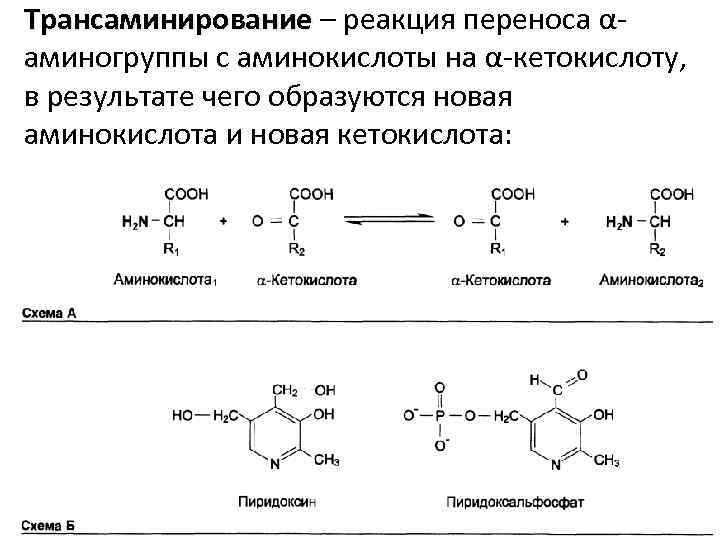
Трансаминирование – реакция переноса αаминогруппы с аминокислоты на α-кетокислоту, в результате чего образуются новая аминокислота и новая кетокислота:
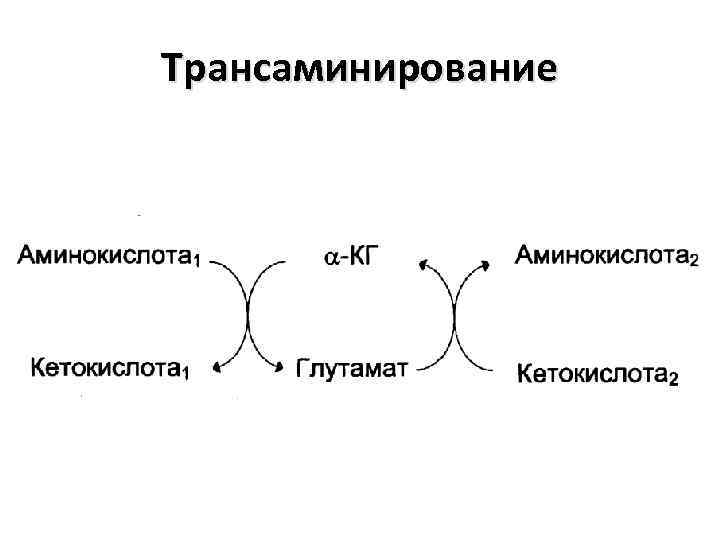
Трансаминирование

Механизм реакции трансаминирования

Примеры реакций трансаминирования АЛТ- аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, ГПТ – глутамат-пируватаминотрансфераза, ПФ - пиридоксальфосфат

Биологическое значение трансаминирования • Это заключительный этап синтеза заменимых аминокислот из соответствующих α-кетокислот, если они в данный момент необходимы клеткам • Это первая стадия дезаминирования большинства аминокислот.

Дезаминирование аминокислот • Это реакция отщепления α-аминогруппы от аминокислоты, в результате образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. • Аммиак превращается в нетоксичное соединение – мочевину и выводится из организма. • Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кетогенеза, в реакциях окисления до CO 2 и H 2 O
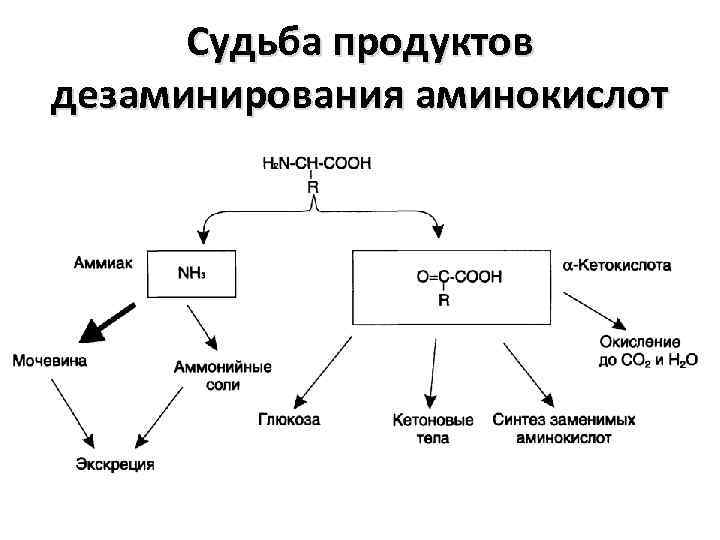
Судьба продуктов дезаминирования аминокислот

Виды дезаминирования: • • Окислительное Непрямое (трансдезаминирование) Неокислительное Внутримолекулярное
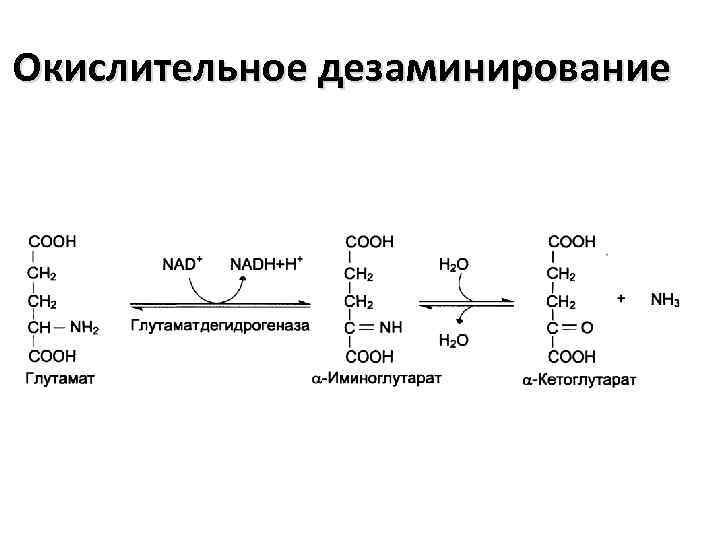
Окислительное дезаминирование
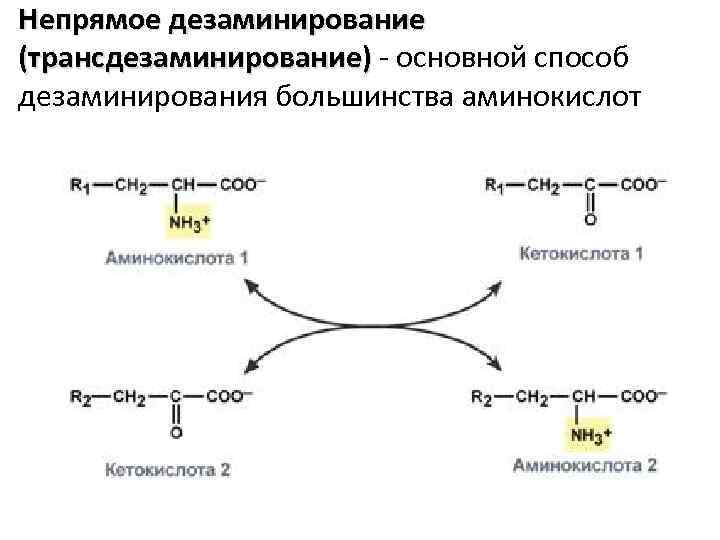
Непрямое дезаминирование (трансдезаминирование) - основной способ дезаминирования большинства аминокислот
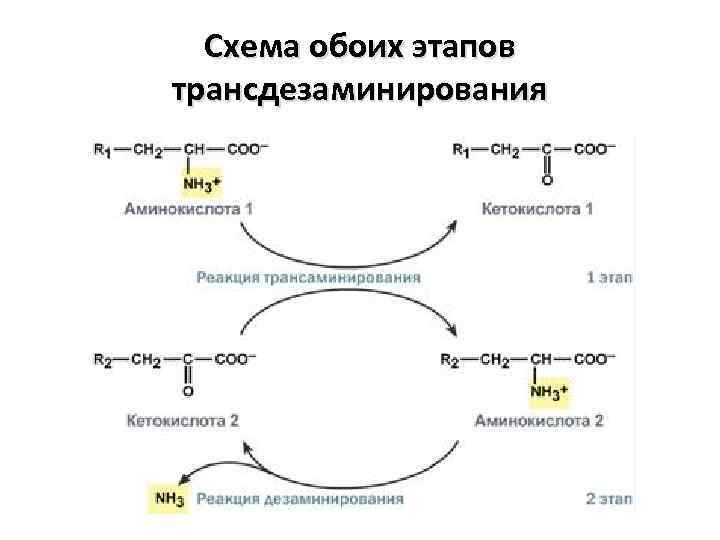
Схема обоих этапов трансдезаминирования
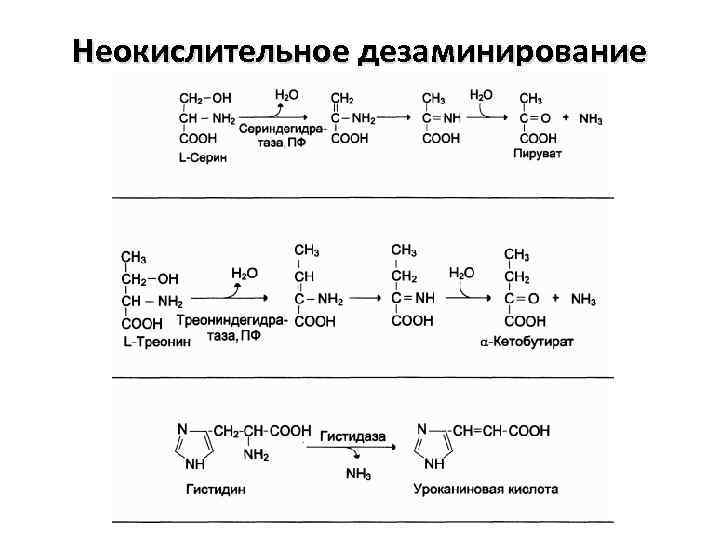
Неокислительное дезаминирование
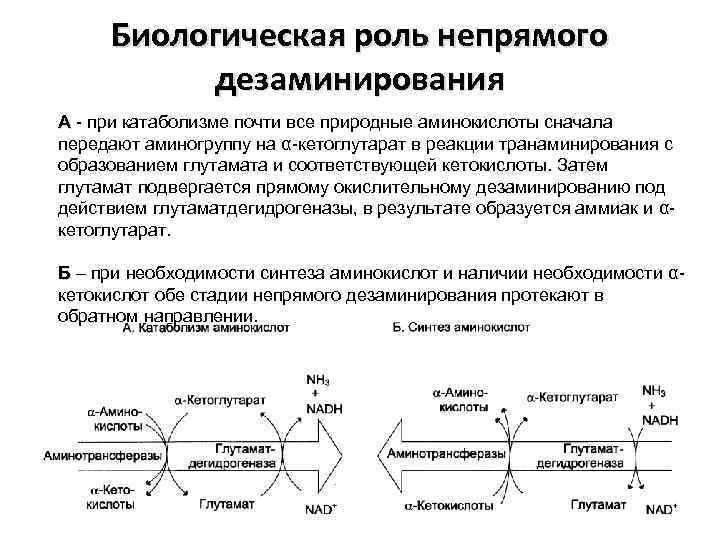
Биологическая роль непрямого дезаминирования А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на α-кетоглутарат в реакции транаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате образуется аммиак и αкетоглутарат. Б – при необходимости синтеза аминокислот и наличии необходимости αкетокислот обе стадии непрямого дезаминирования протекают в обратном направлении.
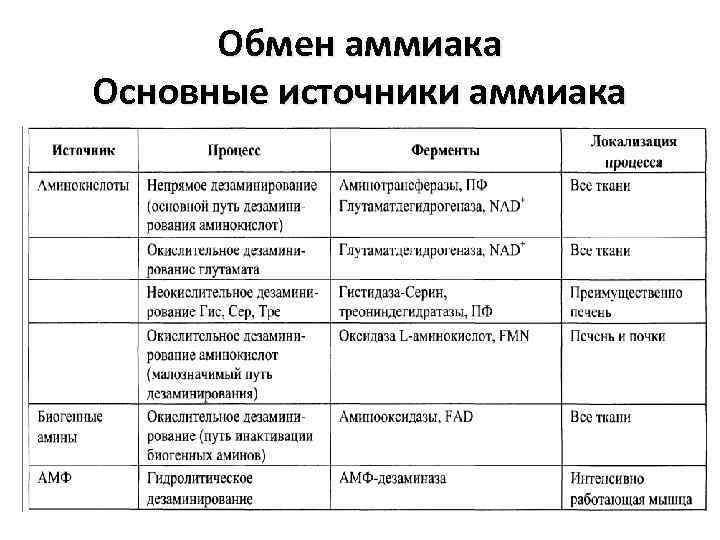
Обмен аммиака Основные источники аммиака
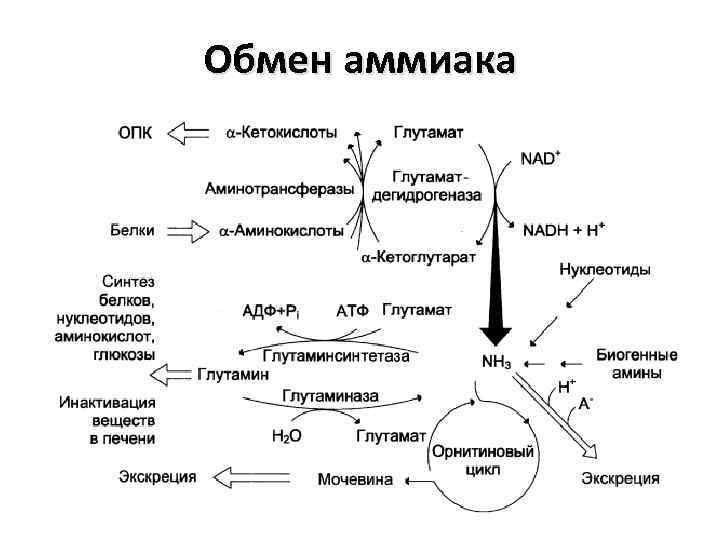
Обмен аммиака
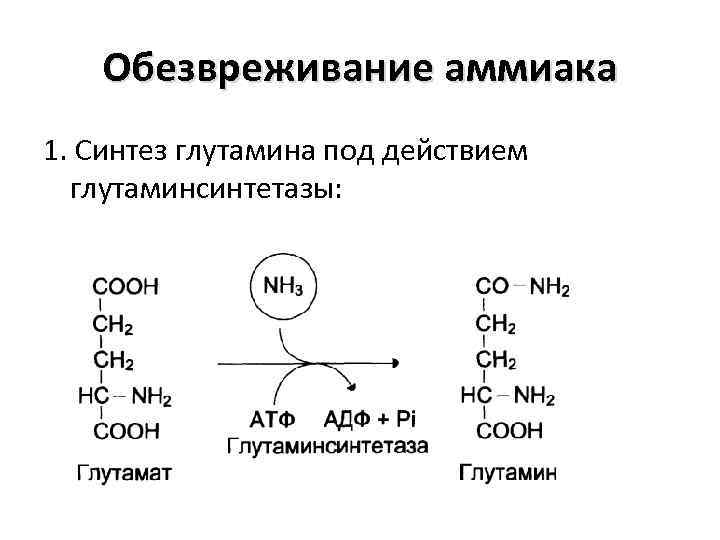
Обезвреживание аммиака 1. Синтез глутамина под действием глутаминсинтетазы:
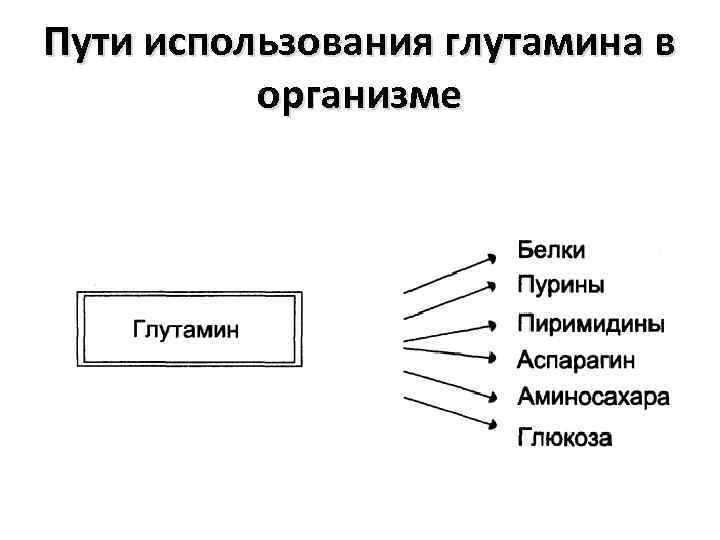
Пути использования глутамина в организме
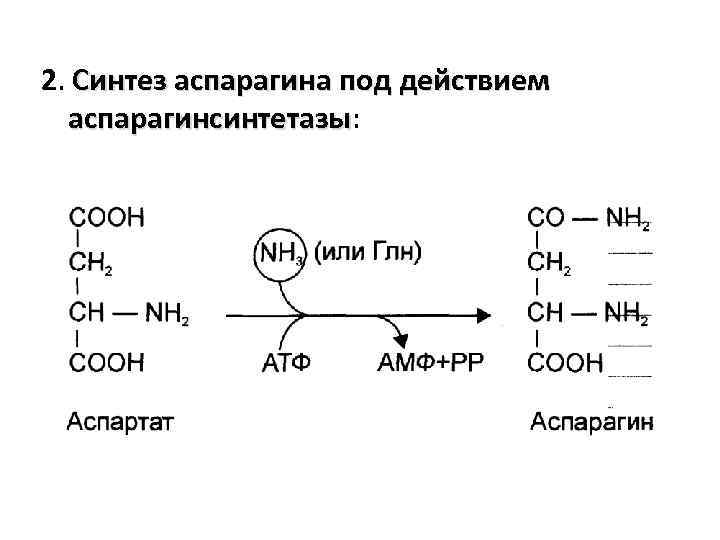
2. Синтез аспарагина под действием аспарагинсинтетазы: аспарагинсинтетазы
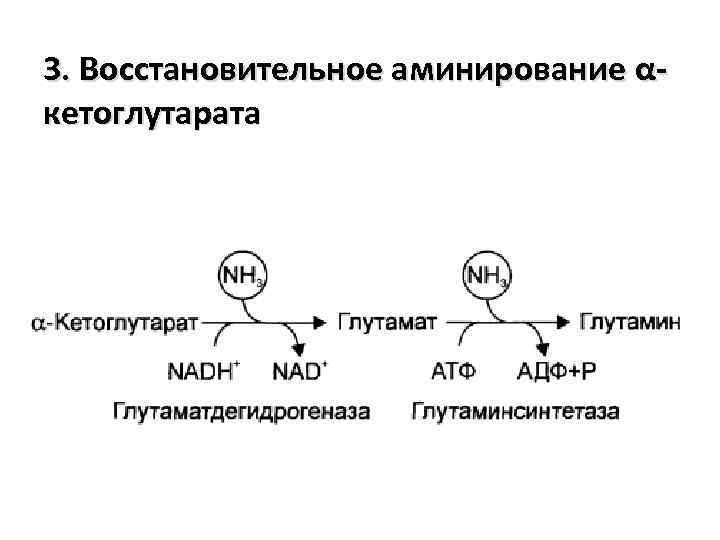
3. Восстановительное аминирование αкетоглутарата
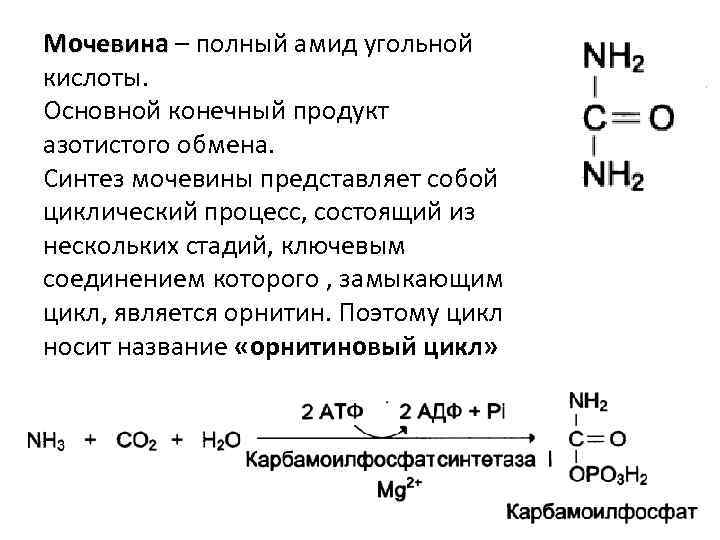
Мочевина – полный амид угольной кислоты. Основной конечный продукт азотистого обмена. Синтез мочевины представляет собой циклический процесс, состоящий из нескольких стадий, ключевым соединением которого , замыкающим цикл, является орнитин. Поэтому цикл носит название «орнитиновый цикл»
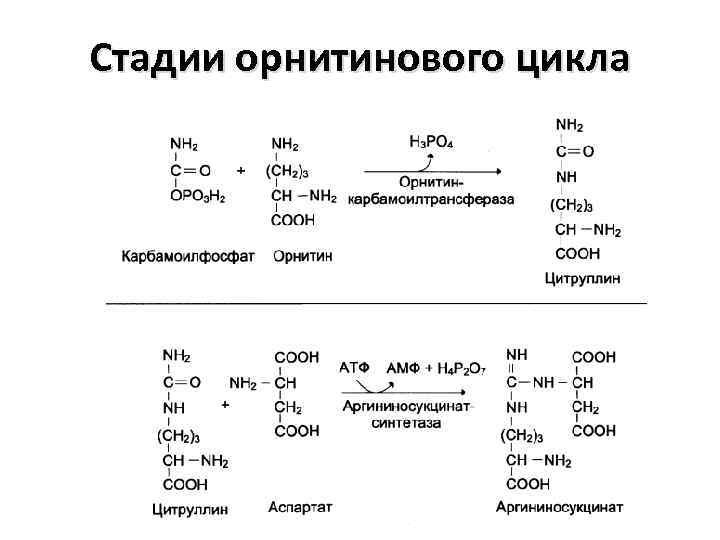
Стадии орнитинового цикла
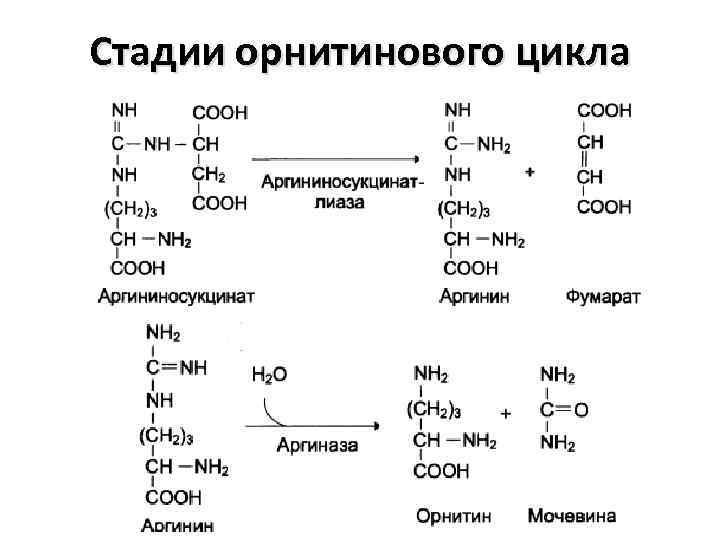
Стадии орнитинового цикла
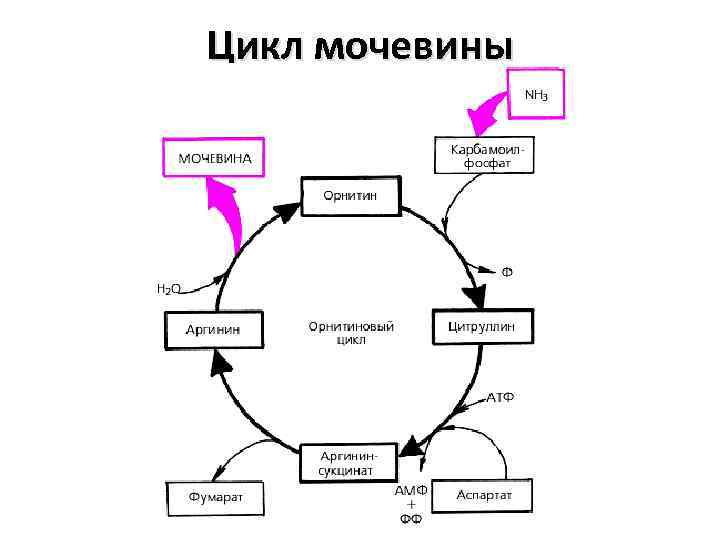
Цикл мочевины
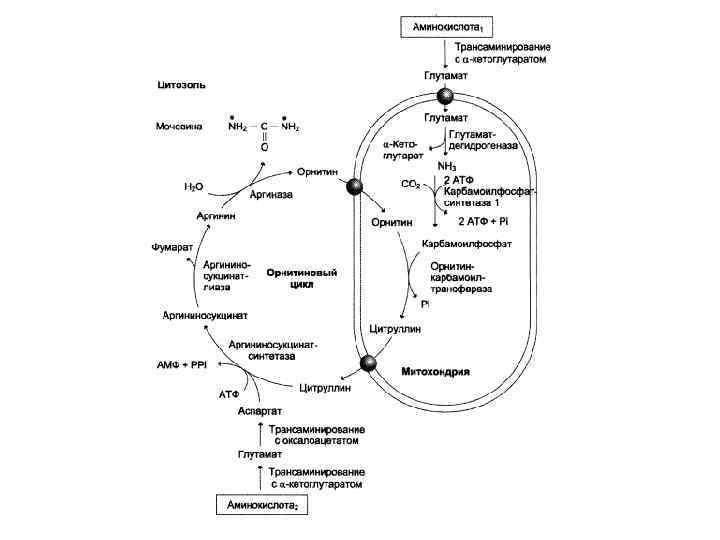
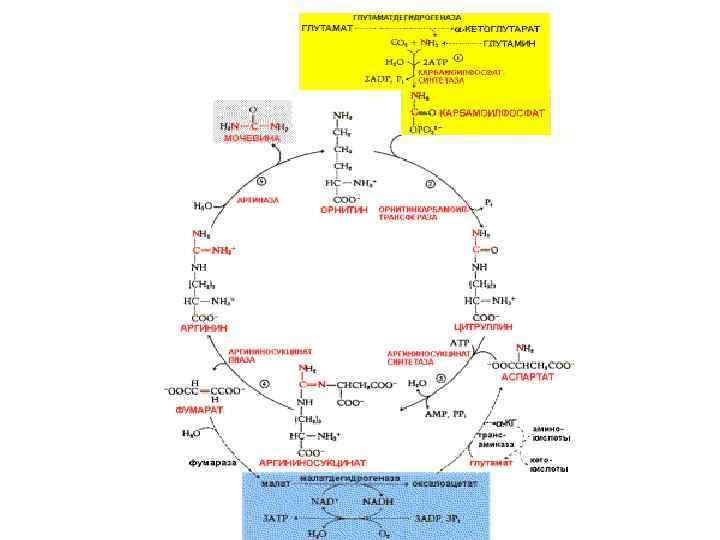

Биологическая роль орнитинового цикла 1. Превращение азота аминокислот в мочевину, которая экскретируется и предотвращает накопление токсичных продуктов (аммиака) 2. Синтез аргинина и пополнение его фонда в организме
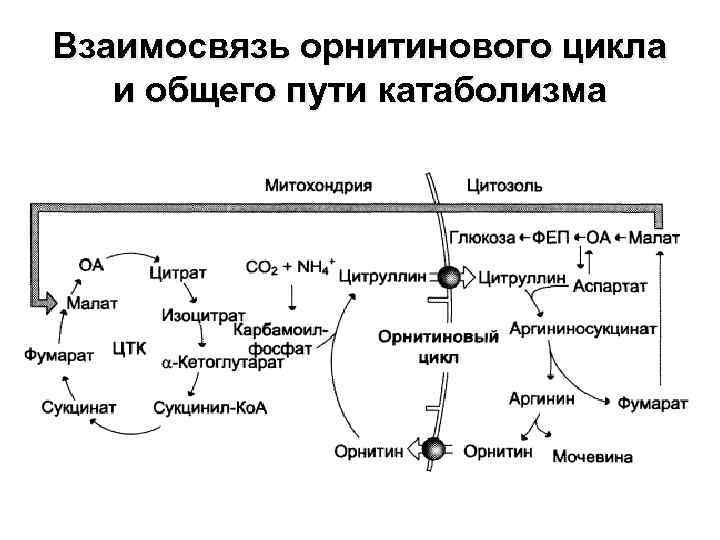
Взаимосвязь орнитинового цикла и общего пути катаболизма
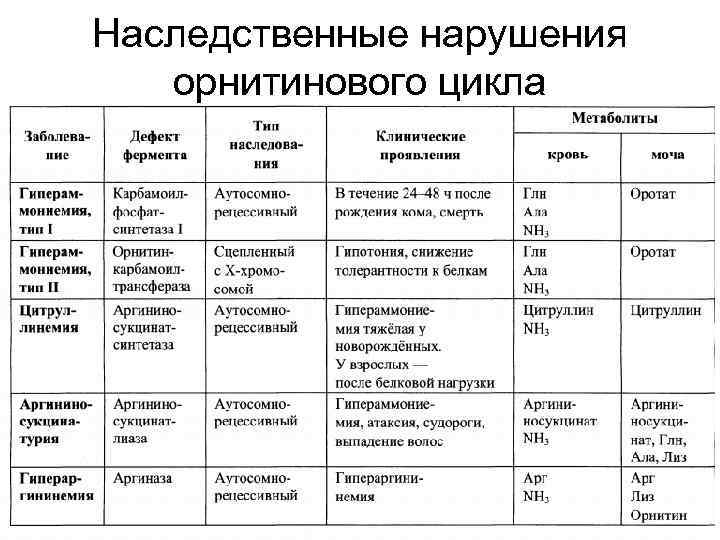
Наследственные нарушения орнитинового цикла
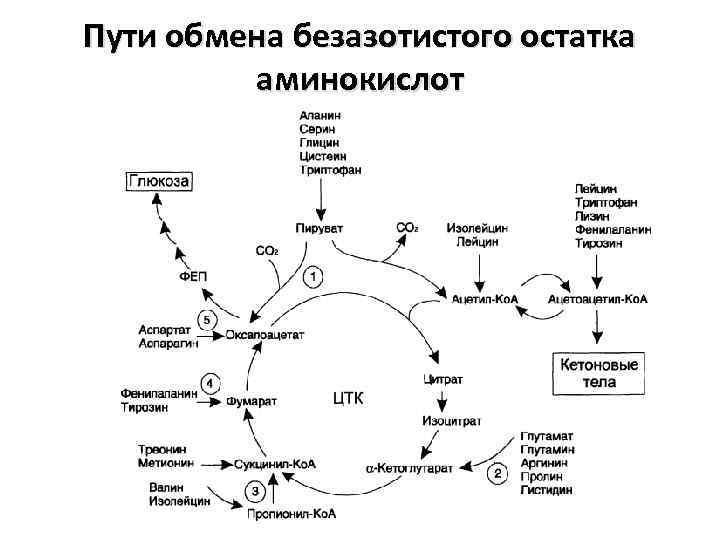
Пути обмена безазотистого остатка аминокислот
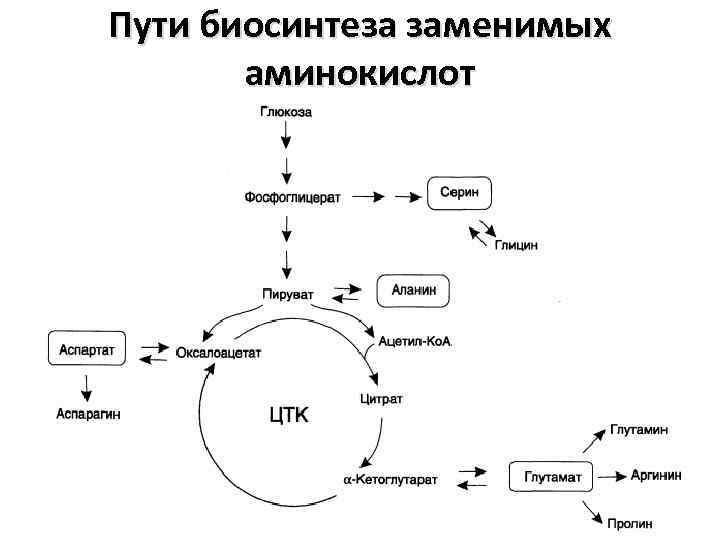
Пути биосинтеза заменимых аминокислот
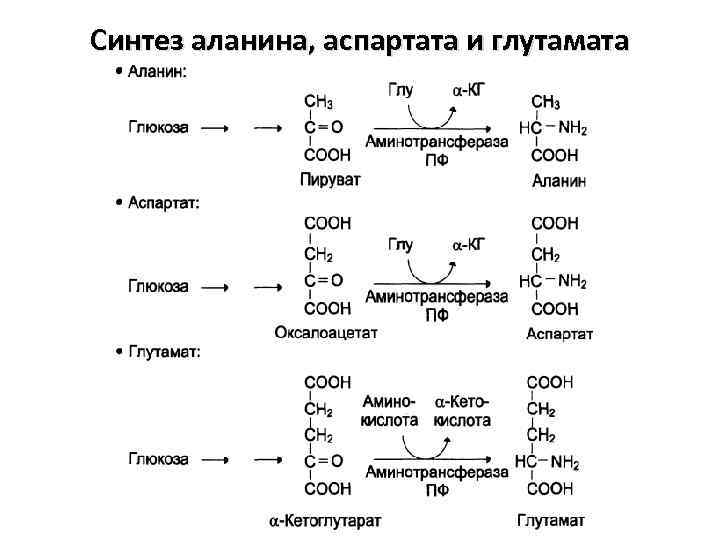
Синтез аланина, аспартата и глутамата
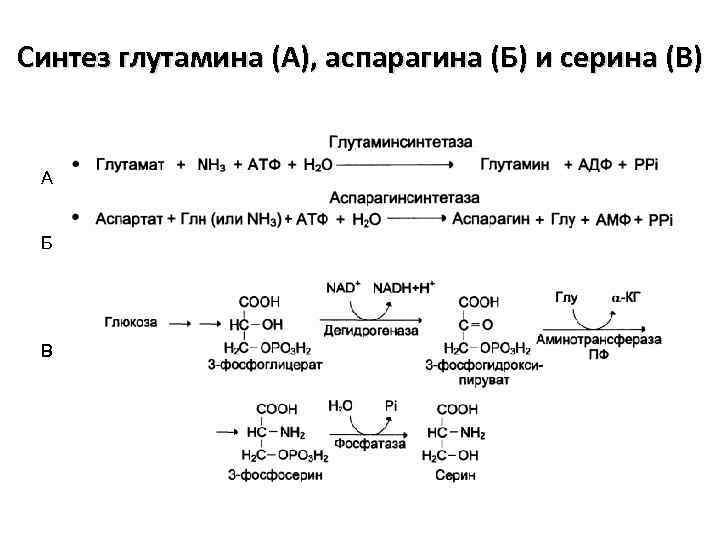
Синтез глутамина (А), аспарагина (Б) и серина (В) А Б В
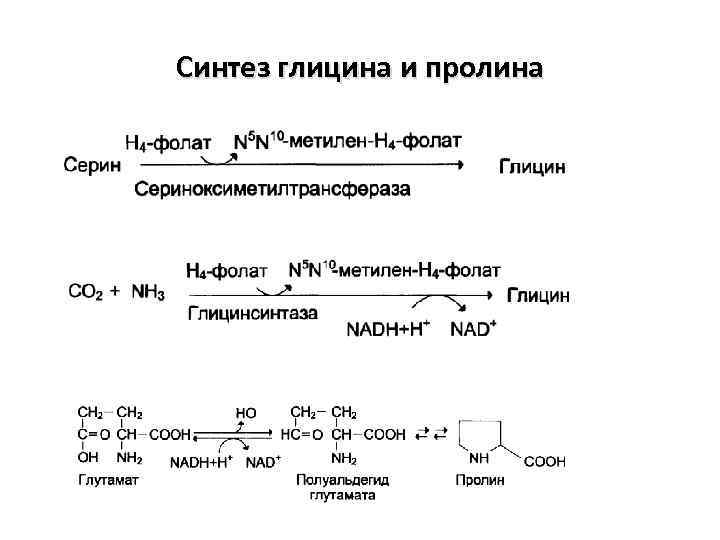
Синтез глицина и пролина
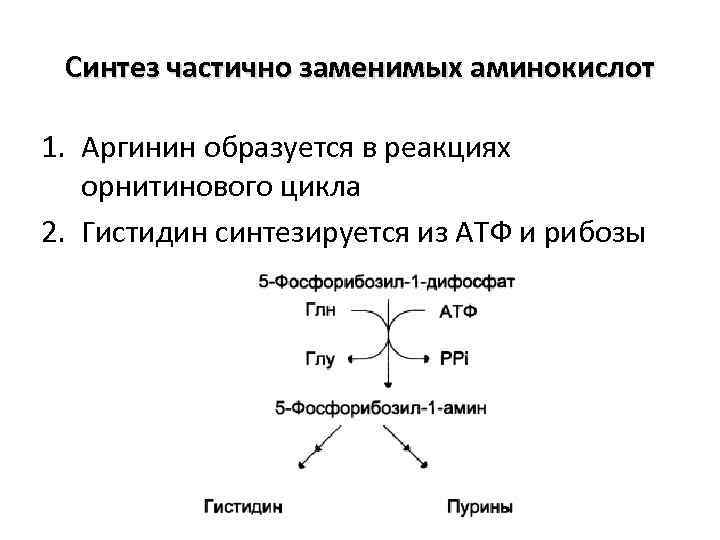
Синтез частично заменимых аминокислот 1. Аргинин образуется в реакциях орнитинового цикла 2. Гистидин синтезируется из АТФ и рибозы
Обмен белков и аминокислот.pptx