1ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ.ppt
- Количество слайдов: 62

ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ 1. Биосинтез аминокислот. 2. Общие пути биосинтеза аминокислот. 3. Катаболизм аминокислот у животных, растений и бактерий. 4. Цикл мочевины 5. Биосинтез аминокислот


• В организме человека массой 70 кг содержится примерно 10 кг белка, большая его часть локализована в мышцах. • баланс азота в организме определяется метаболизмом белков, который регулируется, прежде всего гормонами тестостероном и кортизолом

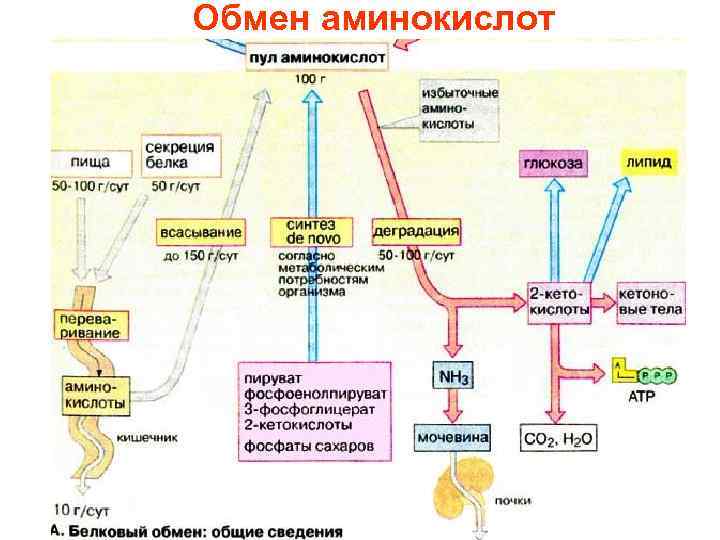
• Полученные с пищей белки подвергаются полному гидролизу в желудочно-кишечном тракте до аминокислот, которые всасываются и кровотоком распределяются в организме. • 8 (незаменимые аминокислоты из 20 белковых аминокислот не могут синтезироваться в организме человека. • Они должны поступать с пищей

• ежедневно необходимо получать с пищей не менее 30 г белка. • Аминокислоты не запасаются в организме, при избыточном поступлении аминокислот в печени окисляется или используется до 100 г аминокислот в сутки. • Содержащийся в них азот превращается в мочевину и в этой форме выделяется с мочой, • углеродный скелет используется в синтезе углеводов, липидов или окисляется с образованием АТФ.

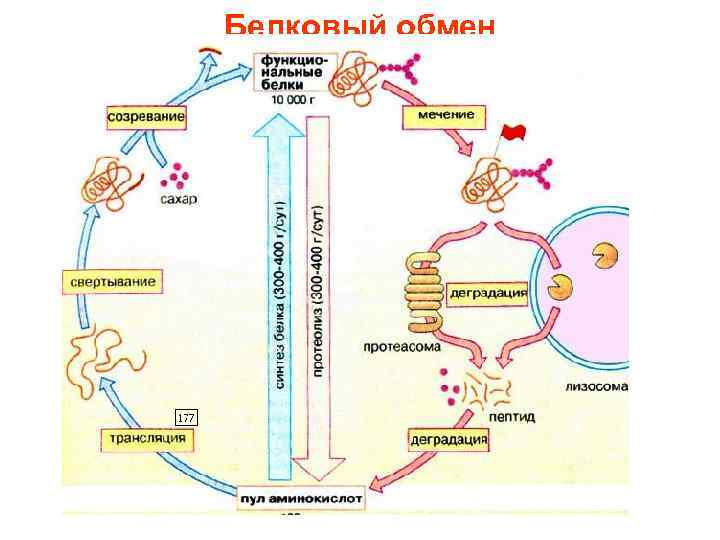
• ежедневно разрушается до аминокислот 300 -400 г белка (протеолиз) • Одновременно примерно то же самое количество аминокислот включается во вновь образованные молекулы белков (белковый биосинтез).

оборот белка в организме • многие белки относительно недолговечны: они начинают обновляться спустя несколько часов после синтеза, а биохимический полупериод составляет 2 -8 дней. • Еще более короткоживущими оказываются ключевые ферменты промежуточного обмена. Они обновляются спустя несколько часов после синтеза. • постоянное разрушение и ресинтез позволяют клеткам быстро приводить в соответствие с метаболическими потребностями уровень и активность наиболее важных ферментов.



оборот белка в организме долговечны структурные белки: гистоны, гемоглобин компоненты цитоскелета.

биосинтез белков • Построение пептидной цепи путем трансляции на рибосоме рассмотрено • Однако активные формы большинства белков возникают прежде всего при помощи вспомогательных белков шаперонов должна сложиться биологически активная конформация пептидной цепи • При посттрансляционном созревании у многих белков удаляются части пептидной цепи или присоединяются дополнительные группы, например олигосахариды или липиды. • Эти процессы происходят в эндоплазматическом ретикулуме и в аппарате Гольджи • Наконец, белки должны транспортироваться в соответствующую ткань или орган (сортировка)

биосинтез белков

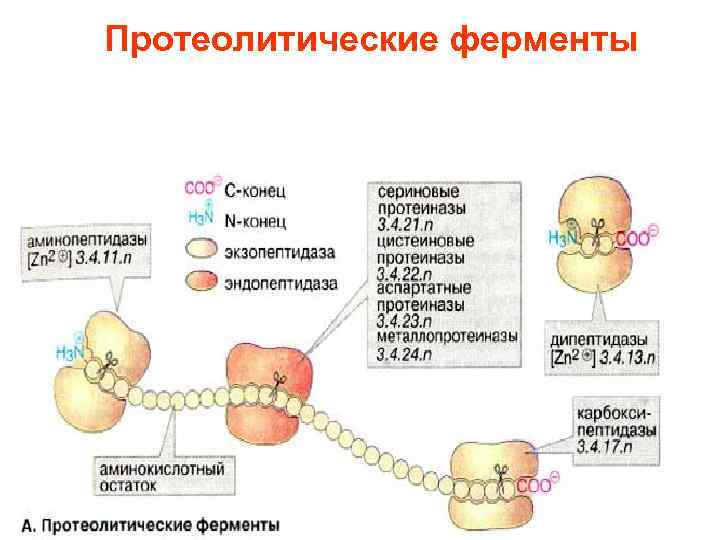
Внутриклеточное разрушение белков (протеолиз) • происходит частично в липосомах • в цитоплазме имеются органеллы, протеасомы, (в которых разрушаются неправильно свернутые или денатурированные белки). • Такие молекулы узнаются с помощью специальных маркеров

Белковый обмен
Обмен аминокислот
Протеолитические ферменты
Деградация аминокислот

• • • ПЯТЬ ВАЖНЕЙШИХ МЕТАБОЛИЧЕСКИХ ПРЕВРАЩЕНИЙ АМИНОКИСЛОТ 1. ДЕКАРБОКСИЛИРОВАНИЕ 2. Окислительное дезаминирование 3. Переаминирование 4. Модификация боковой цепи 5. Полимеризация

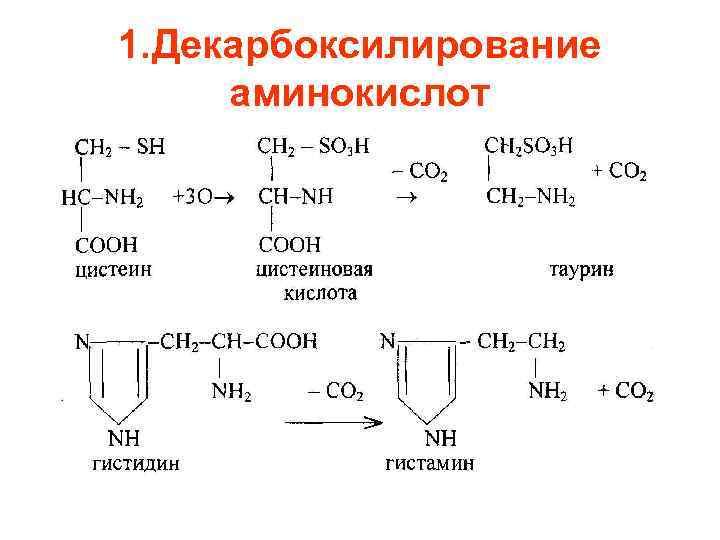
1. Декарбоксилирование аминокислот

• • В тканях животных декарбоксилированию подвергаются аминокислоты: 1. гистидин, 2. тирозин, 3. глутаминовая кислота, 4. 5 -окситриптофан, 5. 3, 4 -диоксифенилаланин (ДОФА), цистеиновая кислота. Первые три входят в состав белков, остальные – продукты обмена – тирозина, триптофана, цистеина.


2. Дезаминирование аминокислот 1. Восстановительное дезаминирование:
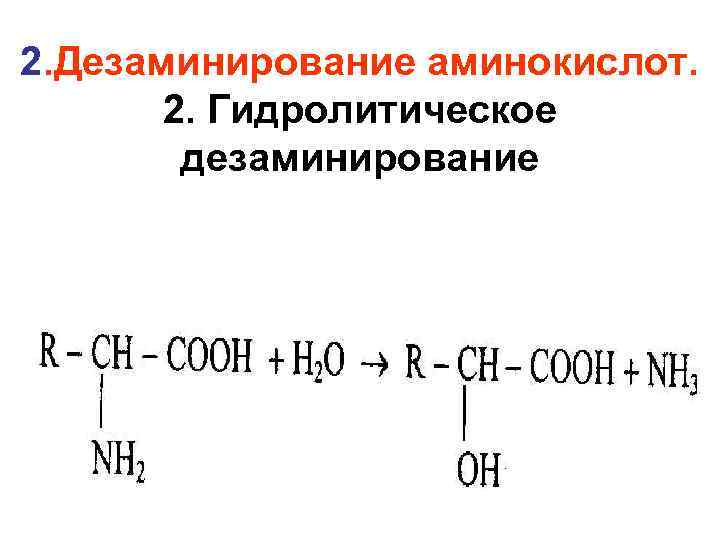
2. Дезаминирование аминокислот. 2. Гидролитическое дезаминирование

2. Дезаминирование аминокислот. 3. Внутримолекулярное дезаминирование:
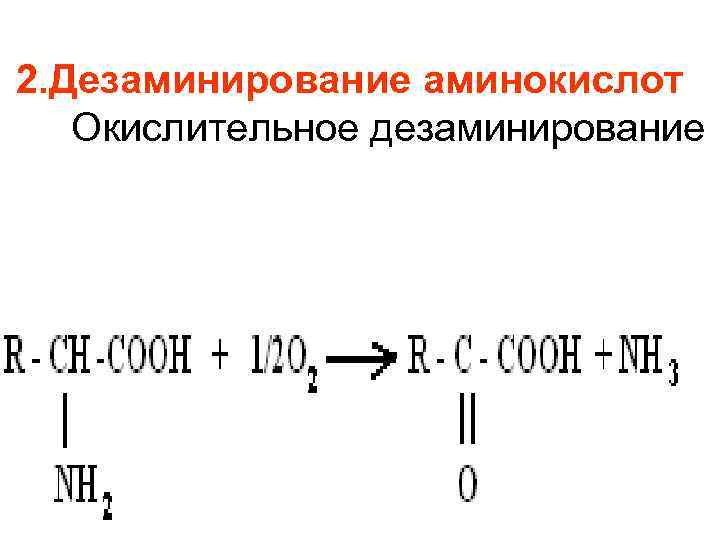
2. Дезаминирование аминокислот Окислительное дезаминирование

Окислительное дезаминирование
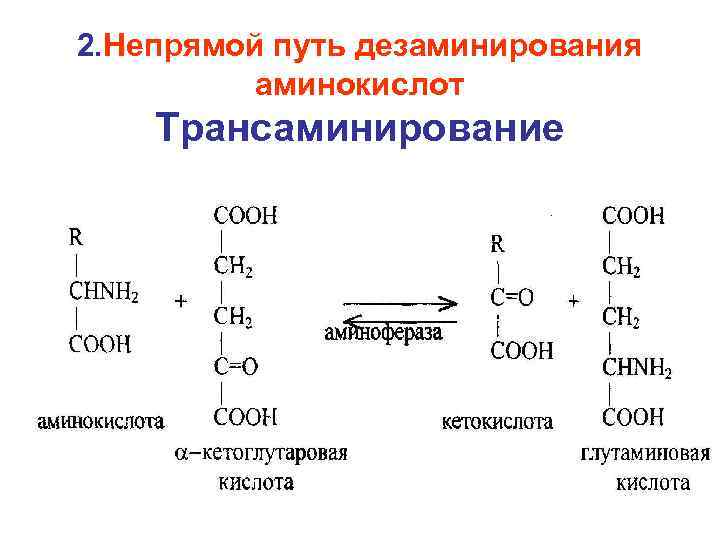
2. Непрямой путь дезаминирования аминокислот Трансаминирование
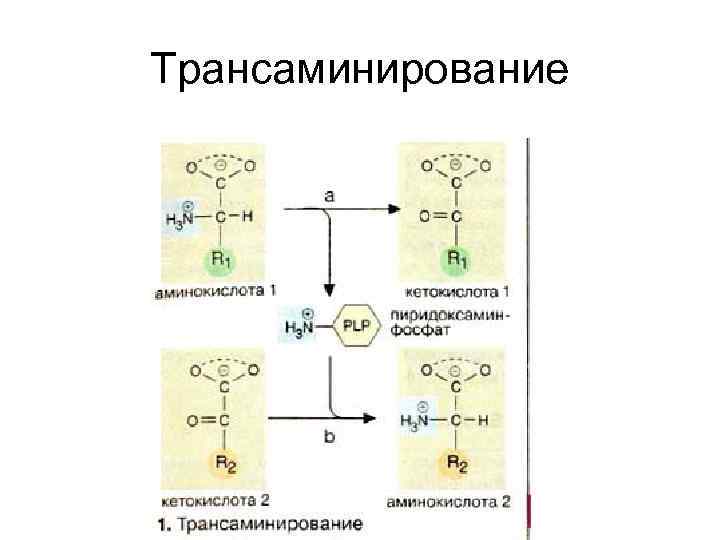
Трансаминирование

• • • ПЯТЬ ВАЖНЕЙШИХ МЕТАБОЛИЧЕСКИХ ПРЕВРАЩЕНИЙ АМИНОКИСЛОТ 1. ДЕКАРБОКСИЛИРОВАНИЕ 2. Окислительное дезаминирование 3. Переаминирование 4. Модификация боковой цепи 5. Полимеризация



Пути обезвреживания аммиака в тканях животных 1. Синтез аммонийных солей. 2. Синтез амидов дикарбоновых аминокислот. 3. Синтез мочевины

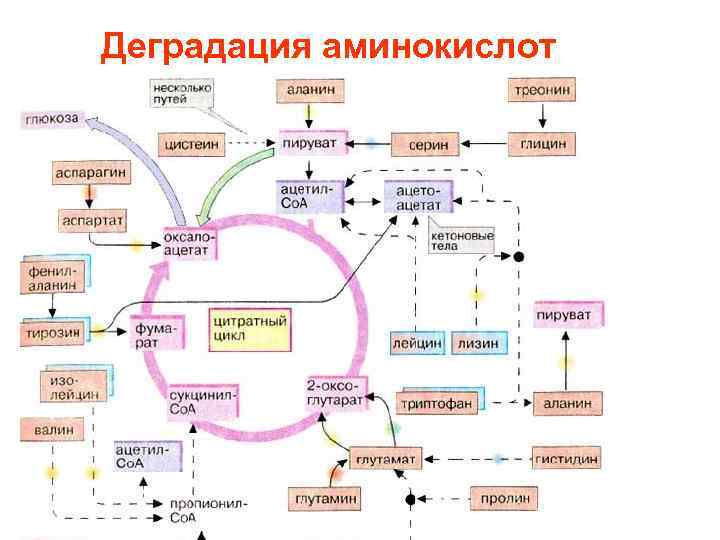
• Деградация аминокислот происходит преимущественно в печени. При этом непосредственно или косвенно освобождается аммиак • Значительные количества аммиака образуются при распаде пуринов и пиримидинов

• Аммиак - основание средней силы, является клеточным ядом. • При высоких концентрациях он повреждает главным образом нервные клетки. • аммиак должен быстро инактивироваться и выводиться из организма. В организме человека это осуществляется прежде всего за счет образования мочевины

• Живущие в воде животные выделяют аммиак непосредственно а воду; например, у рыб он выводится через жабры -(аммониотелические организмы).

• Наземные позвоночные, в том числе человек, выделяют лишь небольшое количество аммиака, а основная его часть превращается в мочевину (уреотелические организмы). • Птицы и рептилии, напротив, образуют мочевую кислоту, которая в связи с экономией воды выделяется преимущественно в твердом виде (урикотелические организмы).

Пути обезвреживания аммиака в тканях животных • 1. Синтез аммонийных солей.

1. Синтез аммонийных солей. • Синтез аммонийных солей происходит ограниченно в почках, это как дополнительное защитное приспособление организма при ацидозах. • Аммиак и кетокислоты частично используются для ресинтеза аминокислот и для синтеза других азотистых веществ. • В тканях почек аммиак участвует в процессе обезвреживания органических и неорганических кислот, образуя с ними нейтральные и кислые соли:

1. Синтез аммонийных солей. • R – COOH + NH 3 → R – COONH 4 • H 2 SO 4 + 2 NH 3 → (NH 4)2 SO 4 • H 3 PO 4 + NH 3 → NH 4 H 2 PO 4

1. Синтез аммонийных солей. • Этим путем организм защищается от потери с мочой при выведения кислот значительного количества катионов (Na, K, отчасти Са, Mg), что могло бы привести к резкому снижению щелочного резерва крови.

Пути обезвреживания аммиака в тканях животных • 2. Синтез амидов

2. Синтез амидов • Одним из путей связывания и обезвреживания аммиака является использование его для образования амидной связи глутамина и аспарагина. • При этом из глутаминовой кислоты под действием фермента глутаминсинтетазы синтезируется глутамин, • из аспарагиновой кислоты при участии аспарагинсинтетазы – аспарагин:

: 2. Синтез амидов

• Мочевина является диамидом угольной кислоты. В противоположность аммиаку это нейтральное и нетоксичное соединение. • При необходимости небольшая молекула мочевины может проходить через мембраны. По этой причине, а также из-за ее хорошей растворимости в воде мочевина легко переносится кровью и выводится с мочой.

• Мочевина образуется в результате циклической последовательности реакций, протекающих в печени. • Оба атома азота берутся из свободного аммиака и за счет дезаминирования аспартата, карбонильная группа — из гидрокарбоната. • На первой стадии, реакция , из гидрокарбоната (НСО 3 -) и аммиака с потреблением 2 молекул АТФ образуется карбамоилфосфат. • Как ангидрид это соединение обладает высоким реакционным потенциалом. • На следующей стадии, реакция , карбамоильный остаток переносится на орнитин с образованием цитруллина.

• Вторая аминогруппа молекулы мочевины поставляется за счет реакции аспартата с цитруллином. • Для этой реакции вновь необходима энергия в форме АТФ, который при этом расщепляется на АМФ и дифосфат. • Для обеспечения необратимости реакции дифосфат гидролизуется полностью (не показано). • Отщепление фумарата от аргининосукцината приводит к аргинину , из которого в результате гидролиза образуется изомочевина, сразу же превращающаяся в результате перегруппировки в мочевину. Остающийся орнитин вновь включается в цикл мочевины

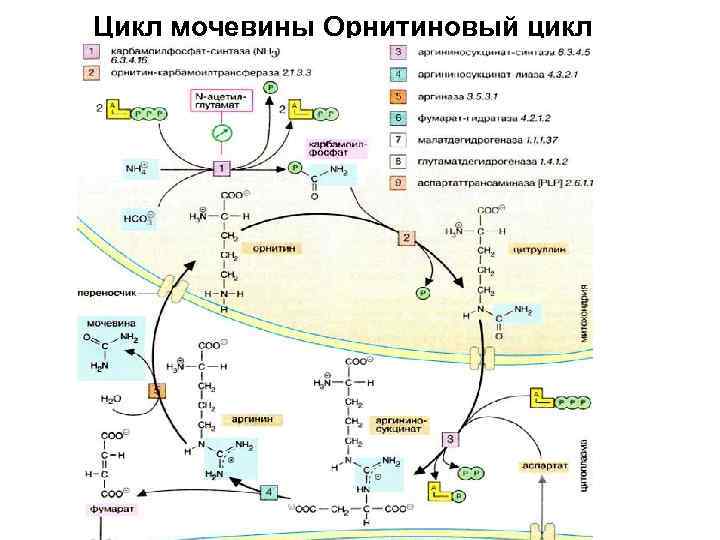
Цикл мочевины Орнитиновый цикл

1 стадия – образование карбамоилфосфата происходит в митохондриях под действием фермента карбомоилфосфат-синтетазы:

синтез цитруллина с участием орнитина

• Цитруллин переходит из митохондрий в цитозоль клеток печени. После этого в цикл вводится вторая аминогруппа в форме аспарагиновой кислоты.
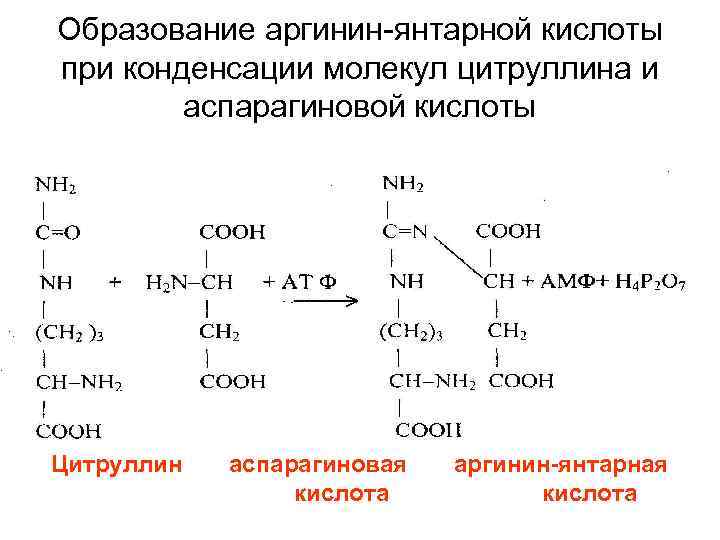
Образование аргинин-янтарной кислоты при конденсации молекул цитруллина и аспарагиновой кислоты Цитруллин аспарагиновая кислота аргинин-янтарная кислота

Расщепление аргинин-янтарной кислоты на аргинин и фумаровую кислоты
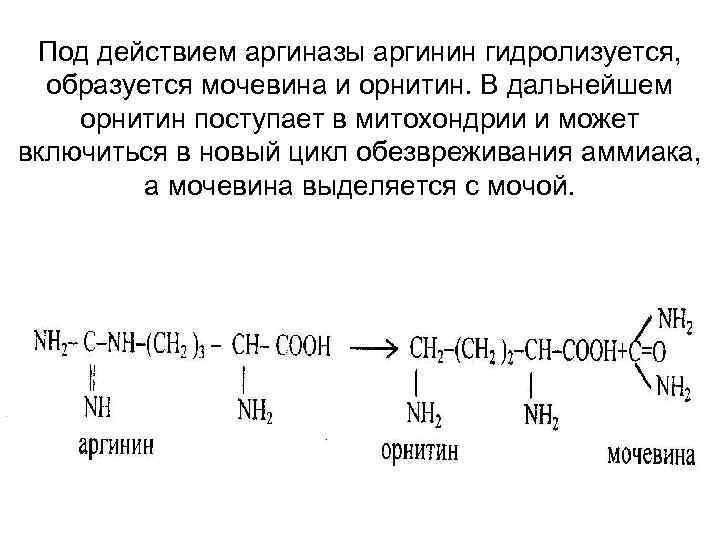
Под действием аргиназы аргинин гидролизуется, образуется мочевина и орнитин. В дальнейшем орнитин поступает в митохондрии и может включиться в новый цикл обезвреживания аммиака, а мочевина выделяется с мочой.

1. В синтезе одной молекулы мочевины нейтрализуется две молекулы NH 3 и CO 2 (HCO 3), (имеет значение в поддержании р. Н 2. Для синтеза одной молекулы мочевины расходуется 3 молекулы АТФ, 2. 1. две АТФ при синтезе карбомоилфосфата, 1. 2. одна АТФ для образования аргинин-янтарной кислоты; 3. фумаровая кислота может превращаться в яблочную и щавелевоуксусную кислоты (цикл Кребса), а последняя в результате трансаминирования или восстановительного аминирования может превратиться в аспарагиновую кислоту.

4. Некоторая часть азота аминокислот выделяется из организма в виде креатинина, который образуется из креатина и креатинфосфата. • 5. Из всего азота мочи на долю мочевины приходится до 80 -90%, аммонийных солей – 6 %.

Нарушения превращения аминокислот

Цикл мочевины


Метаболизм аминокислот высших животных
1ОБМЕН БЕЛКОВ И АМИНОКИСЛОТ.ppt