Обмен белков.ppt
- Количество слайдов: 69

Обмен белков

Азотистый баланс разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей)

Азотистое равновесие - количество поступающего азота равно количеству выделяемого. Такое состояние бывает у здорового человека при нормальном питании. Азотистый баланс положительный (азота поступает больше, чем выводится) у детей, а также у пациентов, выздоравливающих после тяжёлых болезней. Отрицательный азотистый баланс (выделение азота преобладает над его поступлением) наблюдают при старении, голодании и во время тяжёлых заболеваний.

Полноценность питания аминокислоты называют незаменимыми если синтез их сложен и неэкономичен для организма (фенилаланин, метионин, треонин, триптофан, валин, лизин, лейцин, изолейцин) аргинин и гистидин — частично заменимые (у взрослых образуются в достаточных количествах, однако детям для нормального роста организма необходимо дополнительное поступление этих аминокислот с пищей) тирозин и цистеин — условно заменимые, так как для их синтеза необходимы незаменимые аминокислоты

Переваривание белков под действием ферментов протеаз (пептидгидролаз) Субстратная специфичность - с наибольшей скоростью расщепляют пептидные связи, образованные определёнными аминокислотами Эндопептидазы - протеазы, гидролизующие пептидные связи внутри белковой молекулы Экзопептидазы - гидролизуют пептидную связь, образованную концевыми аминокислотами

Желудочный сок — продукт нескольких типов клеток Обкладочные (париетальные) клетки образуют соляную кислоту Главные клетки секретируют пепсиноген Добавочные - выделяют муцинсодержащую слизь Париетальные клетки секретируют в полость желудка гликопротеин, который называют «внутренним фактором» (фактором Касла). Этот белок связывает «внешний фактор» — витамин В 12, предотвращает его разрушение и способствует всасыванию.

При поступлении пищи в желудок, G-клетками, расположенными на малой кривизне и в пилорической области вырабатывается гормон – гастрин, который активирует главные клетки желудка, синтезирующие пепсиноген Пепсиноген - неактивная форма фермента, так клетки желудка защищаются от самопереваривания

Активация фермента происходит в полости желудка путем отщепления небольшого полипептида (ограниченный протеолиз), причем изменяется первичная структура и образуется активный центр Пепсиноген превращается в пепсин Такая активация происходит с помощью соляной кислоты и аутокаталитически (пепсин активирует пепсиноген)

Механизм активации ферментов Частичный протеолиз пепсиноген пепсин Под действием соляной кислоты Под действием пепсина (аутокаталитически)

Пепсин • гидролизует пептидные связи в белках, образованные ароматическими аминокислотами (фенилаланин, триптофан, тирозин) • образованные лейцином и дикарбоновыми аминокислотами

• Париетальные (обкладочные) клетки эпителия желудка секретируют соляную кислоту
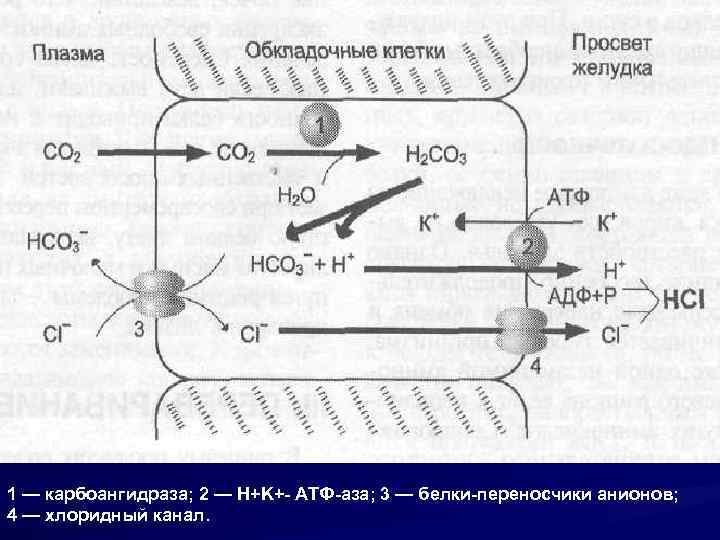
1 — карбоангидраза; 2 — H+K+- АТФ-аза; 3 — белки-переносчики анионов; 4 — хлоридный канал.

Н и Cl накапливаются в ответ на стимуляцию гастрином Таким образом, гастрин стимулирует, как главные клетки, секретирующие пепсиноген, так и обкладочные, секретирующие соляную кислоту

Биохимической особенностью обкладочных клеток является наличие карбангидразы, которая катализирует реакцию образования протонов водорода Бикарбонатные ионы перемещаются в кровь в обмен на ионы хлора

Роль соляной кислоты: активация пепсиногена денатурация пищевых белков бактерицидная попадая в ДПК активирует клетки, секретирующие секретин, холецистокенин, мотилин

Возрастные особенности переваривания белков в желудке У детей грудного возраста в желудке находится фермент реннин (химозин), вызывающий свёртывание молока. Белки успевают расщепиться под действием пепсина.

Определение кислотности желудочного сока используют для диагностики различных заболеваний желудка Повышенная кислотность желудочного сока может быть симптомом язвы желудка и двенадцатиперстной кишки Пониженная кислотность бывает при некоторых видах гастритов Полное отсутствие НСl и пепсина (желудочная ахилия) наблюдается при атрофических гастритах

Дальнейшее переваривание белков идет в кишечнике под действием ферментов поджелудочной железы и энтероцитов Как и пепсиноген, панкреатические ферменты секретируются в неактивной форме

Энтеропептидаза (энтероцитов) активирует трипсиноген, секретируемый поджелудочной железой, превращая в трипсин Трипсин активирует химотрипсиноген и прокарбрксипептидазу, секретируемые поджелудочной железой, превращая в химотрипсин и карбоксипептидазу

Трипсин гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсин - образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три) Карбоксипептидазы А и В—С-концевые остатки аминокислот – карбоксипептидаза А - аминокислоты, содержащие ароматические или гидрофобные радикалы – карбоксипептидаза В — остатки аргинина и лизина.

Кроме панкреатических протеаз в тонком кишечнике присутствуют протеазы, секретируемые энтероцитами Аминопептидаза, являющаяся экзопептидазой, гидролизует пептиды, отщепляя аминокислоты соответственно от N-конца пептида Дипептидаза - гидролизует дипептиды

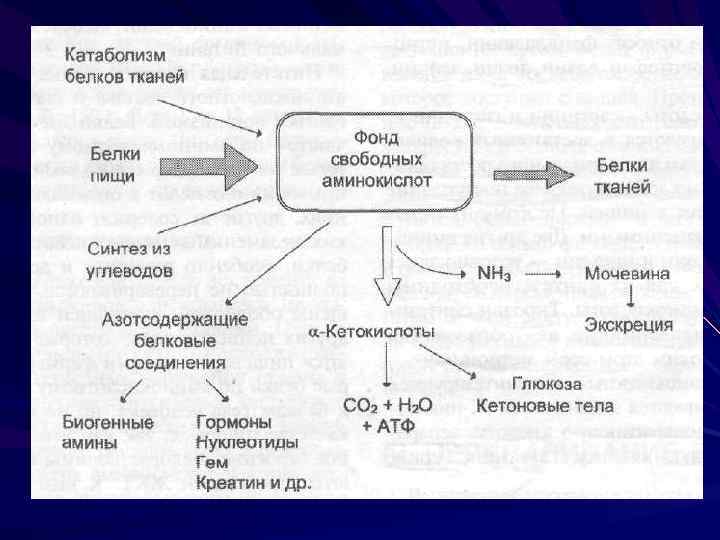
Продуктами переваривания являются свободные аминокислоты

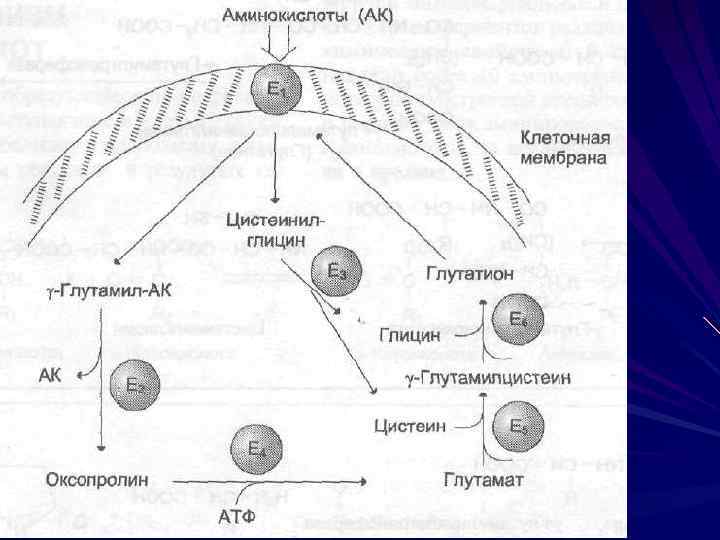
Транспорт аминокислот Вторично-активный транспорт Специфические каналы Гамма-глутамильный цикл
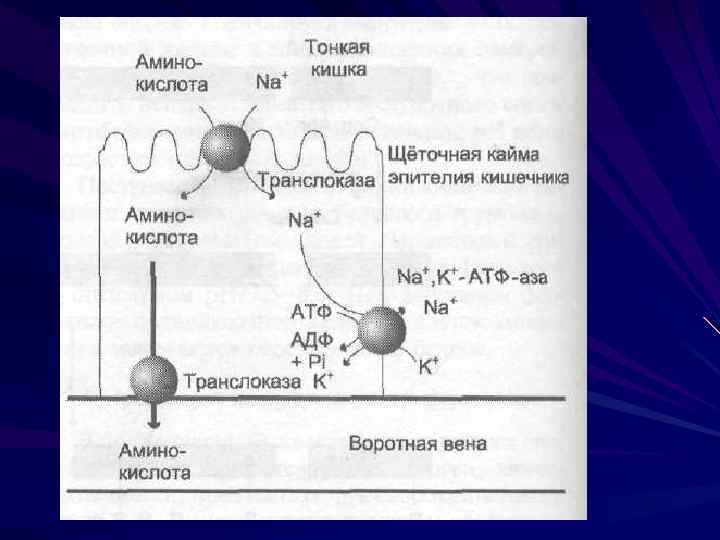

специфические транспортные системы, для переноса определённой группы близких по строению аминокислот нейтральных, с короткой боковой цепью нейтральных, с длинной или разветвлённой боковой цепью с катионными радикалами с анионными радикалами иминокислот

гамма -глутамильный цикл для некоторых нейтральных аминокислот функционирует в кишечнике, почках и, по-видимому, мозге В этой системе участвуют 6 ферментов, один из которых находится в клеточной мембране, а остальные — в цитозоле. Ключевую роль в транспорте аминокислоты играет мембранно-связанный фермент гамма -глутамилтрансфераза (ГГТ) Этот фермент катализирует перенос гамма-глутамильной группы от глутатиона на транспортируемую аминокислоту и последующий перенос комплекса в клетку Глутатион представляет собой трипептид — глутамилцистеин-глицин, который находится во всех тканях животных.

Биологическая роль аминокислот: пластическая, сигнальная

Пластическая функция (СИНТЕЗ) – в первую очередь поступившие в клетку аминокислоты используются для синтеза белков!!! Кроме того из них синтезируются нуклеиновые кислоты и небелковые азотсодержащие соединения – порфирин, креатин мышц, глутатион.

Сигнальная функция – синтез гормонов, нейромедиаторов, биологически активных веществ И только избыток аминокислот распадается, выполняя энергетическую функцию.

Биогенные амины обладают высокой биологической активностью, поскольку способны оказывать воздействие на другие клетки и ткани в небольших концентрациях (обладают сигнальным действием) Образуются из аминокислот в результате декарбоксилирования:

Образование биогенных аминов:

В результате отщепления карбоксильной группы аминокислот образуются амины Реакция катализируется декарбоксилазами, коферментом которых является пиридоксальфосфат (витамин В 6).

Образование биогенных аминов: -аминомасляная кислота (ГАМК) образуется из глутамата в ткани головного мозга, выполняя функции тормозного нейромедиатора

Гистамин образуется из гистидина в тучных клетках Выделяется в ответ на присутствие аллергена, вызывая зуд, отек Является сильным сосудорасширяющим фактором, вызывая расслабление гладкой мускулатуры В клетках слизистой желудка стимулирует секрецию соляной кислоты
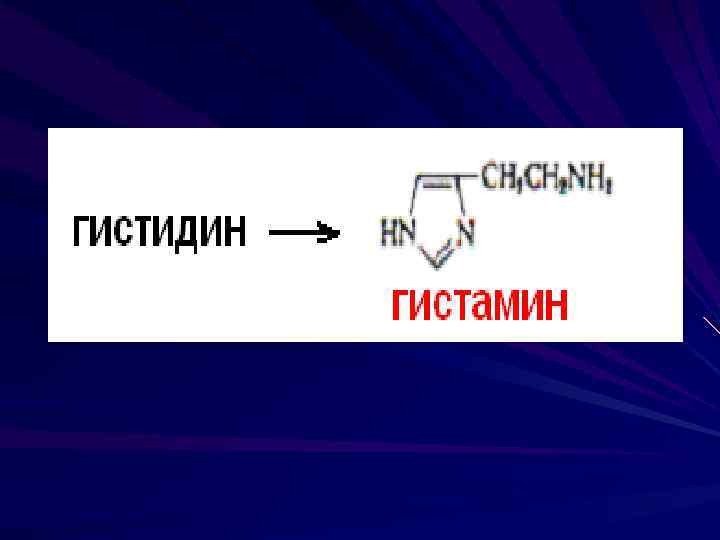

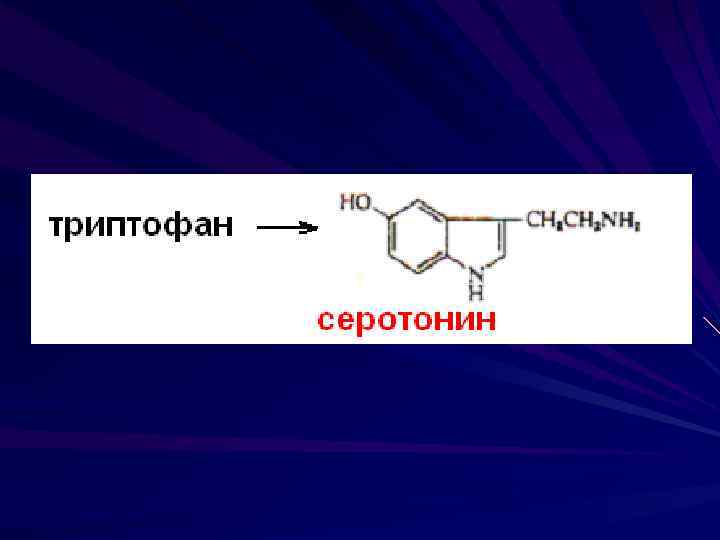
Серотонин образуется из триптофана в нейронах гипоталамуса Нейромедиатор возбуждающего характера Синтезируется эозинофильными лейкоцитами, обладает сосудосуживающим эффектом Сосудосуживающее влияние серотонина на артерии мягкой мозговой оболочке может играть роль в возникновении их спазмов (мигрень)

Норадреналин образуется в результате гидроксилирования дофамина в клетках нервной ткани, мозговом веществе надпочечников Функционирует как медиатор в синаптической передаче нервных импульсов Причем гидроксилирование идет по схожему механизму, рассмотренному выше (свободнорадикальный механизм), плюс обязательное присутствие витамина С.

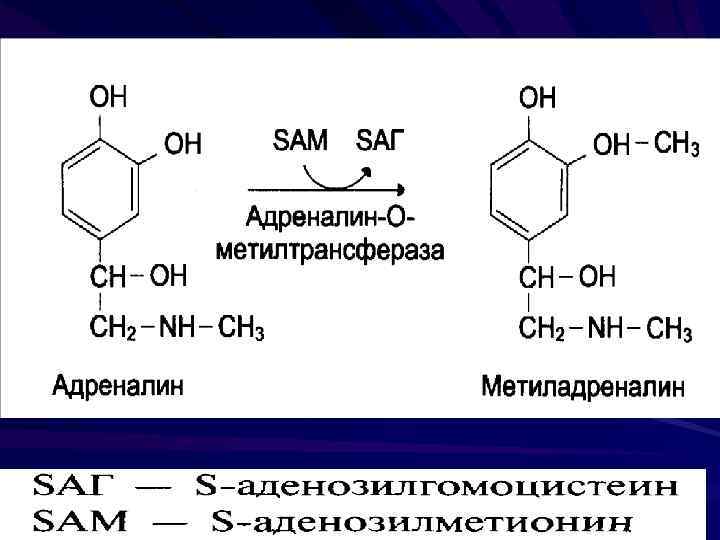
Адреналин - продукт метилирования норадреналина в клетках мозгового вещества надпочечников Выполняет функции гормона Метилирование – перенос метильной группировки, с участием метионина, витаминов В 9, В 12 (химизм этого процесса в биохимии витаминов).


Инактивация биогенных аминов Метилирование при участие метилтрансфераз Окисление моноаминооксидазами с коферментом ФАД
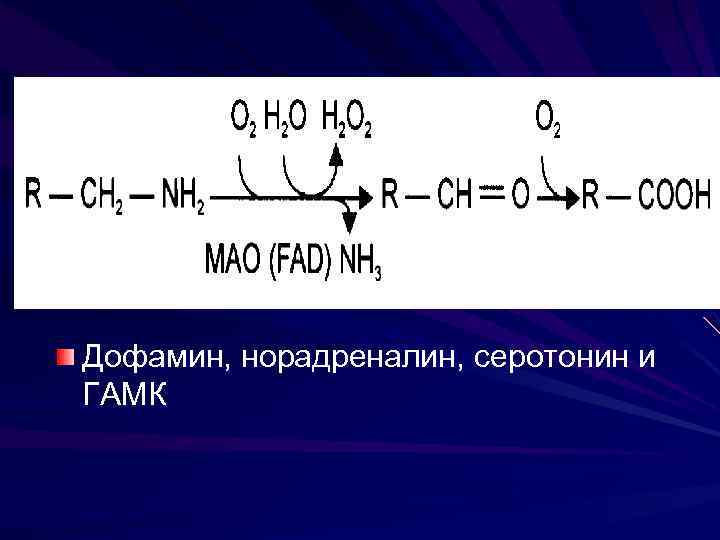
Дофамин, норадреналин, серотонин и ГАМК

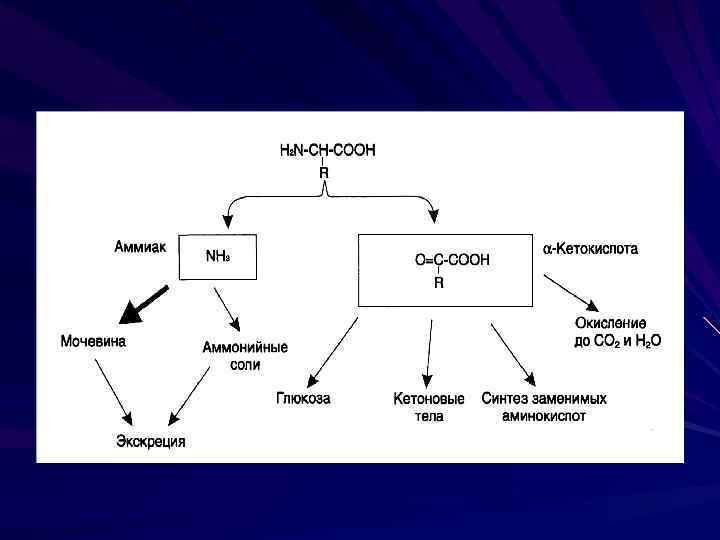
При избытке аминокислот происходит их распад. Осуществляется отсоединение аминогруппы – дезаминирование аминокислот (прямое или непрямое) В ходе распада аминокислот образуется аммиак, который требует немедленного обезвреживания.

Пути использования кетокислот Синтез глюкозы Синтез кетоновых тел Цикл трикарбоновых кислот Синтез заменимых аминокислот

Непрямое дезаминирование аминокислот 1. Трансаминирование 2. Окислительное дезаминирование глутамата

Трансаминирование В ходе реакции трансаминирования аминогруппа переносится от аминокислоты к -кетокислоте В результате получается новая кетокислота и новая аминокислота Реакцию катализируют ферменты аминотрансферазы с участием кофермента пиридоксальфосфата (производное витамина В 6).

Реакция трансаминирования легко обратима в роли кетокислоты выступает -кетоглутарат Трансаминирование происходит практически во всех органах и тканях
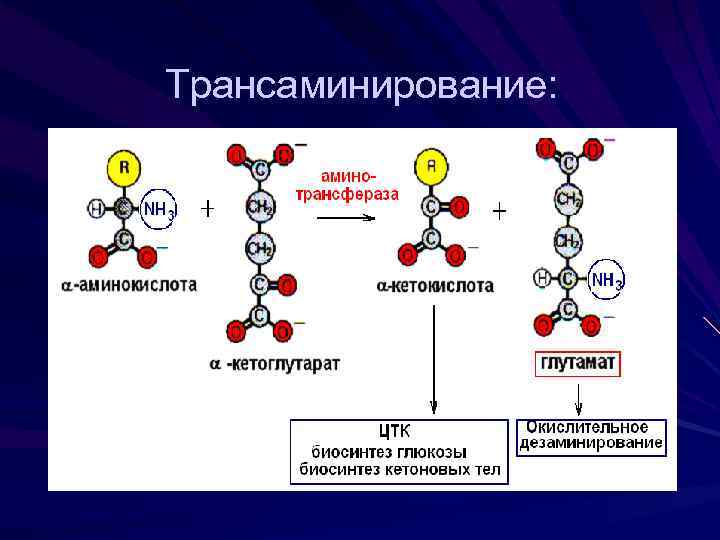
Трансаминирование:

Биологическая роль трансаминирования: Образование кетокислот Путь синтеза заменимых аминокислот, но в этом случае реакция идет в обратном направлении Связывает между собой белковый и углеводный обмены (из пирувата можно получить глюкозу)

Окислительное дезаминирование глутамата - отщепления аминогруппы в виде аммиака, катализируемое NADзависимой дегидрогеназой: В организме человека окислительному дезаменированию подвергается только глутаминовая кислота

Дезаминирование глутамата:

Обезвреживание аммиака Пути образования: Дезаминирование аминокислот Распад пуриновых и пиримидиновых аминокислот Распад биогенных аминов

Аммиак токсичен и, поэтому его содержание в клетках и в крови должно быть предельно мало При накоплении аммиака в клетке, аммиак вступает в реакцию восстановительного амминирования с альфакетоглютаратом:

Восстановительное аминирование:

Токсическое действие аммиака снижается интенсивность реакций ЦТК Развитие алкалоза Нарушение обмена аминокислот В первую очередь страдает ЦНС – Накопление глутамина – Снижение глутамата и ГАМК – Алкалоз – Нарушение транспорта К+ и Na+

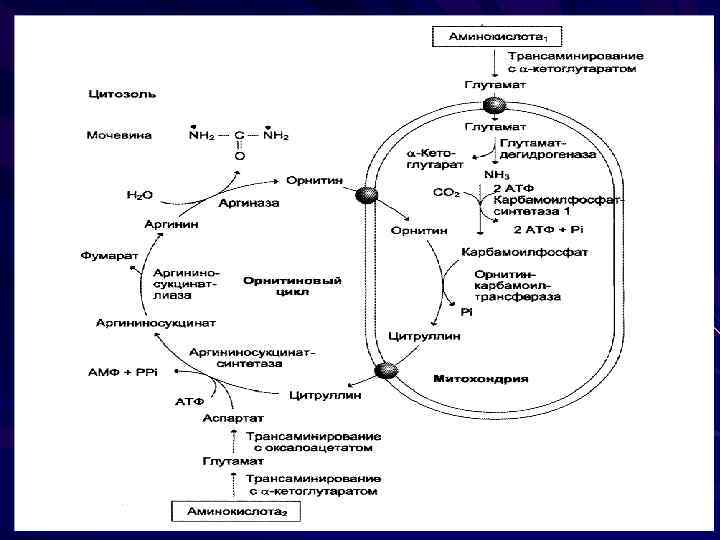
Пути обезвреживания аммиака образование амидов дикарбоновых кислот образование аммонийных солей образование мочевины (орнитиновый цикл)

образование глутамина и аспарагина при участии глутаминсинтетазы и аспарагинсинтетазы глутамин и аспарагин выполняют функцию транспортных форм аммиака в крови и переносят его в печень, где и происходит обезвреживание
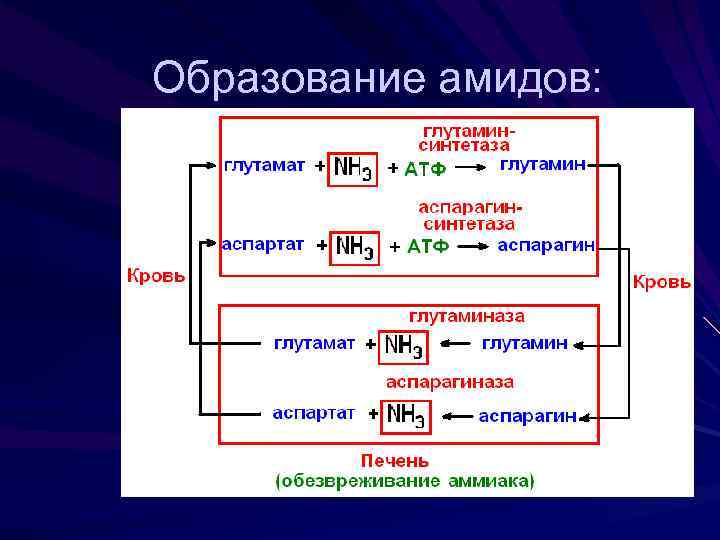
Образование амидов:
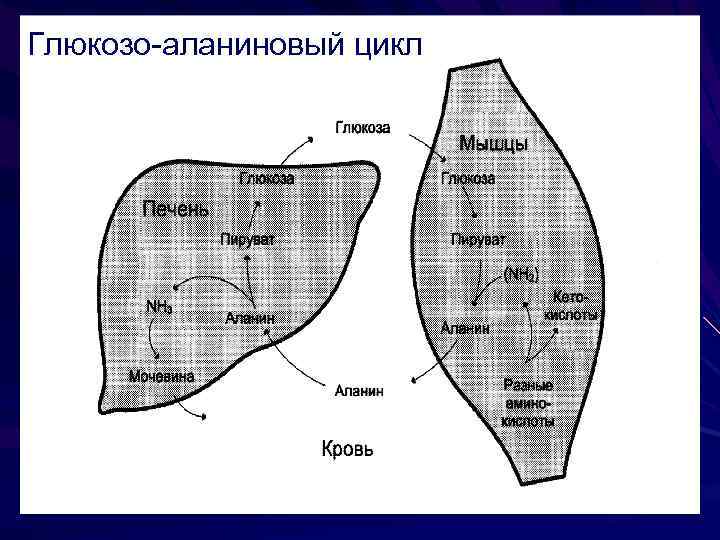
Глюкозо-аланиновый цикл
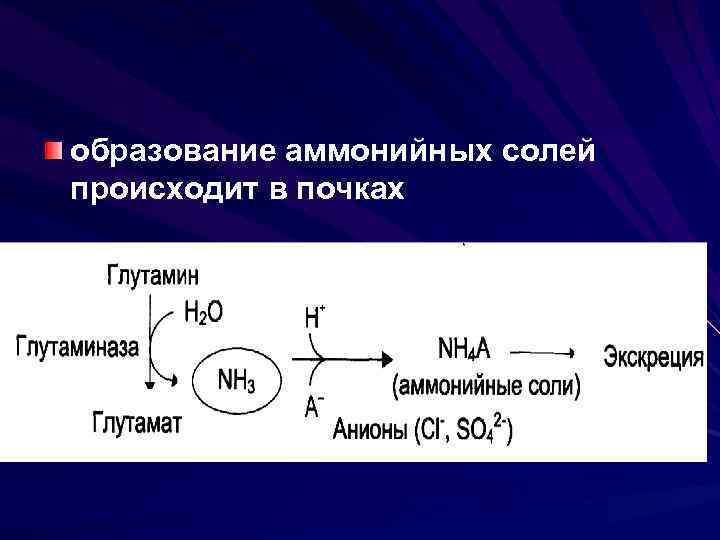
образование аммонийных солей происходит в почках

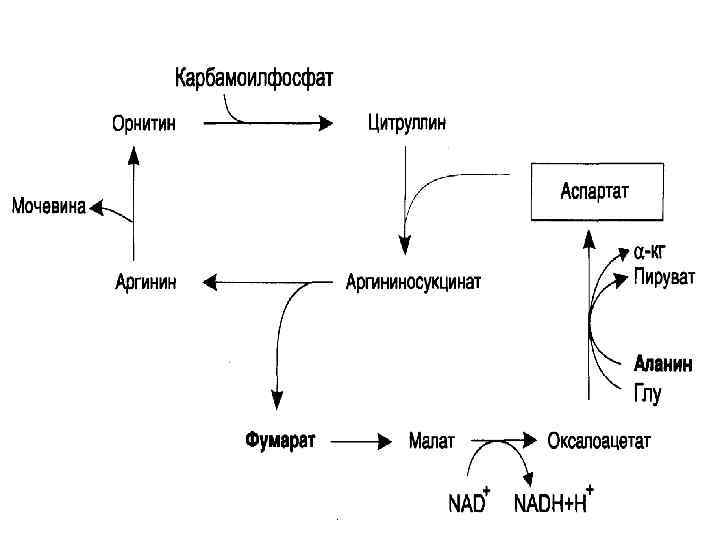
Биосинтез мочевины (орнитиновый цикл) Синтез мочевины - циклический процесс Локализация- митохондрии гепатоцитов Мочевина – инертное, хорошо растворимое нетоксическое вещество Этим путем выводится 80% всего образующегося аммиака

химическая сущность орнитинового цикла заключается в следующим: из аммиака, углекислого газа, воды и аминогруппы аспартата в несколько химических реакций на матрице орнитина строится молекула мочевины синтез идет с затратой энергии мочевина выводится с мочой

Спасибо за внимание!
Обмен белков.ppt