Обмен белков.ppt
- Количество слайдов: 36

Обмен белков 1. Синтез белка • Биосинтез аминокислот • Биосинтез белка 2. Распад белка • Гидролиз белка до аминокислот • Катаболизм аминокислот

Биосинтез аминокислот Аминокислоты – карбоновые кислоты, содержащие аминогруппу. Общая схема синтеза аминокислот: присоединение аминогруппы к углеродному скелету. Для биосинтеза аминокислот требуются: • органические кислоты (углеродный скелет) • аминогруппа (азот) Источниками углеродного скелета для аминокислот являются промежуточные соединения, образующиеся при гликолизе, ПФЦ, ЦТК. Микроорганизмы могут использовать и природные источники углеродсодержащих органических соединений из среды.
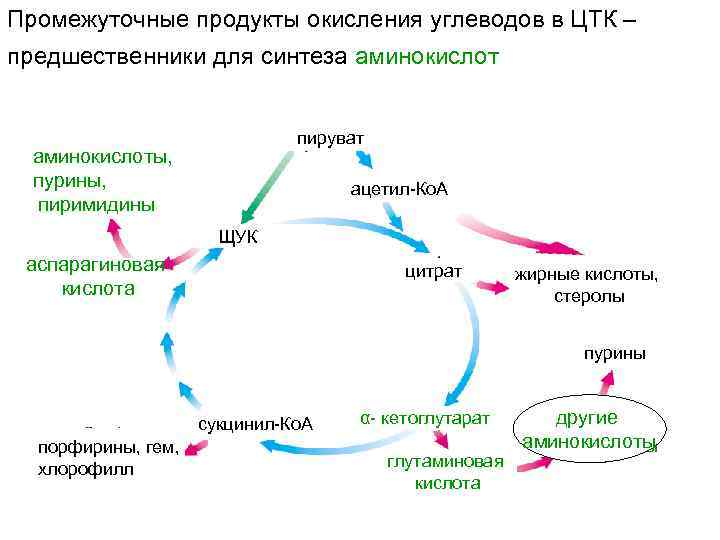
Промежуточные продукты окисления углеводов в ЦТК – предшественники для синтеза аминокислот пируват аминокислоты, пурины, пиримидины ацетил-Ко. А ЩУК аспарагиновая кислота цитрат жирные кислоты, стеролы пурины сукцинил-Ко. А порфирины, гем, хлорофилл α- кетоглутарат глутаминовая кислота другие аминокислоты
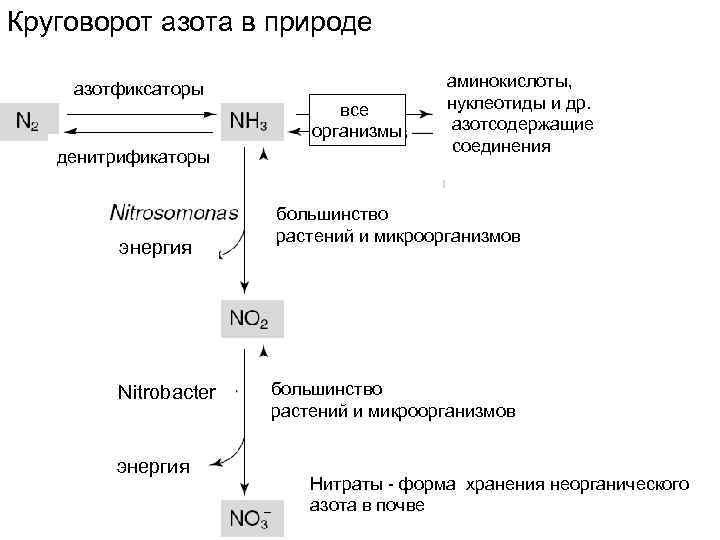
Круговорот азота в природе азотфиксаторы все организмы денитрификаторы энергия Nitrobacter энергия аминокислоты, нуклеотиды и др. азотсодержащие соединения большинство растений и микроорганизмов Нитраты - форма хранения неорганического азота в почве

Источники азота для синтеза аминокислот у животных, растений и микроорганизмов Растения и микроорганизмы азот усваивают из почвы или питательной среды, где азот находится в виде нитратов (NO 3 ‾) или нитритов ( NO 2‾). Прежде чем использовать азот для синтеза аминокислот, они его восстанавливают до аммиака при участии дегидрогеназ: Животные и человек получают азот в восстановленной форме в виде аммиака при усвоении пищи. Но аммиак ядовит как для растений, так и для животных тканей, поэтому он никогда не присутствует свободном виде ни у растений, ни у животных, а всегда сразу связывается органическими соединениями. И Аминогруппа в составе органических соединений используется для синтеза аминокислот и других органических соединений.
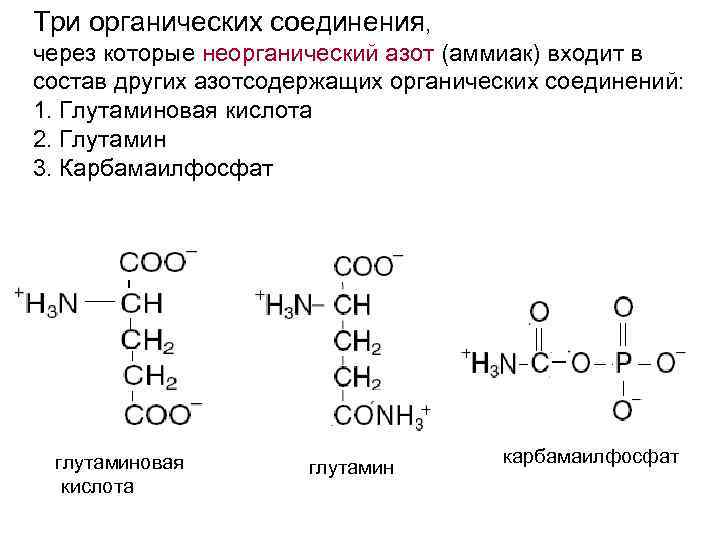
Три органических соединения, через которые неорганический азот (аммиак) входит в состав других азотсодержащих органических соединений: 1. Глутаминовая кислота 2. Глутамин 3. Карбамаилфосфат глутаминовая кислота глутамин карбамаилфосфат
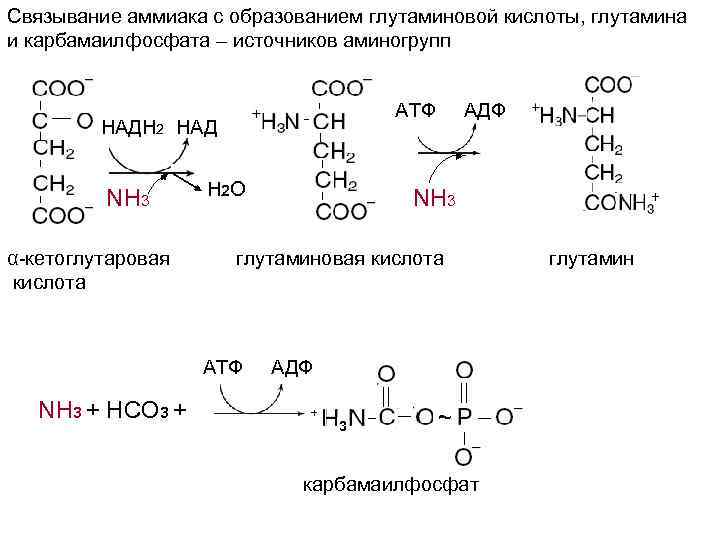
Связывание аммиака с образованием глутаминовой кислоты, глутамина и карбамаилфосфата – источников аминогрупп АТФ АДФ НАДН 2 НАД NH 3 Н 2 О NH 3 α-кетоглутаровая глутаминовая кислота глутамин кислота АТФ АДФ NH 3 + HCO 3 + + 3 ~ карбамаилфосфат

Проблемы со строительными материалами для биосинтеза аминокислот решены : • есть углеродные скелеты - промежуточные соединения из гликолиза, ЦТК, ПФЦ; • есть источники аминогрупп: глутаминовая кислота, глутамин, карбамаилфосфат Рассмотрим как происходит сборка 20 аминокислот, входящих в состав белка
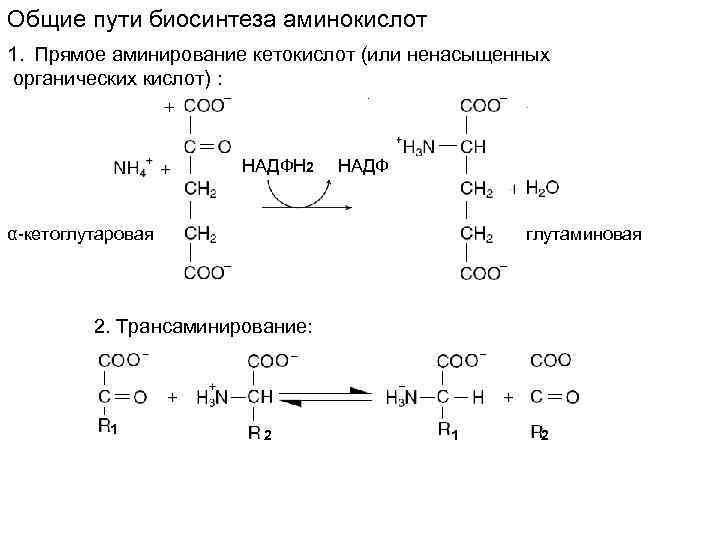
Общие пути биосинтеза аминокислот 1. Прямое аминирование кетокислот (или ненасыщенных органических кислот) : НАДФН 2 НАДФ α-кетоглутаровая глутаминовая 2. Трансаминирование: 1 2
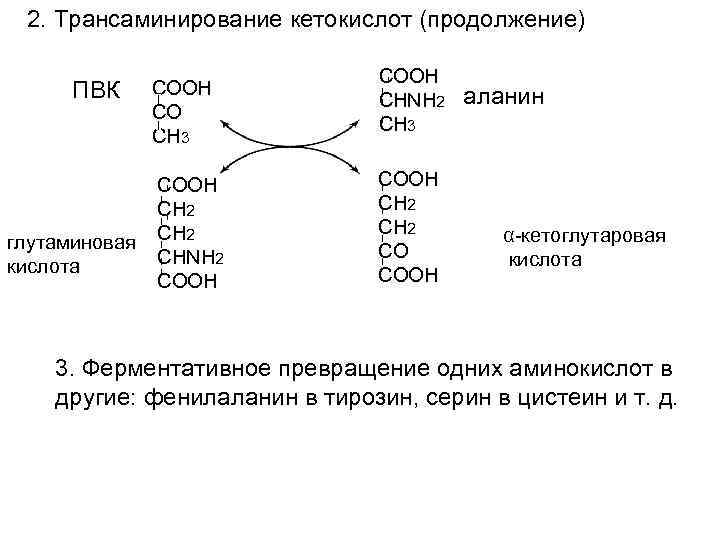
2. Трансаминирование кетокислот (продолжение) ПВК СООН СО СН 3 СООН СН 2 глутаминовая СН 2 СНNН 2 кислота СООН СНNН 2 СН 3 СООН СН 2 СО СООН аланин α-кетоглутаровая кислота 3. Ферментативное превращение одних аминокислот в другие: фенилаланин в тирозин, серин в цистеин и т. д.

Синтез незаменимых аминокислот Незаменимые аминокислоты (аргинин, валин, гистидин, лизин, лейцин, изолейцин, метионин, триптофан, треонин, фенилаланин) не синтезируются в организме человека и животных, т. к. они в ходе эволюции утратили способность к синтезу углеродного скелета незаменимых аминокислот. Их синтезируют растения и большинство микроорганизмов. Синтез незаменимых аминокислот происходит в результате сложных многоступенчатых (до 15) ферментативных реакций. Пути их биосинтеза у различных видов идентичны или близки.
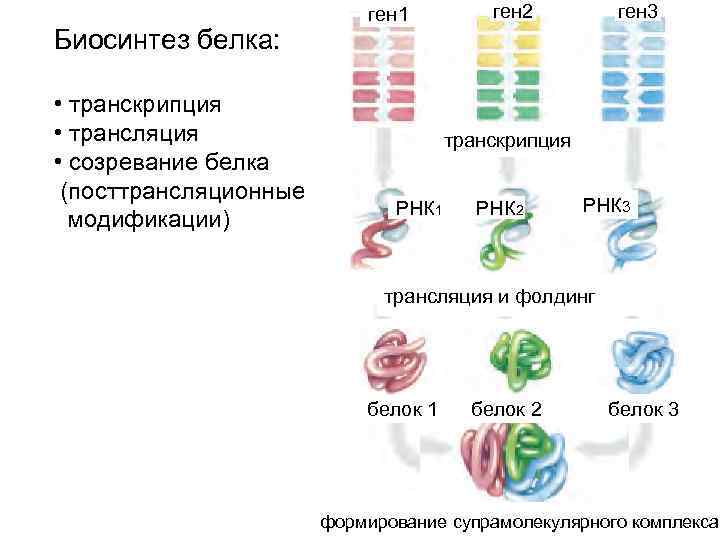
Биосинтез белка: • транскрипция • трансляция • созревание белка (посттрансляционные модификации) ген 1 ген 2 ген 3 транскрипция РНК 1 РНК 2 РНК 3 трансляция и фолдинг белок 1 белок 2 белок 3 формирование супрамолекулярного комплекса

созревание белка (посттрансляционные модификации) повреждение белка Внутри- и внеклеточные протеины подвержены многочисленным формам посттрансляционных модификаций. Большинство из них физиологичны, например, фосфорилирование и гликозилирование, некоторые из них не физиологичны и потенциально вредные, такие как окисление и гликация. Биологическое старение можно определить как физиологический спад со временем, который вероятно вызван изменением белка. Изменение белка по большей части сгенерировано пост-трансляционными модификациями. Карбонилирование белка, которое начинается с остатков лизина и аргинина считаются маркерами окислительного разрушения белка. Количество карбонилированных белков с возрастом возрастает и предполагается научиться управлять этим процессом. Наиболее распространенный и легко обнаруживаемый тип повреждения белков - образование карбонильных групп при окислении аминокислот : лизина , аргинина и пролина [ Stadtman ea 1992 ]. В таблице представлены данные по концентрации карбонильных групп в белках в различных тканях человека и крысы, а также в белках мухи, нематоды и бактерии. Из таблицы видно, что концентрация карбонильных групп и, следовательно, уровень окислительных повреждений в белках не зависят ни от вида организма, ни от типа ткани. При анализе использовали данные для молодых организмов, так как уровень поврежденных белков, как будет видно из дальнейшего изложения, зависит от возраста. Этот уровень составляет 1. 5 -2. 5 нмоль/мг белка, и у молодых особей никогда не превышает 3 нмоль/мг. Такой результат представляется особенно удивительным, поскольку разные организмы, а также различные ткани сильно различаются по интенсивности метаболизма, а следовательно, и по интенсивности продукции свободных радикалов. Каким же образом концентрация поврежденных белков в клетке поддерживается на постоянном уровне? Скорость производства свободных радикалов в клетке зависит, прежде всего, от интенсивности дыхания. Для того, чтобы при усилении дыхания степень повреждения белков поддерживалась на постоянном уровне, необходимо, чтобы при этом происходило увеличение скорости обновления поврежденных белков. То есть скорости дыхания и обновления белков в различных тканях и организмах должны быть коррелированы. Карбоксильные группы белков под действием АФК превращаются в карбонильные группы, которые, в свою очередь, могут взаимодействовать с аминогруппами, образуя Шиффовы основания, приводящие в конечном итоге к образованию поперечных сшивок между белковыми молекулами и нарушению их активности ( Richter et al. , 1988 ). Процесс химического сшивания наблюдается и при гликировании белков, который существенно активируется при окислительном стрессе.

• трансляция

Распад белка (протеолиз): 1. Гидролиз белка до аминокислот 2. Катаболизм аминокислот
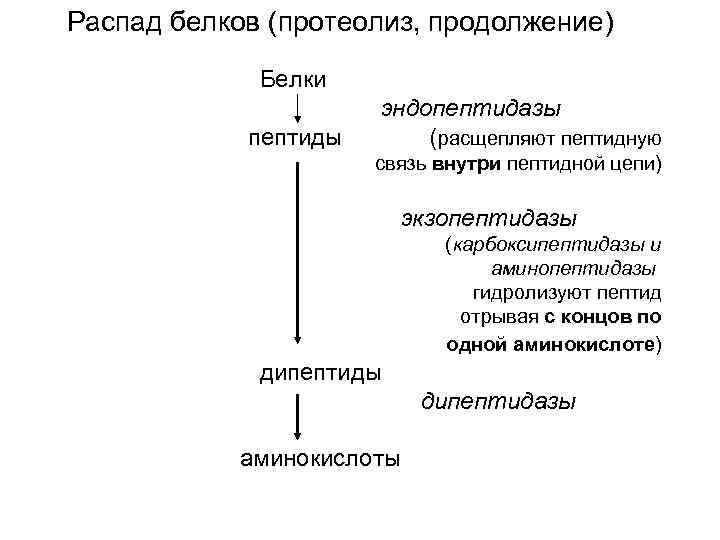
Распад белков (протеолиз, продолжение) Белки эндопептидазы пептиды ( расщепляют пептидную связь внутри пептидной цепи) экзопептидазы (карбоксипептидазы и аминопептидазы гидролизуют пептид отрывая с концов по одной аминокислоте) дипептиды дипептидазы аминокислоты
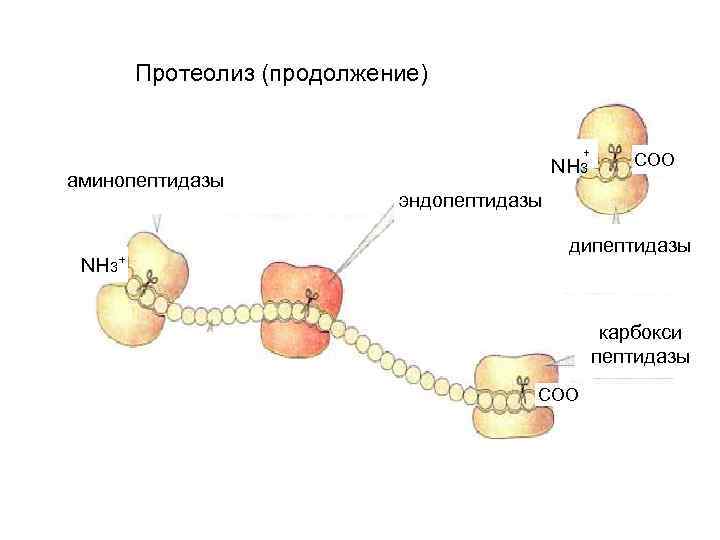
Протеолиз (продолжение) + аминопептидазы NH 3+ NH 3 CОО эндопептидазы дипептидазы карбокси пептидазы CОО
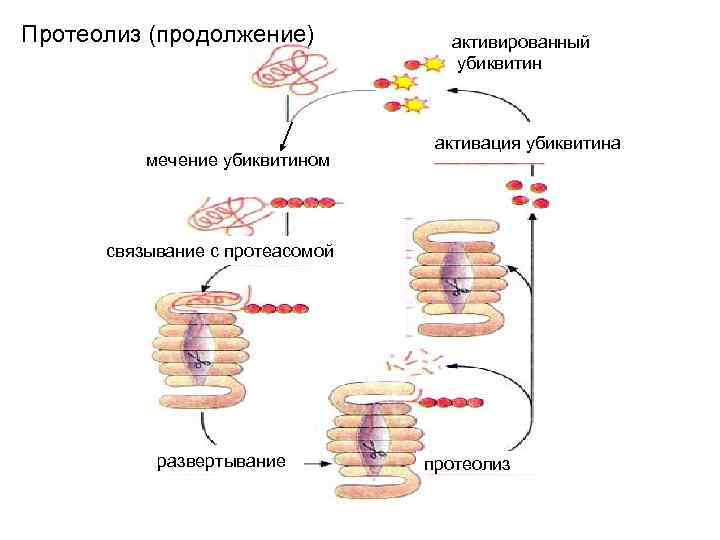
Протеолиз (продолжение) мечение убиквитином активированный убиквитин активация убиквитина связывание с протеасомой развертывание протеолиз
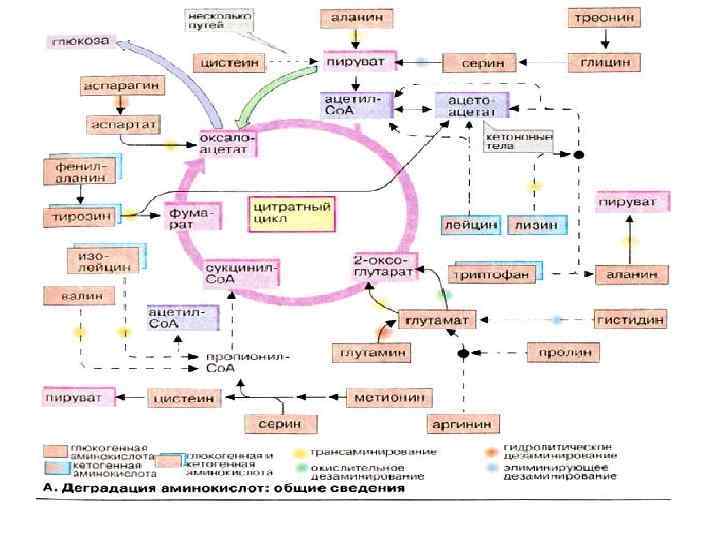

Катаболизм аминокислот Начальная стадия – отщепление α-аминогруппы может происходить двумя путями: , 1. Трансаминирование: аминогруппа от аминокислоты переносится на кетокислоту или на глутаминовую кислоту 2. Дезаминирование: если отщепление NH 2 -группы от аминокислоты происходит в виде аммиака. Эта реакция протекает по 4 различным механизмам: - окислительное дезаминирование - восстановительное - гидролитическое - внутримолекулярное
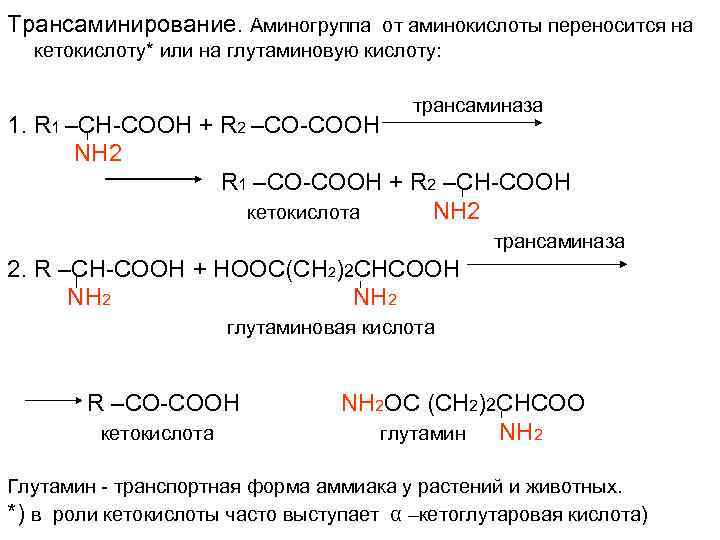
Трансаминирование. Аминогруппа от аминокислоты переносится на кетокислоту* или на глутаминовую кислоту: трансаминаза 1. R 1 –CH-COOH + R 2 –CO-COOH NH 2 R 1 –CО-COOH + R 2 –CН-COOH кетокислота NH 2 трансаминаза 2. R –CH-COOH + HOOC(CH 2)2 CHCOOH NH 2 глутаминовая кислота R –CO-COOH NH 2 OC (CH 2)2 CHCOO кетокислота глутамин NH 2 Глутамин - транспортная форма аммиака у растений и животных. *) в роли кетокислоты часто выступает α –кетоглутаровая кислота)

1. Коллекторная функция трансаминирования 2. Глутамин - транспортная форма аммиака у растений и животных.
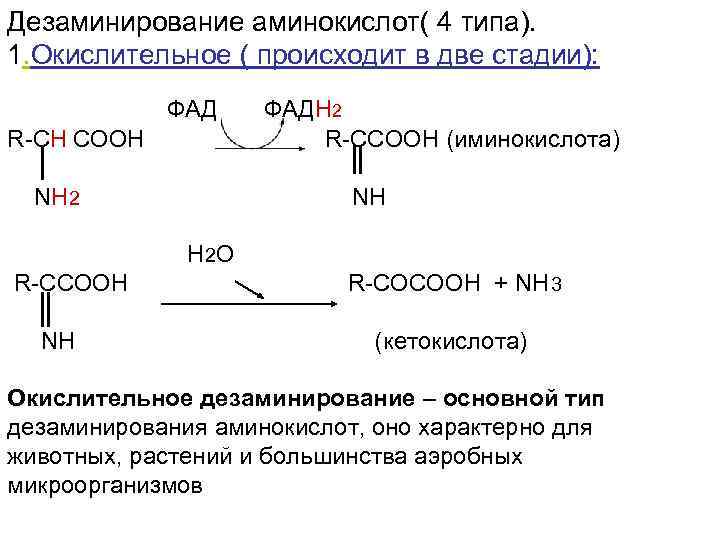
Дезаминирование аминокислот( 4 типа). 1. Окислительное ( происходит в две стадии): ФАДН 2 R-CH COOH R-CCOOH (иминокислота) NH 2 NH H 2 O R-CCOOH R-COCOOH + NH 3 NH (кетокислота) Окислительное дезаминирование – основной тип дезаминирования аминокислот, оно характерно для животных, растений и большинства аэробных микроорганизмов
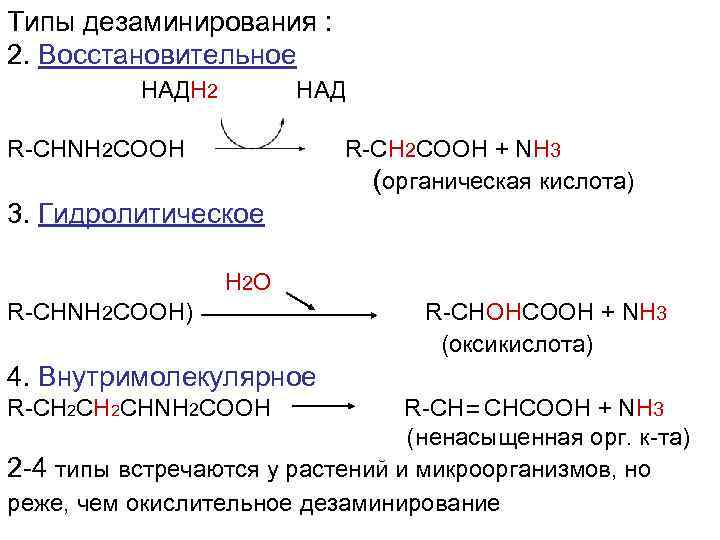
Типы дезаминирования : 2. Восстановительное НАДН 2 НАД R-CHNH 2 COOH R-CH 2 COOH + NH 3 (органическая кислота) 3. Гидролитическое H 2 O R-CHNH 2 COOH) R-CHOHCOOH + NH 3 (оксикислота) 4. Внутримолекулярное R-СН 2 CHNH 2 COOH R-CH CHCOOH + NH 3 (ненасыщенная орг. к-та) 2 -4 типы встречаются у растений и микроорганизмов, но реже, чем окислительное дезаминирование
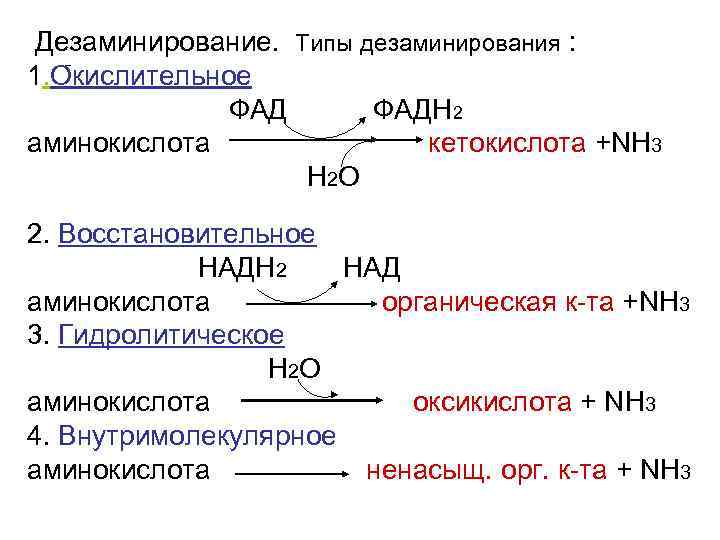
Дезаминирование. Типы дезаминирования : 1. Окислительное ФАДН 2 аминокислота кетокислота +NH 3 H 2 O 2. Восстановительное НАДН 2 НАД аминокислота органическая к-та +NH 3 3. Гидролитическое H 2 O аминокислота оксикислота + NH 3 4. Внутримолекулярное аминокислота ненасыщ. орг. к-та + NH 3

Судьба углеродного скелета после удаления аминогруппы: карбоновые кислоты, кетокислоты, оксикислоты:

Разная судьба NH 3, отщепленного от аминокислот путем дезаминирования : • у растений – он связывается и используется (коллекторная функция глутаминовой кислоты, транспортная функция глутамина) • у большинства животных и человека – аммиак связывается глутаминовой кислотой и в виде глутамина переносится в печень, где либо используется для синтеза аминокислот, либо выводится из организма в виде мочевины

Судьба аминогруппы аминокислота кетокислота трансаминирование α-кетоглутаровая кислота глутаминовая кислота окислительное дезаминирование цикл мочевины мочевина

Цикл мочевины (орнитиновый цикл) (синтез мочевины происходит в печени)
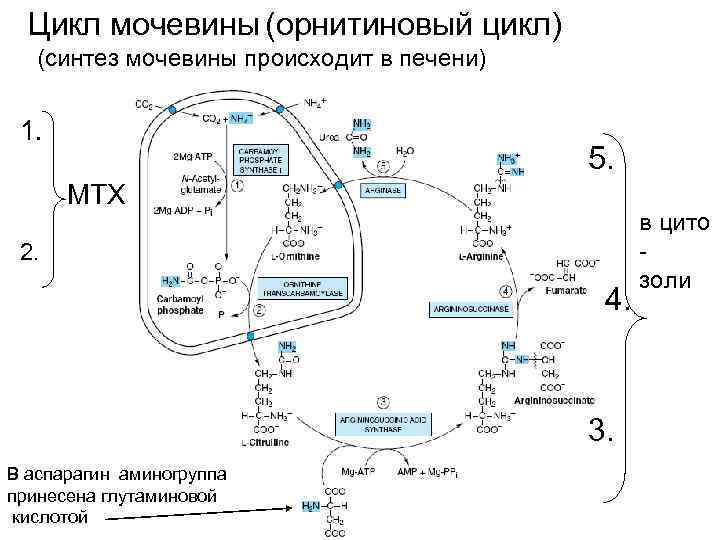
Цикл мочевины (орнитиновый цикл) (синтез мочевины происходит в печени) 1. 5. МТХ 2. 4. 3. В аспарагин аминогруппа принесена глутаминовой кислотой в цито золи

NH 3 В МТХ: + СО 2 АТФ АДФ ~Р карбамаилфосфат орнитин 2. NH 2 цитруллин 1.
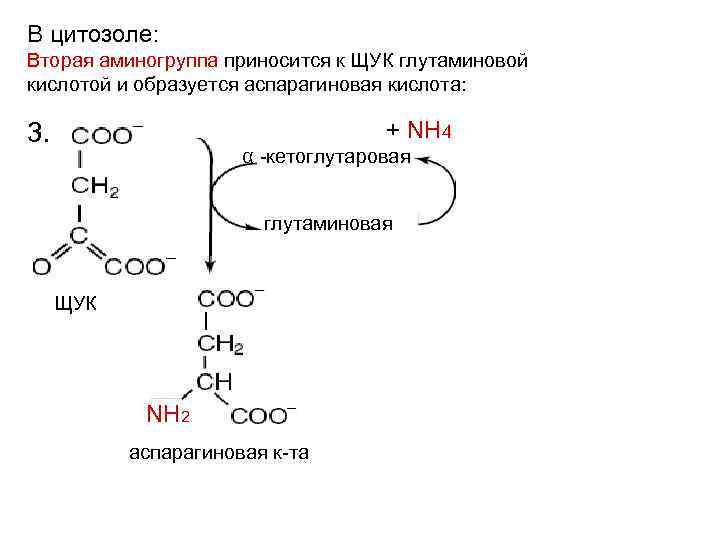
В цитозоле: Вторая аминогруппа приносится к ЩУК глутаминовой кислотой и образуется аспарагиновая кислота: + NH 4 3. α -кетоглутаровая глутаминовая ЩУК NH 2 аспарагиновая к-та
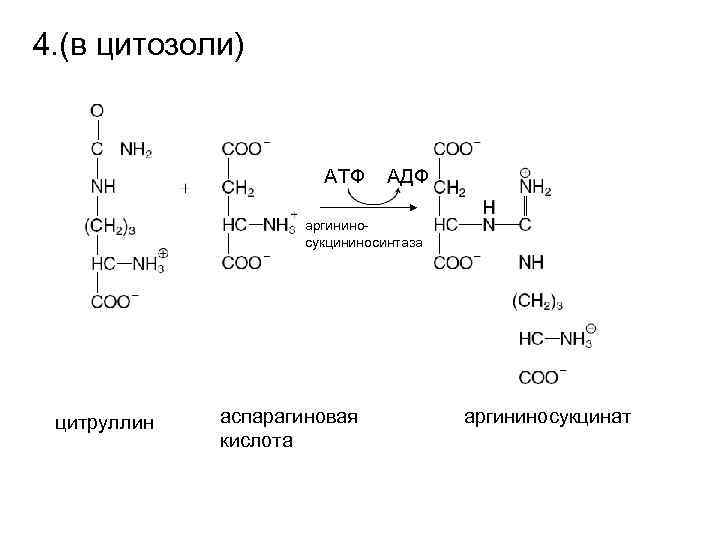
4. (в цитозоли) АТФ АДФ аргининосукцининосинтаза цитруллин аспарагиновая кислота аргининосукцинат
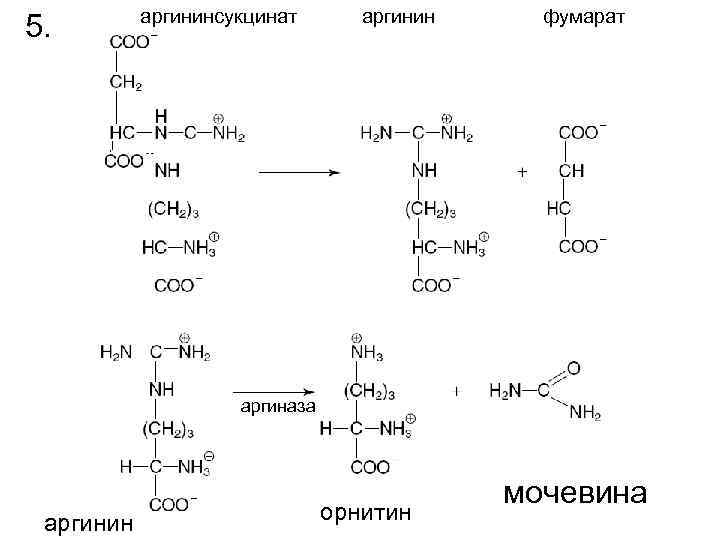
5. аргининсукцинат аргинин фумарат аргиназа аргинин орнитин мочевина

Живые системы отличаются по формам выведения аммиака из организма: уреотелические урикотелические аммониотелические мочевина большинство животных мочевая кислота птицы, пресмыкающиеся аммиак, аммонийные соли водные животные
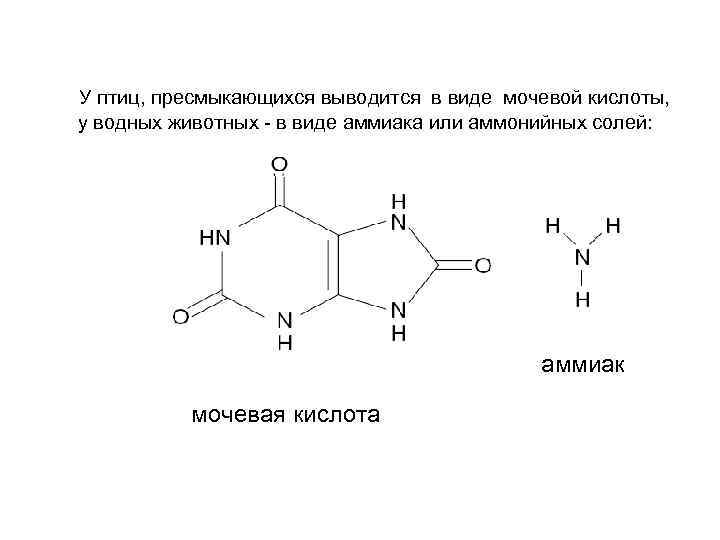
У птиц, пресмыкающихся выводится в виде мочевой кислоты, у водных животных - в виде аммиака или аммонийных солей: аммиак мочевая кислота
Обмен белков.ppt