Темы 5.1-5.5 Наследственность и патолгия.pptx
- Количество слайдов: 127

Областное государственное бюджетное образовательное учреждение «Томский базовый медицинский колледж» Раздел 5 «Наследственность и патология» Преподаватель – Повх Ирина Владимировна

Классификация наследственной патологии В основу генетической классификации наследственных болезней положен этиологический принцип, а именно тип мутаций и характер взаимодействия со средой.

Всю наследственную патологию можно разделить на 5 групп: 1) Хромосомные болезни это заболевания, возникающие в результате хромосомных и геномных мутаций. Хромосомные болезни сопровождаются аномалией количества или структуры хромосом у человека.

2) Генные заболевания - это нарушения, причиной которых являются мутации отдельных генов. Большинство моногенных заболеваний наследуются в соответствии с законами Менделя. В этой группе заболеваний выделяют аутосомно-доминантные, аутосомно-рецессивные, Х-сцепленные доминантные, Х-сцепленные рецессивные и митохондриальные патологические состояния.

3) Болезни с наследственной предрасположенностью (мультифакториальные) - это заболевания, возникающие в результате совместного действия наследственных и внешне средовых факторов. При воздействии на организм средовых факторов реализуется наследственная предрасположенность.

4) Генетические болезни соматических клеток - это нарушения, возникающие в результате мутаций в соматических клетках. Они выделены в самостоятельную группу после обнаружения в клетках при злокачественных новообразованиях специфических хромосомных перестроек, вызывающих активацию онкогенов. К этой группе относятся некоторые опухоли, отдельные пороки развития, аутоиммунные заболевания.

5) Болезни генетической несовместимости матери и плода - развиваются в результате иммунологической реакции организма матери на антиген плода. Наиболее типичное и хорошо изученное заболевание этой группы – гемолитическая болезнь новорожденных, возникающая в результате несовместимости матери и плода по резус-антигену. Болезнь возникает в тех случаях, когда мать имеет резус-отрицательную группу крови, а плод унаследовал резусположительный аллель от отца.

Тема 5. 1 «Хромосомные болезни»

Хромосомные болезни Различают: q геномные синдромы - изменением числа хромосом (полиплоидии и анеуплоидии). qструктурные изменения хромосом.

Полиплоидии характеризуются умножением набора хромосом на число, кратное гаплоидному. Полиплоидия редко обнаруживается у новорожденных, чаще это нарушение выявляется у эмбрионов при выкидышах в первом триместре беременности. Анеуплоидия (гетероплоидия) – это увеличение или уменьшение числа хромосом по одной какой-то паре.

Чаще всего у человека регистрируется наличие дополнительной хромосомы – трисомия (ХХХ, ХХУ). При этом какая-либо хромосома в организме представлена тремя копиями вместо двух положенных, а кариотип больного включает 47 хромосом. Увеличиваться может число как аутосом, так и половых хромосом. Отсутствие одной хромосомы называется моносомией (ХО). Кариотип человека в этом случае содержит 45 хромосом. Совместимой с жизнью является только моносомия ХО № 23 (синдром Шерешевского-Тернера).

Причиной геномных заболеваний является нарушение мейоза у родителей. Тогда все клетки больного имеют аномальный кариотип. Изменение набора хромосом может произойти и во время первых делений зиготы, даже если она была сформирована из нормальных гамет. В таких случаях образуется мозаицизм, т. е часть клеток организма – нормальные, часть – патологичные.

К структурным изменениям хромосом или хромосомным аберрациям относятся: q делеции; q дупликации; q инверсии; q инсерции; q изохромосомы; q кольцевые хромосомы; q транслокации.

Количественные и структурные аномалии аутосом Синдром Дауна (болезнь Дауна) Джон Лэнгдон Хэйдон Даун (1828 - 1896) британский врач, генетик Впервые СД описан в 1866 г английским педиатром Л. Дауном, но только в 1959 г французским генетиком, врачом Дж. Леженом и соавторами было доказано, что это заболевание хромосомной природы, а именно – трисомия по 21 хромосоме.

В настоящее время болезнь изучена достаточно полно, т. к является самой частой формой хромосомной патологии человека (1: 700 -800). Частота рождения больных напрямую связана с возрастом матери и отца, чем старше родители, тем чаще рождение больного ребенка. Цитологически доказано, что 20 % случаев СД имеют отцовское происхождение, 80%.
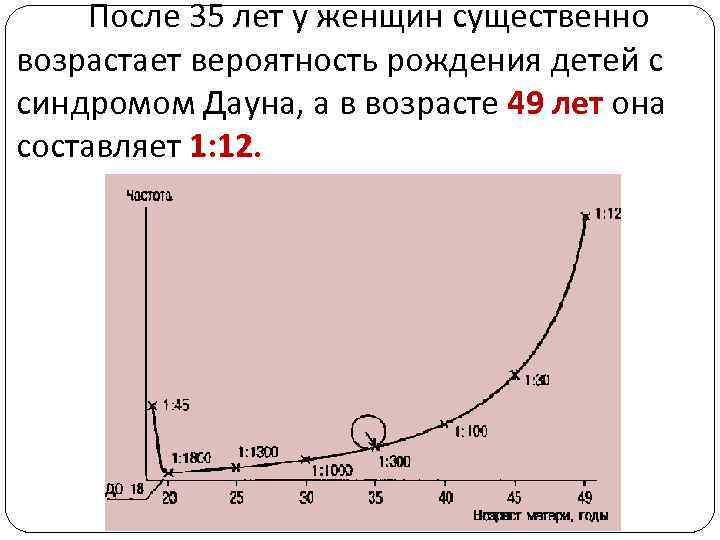
После 35 лет у женщин существенно возрастает вероятность рождения детей с синдромом Дауна, а в возрасте 49 лет она составляет 1: 12.

Варианты СД: 1) Простая трисомия составляет около 95% от общего числа больных с синдромом Дауна; 2) 4% приходится на транслокационный вариант (кариотип 46 хромосом, одна из двух хромосом № 15 соединена с одной из трех № 21); 3) 1% на мозаицизм (часть клеток – нормальные, часть – трисомные).
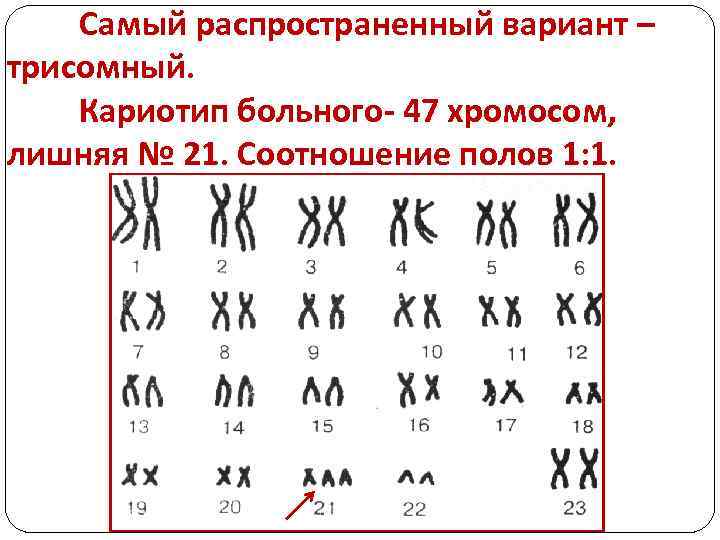
Самый распространенный вариант – трисомный. Кариотип больного- 47 хромосом, лишняя № 21. Соотношение полов 1: 1.

Клиническая картина СД: Дети с СД рождаются в срок, но с умеренно выраженной пренатальной гипоплазией (на 810% ниже средних величин). Череп брахицефалической формы с укорочением передне-заднего размера и уплощением затылка. Роднички шире, чем у здоровых детей и закрываются позже. Более чем у 50% детей имеется третий родничок. Избыток кожи на затылке отмечается у 80% больных.
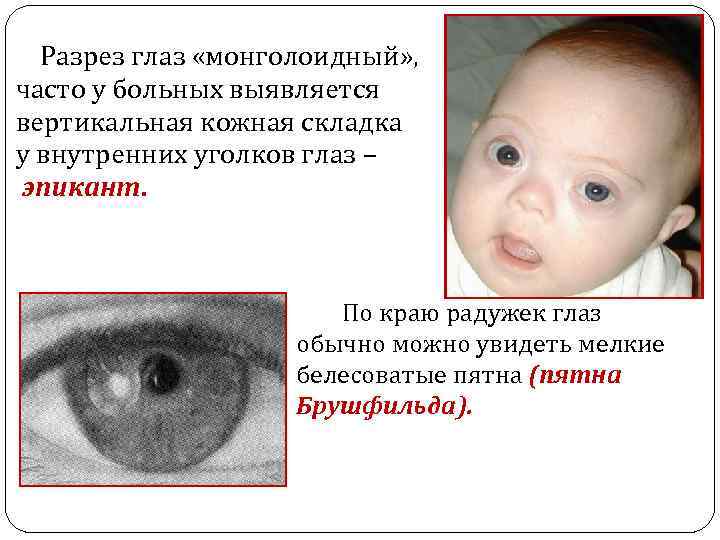
Разрез глаз «монголоидный» , часто у больных выявляется вертикальная кожная складка у внутренних уголков глаз – эпикант. По краю радужек глаз обычно можно увидеть мелкие белесоватые пятна (пятна Брушфильда).

Переносица широкая и вдавленная. Ушные раковины уменьшены и деформированы. У 60% детей с синдромом Дауна рот открыт, язык крупный, складчатый и виден между губами. Губы у большинства детей широкие, сухие, потрескавшиеся. Часто встречаются деформация и деструкция зубов. Руки короткие и широкие, мизинец укорочен, на ступнях обычно сандалевидная щель (увеличение расстояния между I и II пальцами).
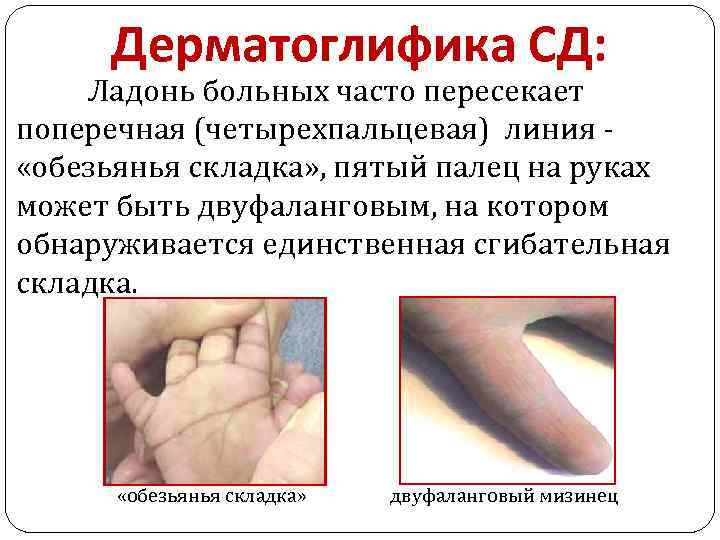
Дерматоглифика СД: Ладонь больных часто пересекает поперечная (четырехпальцевая) линия «обезьянья складка» , пятый палец на руках может быть двуфаланговым, на котором обнаруживается единственная сгибательная складка. «обезьянья складка» двуфаланговый мизинец

Частота встречаемости внешних признаков, обычно сопутствующих СД: q «плоское лицо» - 90% q брахицефалия (аномальное укорочение черепа) - 81% q кожная складка на шее у новорожденных - 81% q эпикантус (вертикальная кожная складка, прикрывающая медиальный угол глазной щели) - 80% q гиперподвижность суставов - 80% q мышечная гипотония - 80% q плоский затылок - 78% q короткие конечности - 70% q брахимезофалангия (укорочение всех пальцев за счет недоразвития средних фаланг) - 70% q катаракта в возрасте старше 8 лет - 66% q открытый рот (в связи с низким тонусом мышц и особым строением нёба) - 65% q зубные аномалии - 65% q аркообразное ( «готическое» ) нёбо - 58%

Частота встречаемости внешних признаков, обычно сопутствующих СД: q клинодактилия 5 -го пальца (искривлённый мизинец) - 60% q плоская переносица - 52% q бороздчатый язык - 50% q поперечная ладонная складка (называемая также «обезьяньей» ) - 45% q короткая широкая шея - 45% клинодактилия 5 -го пальца q ВПС (врождённый порок сердца) - 40% q короткий нос - 40% q страбизм (косоглазие) - 29% q деформация грудной клетки, килевидная или воронкообразная - 27% q пигментные пятна по краю радужки - пятна Брушфильда - 19% q эписиндром - 8% q стеноз или атрезия двенадцатиперстной кишки — 8% q врождённый лейкоз - 8%.

Умственное развитие больных отстает (дебильность, имбецильность, идиотия). Отмечается задержка формирования моторных навыков и речи. Дети позже начитают ходить и говорить. У них резко нарушено абстрактное мышление. Им легче осваивать навыки, связанные с физическими движениями, чем речевые. Больные часто послушные, ласковые, внимательные, терпеливые при обучении. Дети с синдромом Дауна

Диагностика: цитогенетическое исследование хромосом. Лечение: специфического лечения нет. Реабилитация больных с синдромом Дауна должна быть комплексной. Она включает массаж, гимнастику, лекарственную терапию. Питание должно быть полноценным. Большое значение придают воспитанию, занятиям с логопедом. Необходим внимательный уход за больным ребенком, защита его от простуды, инфекций.

Прогноз: умственное и физическое развитие детей протекает с задержкой. Некоторые больные могут учиться во вспомогательной школе. Синдром сочетается с острым лейкозом. Эти дети часто болеют пневмониями, тяжело переносят детские инфекции. Врожденные пороки внутренних органов и недостаточность иммунной системы часто приводят к летальному исходу в первые 5 лет жизни. Средняя продолжительность жизни больных 20 -30 лет, однако, известны случаи, когда больные доживают до глубокой старости.

Синдром Патау (синдром трисомии 13) Генетическая природа синдрома была расшифрована в 1960 г американским генетиком К. Патау и соавторами. Кариотип – 47 хромосом, трисомия № 13, чаще рождаются у матерей старшего возраста. Частота заболевания 1: 6000, соотношение полов 1: 1.
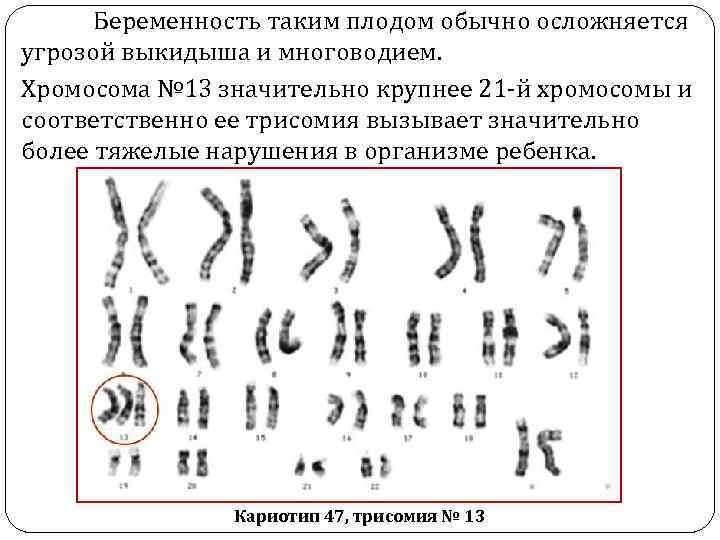
Беременность таким плодом обычно осложняется угрозой выкидыша и многоводием. Хромосома № 13 значительно крупнее 21 -й хромосомы и соответственно ее трисомия вызывает значительно более тяжелые нарушения в организме ребенка. Кариотип 47, трисомия № 13
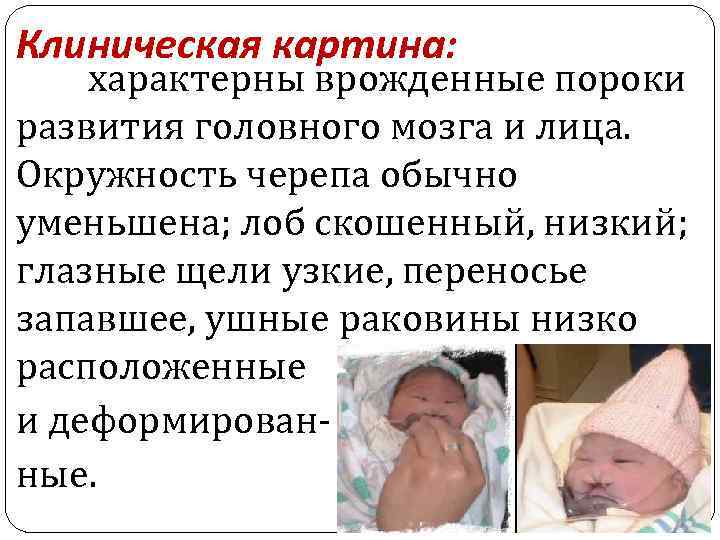
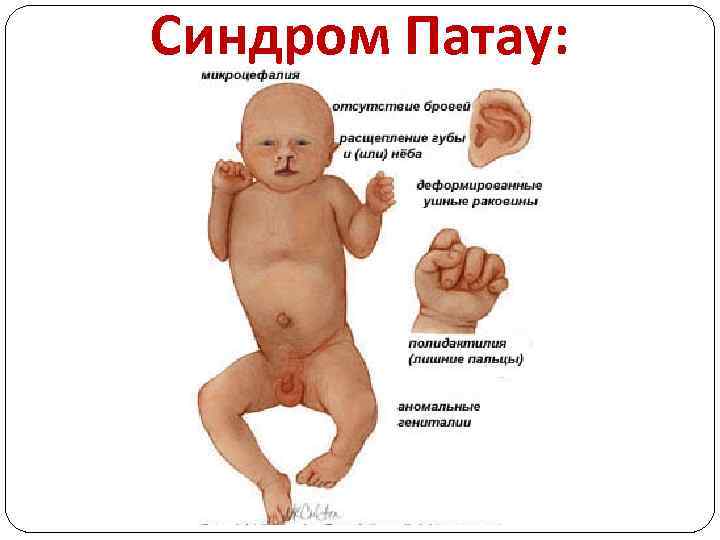
Клиническая картина: характерны врожденные пороки развития головного мозга и лица. Окружность черепа обычно уменьшена; лоб скошенный, низкий; глазные щели узкие, переносье запавшее, ушные раковины низко расположенные и деформированные.
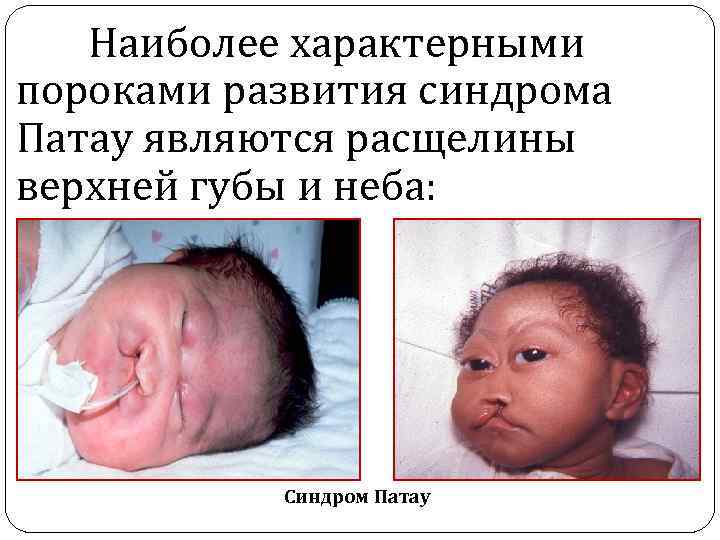
Наиболее характерными пороками развития синдрома Патау являются расщелины верхней губы и неба: Синдром Патау
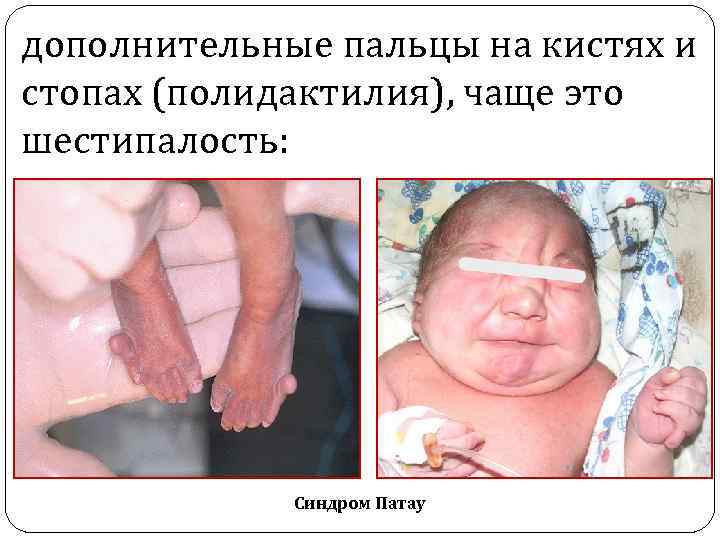
дополнительные пальцы на кистях и стопах (полидактилия), чаще это шестипалость: Синдром Патау

Дерматоглифика: наиболее часто описывают «обезьянью складку» . Характерны пороки развития внутренних органов. В 80% случаев у них отмечаются дефекты перегородок сердца. Пороки почек встречаются у большинства больных, возможно нарушение развития мочеточников. Половые органы поражаются более чем в 50% случаев: у девочек наблюдается удвоение матки и влагалища, у мальчиков – гипоплазия полового члена и крипторхизм (неопущение яичек). Пороки развития органов зрения – анофтальмия (отсутствие глазных яблок), микрофтальмия (недоразвитие глаз), помутнение хрусталика, дисплазия сетчатки встречается более чем у 70% больных. Центральная нервная система поражается в 100% случаев. Масса мозга уменьшена, часто отсутствует передний мозг, недоразвитие мозжечка, иногда мозг не разделен на полушария.
Синдром Патау:

Диагностика: цитогенетическое исследование хромосом. Лечение: симптоматическое. Уход за такими пациентами направлен на облегчение их состояния, предупреждение инфекционных осложнений. Прогноз: в связи с тяжелыми врожденными пороками развития большинство детей с синдромом Патау умирают в первые недели или месяцы жизни (95% - до 1 года). В возрасте старше трех лет остаются в живых единицы. Все дети с синдромом Патау имеют тяжелую умственную отсталость (глубокая идиотия).

Синдром Эдвардса (синдром трисомии 18) Генетическая природа синдрома была расшифрована в 1960 г Д. Эдвардсом и соавторами. Кариотип – 47 хромосом, трисомия № 18. Частота заболевания 1: 7000, соотношение полов 3: 1, причины преобладания патологии у девочек пока не ясны. Беременность при синдроме Эдвардса осложняется угрозой прерывания и многоводием.
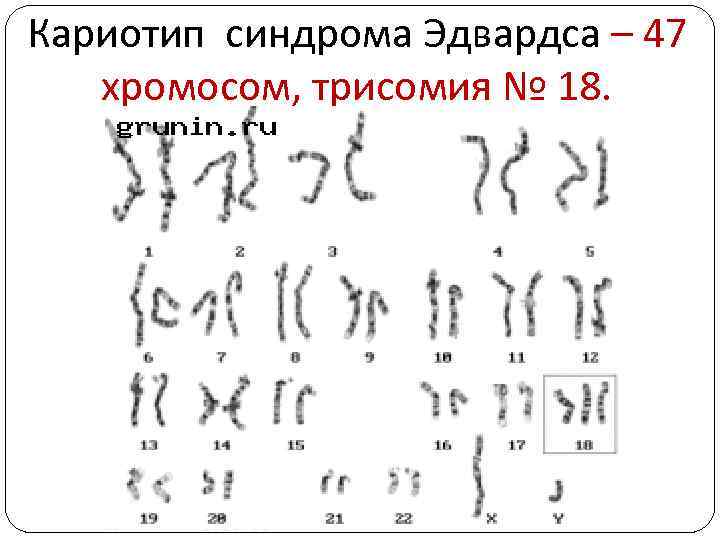
Кариотип синдрома Эдвардса – 47 хромосом, трисомия № 18.
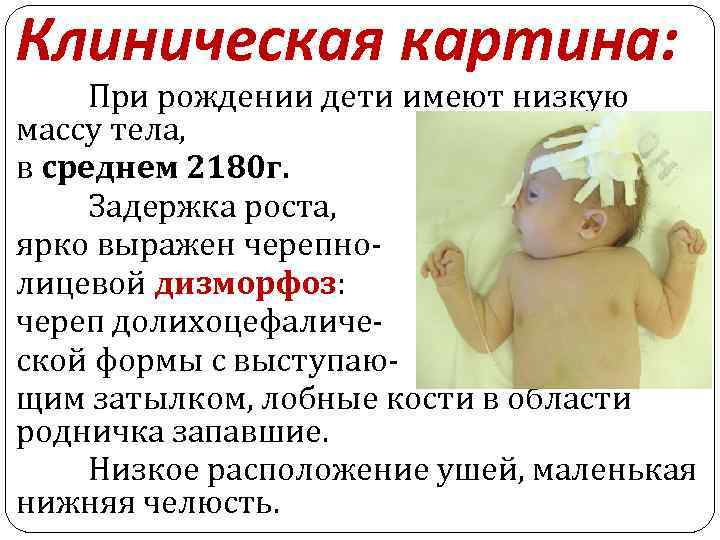
Клиническая картина: При рождении дети имеют низкую массу тела, в среднем 2180 г. Задержка роста, ярко выражен черепнолицевой дизморфоз: череп долихоцефалической формы с выступающим затылком, лобные кости в области родничка запавшие. Низкое расположение ушей, маленькая нижняя челюсть.
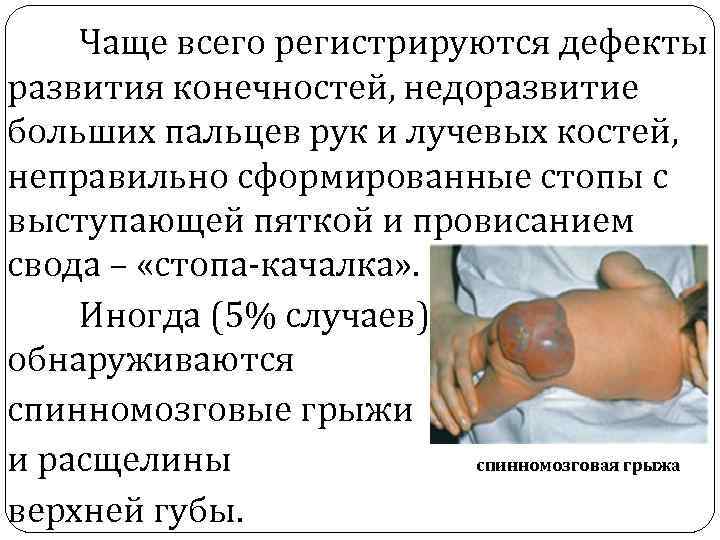
Чаще всего регистрируются дефекты развития конечностей, недоразвитие больших пальцев рук и лучевых костей, неправильно сформированные стопы с выступающей пяткой и провисанием свода – «стопа-качалка» . Иногда (5% случаев) обнаруживаются спинномозговые грыжи и расщелины спинномозговая грыжа верхней губы.
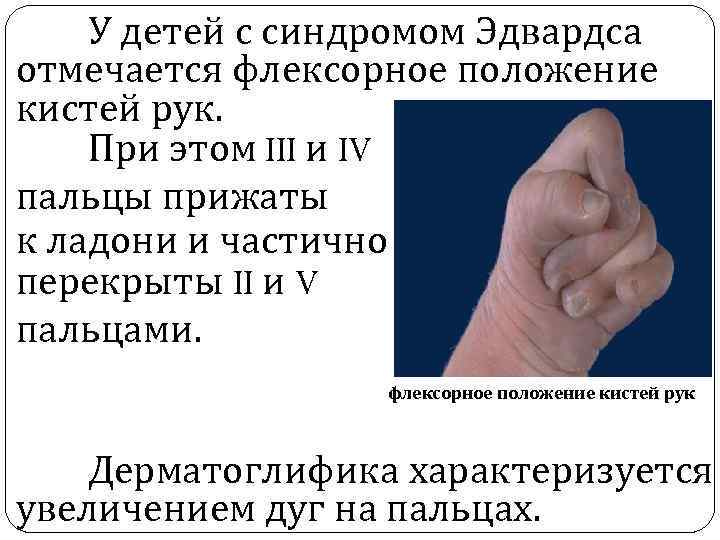
У детей с синдромом Эдвардса отмечается флексорное положение кистей рук. При этом III и IV пальцы прижаты к ладони и частично перекрыты II и V пальцами. флексорное положение кистей рук Дерматоглифика характеризуется увеличением дуг на пальцах.
Пороки сердца и крупных сосудов (90%) – нарушения межжелудочковой перегородки, клапанные пороки. Пороки развития желудочно-кишечного тракта: атрезия (отсутствие отверстия) пищевода, незавершенный поворот кишечника и т. д. Также отмечаются недоразвитие легких, сращение почек, удвоение мочеточников, крипторхизм у мальчиков.

Диагностика: цитогенетическое исследование хромосом. Лечение: симптоматическое. Уход за больными в основном заключается в предупреждении инфекционных осложнений. Прогноз: продолжительность жизни у детей с синдромом Эдвардса резко снижена - 30% новорожденных умирают в первый месяц, 50% - на втором, до года доживают немногим больше 10%.

Синдром «кошачьего крика» Синдром структурной аномалия одной из хромосомы № 5 (укорочение на одну треть короткого плеча - делеция) – впервые описал в 1963 г Дж. Лежен. Кариотип 46 хромосом, укорочение одной из хромосомы № 5 - делеция Частота заболевания 1: 45000. Несколько чаще данный синдром регистрируется у девочек.
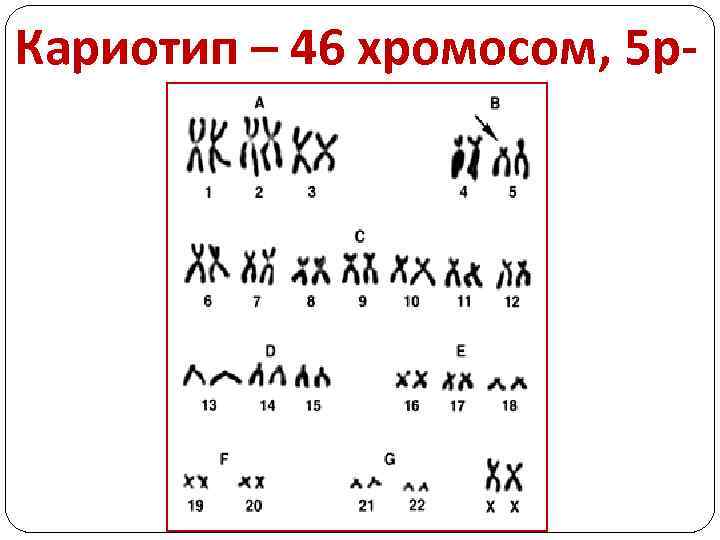
Кариотип – 46 хромосом, 5 р-

Клиническая картина: Масса тела ребенка с этим синдромом обычно несколько ниже. В период новорожденности плач напоминает крик кошки, что связано с аномалиями развития гортани – сужением, мягкостью хрящей, отечностью или необычной складчатостью слизистой, уменьшением надгортанника.

Дети плохо растут, отстают в психическом развитии. Часто у этих детей диагностируется микроцефалия, лунообразное лицо с гипертелоризмом, эпикант, страбизм, низко расположенные уши, короткая шея, мышечная гипотония. « лунообразное» лицо
Врожденные пороки развития внутренних органов встречаются редко, наиболее часто поражается сердце (дефекты межжелудочковой и межпредсердной перегородок). Все больные имеют тяжелую степень умственной недостаточности.

Диагностика: цитогенетическое исследование хромосом. Лечение: симптоматическое. Прогноз: большинство детей погибают в первые годы, около 10% больных достигают 10 летнего возраста.

Аномалии половых хромосом Это группа хромосомных болезней, представленная различными комбинациями дополнительных Х- и Ухромосом, а в случаях мозаицизма - комбинациями разных клонов.

Синдром трипло-Х (синдром трисомии Х) Впервые цитогенетика синдрома была описана в 1959 г. А. Джекобсом. Кариотип 47 хромосом, трисомия № 23 – ХХХ, рождаются девочки.

Синдром типло-Х: кариотип 47, трисомия № 23

Частота заболевания 1: 1000 новорожденных девочек. Как правило, физическое и психическое развитие у женщин с этим синдромом не имеет отклонений от нормы. Это объясняется тем, что у них инактивируются две Х-хромосомы, а одна продолжает функционировать, как у нормальных женщин.

Как правило, у женщин с кариотипом ХХХ не отмечается отклонений в половом развитии, такие индивиды имеют нормальную плодовитость, хотя риск хромосомных нарушений у потомства и спонтанных абортов повышен. Интеллектуальное развитие нормальное или в пределах нижней границы нормы. Лишь у некоторых женщин с трипло-Х отмечаются нарушения репродуктивной функции (вторичная аменорея, дисменорея, ранняя менопауза и др. ).

Синдром Клайнфельтера Впервые описан в 1942 г. Г. Ф. Клайнфельтером, а в 1959 г. П. Джекобс и Дж. Стронг подтвердили хромосомную этиологию данного заболевания. Кариотип 47 хромосом, трисомия № 23 – ХХУ, рождаются мальчики. Частота 1: 500 -700 новорожденных мальчиков.
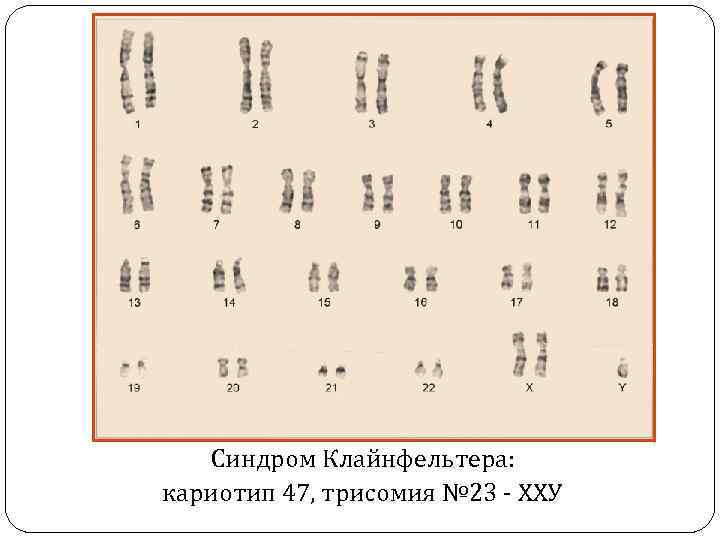
Синдром Клайнфельтера: кариотип 47, трисомия № 23 - ХХУ

Клиническая картина: В период новорожденности заподозрить этот диагноз невозможно. У грудных детей иногда определяются маленькие размеры яичек. Характерная клиническая картина формируется у мальчиков в пубертатном периоде.

Классическими проявлениями этого заболевания считаются высокий рост, непропорционально длинные конечности, нарушение сперматогенеза, уменьшение яичек - крипторхизм. Вторичные половые признаки выражены слабо: рост волос на лице скудный, голос сохраняет высокий тембр. Телосложение несколько феминизировано с отложением жира на бедрах и в нижней части живота. У 25% пациентов обнаруживается увеличение молочных желез - гинекомастия.
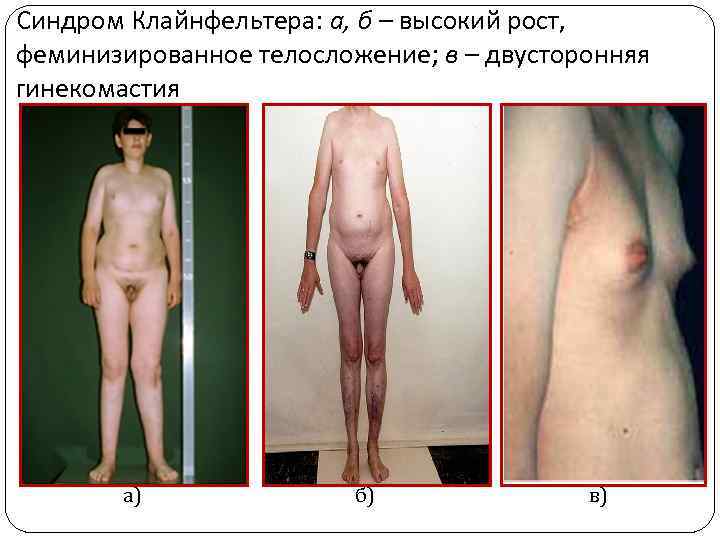
Синдром Клайнфельтера: а, б – высокий рост, феминизированное телосложение; в – двусторонняя гинекомастия а) б) в)

У некоторых больных выявляется катаракта, снижение слуха, врожденные пороки сердца, варикозное расширение вен. Умственная отсталость отмечается в 2550% случаев. Степень умственной отсталости колеблется от пограничных состояний до дебильности различной тяжести. Такие больные вялы, апатичны, безынициативны; им свойственны неустойчивость внимания, повышенная утомляемость и отвлекаемость, снижение работоспособности. Мужчины, страдающие синдромом Клайнфельтера бесплодны.

Диагностика: цитогенетическое исследование хромосом. Лечение: больным с нормальным интеллектом проводят в пубертатный период лечение андрогенами, которые корректируют вторичные половые признаки. Однако подобная терапия не приводит к восстановлению сперматогенеза. Наиболее эффективным методом лечения гинекомастии является хирургический.

Синдром полисомии Ухромосомы Кариотип 47 хромосом, трисомия № 23 – ХУУ. Частота 1: 1000 новорожденных мальчиков. Описаны индивидуумы с кариотипом 48, № 23 – ХУУУ и 49, № 23 – ХУУУУ.

Клиническая картина: Большинство мужчин с таким набором хромосом не отличаются от нормальных индивидов по физическому и умственному развитию, имеют рост выше среднего (более 190 см). Заметных отклонений ни в половом развитии, ни в гормональном статусе, ни в плодовитости у большинства ХУУ – индивидов нет. У таких лиц отмечаются некоторые особенности поведения: они склонны к агрессии и даже криминальным поступкам.

Синдром Шерешевского-Тернера (ХО) Впервые клиническую картину синдрома описал Шерешевский в 1925 г. , в 1938 г. Тернер дал полное описание этого заболевания, которое получило название синдрома Шерешевского -Тернера.
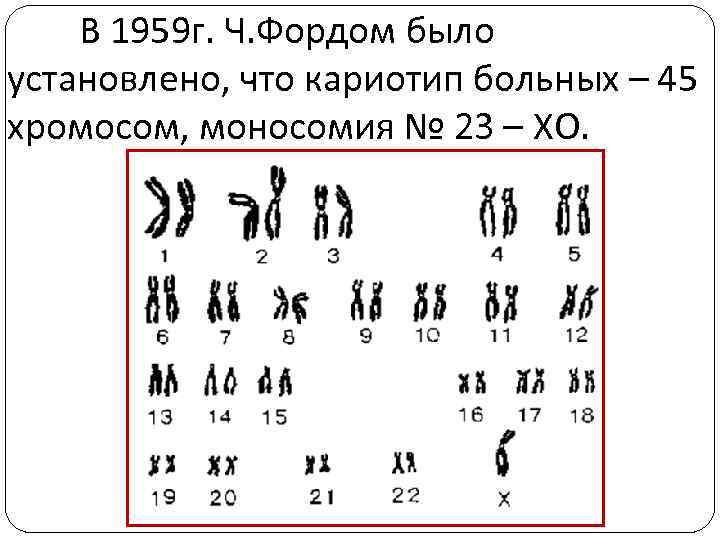
В 1959 г. Ч. Фордом было установлено, что кариотип больных – 45 хромосом, моносомия № 23 – ХО.
Частота – 1: 2000 – 1: 5000 новорожденных девочек. Клиническая картина: Шея короткая, широкая, у части больных встречается вертикальная кожная складка, идущая от затылка к надплечьям - шейный птеригиум.
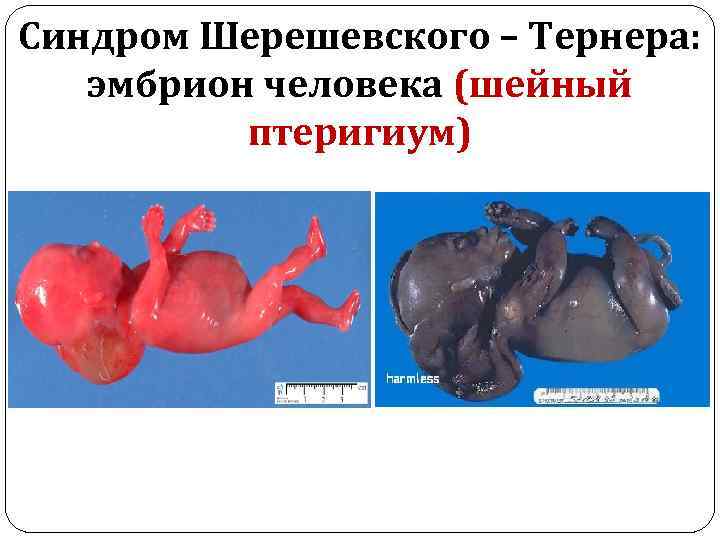
Синдром Шерешевского – Тернера: эмбрион человека (шейный птеригиум)

Наиболее частыми симптомами являются низкий рост, половой инфантилизм (наружные половые органы недоразвиты, большие и малые половые губы гипопластичны, отверстие мочеиспускательного канала расположено низко, влагалище узкое, длинное, матка недоразвита, уменьшена в размерах), вторичные половые признаки не развиты или развиты очень слабо.
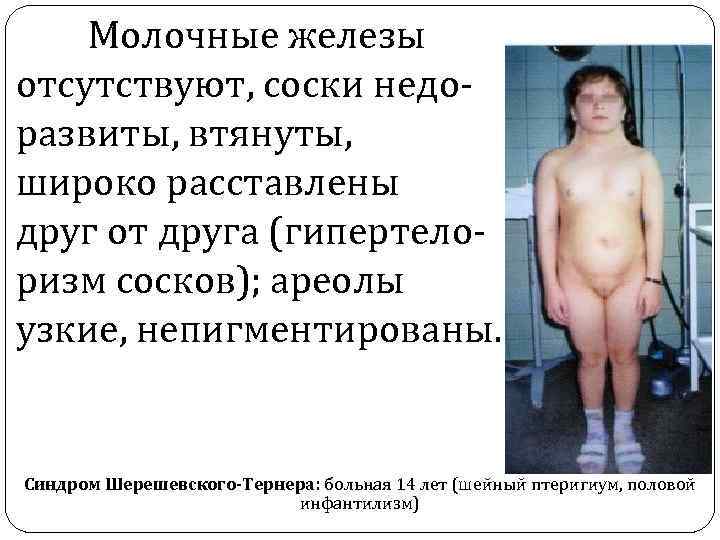
Молочные железы отсутствуют, соски недоразвиты, втянуты, широко расставлены друг от друга (гипертелоризм сосков); ареолы узкие, непигментированы. Синдром Шерешевского-Тернера: больная 14 лет (шейный птеригиум, половой инфантилизм)

Грудная клетка расширена «щитовидная» . Уши деформированы, низко расположены. У большинства больных наблюдают высокое, «готическое» небо. На коже часто расположено множество родинок. Нередки пороки сердца, аномалии почек. Интеллект нарушается редко.
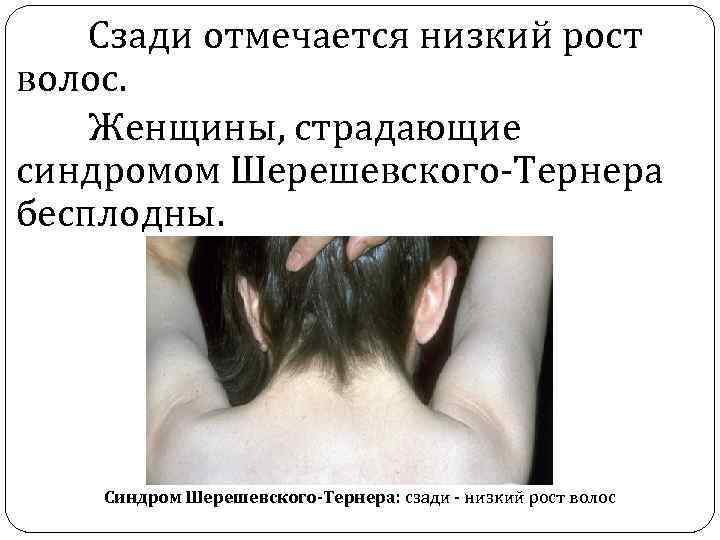
Сзади отмечается низкий рост волос. Женщины, страдающие синдромом Шерешевского-Тернера бесплодны. Синдром Шерешевского-Тернера: сзади - низкий рост волос

Диагностика: цитогенетическое исследование хромосом. Лечение: до 12 -14 лет таким девочкам проводится терапия, корригирующая задержку роста. С 13 -14 лет используют препараты женских половых гормонов, которые вызывают формирование вторичных половых признаков и менструального цикла.

При необходимости оперативно исправляются врожденные пороки развития и косметические нарушения (удаление крыловидных складок). Синдром Шерешевского-Тернера: шейный птеригиум (до и после операции)

Тема 5. 2 «Генные болезни»

Генные болезни (ферментопатии) – это разнообразная по клинической картине группа заболеваний, обусловленная мутациями единичных генов. Патологический процесс, возникающий в результате мутации единичного гена, проявляется одновременно на молекулярном, клеточном и органном уровнях у любого индивида.

Генные болезни могут носить характер наследования: q аутосомно-доминантный; q аутосомно-рецессивный; q Х-сцепленный доминантный и рецессивный; q У-сцепленный.

Аутосомно-доминантные заболевания: q Синдром Марфана; q Нейрофиброматоз (болезнь Реклингхаузена); q Ахондроплазия (врожденная хондродистрофия); q Синдром Холта-Орама (синдром рука-сердце) и др.

Аутосомно-рецессивные заболевания: q Фенилкетонурия (ФКУ, болезнь Феллинга) - нарушение обмена аминокислоты фенилаланин; q Галактоземия (нарушение обмена углеводов); q Мукополисахаридозы - синдромом Гурлера (накопление в клетках полимерных высокомолекулярных соединений углеводов с белками); q. Муковисцидоз; q болезнь Тея-Сакса (нарушение обмена липидов); q Врожденный гипотиреоз (ВГ), Адреногенитальный синдром (АГС) - нарушение обмена гормонов.

Х-сцепленные рецессивные заболевания q. Гемофилия (несвертываемость крови); q Дальтонизм (цветовая слепота); q Псевдогипертрофическая мышечная дистрофия Дюшенна; q Ангидрозная эктодермальная дисплазия (отсутствие потовых желез, нарушение терморегуляции); q Ихтиоз и др.

Х-сцепленные доминантные заболевания q Гипоплазия зубной эмали; q Наследственный рахит, резистентный к витамину D и др;

У- сцепленные q гипертрихоз ушной раковины; q перепончатое сращение пальцев и др.

Тема 5. 3 «Наследственное предрасположение к болезням»

Болезни с наследственной редрасположенностью – большая группа заболеваний, развитие которых обусловлено взаимодействием определенных наследственных факторов (мутации, сочетания генов) и факторов среды.

Наследственная предрасположенность к болезни может наследоваться: q. Моногенно; q. Полигенно.

Моногенные формы наследуются, как правило, по аутосомнорецессивному или по Х-сцепленному типу. Генетическую основу моногенно обусловленных форм наследственной предрасположенности составляют мутации отдельных генов. Но для патологического проявления этих мутаций обязательно необходимо действие внешнесредового фактора (или нескольких факторов).

Например: У человека описана мутация, обуславливающая патологическую реакцию на загрязнение атмосферы, которая проявляется в раннем развитии эмфиземы легких (в возрасте 30 -40 лет). Нежелательные реакции у генетически предрасположенных индивидов могут вызывать определенные пищевые продукты: некоторые дети страдают целиакией – синдромом нарушения полостного пищеварения в связи с непереносимостью глютена (белок пшеницы и других злаковых). Дети начинают тяжело болеть, как только начинается прикорм манной кашей. Без продуктов из пшеницы такие дети развиваются нормально.

Полигенная наследственная предрасположенность определяется сочетанием аллелей нескольких генов. Именно комбинация аллелей нескольких генов предрасполагает к болезням. Свой патологический потенциал они проявляют вместе с комплексом нескольких внешнесредовых факторов (мультифакториальные заболевания). Соотношение генетических и средовых факторов различно не только для данной болезни, но и для каждого больного.

Выделяют три группы мультифакториальных заболеваний: q врожденные пороки развития: гидроцефалия; расщелина губы и неба; вывих бедра; спинномозговая грыжа. q психические и нервные болезни: шизофрения; эпилепсия; рассеянный склероз. q соматические болезни среднего возраста: псориаз; бронхиальная астма; гипертоническая болезнь; ишемическая болезнь сердца и др.

Особенности наследования прерывистых мультифакториальных заболеваний: Рассмотрим на примере врожденного порока развития - расщелины губы и неба. Родители ребенка с данным врожденным пороком, как правило, здоровы. Однако рождение больного ребенка свидетельствует, что каждый из них является носителем многих аддитивных (условно аномальных) генов, количество которых все же недостаточно, чтобы сформировался дефект у родителей. Если ребенок случайным образом унаследует критическое число «аномальных» генов, т. е. порог будет превышен, возникает порок развития — расщелина губы.

Следовательно, для проявления болезней с наследственной предрасположенностью необходимо конкретное сочетание наследственных и внешних факторов. Чем больше будет выражена наследственная предрасположенность и больше вредных воздействий среды, тем выше вероятность заболевания и тяжесть течения: - при слабой наследственной предрасположенности и невыраженных неблагоприятных факторах организм успешно поддерживает гомеостаз и болезнь не развивается, но при усилении неблагоприятных воздействий определенный процент лиц все, же заболеет; - при большей выраженности генетической предрасположенности, при тех же факторах среды болезнь проявится раньше и тяжелее.

Тема 5. 4 «Диагностика наследственных заболеваний»

В настоящее время для диагностики наследственных болезней применяются следующие лабораторные методы: 1) Цитогенетические; 2) Биохимические; 3) Молекулярно-генетические.

1)Методы цитогенетического исследования можно условно подразделить на прямые и непрямые. q Прямые методы - это методы получения препаратов делящихся клеток без культивирования. q Непрямые методы – это получение препаратов хромосом из клеток, культивированных в искусственных питательных средах.

Прямые методы позволяют: проводить хромосомный анализ клеток опухолей, но в основном используются для изучения костного мозга. Костный мозг получают при стернальной пункции, помещают его в питательную среду, добавляют колхицин (он останавливает деление клеток на стадии метафазы), инкубируют клетки около 23 ч при 37°С, а затем готовят препараты хромосом.

Непрямые методы связаны с культивированием клеток. Объект для исследования – культура лейкоцитов периферической крови. К 1 -2 мл венозной крови, добавить гепарин и поместить в смесь питательной среды с фитогемагглютинином (белок бобовых растений), для стимуляции деления клеток на 48 -72 часа. За 2 ч до окончания культивирования добавляют колхицин, разрушающий веретено деления и останавливающий клеточное деление на стадии метафазы. Затем проводят гипотонизацию клеток, используя гипотонический раствор хлорида кальция или цитрата натрия. В гипотоническом растворе клетки набухают, ядерная оболочка разрывается, межхромосомные связи рвутся, и хромосомы свободно плавают в цитоплазме, на некотором расстоянии друг от друга (метафазные пластинки). Клеточную суспензию фиксируют смесью метанола и уксусной кислоты в соотношении 3: 1. При нанесении такой суспензии на предметное стекло фиксатор испаряется, и хромосомы плотно прилипают к стеклу. Для точного изучения хромосом, делают фотографии, затем вырезают хромосомы и располагают их в порядке убывающей величины, так строят кариограмму или идиограмму. Для идентификации хромосом применяют количественный морфометрический анализ, измеряют длину хромосомы в микрометрах, соотношение длины короткого и длинного плеча ко всей хромосоме, то есть находят центромерный индекс (ЦИ).

Следующая стадия цитогенетических методов это окраска препаратов. Простые методы окраски – окраска по Гимзе ( «рутинная окраска» ). Краситель Гимзы окрашивает хромосомы равномерно по всей длине, при этом выделяются центромеры и вторичные перетяжки (если хромосома имеет спутник). Метод позволяет провести подсчет хромосом, их групповую принадлежность, проанализировать повреждения (хромосомные аберрации). Однако метод не дает возможности индивидуальной идентификации хромосом. Дифференциальные методы окраски хромосом дают достаточно полное представление о кариотипе и используются для определения структурных хромосомных аномалий. Под дифференциальной окрашиваемостью хромосом понимают их способность к избирательному окрашиванию по длине. Окрашивание обеспечивается температурносолевыми воздействиями на фиксированные хромосомы. При этом выявляется их структурная дифференцировка по длине, выражающаяся в виде чередования гетеро - и эухроматина (темные и светлые участки). Протяженность этих участков специфична для каждой хромосомы, соответствующего плеча и района. При этом окрашивании идентифицируются все хромосомы, плечи и определенные районы хромосом. Наибольшее применение получили методы дифференциальной окраски красителем Гимза (G – окраска) и флуоресцирующим красителем акрихином и акрихин-пиритом (Q –метод). Эти методы пригодны для анализа хромосом, полученных из культур клеток любых тканей.

2) Биохимические методы в отличие от цитогенетических многоступенчаты. Объектами биохимической диагностики могут быть моча, пот, плазма и сыворотка крови, форменные элементы крови, культура клеток (фибробласты, лимфоциты). Различают два вида программ первичной биохимической диагностики: q массовые; q селективные.

Существуют массовые просеивающие программы диагностики среди новорожденных (неонатальный скрининг) фенилкетонурии, врожденного гипотиреоза, адреногенитального синдрома, галактоземии и муковисцидоза. Биологическим материалом для диагностики является кровь. Высушенные капли крови новорожденных на хромотографической или фильтровальной бумаге пересылают из родильных домов в специализированную лабораторию в течение двухтрех дней после взятия пробы. Селективные диагностические программы предусматривают целенаправленное обследование меньших по объему категорий детей. В селективных программах могут использоваться простые качественные реакции (например, тест с хлоридом железа для выявления фенилкетонурии) или более точные методы, позволяющие обнаруживать большие группы отклонений. Показаниями для селективного скрининга у новорожденных являются такие симптомы, как судороги, кома, рвота, гипотония, желтуха, специфический запах мочи и пота, ацидоз, нарушенное кислотно-основное равновесие, остановка роста. У детей биохимические методы используются во всех случаях подозрения на наследственные болезни обмена веществ (задержка физического и умственного развития, потеря приобретенных функций, специфическая для какой-либо наследственной болезни клиническая картина).

3) Молекулярно-генетические методы – это большая и разнообразная группа методов, предназначенных для выявления вариаций в структуре исследуемого участка ДНК. В основе этих методов лежат «манипуляции» с ДНК и РНК. Сегодня эти методы используют при диагностике многих наследственных болезней: гемофилии, гемоглобинопатиях, митохондриальных болезней, муковисцидозе, фенилкетонурии, миопатии Дюшенна и др. Кроме того, методы ДНК-технологии применяются: в исследованиях для определения происхождения популяции людей, в практике судебной медицины, для определения отцовства или степени родства, для генетического анализа клеток костного мозга при его трансплантации от донора реципиенту, для определения мутаций, при диагностике наследственных болезней и для расшифровки генома человека.

Тема 5. 5 «Профилактика и лечение наследственных заболеваний. Медикогенетическое консультирование»

Виды профилактики наследственной патологии: q первичную; q вторичную; q третичную.

Под первичной профилактикой понимают такие действия, которые должны предупредить рождение больного ребенка. Вторичная профилактика осуществляется путем прерывания беременности в случае высокой вероятности заболевания плода или пренатально диагностированной болезни. Прерывание производится только с согласия женщины и в установленные сроки.

Под третичной профилактикой наследственной патологии подразумевают коррекцию проявления патологических генотипов. С ее помощью можно добиться полной нормализации или снижения выраженности патологического процесса.

Медико-генетическое консультирование (МГК): специализированный вид медицинской помощи населению, направленной на профилактику наследственной патологии.

Суть консультирования заключается в определении прогноза рождения ребенка с наследственной патологией, объяснении вероятности этого события и помощи консультирующейся семье в принятии правильного решения о деторождении.
В России, специализированные службы – медико-генетические консультации, осуществляющие МГК, созданы в Москве, Санкт-Петербурге и в нашем городе.

МГК г. Томска: Томский НИИ медицинской генетики является одним из ведущих медико-генетических учреждений России. Он был основан в 1982 году и является первым специализированным институтом в области медицинской генетики на территории Сибири и Дальнего Востока. Генетическая клиника создана в 1994 году.

Сегодня деятельность института включает осуществление специализированной медицинской помощи пациентам с наследственными и врожденными заболеваниями, научных исследований и профессионального образования в области медицинской генетики. ТНЦ СО РАМН Институт медицинской генетики – генетическая клиника

Проспективное и ретроспективное консультирование: МГК наиболее эффективно, когда оно проводится как проспективное консультирование (риск рождения больного ребенка определяется до наступления беременности или в ранние ее сроки). Такое консультирование проводят в следующих случаях: q кровного родства супругов; q отягощенной наследственности по линии мужа или жены; q тератогенного воздействия в первые три месяца беременности; q неблагополучного протекания беременности и повторных спонтанных абортов.

В большинстве случаев поводом для обследования у врача-генетика является наследственное или предположительно наследственное заболевание у ребенка. Такое консультирование называется ретроспективным. Оно проводится после рождения больного ребенка (врожденные пороки развития, задержка физического развития и умственная отсталость) с целью уточнения диагноза, прогноза течения заболевания, определения повторного риска рождения больного ребенка.

Массовые методы выявления наследственных заболеваний Массовые программы обследования людей – скрининг (от английского screening – просеивание) впервые были внедрены в медицинскую практику в начале XX века в США. Основная задача просеивающих программ заключается в раннем выявлении заболеваний на доклинической стадии, когда их терапия может оказаться особенно эффективной.

Неонатальный скрининг на наследственные заболевания Впервые массовое обследование новорожденных на наличие наследственных дефектов обмена веществ внедрили 30 лет назад в США. Первоначально проводилось выявление только одного заболевания – фенилкетонурии. В настоящее время в большинстве цивилизованных стран новорожденные исследуются на несколько дефектов обмена веществ. В России согласно приказу Минздравсоцразвития России № 185 от 22. 03. 06 г. «О массовом обследовании новорожденных детей на наследственные заболевания» проводится массовый скрининг новорожденных детей на следующие наследственные заболевания: адреногенитальный синдром, галактоземию, врожденный гипотиреоз, муковисцидоз и фенилкетонурию.
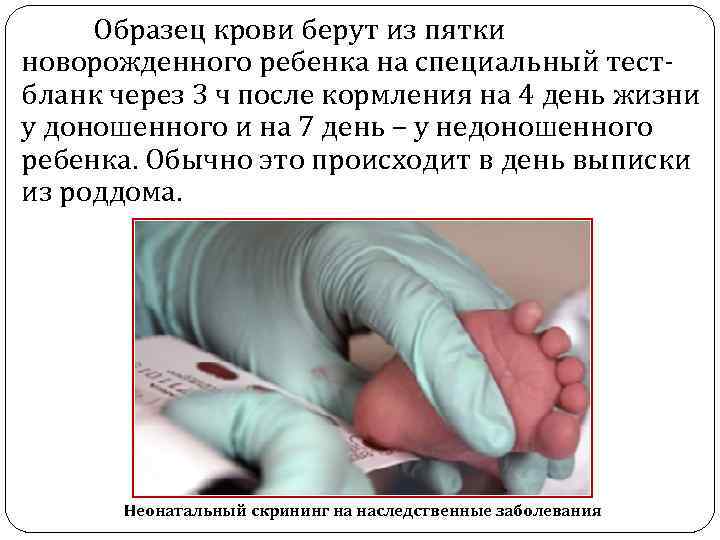
Образец крови берут из пятки новорожденного ребенка на специальный тестбланк через 3 ч после кормления на 4 день жизни у доношенного и на 7 день – у недоношенного ребенка. Обычно это происходит в день выписки из роддома. Неонатальный скрининг на наследственные заболевания

Пренатальная диагностика врожденных пороков развития и хромосомных заболеваний Одной из важнейших частей работы по профилактике рождения больного ребенка является дородовая (пренатальная) диагностика заболеваний у плода.

Пренатальная диагностика – комплексная, область медицины, использующая ультразвуковую диагностику, хирургическую технику и лабораторные методы. Выделяют методы пренатальной диагностики: 1. Просеивающие; 2. Неинвазивные; 3. Инвазивные – с последующей лабораторной диагностикой.

1. Просеивающие методы (скрининг беременных женщин) позволяют выделить женщин, имеющих повышенный риск рождения ребенка с наследственной патологией. Программы массового скрининга беременных женщин стали активно внедряться в практику здравоохранения с конца XX века. Чаще всего исследуют: - α-фетопротеина (АФП); - хорионического гонадотропина человека (ХГЧ); - неконъюгированного (несвязанного) эстриола. Изменение уровня этих веществ в крови беременной может указывать на заболевание ее плода.

2. Неинвазивные методы – это методы обследования плода без оперативного вмешательства. В настоящее время к ним относится ультразвуковое исследование (УЗИ), которое широко используется для обнаружения врожденных пороков развития, а также позволяет оценить функциональное состояние плода, плаценты, пуповины и оболочек. УЗИ, выполняемое на 20 – 22 -й неделе беременности позволяет обнаружить до 70% всех возможных врожденных пороков развития. Ультразвуковое исследование

3. Инвазивные методы пренатальной диагностики – это способы получения образцов клеток и тканей эмбриона, плода и провизорных органов (плаценты, оболочки) с последующим изучением полученных материалов. Эти методы постоянно совершенствуются, чтобы обеспечить наиболее раннее, безопасное и достоверное выявление наследственных заболеваний.

В настоящее время в мировой практике применяются следующие инвазивные методы: q хорион - и плацентобиопсия; q получение амниотической жидкости (амниоцентез); q биопсия тканей плода, взятие крови плода (кордоцентез); q фетоскопия.

Хорион - и плацентобиопсия используются с конца 80 -х годов. Эти методы применяют с целью получения небольшого количества ворсин хориона или кусочков плаценты в период с 9 -й по 12 -ю неделю беременности. Процедуру проводят под контролем ультразвукового исследования, отсасывая или отщипывая несколько ворсин или кусочков плаценты. Доступ возможен как через шейку матки, так и сквозь переднюю брюшную стенку.

Амниоцентез – это прокол плодного пузыря с целью получения околоплодной жидкости и находящихся в ней слущенных клеток амниона и плода. Метод используется для пренатальной диагностики с начала 70 -х годов. Процедура проводится на 15 -18 -й неделе беременности, когда количество околоплодных вод несколько больше, чем в другие сроки беременности.
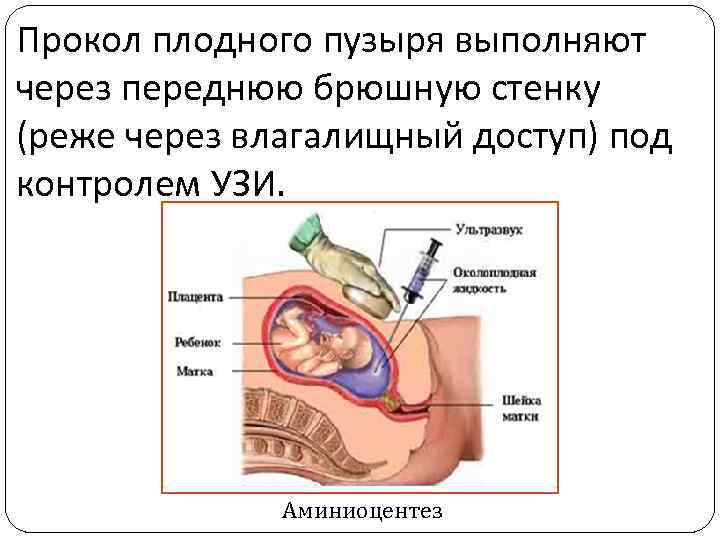
Прокол плодного пузыря выполняют через переднюю брюшную стенку (реже через влагалищный доступ) под контролем УЗИ. Аминиоцентез

Для исследования обычно извлекают 15 -20 мл жидкости. Основным источником диагностического материала являются клетки, находящиеся в амниотической жидкости. Их культивируют в течение 2 -4 недель и в дальнейшем используют для цитогенетических и биохимический исследований. В настоящее время с помощью амниоцентеза диагностируют все хромосомные аномалии, многие наследственные болезни обмена веществ и др.

Биопсия тканей плода как диагностическая процедура осуществляется во втором триместре беременности под контролем УЗИ. Для диагностики тяжелых поражений кожи (ихтиоз, эпидермолиз) биопсия кожи плода проводится с последующим патоморфологическим исследованием. Биопсию мышц плода производят для диагностики миодистрофии Дюшенна. Биоптат исследуют иммунофлуоресцентным методом.
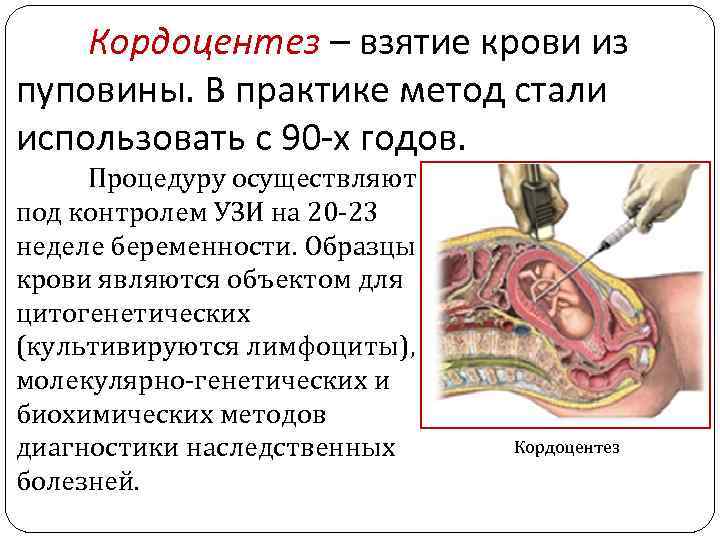
Кордоцентез – взятие крови из пуповины. В практике метод стали использовать с 90 -х годов. Процедуру осуществляют под контролем УЗИ на 20 -23 неделе беременности. Образцы крови являются объектом для цитогенетических (культивируются лимфоциты), молекулярно-генетических и биохимических методов диагностики наследственных болезней. Кордоцентез

Фетоскопия – введение в полость матки специального гибкого оптического прибора – фетоскопа, с целью визуального обследования плода для выявления врожденных пороков развития. Метод проводится на 18 -24 неделе беременности и применяется только по особым показаниям.
Фетоскопия может вызвать осложнения беременности, выкидыши отмечаются в 7 -7% случаев, поэтому применяется очень редко, в основном для биопсии тканей плода. Фетоскопия

Темы 5.1-5.5 Наследственность и патолгия.pptx