ox_red_reakce.ppt
- Количество слайдов: 25

OBECNÁ CHEMIE OXIDAČNĚ REDUKČNÍ REAKCE Ing. Alena Hejtmánková, CSc. Katedra chemie Agronomická fakulta ČZU Praha © Praha, 2003 Obecná chemie. Redox reakce. 1
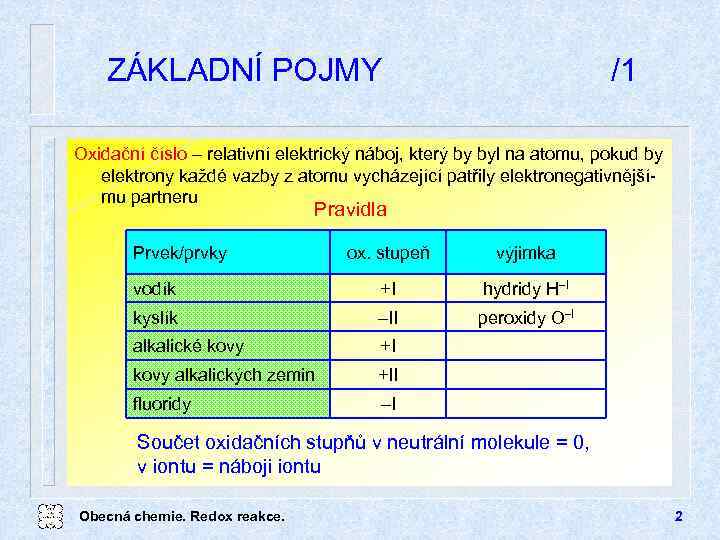
ZÁKLADNÍ POJMY /1 Oxidační číslo relativní elektrický náboj, který by byl na atomu, pokud by elektrony každé vazby z atomu vycházející patřily elektronegativnějšímu partneru Pravidla Prvek/prvky ox. stupeň výjimka vodík +I hydridy H I kyslík II peroxidy O I alkalické kovy +I kovy alkalických zemin +II fluoridy I Součet oxidačních stupňů v neutrální molekule = 0, v iontu = náboji iontu Obecná chemie. Redox reakce. 2

ZÁKLADNÍ POJMY /2 Vaznost počet vazebných elektronových párů vycházejících z daného prvku (většinou vaznost oxidační číslo) H 3 PO 2 H H O P H Obecná chemie. Redox reakce. O oxidační stupeň +I vaznost 4 3
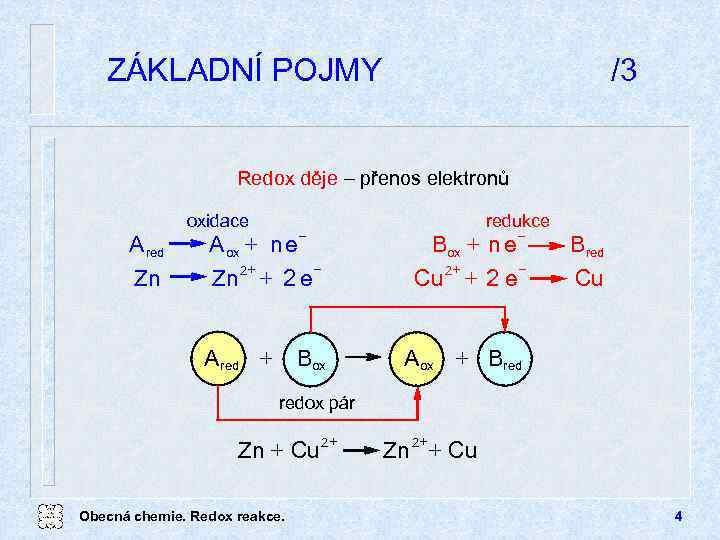
ZÁKLADNÍ POJMY /3 Redox děje přenos elektronů oxidace A red Zn redukce + n e Box + Cu 2 + 2 e A ox + n e + Zn 2 + 2 e A red + Bred Cu A ox + Bred Box redox pár Zn + Cu 2 Obecná chemie. Redox reakce. + + Zn 2 + Cu 4

ZÁKLADNÍ POJMY /4 Silná oxidační činidla snadno redukovatelné látky KMn. O 4, K 2 Cr 2 O 7, HNO 3, K 2 S 2 O 8 Silná redukční činidla snadno oxidovatelné látky H 2, C, CO, kovy, Sn 2+ Obecná chemie. Redox reakce. 5
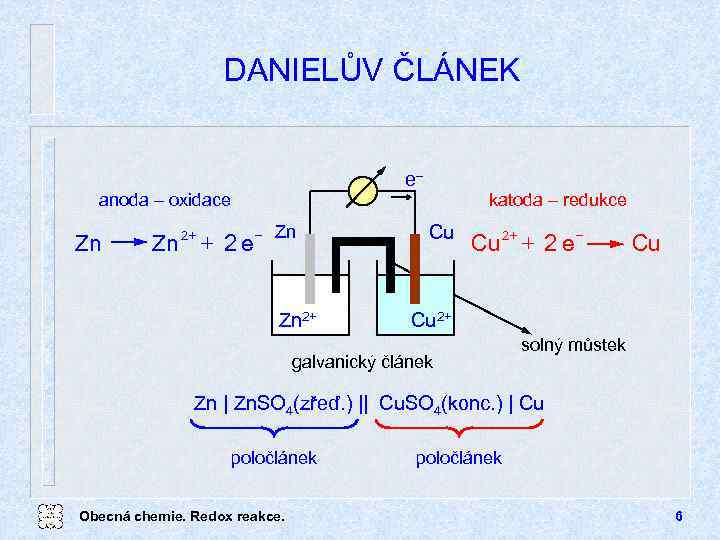
DANIELŮV ČLÁNEK e anoda oxidace Zn + Zn 2 + 2 e Zn Zn 2+ katoda redukce Cu + Cu 2 + 2 e Cu Cu 2+ galvanický článek solný můstek Zn | Zn. SO 4(zřeď. ) || Cu. SO 4(konc. ) | Cu poločlánek Obecná chemie. Redox reakce. poločlánek 6

TYPY GALVANICKÝCH ČLÁNKŮ /1 1. Primární články u zdroj stejnosměrného proudu, nízký výkon u vybitím se znehodnotí Cu | Cu(NO 3)2 (zřeď. ) || Ag. NO 3 (zřeď. ) | Ag + Cu 2 (aq) + 2 e anoda oxidace Cu(s) katoda redukce 2 Ag (aq) + 2 e + + Cu(s) + 2 Ag (aq) Obecná chemie. Redox reakce. 2 Ag(s) + Cu 2 (aq) 7

TYPY GALVANICKÝCH ČLÁNKŮ /2 Komerční články suchý článek (Leclancheův) E = 1, 5 V Zn | Mn. O 2 (pasta), NH 4 Cl, H 2 O, C | C anoda oxidace Zn(s) + Zn 2 (aq) + 2 e katoda redukce + + 4 NH 4 (aq) + e Mn. O 2 (s) + Zn + 2 Mn. O 2 + 8 NH 4 Obecná chemie. Redox reakce. 3+ Mn (aq) + 4 NH 3 + 2 H 2 O + + Zn 2 + 2 Mn 3 + 8 NH 3 + 4 H 2 O 8

TYPY GALVANICKÝCH ČLÁNKŮ /3 2. Sekundární články olověný akumulátor, E = 12 V (6 x 2 V) lze je znovu nabít u opotřebení elektrod u kontrola hustoty elektrolytu u anoda oxidace Pb | H 2 SO 4 | Pb. O 2 2+ + 2 e Pb(s) Pb (aq) + Pb 2 (aq) + SO 2 (aq) Pb. SO 4 (s) 4 katoda redukce + Pb. O 2 (s) + 4 H (aq) + 2 e + Pb 2 (aq) + SO 2 (aq) 4 + Pb + Pb. O 2 + 4 H + 2 SO 2 4 Obecná chemie. Redox reakce. + Pb 2 (aq) + 2 H 2 O Pb. SO 4 (s) 2 Pb. SO 4 + 2 H 2 O 9

TYPY GALVANICKÝCH ČLÁNKŮ /4 Článek Ni Cd (hodinky, kalkulačky) elektrolyt KOH anoda oxidace Cd(s) + 2 OH Cd(OH) 2 (s) + 2 e katoda redukce Ni. O 2 (s) + 2 H 2 O + 2 e Ni(OH)2 (s) + 2 OH Palivové články palivo (H 2, CO, alkoholy) na anodě elektrochemicky oxidovány, oxidovadlo (vzduch, O 2) redukováno na katodě, ekologicky výhodné Obecná chemie. Redox reakce. 10
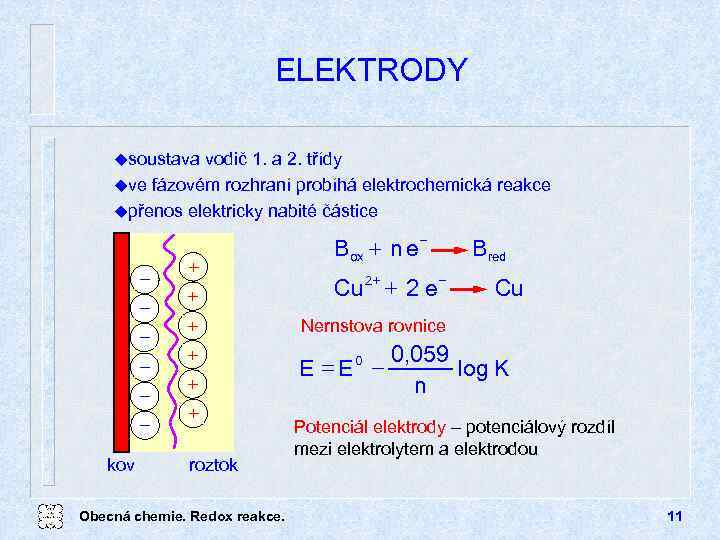
ELEKTRODY usoustava vodič 1. a 2. třídy uve fázovém rozhraní probíhá elektrochemická reakce upřenos elektricky nabité částice kov + Box + n e + + 2 e Cu + Nernstova rovnice + + + roztok Obecná chemie. Redox reakce. 2+ Bred E = E 0 Cu 0, 059 log K n Potenciál elektrody potenciálový rozdíl mezi elektrolytem a elektrodou 11

TYPY ELEKTROD /1 Elektrody I. druhu heterogenní u kationtové + Mn + n e M 0, 059 = E 0 + E log a. Mn+ n Příklady Stříbrná elektroda + Ag + e Ag Vodíková elektroda (Pt) H 2 2 H E = E 0 + 0, 059 log a Ag + H(g) + H 2 O(l) E 0 = E(a Ag + = 1) E = E 0 + 0, 059 log a. H 3 O+ Obecná chemie. Redox reakce. + H 3 O (aq) + e 12

TYPY ELEKTROD /2 Elektrody I. druhu heterogenní u aniontové (Pt) Cl 2 Cl (g) + e 2 Cl (aq) E = E 0 + 0, 059 log a Cl Obecná chemie. Redox reakce. 13

TYPY ELEKTROD /3 Elektrody II. druhu heterogenní Argentchloridová elektroda Ag (kov) | Ag. Cl(s) | KCl(aq) Ag. Cl + Ag + Cl Ag+ + e Ag Ag. Cl + e E = E 0 0, 059 log a Cl K S = a Ag + a. Cl Ag + Cl Kalomelová elektroda 2 Hg 2 Cl 2 + 2 e 2 Hg + 2 Cl E = E 0 0, 059 log a Cl Obecná chemie. Redox reakce. 14

TYPY ELEKTROD /4 Elektrody oxidačně redukční homogenní Fe 3+ + e Pt Fe 2+ Petersova rovnice aox 0, 059 E =E + log n ared a Fe 3 + 0 E = E + 0, 059 log a Fe 2+ 0 Fe 2+/Fe 3+ Obecná chemie. Redox reakce. 15
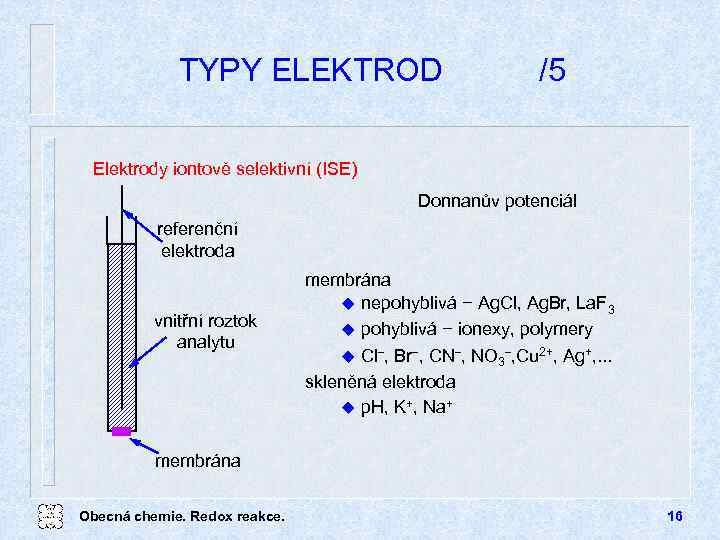
TYPY ELEKTROD /5 Elektrody iontově selektivní (ISE) Donnanův potenciál referenční elektroda vnitřní roztok analytu membrána u nepohyblivá − Ag. Cl, Ag. Br, La. F 3 u pohyblivá − ionexy, polymery u Cl , Br , CN , NO 3 , Cu 2+, Ag+, . . . skleněná elektroda u p. H, K+, Na+ membrána Obecná chemie. Redox reakce. 16

ELEKTROMOTORICKÉ NAPĚTÍ Absolutní hodnotu potenciálu elektrody E nelze změřit, lze měřit jen elektromotorické napětí (EMN), relativní hodnoty Dohoda Standardní vodíková elektroda E 0 = 0 V Pt | H 2 (p. H 2 = 101, 325 k. Pa) | H 3 O+ (a = 1) (Standardní) redukční potenciál elektrody E 0 red U = E P EL = E + E L = oxidace P = redukce + samovolná redukce Ered > 0 E 0 red klesá redukční účinky rostou samovolná oxidace Ered < 0 E 0 red roste oxidační účinky rostou Obecná chemie. Redox reakce. 17

APLIKACE MĚŘENÍ EMN /1 p. H, koncentrace iontů u měrná elektroda E = f(c) u referentní elektroda E ≠ f(c) u elektrody II. druhu Ag. Cl, kalomelová) Obecná chemie. Redox reakce. 18

APLIKACE MĚŘENÍ EMN /2 Výpočet EMN článku u bezproudový stav − rovnováha => U = max 0 U 0 = Ered + E 0 ox + U 0 = E E Zn + Cu 2 oxidace redukce + + Zn 2 + Cu + 0 Zn Zn 2 + 2 e E 0 = + 0, 76 V Ered = 0, 76 V ox + 0 Cu 2 + 2 e Cu E red = + 0, 34 V U 0 = 0, 34 ( 0, 76) = 1, 1 (V) Obecná chemie. Redox reakce. U 0 = 0, 34 + 0, 76 = 1, 1 (V) 19

APLIKACE MĚŘENÍ EMN /3 Síla oxidačních a redukčních činidel u látka s pozitivnějším E 0 red = silnější oxidační činidlo u látka s pozitivnějším E 0 ox = silnější redukční činidlo Obecná chemie. Redox reakce. 20

APLIKACE MĚŘENÍ EMN /4 Předpověď průběhu redox děje 0 E 0 + E red > 0 ox spontánní reakce 0 E 0 + E red < 0 ox reakce neprobíhá Fe 3+ + Ag Fe 2+ + Ag + 0 Fe 3+ + e Fe 2+ E red = + 0, 77 V E 0 = 0, 80 V Ag Ag+ + e ox Obecná chemie. Redox reakce. E = 0, 03 V reakce neprobíhá 21
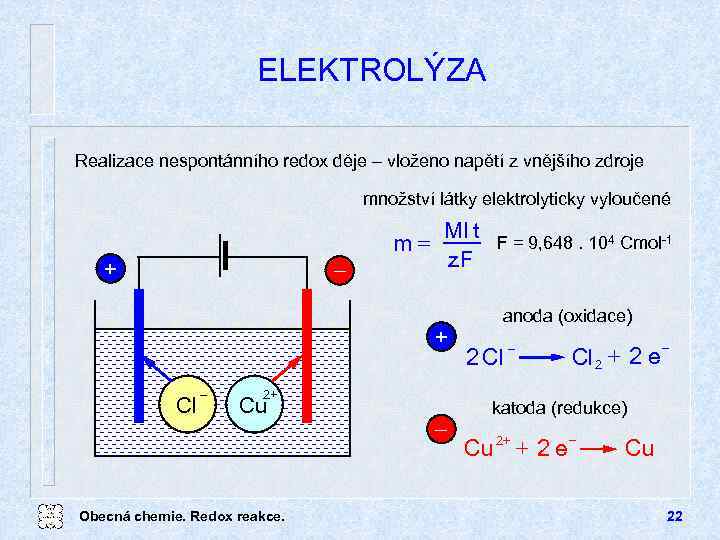
ELEKTROLÝZA Realizace nespontánního redox děje vloženo napětí z vnějšího zdroje množství látky elektrolyticky vyloučené + m= MI t F = 9, 648. 104 Cmol-1 z. F + Cl 2+ Cu Obecná chemie. Redox reakce. anoda (oxidace) 2 Cl + 2 e Cl 2 katoda (redukce) 2+ + 2 e Cu Cu 22

APLIKACE ELEKTROLÝZY /1 Elektrolýza Na. Cl (aq) solanky + anoda (oxidace) 2 Cl 2 + 2 e katoda (redukce) 2 H 2 O + 2 e H 2 + 2 OH výroba Na. OH (hromadí se v elektrolyzéru) Elektrolýza taveniny Na. Cl + anoda (oxidace) 2 Cl 2 + 2 e Obecná chemie. Redox reakce. katoda (redukce) + Na + e Na 23

APLIKACE ELEKTROLÝZY /2 Elektrolýza s aktivní anodou Cu. SO 4 + anoda (oxidace) Cu 2+ Cu + 2 e katoda (redukce) 2+ Cu + 2 e Cu elektrolytické čištění kovů, pokovování předmětů Elektrogravimetrie zváží se produkt elektrodové reakce (inertní elektroda) Obecná chemie. Redox reakce. 24

KONEC 25
ox_red_reakce.ppt