OBECNÁ CHEMIE KINETIKA CHEMICKÝCH REAKCÍ Ing. Alena Hejtmánková,


OBECNÁ CHEMIE KINETIKA CHEMICKÝCH REAKCÍ Ing. Alena Hejtmánková, CSc. Katedra chemie Agronomická fakulta ČZU Praha © Praha, 2003
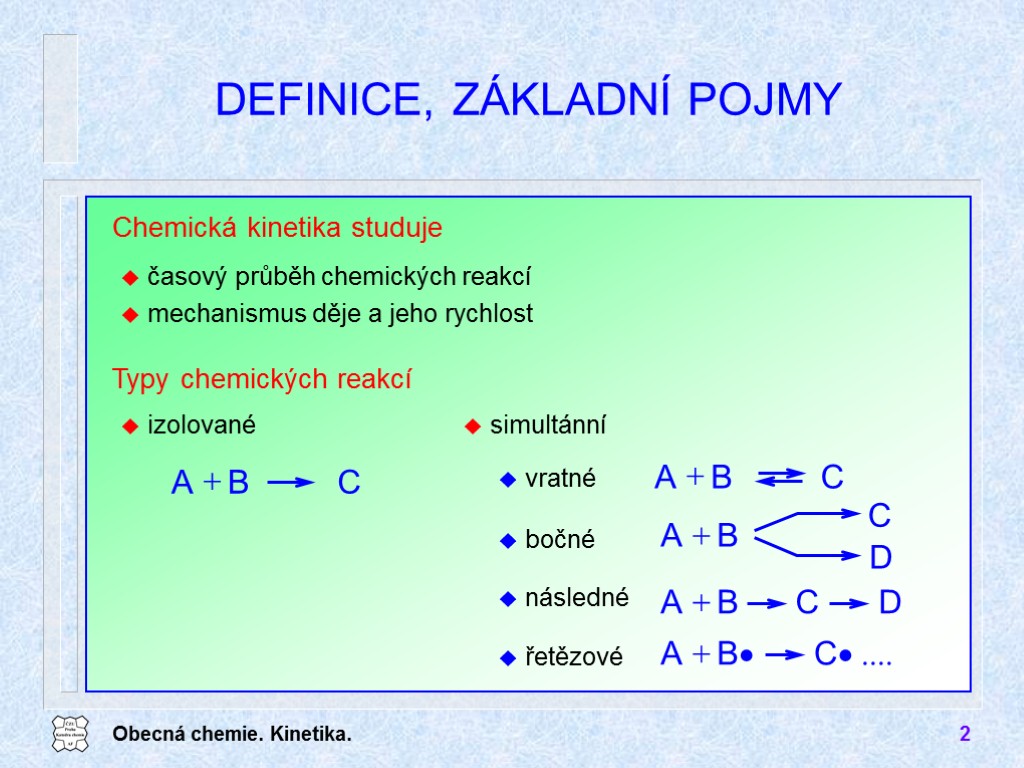
Obecná chemie. Kinetika. 2 DEFINICE, ZÁKLADNÍ POJMY Chemická kinetika studuje časový průběh chemických reakcí mechanismus děje a jeho rychlost Typy chemických reakcí

Obecná chemie. Kinetika. 3 REAKČNÍ RYCHLOST /1 Reakční rychlost změna látkového množství (koncentrace) látky za jednotku času
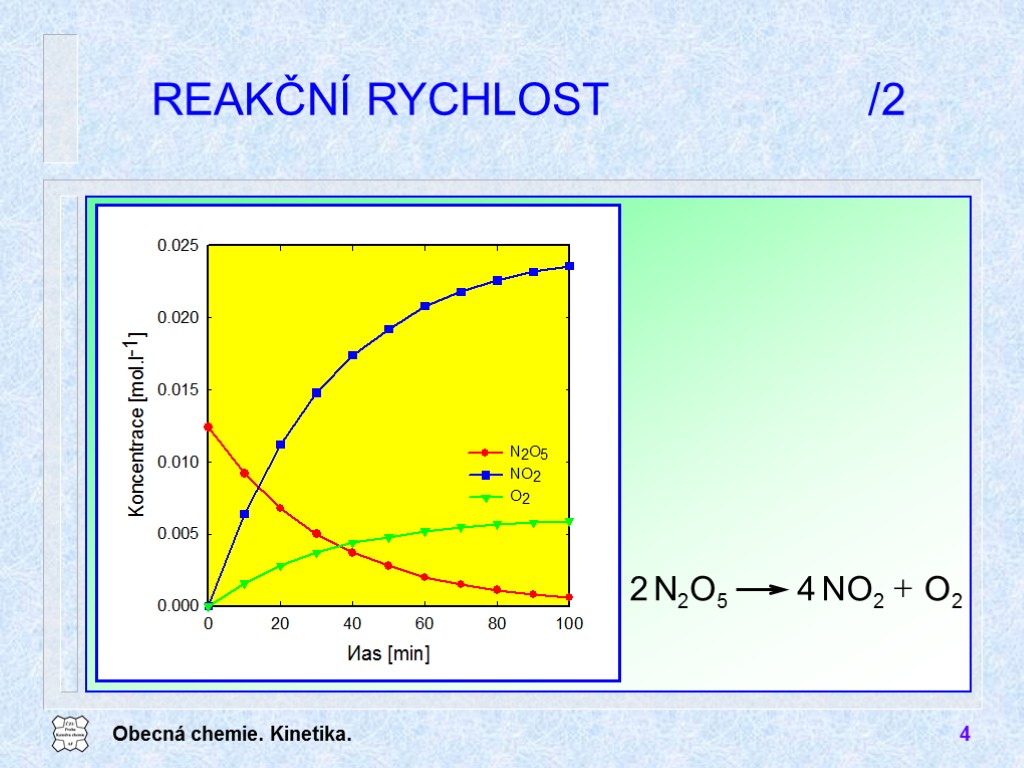
Obecná chemie. Kinetika. 4 REAKČNÍ RYCHLOST /2
![Obecná chemie. Kinetika. 5 REAKČNÍ RYCHLOST /3 k – rychlostní konstanta, [k] = (mol.l1)1x Obecná chemie. Kinetika. 5 REAKČNÍ RYCHLOST /3 k – rychlostní konstanta, [k] = (mol.l1)1x](https://present5.com/customparser/7515829_307576181 --- kinetika_chem_reakci.ppt/slide_5.jpg)
Obecná chemie. Kinetika. 5 REAKČNÍ RYCHLOST /3 k – rychlostní konstanta, [k] = (mol.l1)1x s1 x – řád reakce, x = a + b molekularita reakce

Obecná chemie. Kinetika. 6 REAKČNÍ RYCHLOST /4 A frekvenční faktor EA aktivační energie Reakční rychlost ovlivňuje koncentrace reagujících látek teplota zvýšení o 10 ºC zvýšení rychlosti reakce 2−4krát teplotní koeficient reakce Arrheniova rovnice vhodná orientace pravděpodobnost srážky
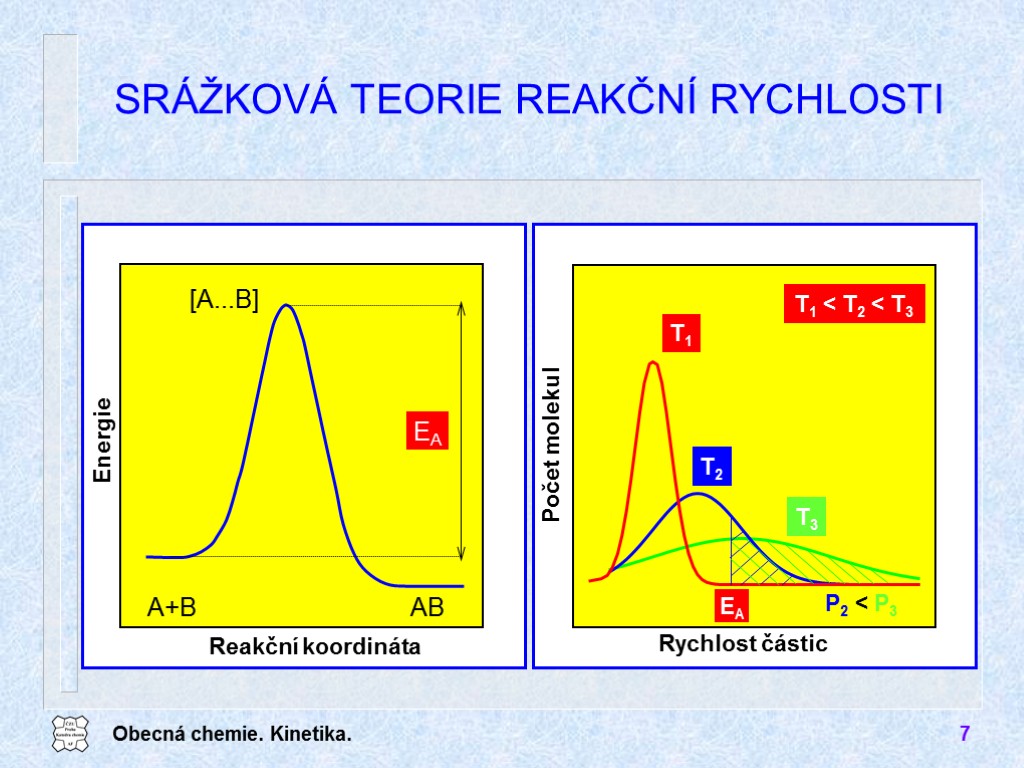
Obecná chemie. Kinetika. 7 SRÁŽKOVÁ TEORIE REAKČNÍ RYCHLOSTI
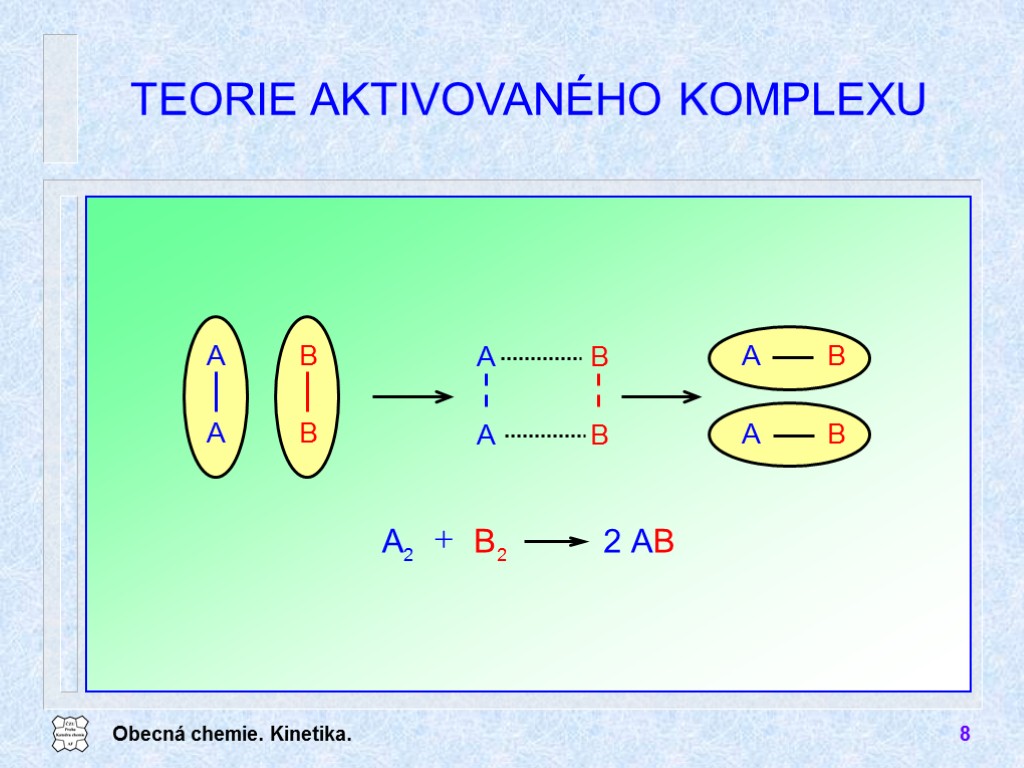
Obecná chemie. Kinetika. 8 TEORIE AKTIVOVANÉHO KOMPLEXU
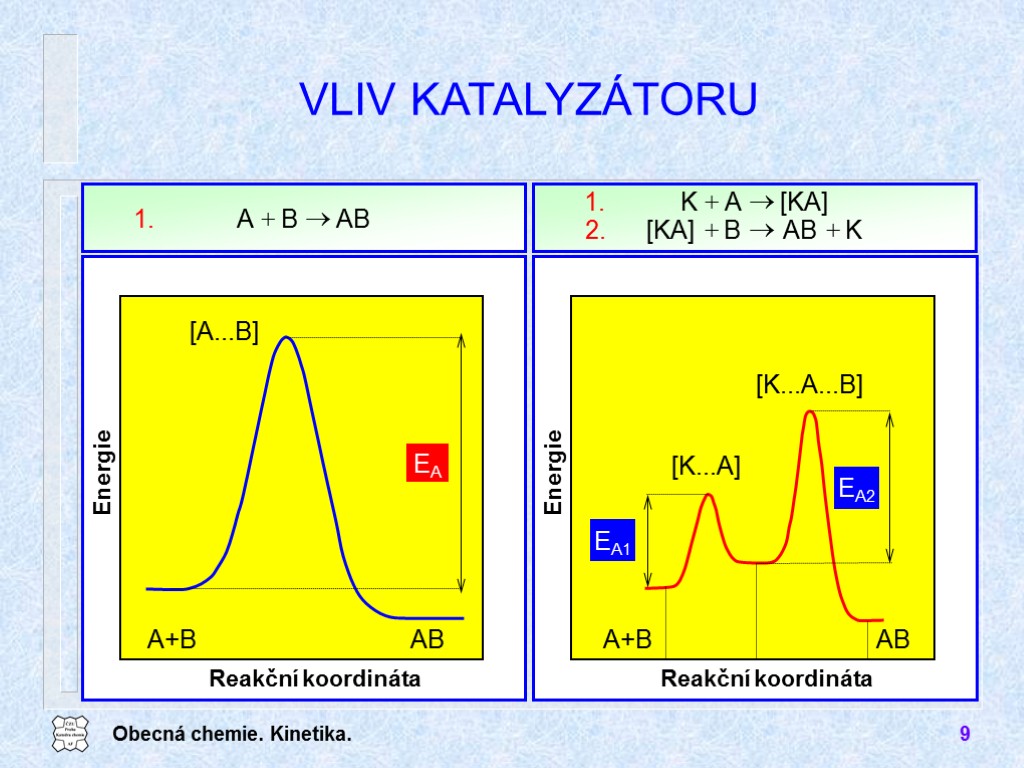
Obecná chemie. Kinetika. 9 VLIV KATALYZÁTORU

Obecná chemie. Kinetika. 10 KATALYZÁTORY Katalyzátory homogenní heterogenní Autokatalýza katalyzátorem je produkt reakce Negativní katalyzátory inhibitory (stabilizátory a katalytické jedy) Selektivita katalyzátorů enzymy

Obecná chemie. Kinetika. 11 ROZSAH REAKČNÍCH RYCHLOSTÍ u následných reakcí je rychlost určujícím krokem nejpomalejší reakce
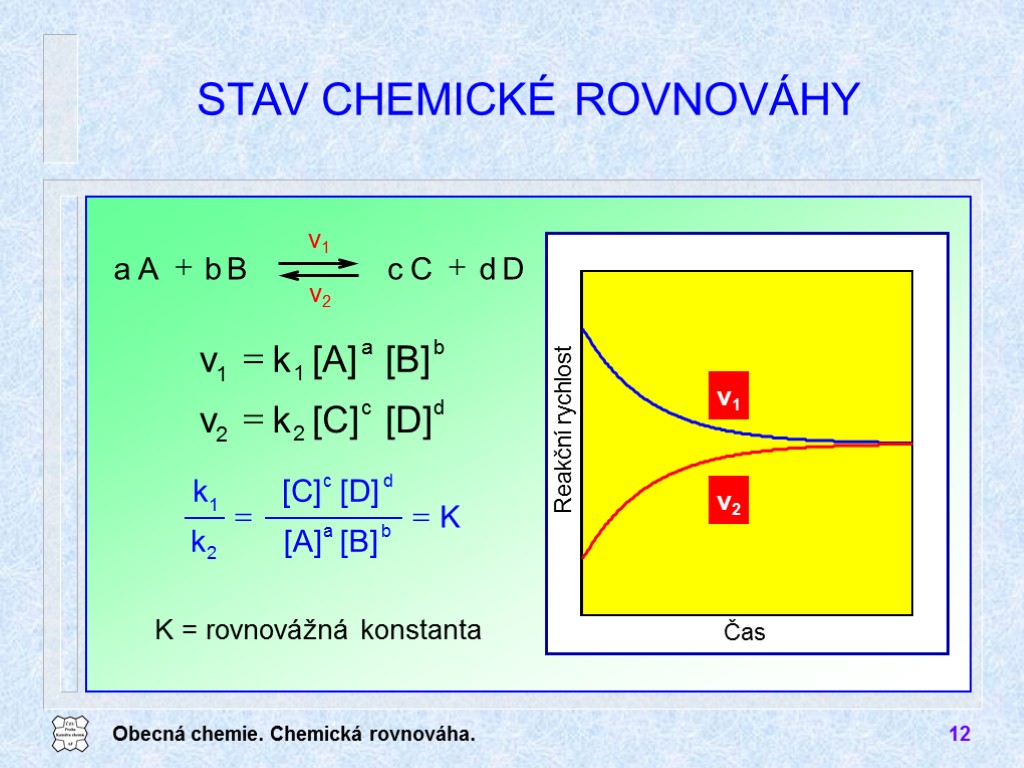
Obecná chemie. Chemická rovnováha. 12 STAV CHEMICKÉ ROVNOVÁHY K = rovnovážná konstanta
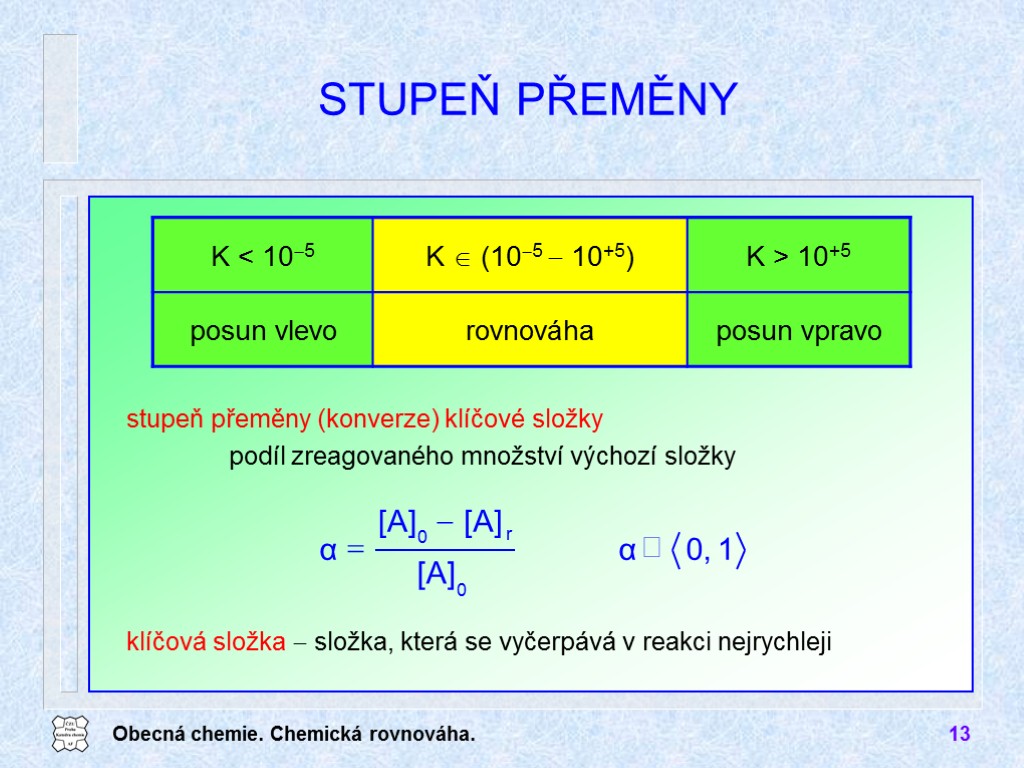
Obecná chemie. Chemická rovnováha. 13 stupeň přeměny (konverze) klíčové složky podíl zreagovaného množství výchozí složky STUPEŇ PŘEMĚNY klíčová složka složka, která se vyčerpává v reakci nejrychleji
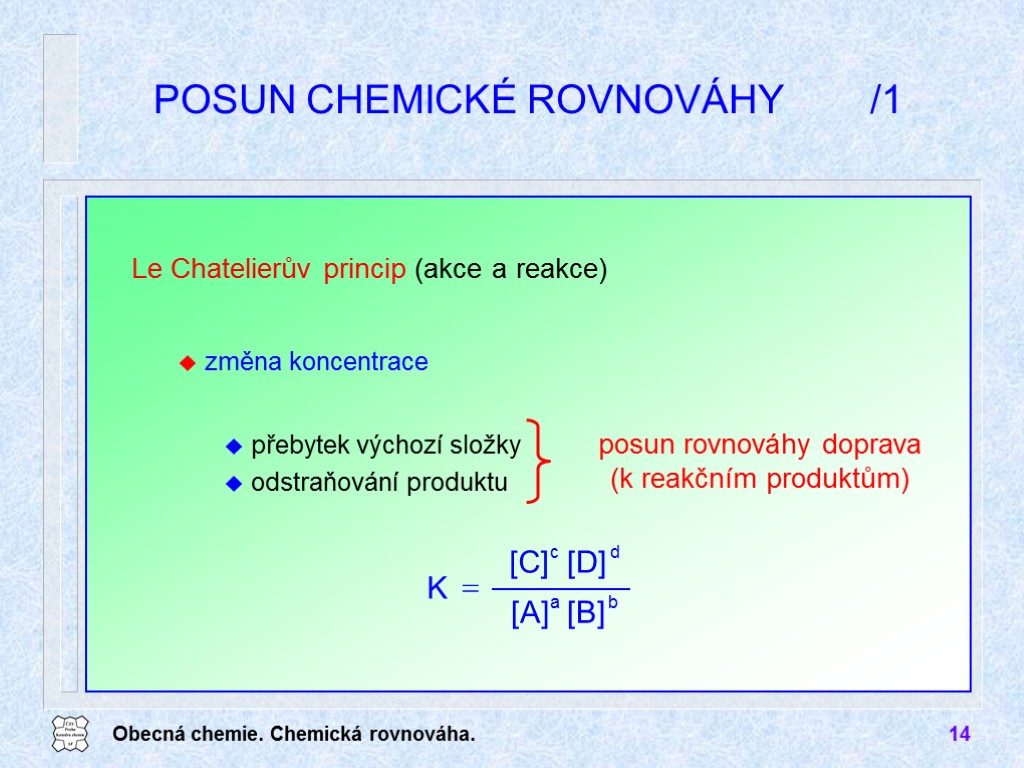
Obecná chemie. Chemická rovnováha. 14 Le Chatelierův princip (akce a reakce) POSUN CHEMICKÉ ROVNOVÁHY /1 přebytek výchozí složky odstraňování produktu změna koncentrace
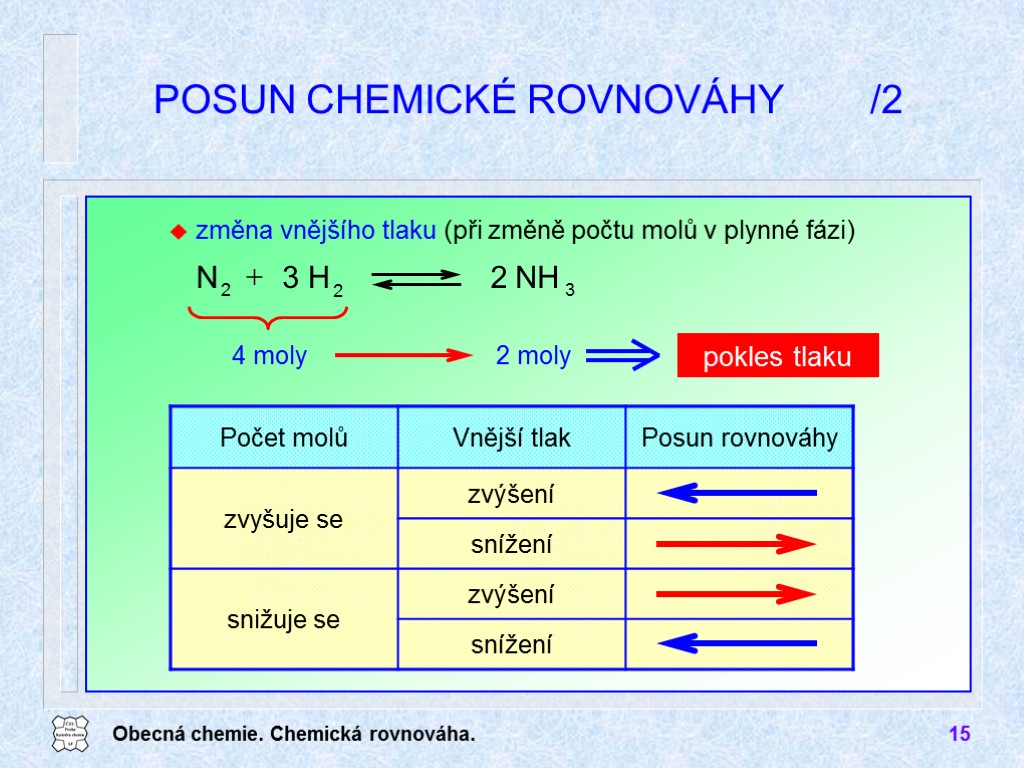
Obecná chemie. Chemická rovnováha. 15 POSUN CHEMICKÉ ROVNOVÁHY /2 4 moly 2 moly pokles tlaku změna vnějšího tlaku (při změně počtu molů v plynné fázi) 3 2 2 NH 2 H 3 N +
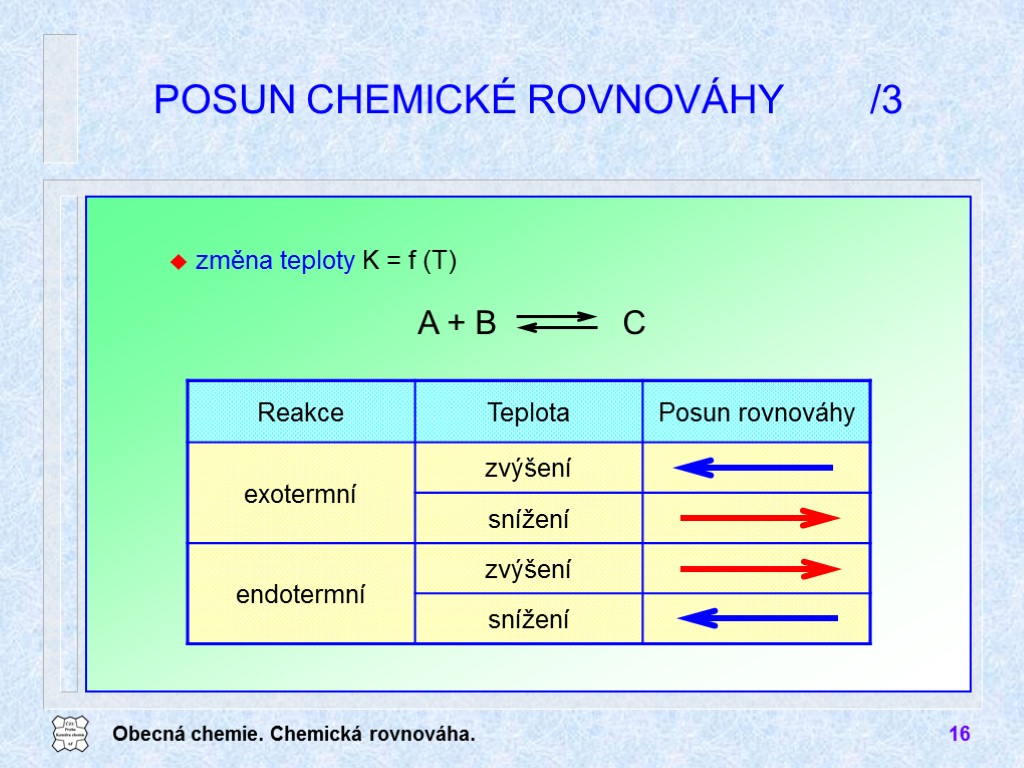
Obecná chemie. Chemická rovnováha. 16 POSUN CHEMICKÉ ROVNOVÁHY /3 změna teploty K = f (T)

17 KONEC
kinetika_chem_reakci.ppt
- Количество слайдов: 17

