OBECNÁ CHEMIE CHEMICKÁ REAKCE Ing. Alena Hejtmánková, CSc.


OBECNÁ CHEMIE CHEMICKÁ REAKCE Ing. Alena Hejtmánková, CSc. Katedra chemie Agronomická fakulta ČZU Praha © Praha, 2003

Obecná chemie. Chemická reakce. 2 DEFINICE, ZÁKLADNÍ POJMY Chemická reakce změna vnějších fyzikálních podmínek (tlak, teplota) zavedení další vhodné látky do systému proces, kdy zanikají staré chemické vazby a vznikají nové výhody energetické strukturní

Obecná chemie. Chemická reakce. 3 Základní typy chemických reakcí KLASIFIKACE REAKCÍ /1

Obecná chemie. Chemická reakce. 4 KLASIFIKACE REAKCÍ /2 Rozdělení chemických reakcí podle počtu fází homogenní (reaktanty a produkty ve stejné fázi) heterogenní (reakce na fázovém rozhraní)
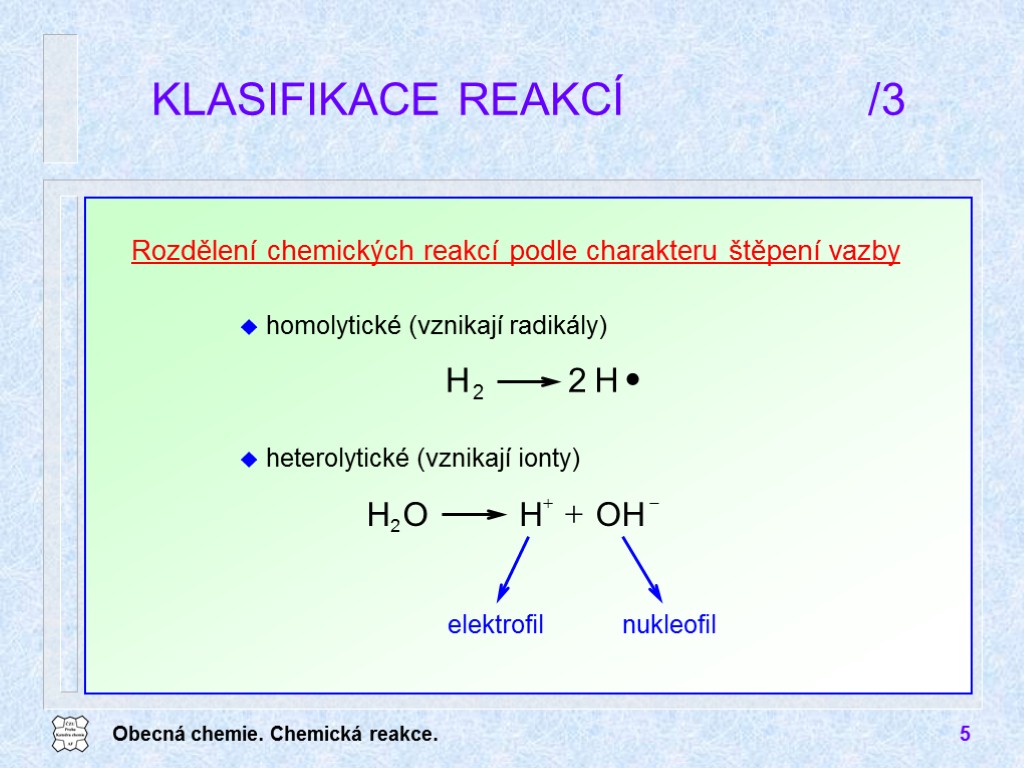
Obecná chemie. Chemická reakce. 5 KLASIFIKACE REAKCÍ /3 Rozdělení chemických reakcí podle charakteru štěpení vazby homolytické (vznikají radikály) heterolytické (vznikají ionty)

Obecná chemie. Chemická reakce. 6 KLASIFIKACE REAKCÍ /4 Rozdělení chemických reakcí podle reagujících částic molekulové radikálové (řetězový mechanismus) iontové (většina anorganických reakcí v polárních rozpouštědlech) terminace propagace iniciace
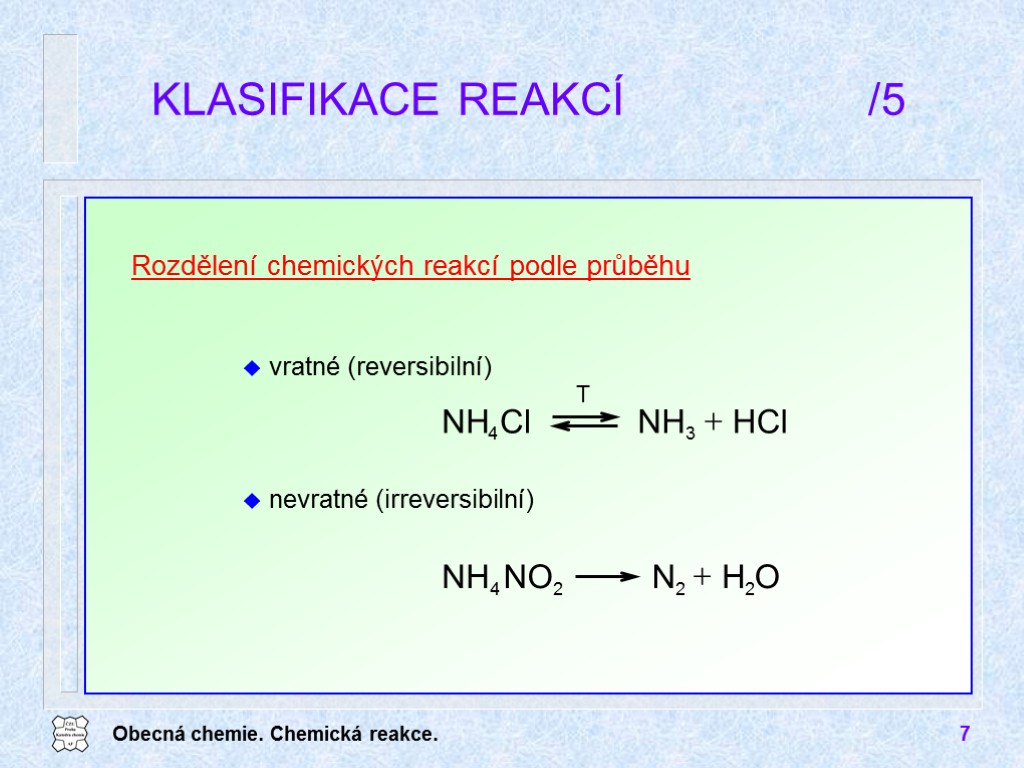
Obecná chemie. Chemická reakce. 7 KLASIFIKACE REAKCÍ /5 Rozdělení chemických reakcí podle průběhu vratné (reversibilní) nevratné (irreversibilní)

Obecná chemie. Chemická reakce. 8 KLASIFIKACE REAKCÍ /6 Rozdělení chemických reakcí podle energetické bilance reakce exotermické (reakční teplo se uvolňuje) reakce endotermické (reakční teplo je nutno dodat) enthalpie H vyjadřuje energetické změny U = vnitřní energie soustavy

Obecná chemie. Chemická reakce. 9 KLASIFIKACE REAKCÍ /7 Rozdělení chemických reakcí podle přenášených částic reakce oxidačně-redukční (přenos elektronu e) reakce koordinační (komplexotvorné) reakce protolytické (přenos protonu H+) reakce kyseliny a zásady = acidobazická reakce změna oxidačních čísel přenos atomů nebo skupin atomů

Obecná chemie. Termodynamika. 10 CHEMICKÁ ENERGETIKA TERMODYNAMIKA Základ tvoří 2 axiomatické věty 1. věta zákon zachování energie 2. věta přírodní děje nevratné Termodynamika studuje energetické bilance uskutečnitelnost chemických reakcí směr průběhu rovnovážné stavy stabilitu látek
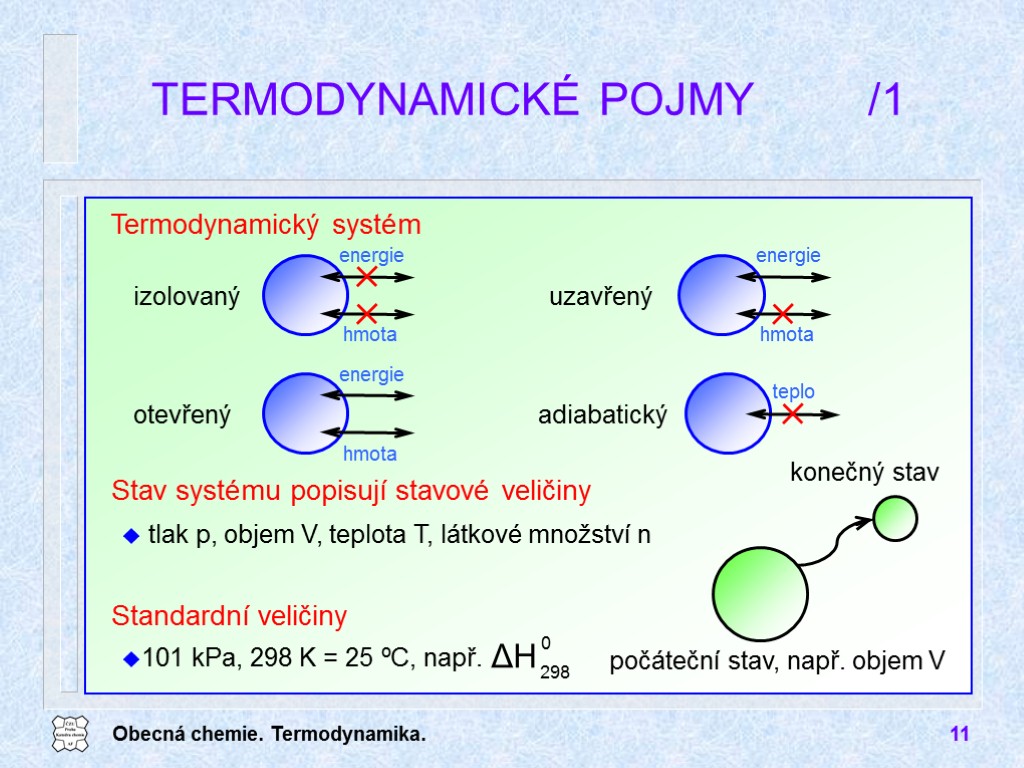
Obecná chemie. Termodynamika. 11 TERMODYNAMICKÉ POJMY /1 otevřený uzavřený tlak p, objem V, teplota T, látkové množství n Termodynamický systém Stav systému popisují stavové veličiny Standardní veličiny 101 kPa, 298 K = 25 ºC, např.

Obecná chemie. Termodynamika. 12 TERMODYNAMICKÉ POJMY /2 Vnitřní energie U + vnější energie Ek, Ep U nelze měřit absolutně měřitelná je její změna DU

Obecná chemie. Termodynamika. 13 1. VĚTA TERMODYNAMICKÁ Vzrůst vnitřní energie systému znamená pokles energie okolí a naopak. Vzrůst vnitřní energie systému je při jakémkoliv ději roven součtu tepla a práce, které systém při tomto ději přijal.
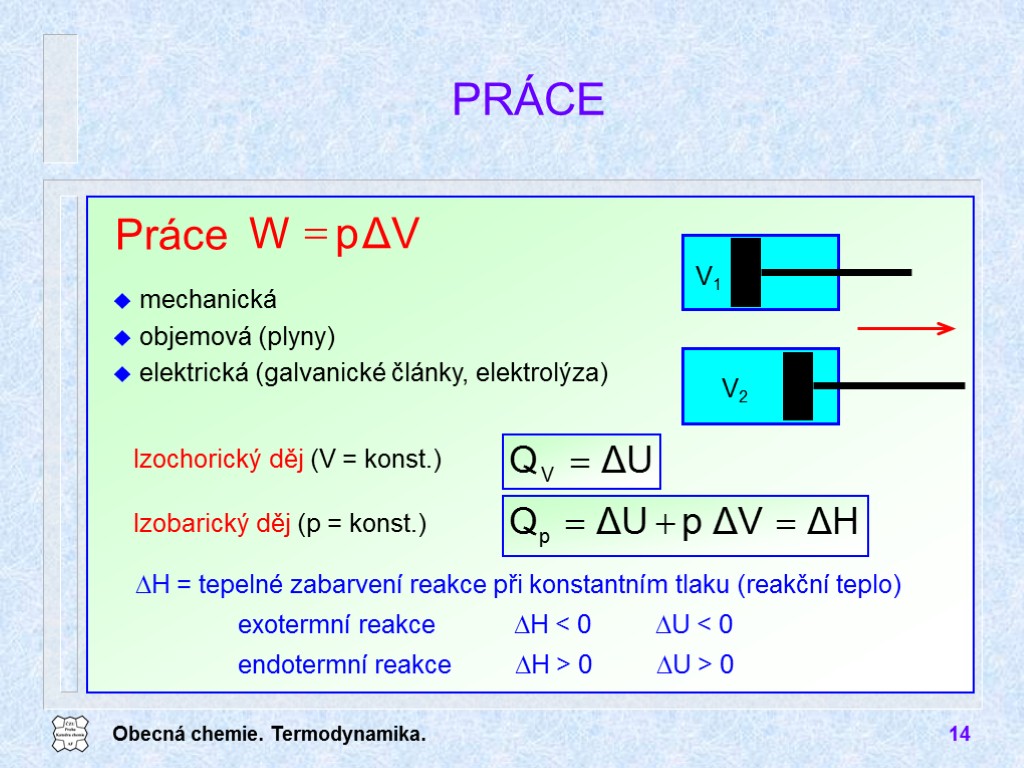
Obecná chemie. Termodynamika. 14 Práce mechanická objemová (plyny) elektrická (galvanické články, elektrolýza) PRÁCE Izochorický děj (V = konst.) Izobarický děj (p = konst.) DH = tepelné zabarvení reakce při konstantním tlaku (reakční teplo) exotermní reakce DH < 0 DU < 0 endotermní reakce DH > 0 DU > 0
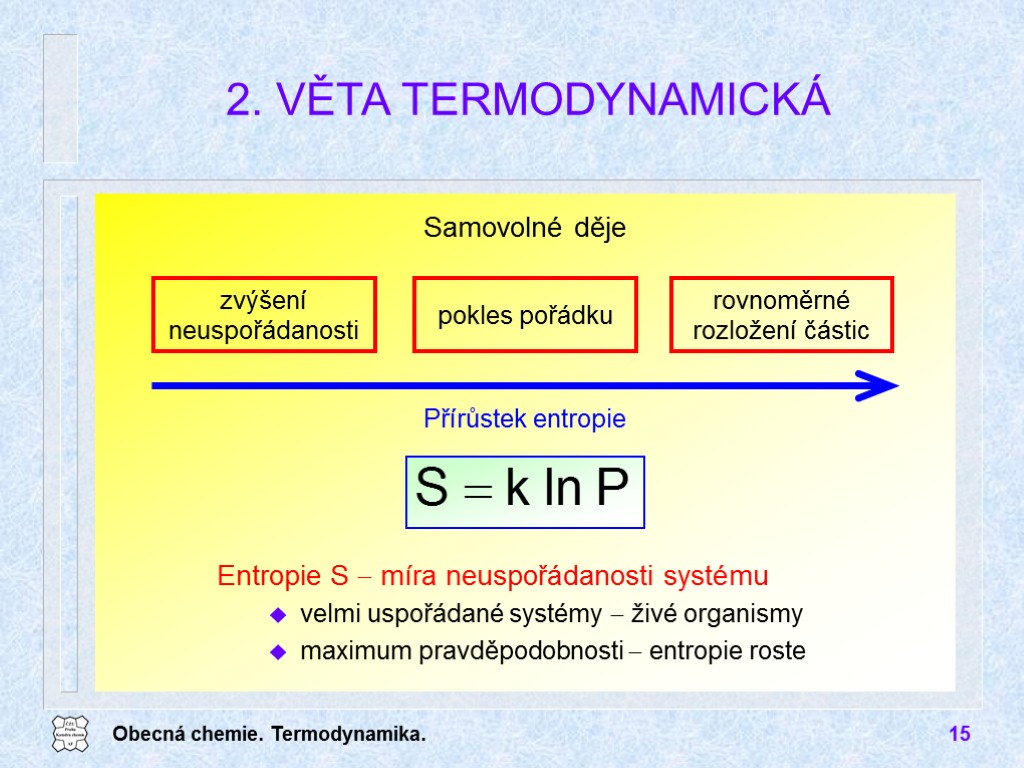
Obecná chemie. Termodynamika. 15 Samovolné děje 2. VĚTA TERMODYNAMICKÁ Přírůstek entropie zvýšení neuspořádanosti pokles pořádku rovnoměrné rozložení částic Entropie S míra neuspořádanosti systému velmi uspořádané systémy živé organismy maximum pravděpodobnosti entropie roste

Obecná chemie. Termodynamika. 16 SPONTÁNNÍ PRŮBĚH DĚJŮ /1 Nová funkce G Gibbsova energie (volná enthalpie) člen enthalpický rozhodující vliv člen entropický vliv roste s teplotou T Kritéria pro spontánní průběh dějů snížení energie zvýšení neuspořádanosti růst entropie Entropie roste tuhý stav kapalný stav plynný stav rozpouštění tuhé látky v kapalině děje, kdy se zvyšuje počet molekul mísení plynů
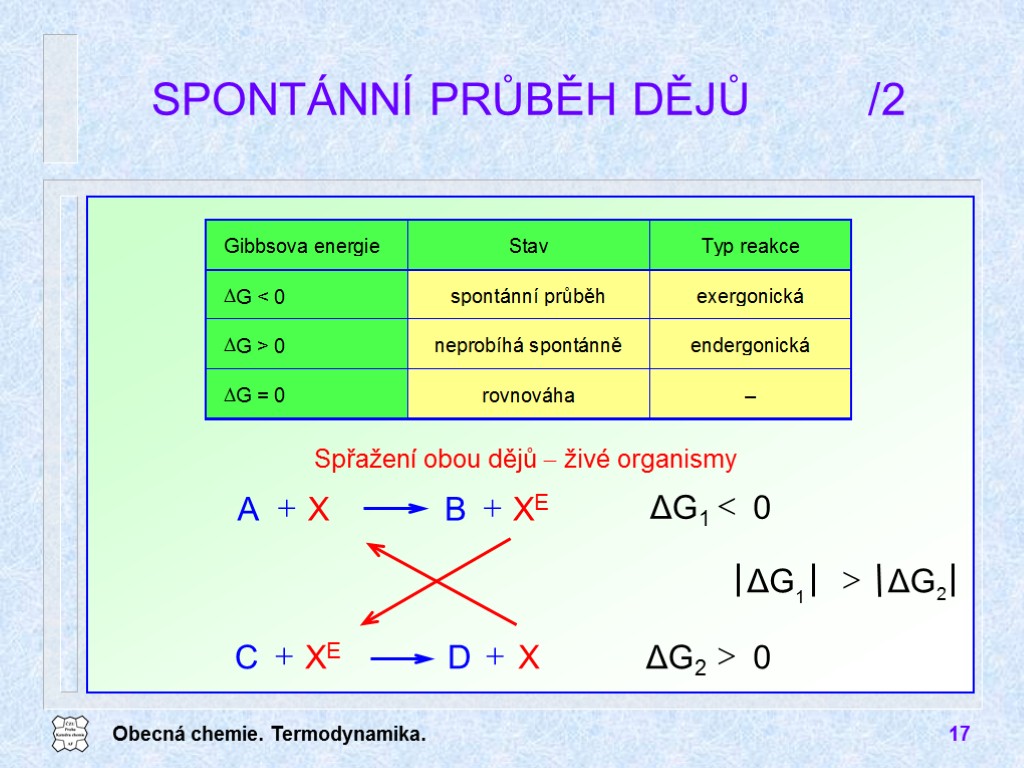
Obecná chemie. Termodynamika. 17 SPONTÁNNÍ PRŮBĚH DĚJŮ /2 Spřažení obou dějů živé organismy
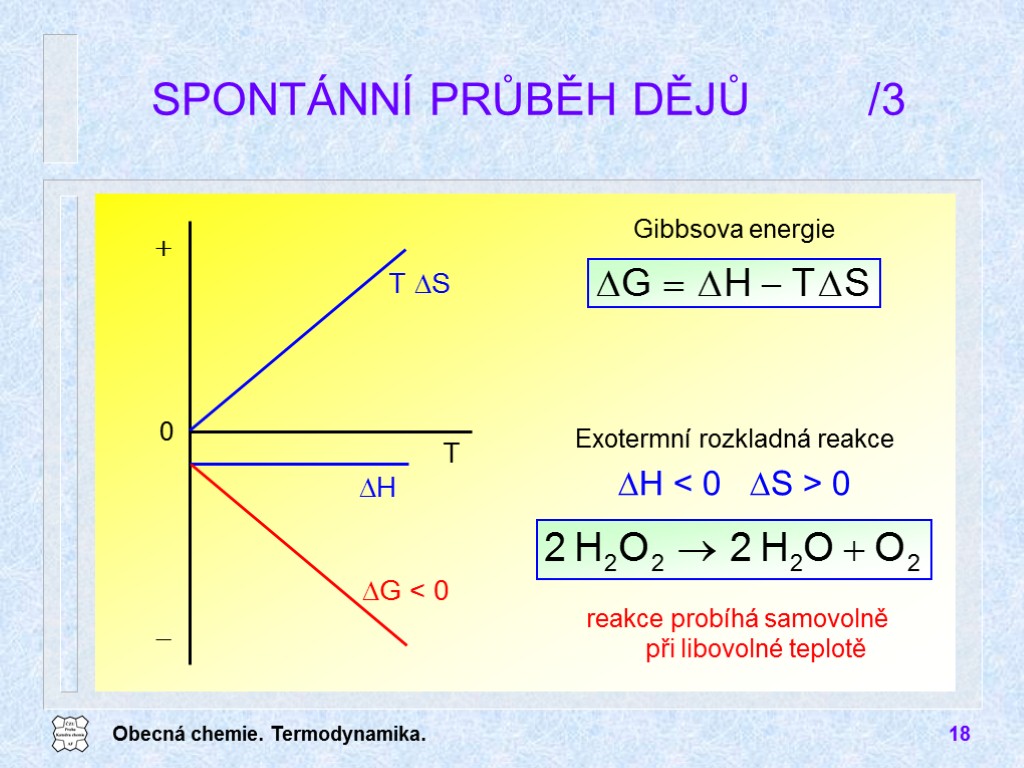
Obecná chemie. Termodynamika. 18 SPONTÁNNÍ PRŮBĚH DĚJŮ /3 Exotermní rozkladná reakce DH < 0 DS > 0 Gibbsova energie reakce probíhá samovolně při libovolné teplotě
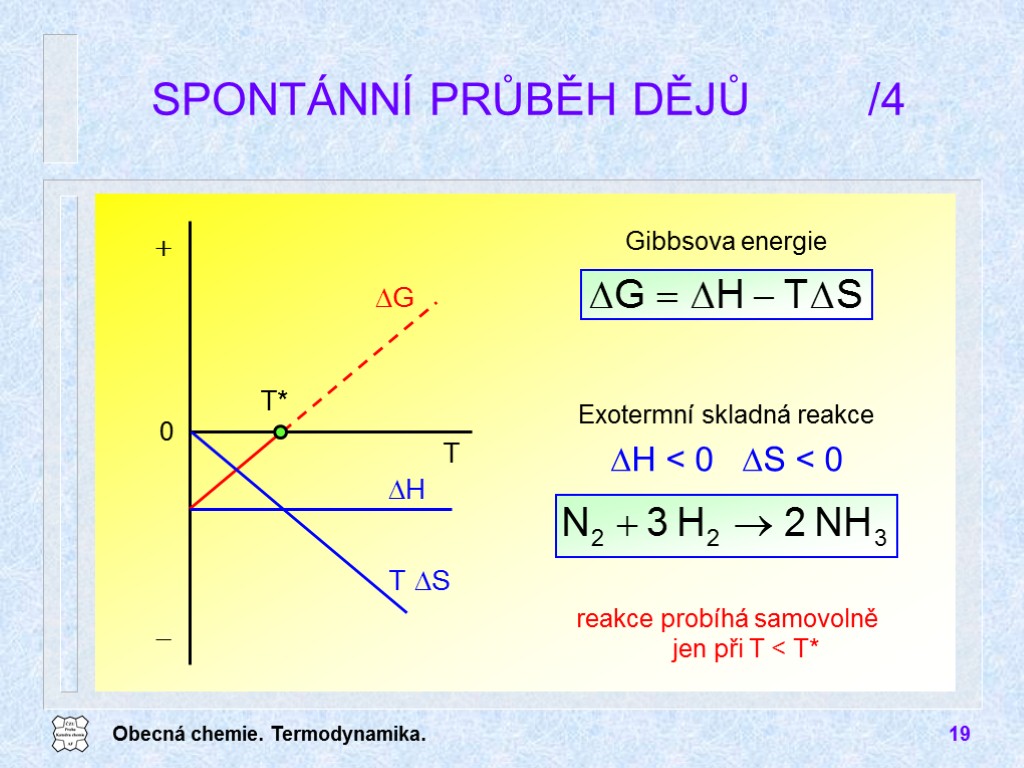
Obecná chemie. Termodynamika. 19 SPONTÁNNÍ PRŮBĚH DĚJŮ /4 Exotermní skladná reakce DH < 0 DS < 0 Gibbsova energie reakce probíhá samovolně jen při T < T*
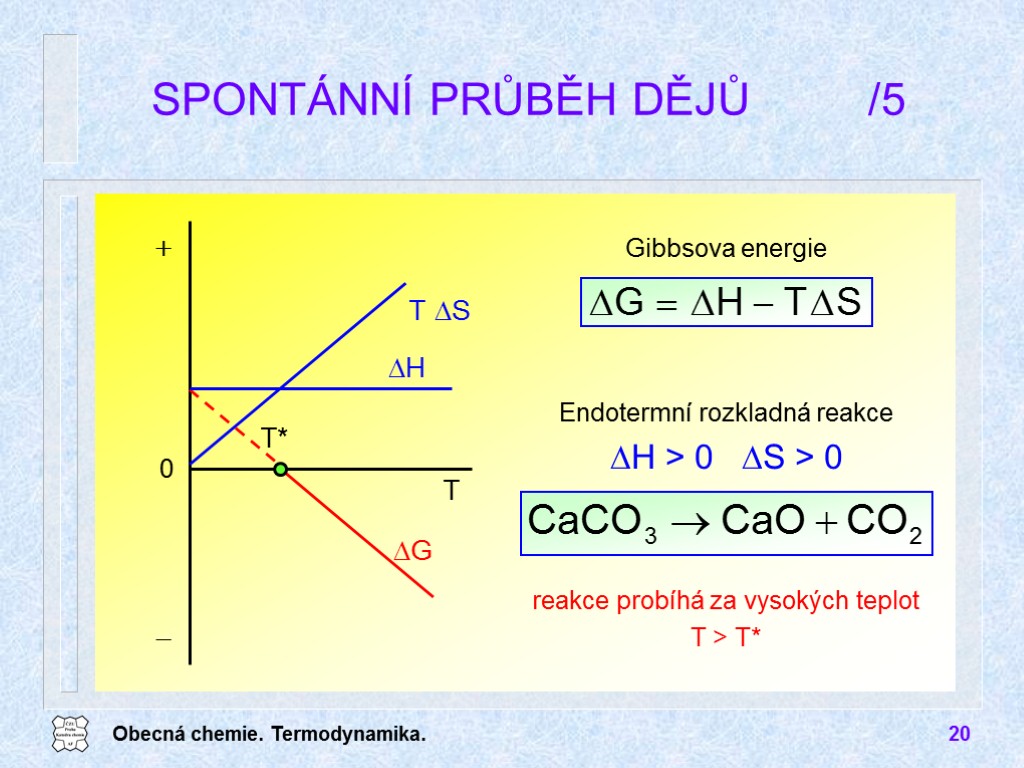
Obecná chemie. Termodynamika. 20 SPONTÁNNÍ PRŮBĚH DĚJŮ /5 Endotermní rozkladná reakce DH > 0 DS > 0 Gibbsova energie reakce probíhá za vysokých teplot T > T*
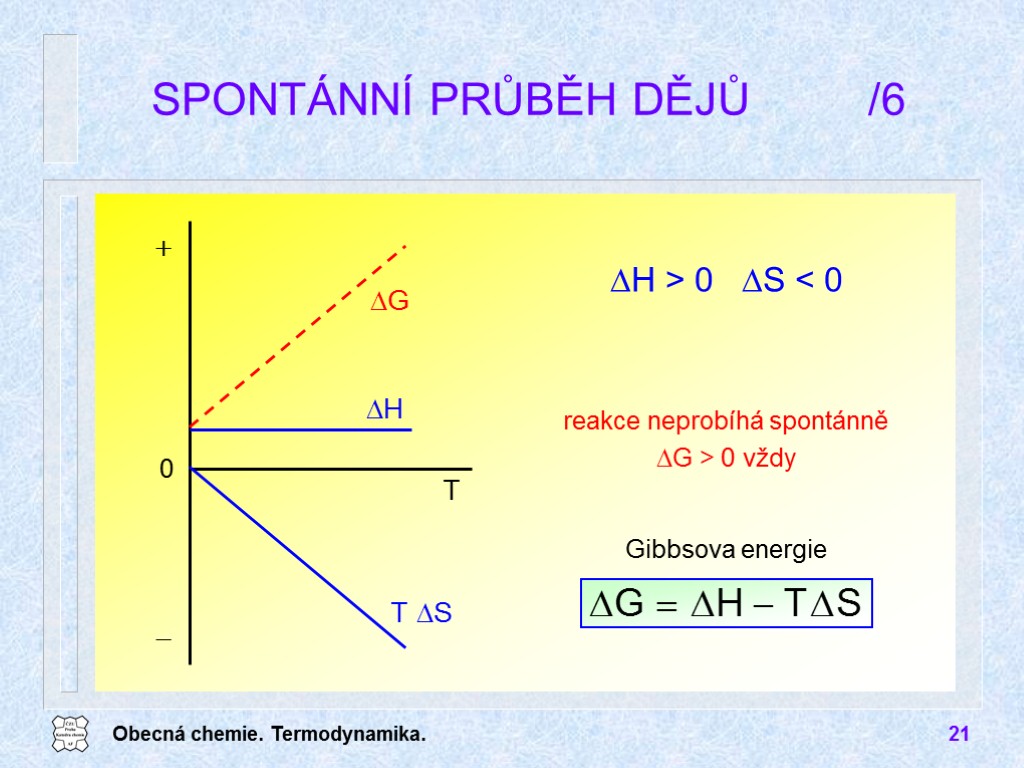
Obecná chemie. Termodynamika. 21 SPONTÁNNÍ PRŮBĚH DĚJŮ /6 DH > 0 DS < 0 Gibbsova energie reakce neprobíhá spontánně DG > 0 vždy

22 KONEC
chem_reakce.ppt
- Количество слайдов: 22

