chem_reakce.ppt
- Количество слайдов: 22

OBECNÁ CHEMIE CHEMICKÁ REAKCE Ing. Alena Hejtmánková, CSc. Katedra chemie Agronomická fakulta ČZU Praha © Praha, 2003 Obecná chemie. Termodynamika. 1

DEFINICE, ZÁKLADNÍ POJMY Chemická reakce změna vnějších fyzikálních podmínek (tlak, teplota) u zavedení další vhodné látky do systému u proces, kdy zanikají staré chemické vazby a vznikají nové u H 2 (g) + I 2 (g) výchozí látky 400 o C 2 HI (g) reakční produkt Vazebné energie [k. J/mol] výhody energetické u strukturní u H 2 I 2 2 HI 435 150 299 598 Rozdíl Obecná chemie. Chemická reakce. 585 13 2

KLASIFIKACE REAKCÍ /1 Základní typy chemických reakcí u skladné (syntéza) Fe + S Fe. S u rozkladné (analýza) Ca. CO 3 Ca. O + CO 2 u substituční Cu. SO 4 + Zn u podvojná záměna Ba. Cl 2 + Na 2 SO 4 u polymerace n CH 2 = CH 2 polykondenzace n H 2 N CH 2 CO OH [ NH CH 2 CO ] n + (n 1)H 2 O u Obecná chemie. Chemická reakce. Zn. SO 4 + Cu Ba. SO 4 + 2 Na. Cl [ CH 2 ] n 3

KLASIFIKACE REAKCÍ /2 Rozdělení chemických reakcí podle počtu fází u homogenní (reaktanty a produkty ve stejné fázi) N 2 (g) + H 2 (g) u 2 NH 3 (g) heterogenní (reakce na fázovém rozhraní) 2 HCl (aq) + Zn (s) Zn. Cl 2 (aq) + H 2 (g) plyn gas g kapalina liquid l tuhá látka solid s ve vodném roztoku aqua aq Obecná chemie. Chemická reakce. 4
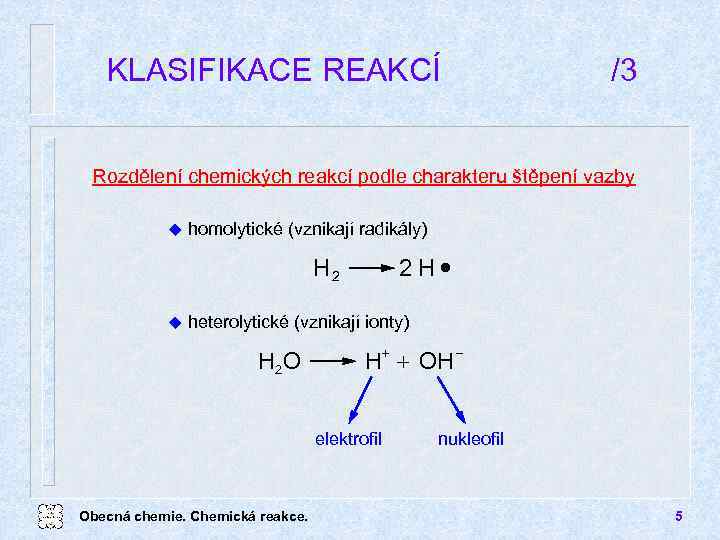
KLASIFIKACE REAKCÍ /3 Rozdělení chemických reakcí podle charakteru štěpení vazby u homolytické (vznikají radikály) 2 H· H 2 u heterolytické (vznikají ionty) H 2 O + H + OH elektrofil Obecná chemie. Chemická reakce. nukleofil 5

KLASIFIKACE REAKCÍ /4 Rozdělení chemických reakcí podle reagujících částic NO 2 + CO NO + CO 2 u molekulové u radikálové (řetězový mechanismus) u iniciace u u u propagace terminace Cl 2 2 Cl · + H 2 H · + Cl 2 H· + H· Cl · + Cl · HCl + H · HCl + Cl · H 2 H · + Cl · Cl 2 HCl iontové (většina anorganických reakcí v polárních rozpouštědlech) 2 CO 3 + H 2 O Obecná chemie. Chemická reakce. HCO + OH 3 6
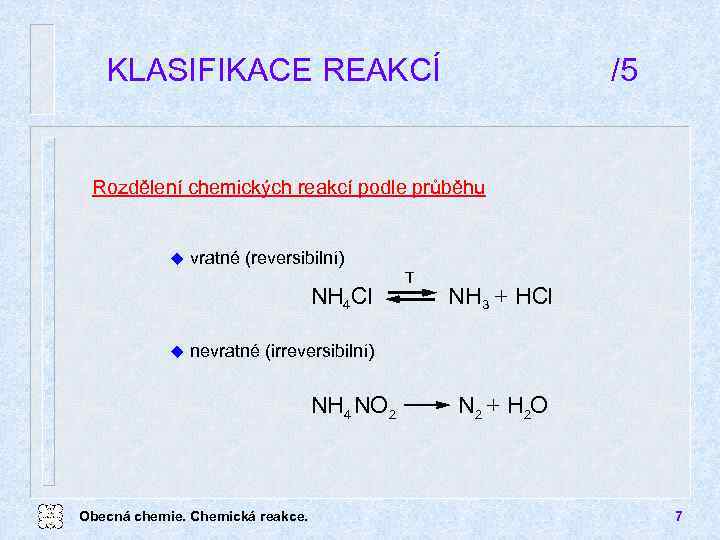
KLASIFIKACE REAKCÍ /5 Rozdělení chemických reakcí podle průběhu u vratné (reversibilní) NH 4 Cl u T NH 3 + HCl nevratné (irreversibilní) NH 4 NO 2 Obecná chemie. Chemická reakce. N 2 + H 2 O 7

KLASIFIKACE REAKCÍ /6 Rozdělení chemických reakcí podle energetické bilance enthalpie H vyjadřuje energetické změny ΔH = ΔU + p ΔV U = vnitřní energie soustavy u reakce exotermické (reakční teplo se uvolňuje) ΔH < 0 u reakce endotermické (reakční teplo je nutno dodat) ΔH > 0 Obecná chemie. Chemická reakce. 8

KLASIFIKACE REAKCÍ /7 Rozdělení chemických reakcí podle přenášených částic u reakce protolytické (přenos protonu H+) HCl + H 2 O + H 3 O + Cl reakce kyseliny a zásady = acidobazická reakce u reakce oxidačně-redukční (přenos elektronu e ) + S 0 + 6 HN VO 3 + + H 2 S VI O 4 + 6 N IVO 2 + 2 H 2 O změna oxidačních čísel u reakce koordinační (komplexotvorné) Cu. SO 4 + 4 NH 3 [Cu(NH 3 ) 4 ]SO 4 přenos atomů nebo skupin atomů Obecná chemie. Chemická reakce. 9

CHEMICKÁ ENERGETIKA TERMODYNAMIKA Termodynamika studuje energetické bilance u uskutečnitelnost chemických reakcí směr průběhu u rovnovážné stavy u stabilitu látek u Základ tvoří 2 axiomatické věty 1. věta zákon zachování energie u 2. věta přírodní děje nevratné u Obecná chemie. Termodynamika. 10
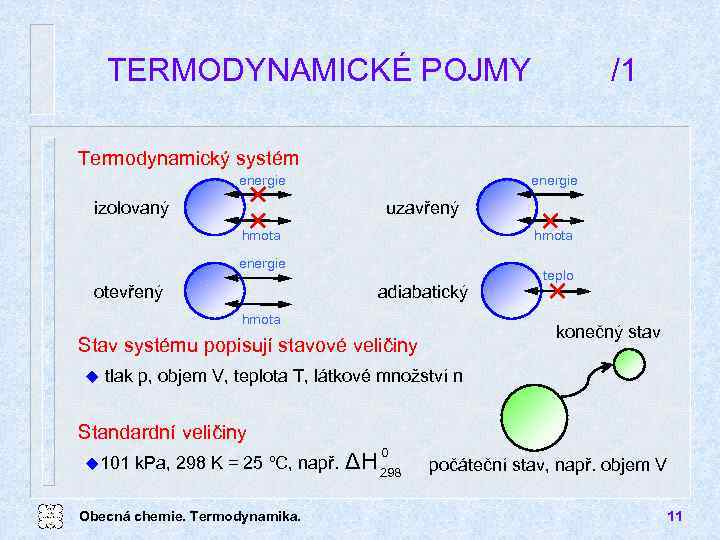
TERMODYNAMICKÉ POJMY /1 Termodynamický systém energie izolovaný energie uzavřený hmota energie adiabatický otevřený hmota konečný stav Stav systému popisují stavové veličiny u teplo tlak p, objem V, teplota T, látkové množství n Standardní veličiny u 101 k. Pa, 298 K = 25 ºC, např. Obecná chemie. Termodynamika. 0 ΔH 298 počáteční stav, např. objem V 11

TERMODYNAMICKÉ POJMY /2 Vnitřní energie U + vnější energie Ek, Ep translační u rotační u vibrační u vzájemné silové působení u energie elektronů u molekuly atomy U nelze měřit absolutně měřitelná je její změna DU ΔU = UB UA Vnitřní energie U Obecná chemie. Termodynamika. tepelná Q netepelná práce W 12

1. VĚTA TERMODYNAMICKÁ ΔU = Q + ( W) Vzrůst vnitřní energie systému je při jakémkoliv ději roven součtu tepla a práce, které systém při tomto ději přijal. Vzrůst vnitřní energie systému znamená pokles energie okolí a naopak. Obecná chemie. Termodynamika. 13
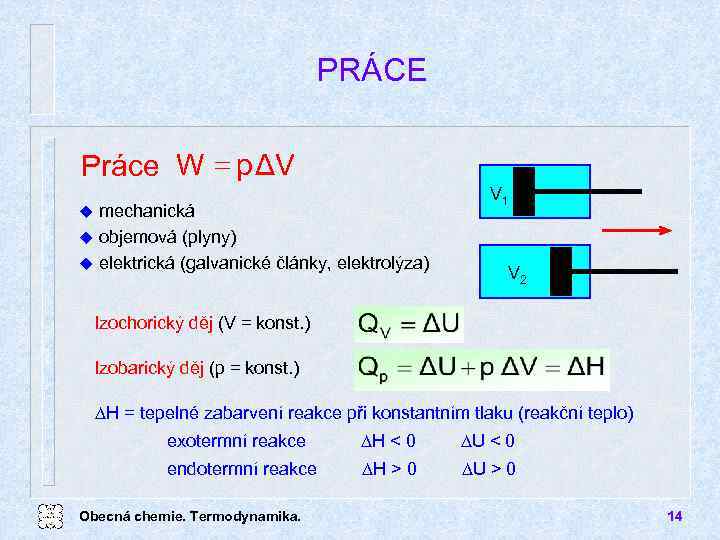
PRÁCE Práce W = p ΔV mechanická u objemová (plyny) u elektrická (galvanické články, elektrolýza) u V 1 V 2 Izochorický děj (V = konst. ) Izobarický děj (p = konst. ) DH = tepelné zabarvení reakce při konstantním tlaku (reakční teplo) exotermní reakce DH < 0 DU < 0 endotermní reakce DH > 0 DU > 0 Obecná chemie. Termodynamika. 14
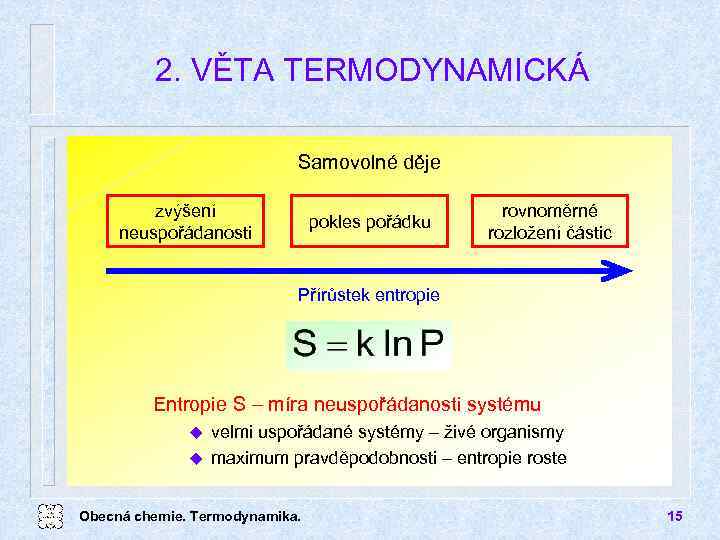
2. VĚTA TERMODYNAMICKÁ Samovolné děje zvýšení neuspořádanosti pokles pořádku rovnoměrné rozložení částic Přírůstek entropie Entropie S míra neuspořádanosti systému velmi uspořádané systémy živé organismy u maximum pravděpodobnosti entropie roste u Obecná chemie. Termodynamika. 15

SPONTÁNNÍ PRŮBĚH DĚJŮ /1 Entropie roste tuhý stav kapalný stav plynný stav u rozpouštění tuhé látky v kapalině u děje, kdy se zvyšuje počet molekul u mísení plynů u Kritéria pro spontánní průběh dějů u snížení energie u zvýšení neuspořádanosti růst entropie Nová funkce G Gibbsova energie (volná enthalpie) člen enthalpický rozhodující vliv u člen entropický vliv roste s teplotou T u Obecná chemie. Termodynamika. 16
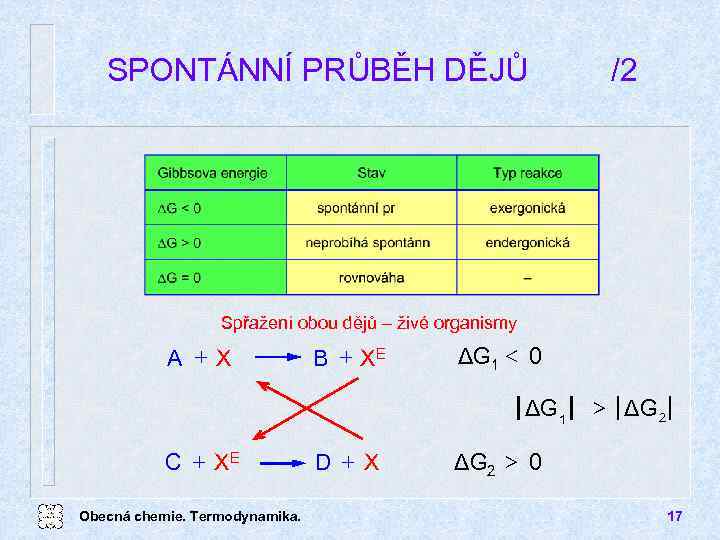
SPONTÁNNÍ PRŮBĚH DĚJŮ /2 Spřažení obou dějů živé organismy A +X B + XE ΔG 1 < 0 ΔG 1 C + XE Obecná chemie. Termodynamika. D + X > ΔG 2 > 0 17
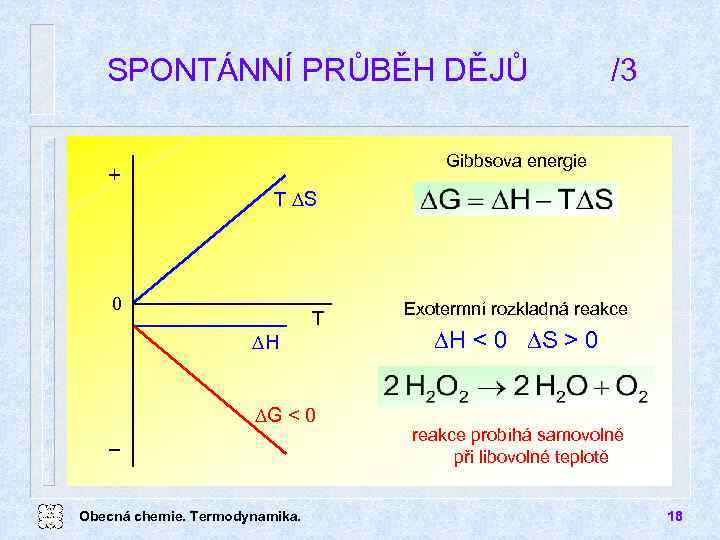
SPONTÁNNÍ PRŮBĚH DĚJŮ /3 Gibbsova energie + T DS 0 DH T DG < 0 Obecná chemie. Termodynamika. Exotermní rozkladná reakce DH < 0 DS > 0 reakce probíhá samovolně při libovolné teplotě 18
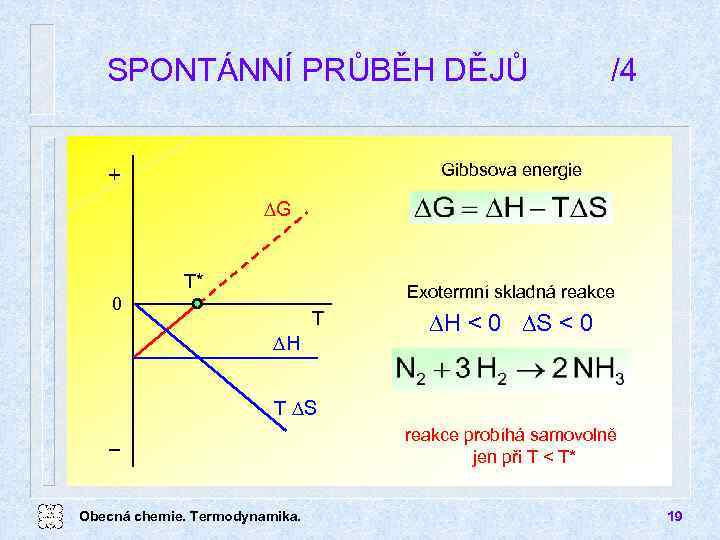
SPONTÁNNÍ PRŮBĚH DĚJŮ /4 Gibbsova energie + DG T* Exotermní skladná reakce 0 T DH DH < 0 DS < 0 T DS Obecná chemie. Termodynamika. reakce probíhá samovolně jen při T < T* 19
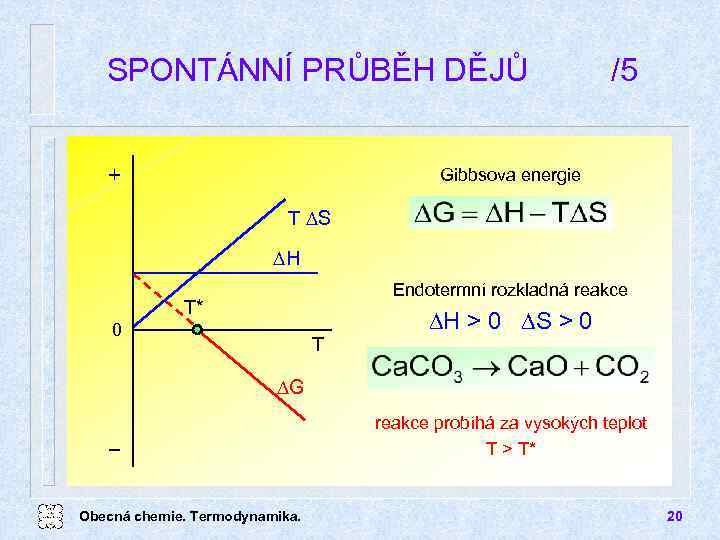
SPONTÁNNÍ PRŮBĚH DĚJŮ + /5 Gibbsova energie T DS DH Endotermní rozkladná reakce T* 0 T DH > 0 DS > 0 DG Obecná chemie. Termodynamika. reakce probíhá za vysokých teplot T > T* 20
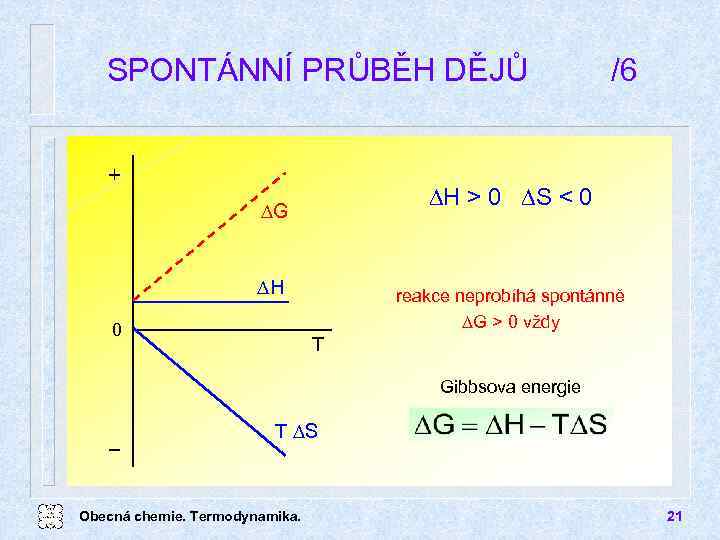
SPONTÁNNÍ PRŮBĚH DĚJŮ + DH > 0 DS < 0 DG DH 0 /6 reakce neprobíhá spontánně DG > 0 vždy T Gibbsova energie T DS Obecná chemie. Termodynamika. 21

KONEC 22
chem_reakce.ppt