Мусинов-Совершенств оборота ЛС МИ - горздрав 2015 июль.pptx
- Количество слайдов: 16

О мерах по совершенствованию обращения лекарственных средств и медицинских изделий Мусинов С. Р. генеральный директор РГП на ПХВ Национальный центр экспертизы ЛС, ИМН и МТ» Алматы, июль 2015 1

Государственное регулирование обращения ЛС и МИ Кодекс РК «О здоровье народа и системе здравоохранения» Статья 5 Основы государственного регулирования в области здравоохранения Государственное регулирование в области здравоохранения осуществляется путем проведения: Ø государственного контроля за медицинской, фармацевтической деятельностью и государственного санитарно-эпидемиологического надзора; Ø лицензирования медицинской и фармацевтической деятельности; Ø аккредитации в области здравоохранения; Ø аттестации в области здравоохранения; Ø сертификации специалистов в области здравоохранения; Ø государственной регистрации ЛС, ИМН и МТ, отдельных видов продукции и веществ, оказывающих вредное воздействие на здоровье человека; Ø подтверждения соответствия товаров (работ, услуг) в области здравоохранения, кроме ЛС Ø государственного регулирования цен на ЛС, ИМН и медицинские услуги в рамках гарантированного объема бесплатной медицинской помощи. 2

Меры по идентификации ЛС и МИ и борьбе с фальсифицированной продукцией ЦЕЛЬ Создать единую национальную систему прослеживания за движением ЛС и МИ на рынке РК для: Ø противодействия проникновению контрафактной продукции, Ø повышения эффективности цепи поставок, Ø повышения уровня безопасности пациентов, Ø мониторинга побочных действий, Ø мониторинга цен ЗАДАЧИ Ø Создать систему отслеживания Ø Войти в число участников GS 1 Healthcare с подписанием договора и меморандума о взаимодействии и сотрудничестве с GS 1 Healthcare (Сектор здравоохранения в Ассоциации Автоматической идентификации) 3

Что такое отслеживание ЛС и МИ § Фармацевтическая система отслеживания включает в себя инфраструктуру связи и программного обеспечения, которые используются для работы базы данных Data. Matrix вместе с компьютерами, установленными в целях отслеживания ЛС и МИ на основе уведомлений, полученных из каждой точки цепи, начиная с производства или ввоза. § Отслеживание начинается с производства каждого препарата и изделия. Ведется мониторинг по всей цепочке поставок, который заканчивается в аптеке. § Система предназначена для отслеживания местоположения каждой единицы продукции. § Система отслеживания должна быть разработана в соответствии с принятыми международными стандартами для операций в цепи поставок. § ISO (международная организация по стандартам), EPCglobal утвердила стандарты, определяющие методики кодирования операций в цепочке поставок произведенных продуктов на рынке, и работает вместе с GS 1.

Цели и объекты системы Фармацевтическая система отслеживания обеспечивает безопасное снабжение надежными ЛС и МИ, предотвращая фальсификацию и контрабанду лекарственных препаратов, которые значительно угрожают здоровью человека. § Предотвращение фальсификации § Предотвращение продажи поддельной продукции § Предотвращение продажи контрабанды § Предотвращение незаконной продажи § Поддержка рационального использования медицинской продукции § Предотвращение «черного рынка» , который возникает особенно во время эпидемий § Возможность отслеживания наркотических препаратов более эффективно § Улучшение фармаконадзора, принятие мгновенных и точечных действий при отзыве лекарственных препаратов § Эффективный надзор и контроль продукции

Для безопасной системы поставок здравоохранения Единица / Единичная доза ти с но с па о ез а е б ент и ен аци ыш п Постепенное расширение в Вторичная Коробка Сложность Первичная По управления данными в цепи поставок и улучшение безопасности пациентов Паллета Взаимосвязь Автоматическая идентификация и сбор данных Электронный Каталог Продукции Электронный Обмен Прослеживаемость Приложения для Пункта Мед. Помощи Данными

Внедрение стандартов GS 1 приводит к снижению необоснованных затрат в следующих сферах: § Снабжения (расходы за ручную проверку, транспортировку срочных заказов в результате недостаточной поставки) § Внешней логистики (расходы за сбор данных) § Страховой медицины § Сокращения уровней запасов приблизительно на 20 % § Снижения объема товаров с истекшим сроком годности примерно на 80 % § Экономия времени и средств, благодаря автоматическому повторному размещению заказа, выписке электронных счетов § Ускорения процедуры отзыва товара § Максимально эффективного использования консигнационных товаров

Мониторинг цен Согласно Приказу Министра здравоохранения Республики Казахстан от 30 июля 2015 года № 639 «Об утверждении Правил формирования цен на лекарственные средства (ЛС), изделия медицинского назначения (ИМН) в рамках гарантированного объема бесплатной медицинской помощи (ГОБМП)» : мониторинг цен на ЛС и ИМН осуществляет РГП на ПХВ «Национальный Центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники» МЗСР РК путем формирования единой базы цен Республики Казахстан на ЛС и ИМН в рамках ГОБМП. Мониторинг цен осуществляется для: § Определения предельной цены на ЛС, ИМН в рамках ГОБМП; § Определения оптимальной цены стоимости генерических ЛС по отношению к оригинальным ЛС; § Рационального использования бюджетных средств при максимальной обеспеченности населения качественными ЛС. 8
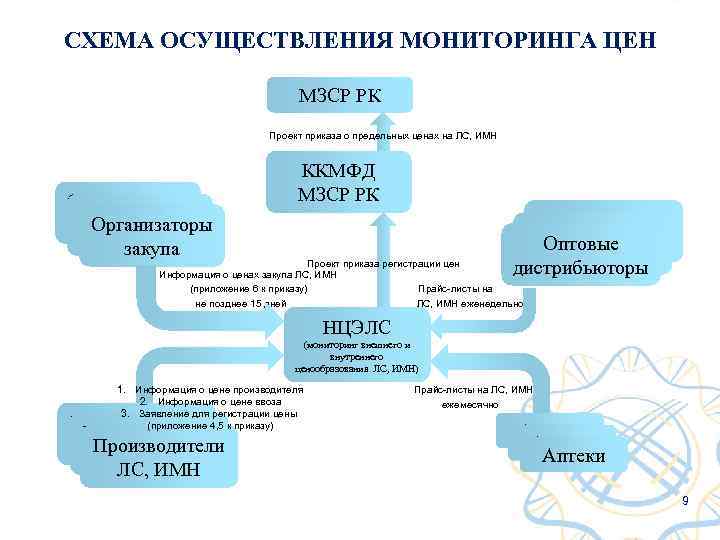
СХЕМА ОСУЩЕСТВЛЕНИЯ МОНИТОРИНГА ЦЕН МЗСР РК Проект приказа о предельных ценах на ЛС, ИМН Организаторы закупа ККМФД МЗСР РК Оптовые дистрибьюторы Проект приказа регистрации цен Информация о ценах закупа ЛС, ИМН (приложение 6 к приказу) Прайс-листы на не позднее 15 дней ЛС, ИМН еженедельно НЦЭЛС (мониторинг внешнего и внутреннего ценообразования ЛС, ИМН) 1. Информация о цене производителя 2. Информация о цене ввоза 3. Заявление для регистрации цены (приложение 4, 5 к приказу) Производители ЛС, ИМН Прайс-листы на ЛС, ИМН ежемесячно Аптеки 9

Нормативные правовые акты, принятые в рамках реализации Кодекса РК v В рамках реализации Кодекса введены в действие 20 НПА регулирующие фармацевтическую деятельность v В Министерстве Юстиции на стадии согласования и регистрации находятся 12 НПА

Клинические исследования § С 2016 года – в рамках общего рынка ЕАЭС с целью признания результатов клинических исследований лекарственных средств обязательным условием является проведение клинических исследований в соответствии с требованиями GCP § Утвержден Приказ МЗСР РК от 29. 06. 2015 г. № 533 «Порядок аккредитации медицинских организаций на право проведения клинических исследований фармакологических и лекарственных средств, изделий медицинского назначения и медицинской техники» § Аккредитацию будет проводить МЗСР РК § Национальный центр создал обучающий Центр по обучению субъектов рынка требованиям надлежащих практик, в т. ч. GCP 11

Фармаконадзор ЛС и мониторинг побочных действий ЛС, МИ Приказ МЗСР РК от 29 мая 2015 года № 421 «Правила проведения фармаконадзора лекарственных средств и мониторинга побочных действий лекарственных средств, изделий медицинского назначения и медицинской техники» (вступил в силу 20 июля 2015 года) Приказом определены функции и ответственность уполномоченного органа, государственной экспертной организации, медицинских организаций, держателей регистрационных удостоверений за проведение фармаконадзора лекарственных средств и мониторинга побочных действий лекарственных средств и медицинских изделий. Уполномоченный орган – Комитет контроля медицинской и фармацевтической деятельности: Осуществляет учет результатов мониторинга ПД ЛС, ИМН и МТ при проведении аттестации медицинских и фармацевтических работников и аккредитации медицинских организаций, а также при контроле качества медицинских услуг Принимает регуляторные меры в отношении ЛС по результатам анализа причинноследственной связи побочных действий 12

Функции уполномоченной организации – НЦЭЛС Ø сбор и учет карт-сообщений о ПД ЛС, ИМН и МТ через интернет-ресурсы в режиме онлайн или по факсу или по электронной почте уполномоченной организации (ранее карты-сообщения представлялись только на бумажном носителе) Ø анализ, оценку и верификацию спонтанных сообщений о ПД ЛС, ИМН и МТ , поступающих от медицинских и фармацевтических работников, потребителей Ø оценку причинно-следственной связи между клиническими проявлениями ПД ЛС с применением подозреваемого ЛС, а также между происшествиями и типами, видами, моделями ИМН и МТ Ø проведение научных семинаров и конференций по мониторингу, участи в других научных конференциях и семинарах с сообщениями по мониторингу Ø рассылает медицинским и фармацевтическим работникам информационные письма об изменениях профиля безопасности ЛС, оценке соотношения пользариск и изменениях в рекомендации по применению Ø сотрудничает с медицинскими учебными заведениями, другими государственными организациями и институтами в сфере здравоохранения 13

Функции Местных органов государственного управления здравоохранением: § организуют работу по мониторингу ПД и (или) отсутствия эффективности ЛС, ИМН и МТ в медицинских организациях с назначением ответственных лиц за мониторинг ПД § Медицинские работники информируют ответственное лицо о побочных действиях и (или) отсутствие эффективности (ранее данной нормы не было) ЛС для сбора и предоставления в уполномоченную организацию. § Ответственное лицо обеспечивает предоставление в уполномоченную организацию информации о ПД и (или) отсутствие эффективности путем: § заполнения карты-сообщения и своевременную передачу в уполномоченную организацию; § занесение информации о ПД, серьезных ПД и об отсутствии эффективности в медицинскую карту стационарного и (или) амбулаторного пациента; § ведение статистики по выявленным случаям ПД в медицинской организации; § предоставления отчета о побочных реакциях (действиях), серьезных побочных реакциях (действиях) и отсутствии эффективности ЛС, ИМН и МТ в уполномоченный орган не позднее 15 февраля текущего года. 14

продолжение § Карты-сообщения передаются через портал уполномоченной организации в онлайн режиме с содержанием обязательного минимального объема информации, требуемого для установления оценки причинно-следственной связи между развитием побочных реакций и (или) отсутствием эффективности. § Сроки предоставления заполненной карты-сообщения о ПД и (или) эффективности в уполномоченную организацию в случаях выявления: серьезной ПД, со смертельным исходом или с угрозой для жизни, в течение 48 часов от момента, когда стало известно об этом случае; § § серьезной ПД, серьезной непредвиденной реакции и ПД, не относящихся к серьезным, в течение 15 дней от момента, когда стало известно об этом случае; § § ПД во время клинического исследования в течение 15 суток. Для получения доступа на портал уполномоченной организации для передачи картсообщений о ПД : местные органы государственного управления здравоохранением представляют перечень МО с указанием данных ответственного лица за мониторинг ПД; территориальные департаменты ККМФД перечень фармацевтических организаций с указанием данных ответственного лица за мониторинг ПД; держатели РУ данные ответственного лица по фармаконадзору, уполномоченного представителя по мониторингу ПД на территории РК. 15

Спасибо за внимание! 16
Мусинов-Совершенств оборота ЛС МИ - горздрав 2015 июль.pptx