 ns 2 np 3
ns 2 np 3
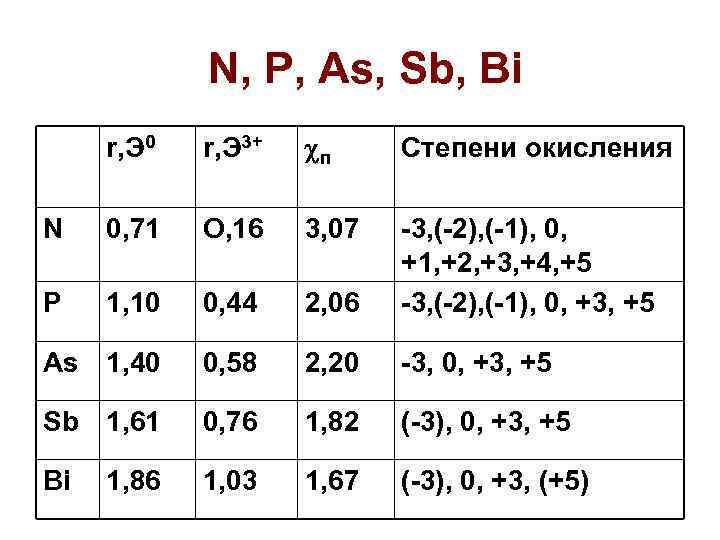 N, P, As, Sb, Bi r, Э 0 r, Э 3+ п Степени окисления N 0, 71 O, 16 3, 07 P 1, 10 0, 44 2, 06 -3, (-2), (-1), 0, +1, +2, +3, +4, +5 -3, (-2), (-1), 0, +3, +5 As 1, 40 0, 58 2, 20 -3, 0, +3, +5 Sb 1, 61 0, 76 1, 82 (-3), 0, +3, +5 Bi 1, 03 1, 67 (-3), 0, +3, (+5) 1, 86
N, P, As, Sb, Bi r, Э 0 r, Э 3+ п Степени окисления N 0, 71 O, 16 3, 07 P 1, 10 0, 44 2, 06 -3, (-2), (-1), 0, +1, +2, +3, +4, +5 -3, (-2), (-1), 0, +3, +5 As 1, 40 0, 58 2, 20 -3, 0, +3, +5 Sb 1, 61 0, 76 1, 82 (-3), 0, +3, +5 Bi 1, 03 1, 67 (-3), 0, +3, (+5) 1, 86
 Распространенность и минералы N – 18 место, N 2, Na. NO 3 (селитра) P – 13 место; Ca 3(PO 4)3 (фосфорит), Ca 3(PO 4)2. Ca(OH, F)2 (апатит) As – 51 место, As 4 S 4 (реальгар), Fe. As. S (арсенопирит) Sb – 59 место, Sb 2 S 3 (антимонит на картинке) Bi – 60 место, Bi 2 S 3 (висмутит)
Распространенность и минералы N – 18 место, N 2, Na. NO 3 (селитра) P – 13 место; Ca 3(PO 4)3 (фосфорит), Ca 3(PO 4)2. Ca(OH, F)2 (апатит) As – 51 место, As 4 S 4 (реальгар), Fe. As. S (арсенопирит) Sb – 59 место, Sb 2 S 3 (антимонит на картинке) Bi – 60 место, Bi 2 S 3 (висмутит)
 Открытие элементов • N – 1772 г. , англ. Кавендиш, Резерфорд + Пристли, швед Шееле, француз Лавуазье; от греч. «отрицающий жизнь» • P – 1669 г. , немец Бранд, от греч. «несущий огонь» • As - известен давно, от греч. «принадлежность к муж. роду» • Sb – известен давно, от греч. «противник уединения» • Bi – 1739 г. , Потт, от нем. «Weise materia»
Открытие элементов • N – 1772 г. , англ. Кавендиш, Резерфорд + Пристли, швед Шееле, француз Лавуазье; от греч. «отрицающий жизнь» • P – 1669 г. , немец Бранд, от греч. «несущий огонь» • As - известен давно, от греч. «принадлежность к муж. роду» • Sb – известен давно, от греч. «противник уединения» • Bi – 1739 г. , Потт, от нем. «Weise materia»
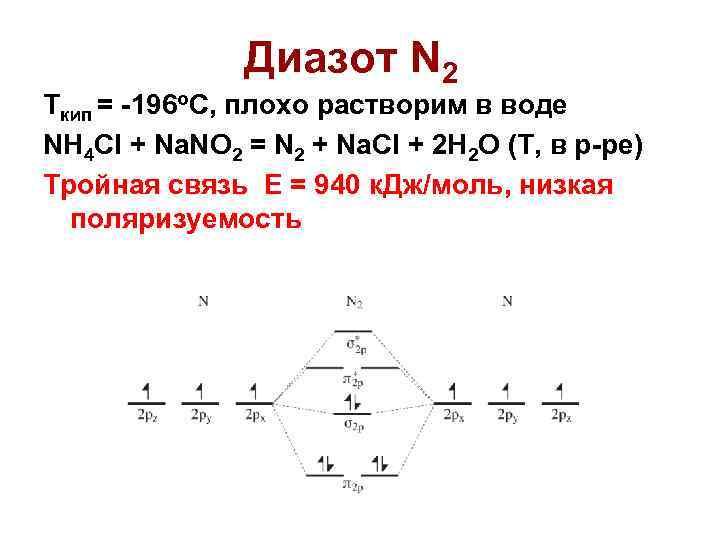 Диазот N 2 Ткип = -196 о. С, плохо растворим в воде NH 4 Cl + Na. NO 2 = N 2 + Na. Cl + 2 H 2 O (T, в р-ре) Тройная связь Е = 940 к. Дж/моль, низкая поляризуемость
Диазот N 2 Ткип = -196 о. С, плохо растворим в воде NH 4 Cl + Na. NO 2 = N 2 + Na. Cl + 2 H 2 O (T, в р-ре) Тройная связь Е = 940 к. Дж/моль, низкая поляризуемость
 Связывание диазота N 2 = 2 N K 298 = 10 -120 (!!!) N 2 + Li = Li 3 N при комнатной Т, нитриды N 2 + 3 Mg = Mg 3 N 2 при нагревании N 2 + O 2 = 2 NO большие затраты энергии N 2 + 3 H 2 = 2 NH 3 процесс Габера: r. H< 0, P, T, катализатор В природе – фермент нитрогеназа
Связывание диазота N 2 = 2 N K 298 = 10 -120 (!!!) N 2 + Li = Li 3 N при комнатной Т, нитриды N 2 + 3 Mg = Mg 3 N 2 при нагревании N 2 + O 2 = 2 NO большие затраты энергии N 2 + 3 H 2 = 2 NH 3 процесс Габера: r. H< 0, P, T, катализатор В природе – фермент нитрогеназа
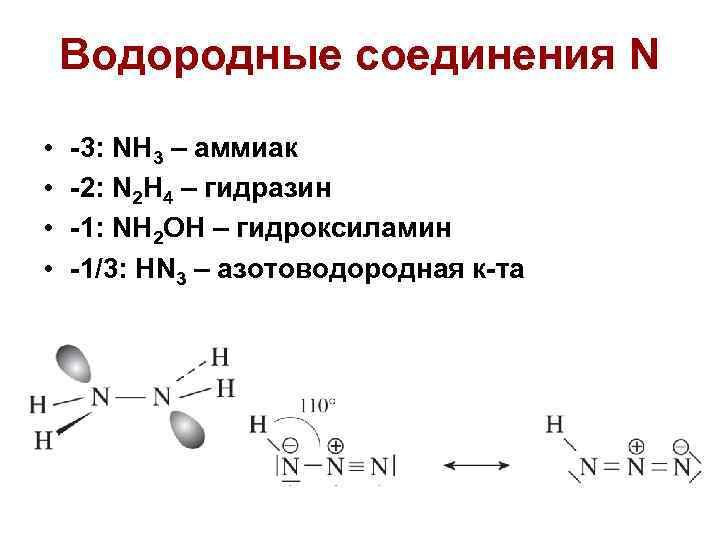 Водородные соединения N • • -3: NH 3 – аммиак -2: N 2 H 4 – гидразин -1: NH 2 OH – гидроксиламин -1/3: HN 3 – азотоводородная к-та
Водородные соединения N • • -3: NH 3 – аммиак -2: N 2 H 4 – гидразин -1: NH 2 OH – гидроксиламин -1/3: HN 3 – азотоводородная к-та
 Получение a) Промышленность: процесс Габера. Лабор. NH 4 Clконц + Na. OHтв = NH 3↑ + Na. Cl + H 2 O б) 2 NH 3 + Na. Cl. O = N 2 H 4 + Na. Cl + H 2 O Для получения безводного перегоняют над щелочью в) Электрохим. восстановление разб. р-ров NO 3 - + 7 H+ + 6 e = NH 2 OH + 2 H 2 O NO 2 - + 2 HSO 3 - + H 2 O = NH 3 OH+ + 2 SO 42 г) N 2 H 5+ + NO 2 - = HN 3 + 2 H 2 O
Получение a) Промышленность: процесс Габера. Лабор. NH 4 Clконц + Na. OHтв = NH 3↑ + Na. Cl + H 2 O б) 2 NH 3 + Na. Cl. O = N 2 H 4 + Na. Cl + H 2 O Для получения безводного перегоняют над щелочью в) Электрохим. восстановление разб. р-ров NO 3 - + 7 H+ + 6 e = NH 2 OH + 2 H 2 O NO 2 - + 2 HSO 3 - + H 2 O = NH 3 OH+ + 2 SO 42 г) N 2 H 5+ + NO 2 - = HN 3 + 2 H 2 O
 Нитриды • Ионные Li 3 N, Mg 2 N 3, Cu 3 N, Zn 3 N 2 Полностью гидролизуются водой • Ковалентные Si 3 N 4, Ge 3 N 4, в том числе со структурой алмаза Al. N, Ga. N Инертные, термически стабильные • Металлоподобные Ti. N, Cr 2 N, Fe 4 N Инертные, тугоплавкие, твердые Катализаторы, полупроводники, конст. материалы
Нитриды • Ионные Li 3 N, Mg 2 N 3, Cu 3 N, Zn 3 N 2 Полностью гидролизуются водой • Ковалентные Si 3 N 4, Ge 3 N 4, в том числе со структурой алмаза Al. N, Ga. N Инертные, термически стабильные • Металлоподобные Ti. N, Cr 2 N, Fe 4 N Инертные, тугоплавкие, твердые Катализаторы, полупроводники, конст. материалы
 Получение НИТРИДЫ: Al + NH 3 = Al. N + 3/2 H 2 (600 o. C) 2 Al + N 2 = Al. N (1000 o. C) АМИДЫ: Naтв + NH 3 газ = Na. NH 2 + 1/2 H 2 Naтв = Na+ (solv) + e- (solv) (solv – жидкий NH 3) Naтв + NH 3 ж = Na. NH 2 + 1/2 H 2 (катализатор Fe) ГИДРАЗИНИДЫ: Naтв + N 2 H 4 ж = Na. N 2 H 3 + 1/2 H 2 АЗИДЫ: 2 Na. NH 2 тв + N 2 O г = Na. N 3 + Na. OH +NH 3 3 Na. NH 2 + Na. NO 3 = Na. N 3 + 3 Na. OH +NH 3 (две эти реакции при 180 о. С)
Получение НИТРИДЫ: Al + NH 3 = Al. N + 3/2 H 2 (600 o. C) 2 Al + N 2 = Al. N (1000 o. C) АМИДЫ: Naтв + NH 3 газ = Na. NH 2 + 1/2 H 2 Naтв = Na+ (solv) + e- (solv) (solv – жидкий NH 3) Naтв + NH 3 ж = Na. NH 2 + 1/2 H 2 (катализатор Fe) ГИДРАЗИНИДЫ: Naтв + N 2 H 4 ж = Na. N 2 H 3 + 1/2 H 2 АЗИДЫ: 2 Na. NH 2 тв + N 2 O г = Na. N 3 + Na. OH +NH 3 3 Na. NH 2 + Na. NO 3 = Na. N 3 + 3 Na. OH +NH 3 (две эти реакции при 180 о. С)
 Ox-red реакции • N 2 H 4 - f. G 0 >0, стабилен, т. к. кинетически инертен; хороший восстановитель p. H=0: N 2 + 5 H+ + 4 e- = N 2 H 5+ E = -0, 23 B p. H=14: N 2 + 4 H 2 O +2 e- = N 2 H 4 +4 OH- E = -1, 16 B N 2 H 5+ + 4 Fe 3+ = N 2 + 4 Fe 2+ + 5 H+ N 2 H 4 + O 2 = N 2 + 2 H 2 O (алкилгидразины ракетное топливо) • NH 2 OH - f. G 0 >0, легко разлагается, чаще всего восстановитель 3 NH 2 OH = NH 3 + N 2 + 3 H 2 O 4 Fe 3+ + 2 NH 3 OH+ = 4 Fe 2+ + N 2 O + 6 H+ + H 2 O
Ox-red реакции • N 2 H 4 - f. G 0 >0, стабилен, т. к. кинетически инертен; хороший восстановитель p. H=0: N 2 + 5 H+ + 4 e- = N 2 H 5+ E = -0, 23 B p. H=14: N 2 + 4 H 2 O +2 e- = N 2 H 4 +4 OH- E = -1, 16 B N 2 H 5+ + 4 Fe 3+ = N 2 + 4 Fe 2+ + 5 H+ N 2 H 4 + O 2 = N 2 + 2 H 2 O (алкилгидразины ракетное топливо) • NH 2 OH - f. G 0 >0, легко разлагается, чаще всего восстановитель 3 NH 2 OH = NH 3 + N 2 + 3 H 2 O 4 Fe 3+ + 2 NH 3 OH+ = 4 Fe 2+ + N 2 O + 6 H+ + H 2 O
 Ox-red реакции • HN 3 - f. G 0 >0, взрывается, 2 HN 3 = H 2 + 3 N 2 • NH 3 – слабый восстановитель 8 NH 4 OH + 3 Br 2 = 6 NH 4 Br + N 2 + 8 H 2 O 3 Cu. Oтв + 2 NH 3 г = 3 Cu + N 2 + 3 H 2 O (при T) 4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O (без катализатора) 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O (с катализатором)
Ox-red реакции • HN 3 - f. G 0 >0, взрывается, 2 HN 3 = H 2 + 3 N 2 • NH 3 – слабый восстановитель 8 NH 4 OH + 3 Br 2 = 6 NH 4 Br + N 2 + 8 H 2 O 3 Cu. Oтв + 2 NH 3 г = 3 Cu + N 2 + 3 H 2 O (при T) 4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O (без катализатора) 4 NH 3 + 5 O 2 = 4 NO + 6 H 2 O (с катализатором)
 Термолиз солей аммония • Соли кислот не окислителей HX (X = Cl, Br, I), H 2 CO 3, H 3 PO 4 (NH 4)2 CO 3 = CO 2 + 2 NH 3 +2 H 2 O NH 4 H 2 PO 4 = NH 3 + H 3 PO 4 • Соли кислот окислителей 2 NH 4 NO 3 = N 2 O + 2 H 2 O (NH 4)2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4 H 2 O NH 4 NO 2 = N 2+ 2 H 2 O (NH 4)2 SO 4 = NH 3 + NH 4 HSO 4 3 NH 4 HSO 4 = N 2 + NH 3 + 3 SO 2 + 6 H 2 O
Термолиз солей аммония • Соли кислот не окислителей HX (X = Cl, Br, I), H 2 CO 3, H 3 PO 4 (NH 4)2 CO 3 = CO 2 + 2 NH 3 +2 H 2 O NH 4 H 2 PO 4 = NH 3 + H 3 PO 4 • Соли кислот окислителей 2 NH 4 NO 3 = N 2 O + 2 H 2 O (NH 4)2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4 H 2 O NH 4 NO 2 = N 2+ 2 H 2 O (NH 4)2 SO 4 = NH 3 + NH 4 HSO 4 3 NH 4 HSO 4 = N 2 + NH 3 + 3 SO 2 + 6 H 2 O
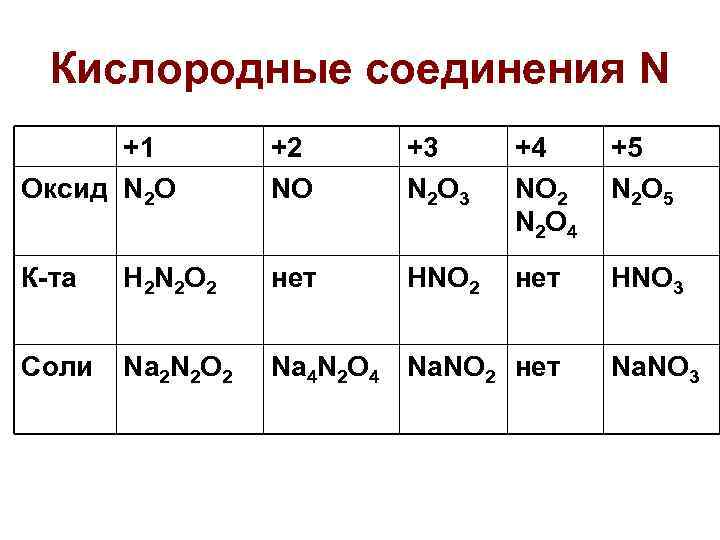 Кислородные соединения N +1 Оксид N 2 O +2 NO +3 N 2 O 3 +4 NO 2 N 2 O 4 +5 N 2 O 5 К-та H 2 N 2 O 2 нет HNO 3 Соли Na 2 N 2 O 2 Na 4 N 2 O 4 Na. NO 2 нет Na. NO 3
Кислородные соединения N +1 Оксид N 2 O +2 NO +3 N 2 O 3 +4 NO 2 N 2 O 4 +5 N 2 O 5 К-та H 2 N 2 O 2 нет HNO 3 Соли Na 2 N 2 O 2 Na 4 N 2 O 4 Na. NO 2 нет Na. NO 3
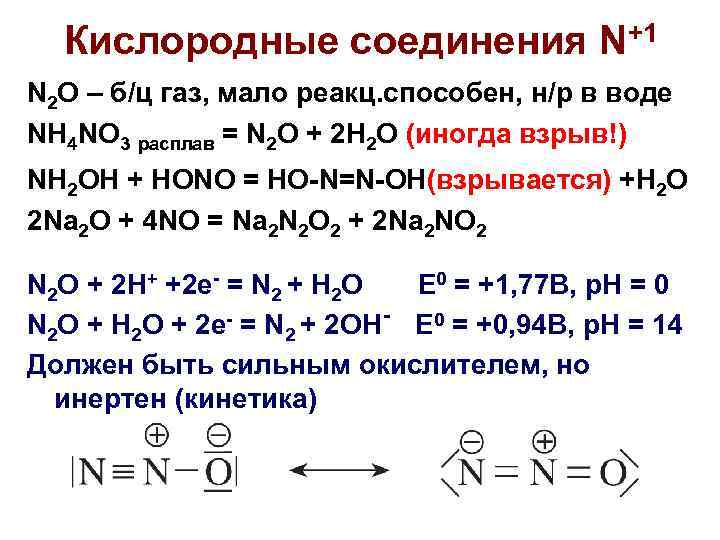 Кислородные соединения N+1 N 2 O – б/ц газ, мало реакц. способен, н/р в воде NH 4 NO 3 расплав = N 2 O + 2 H 2 O (иногда взрыв!) NH 2 OH + HONO = HO-N=N-OH(взрывается) +H 2 O 2 Na 2 O + 4 NO = Na 2 N 2 O 2 + 2 Na 2 NO 2 N 2 O + 2 H+ +2 e- = N 2 + H 2 O E 0 = +1, 77 B, p. H = 0 N 2 O + H 2 O + 2 e- = N 2 + 2 OH- E 0 = +0, 94 B, p. H = 14 Должен быть сильным окислителем, но инертен (кинетика)
Кислородные соединения N+1 N 2 O – б/ц газ, мало реакц. способен, н/р в воде NH 4 NO 3 расплав = N 2 O + 2 H 2 O (иногда взрыв!) NH 2 OH + HONO = HO-N=N-OH(взрывается) +H 2 O 2 Na 2 O + 4 NO = Na 2 N 2 O 2 + 2 Na 2 NO 2 N 2 O + 2 H+ +2 e- = N 2 + H 2 O E 0 = +1, 77 B, p. H = 0 N 2 O + H 2 O + 2 e- = N 2 + 2 OH- E 0 = +0, 94 B, p. H = 14 Должен быть сильным окислителем, но инертен (кинетика)
 Кислородные соединения N+2 NO - б/ц газ, реакц. способен, н/р в воде, парамагнитный 3 Cu + 8 HNO 3 разб = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O 2 Na. ONO + 2 Na = Na 4[O 2 N-NO 2] (в ж. NH 3, в прис. следов воды или Т – взрыв!!) А) БИОЛОГИЧЕСКАЯ ФУНКЦИЯ Образуется in vivo, снижение давления, передача нервных импульсов, разрушение микробов Б) ЭКОЛОГИЯ 2 NO = N 2 + O 2 (Cu+ на цеолите)
Кислородные соединения N+2 NO - б/ц газ, реакц. способен, н/р в воде, парамагнитный 3 Cu + 8 HNO 3 разб = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O 2 Na. ONO + 2 Na = Na 4[O 2 N-NO 2] (в ж. NH 3, в прис. следов воды или Т – взрыв!!) А) БИОЛОГИЧЕСКАЯ ФУНКЦИЯ Образуется in vivo, снижение давления, передача нервных импульсов, разрушение микробов Б) ЭКОЛОГИЯ 2 NO = N 2 + O 2 (Cu+ на цеолите)
 Кислородные соединения N+3 N 2 O 3 – образует синию жидкость (Тпл= -100 о. С), в газе диссоциирует на NO и NO 2 NO + NO 2 + H 2 O = 2 HNO 2 (смесь газов 1: 1) NO + NO 2 +2 Na. OH = 2 Na. NO 2 + H 2 O HNO 2 – сильный (и быстрый) окислитель HNO 2 + H+ + e- = NO + H 2 O E 0 = +1, 00 B HNO 2 + H+ = NO+ + H 2 O (нитрозоний катион) Окисляется Mn. O 4 -, Cr 2 O 72 - до NO 3 -
Кислородные соединения N+3 N 2 O 3 – образует синию жидкость (Тпл= -100 о. С), в газе диссоциирует на NO и NO 2 NO + NO 2 + H 2 O = 2 HNO 2 (смесь газов 1: 1) NO + NO 2 +2 Na. OH = 2 Na. NO 2 + H 2 O HNO 2 – сильный (и быстрый) окислитель HNO 2 + H+ + e- = NO + H 2 O E 0 = +1, 00 B HNO 2 + H+ = NO+ + H 2 O (нитрозоний катион) Окисляется Mn. O 4 -, Cr 2 O 72 - до NO 3 -
 Кислородные соединения N+4 NO 2 – бурый, реакционноспособный, парамагнитный газ, ядовит N 2 O 4 – бесцветный, диамагнитный, Тпл=-11 о. С 2 NO 2 = N 2 O 4 (K = 0, 115 при 25 о. С) Cu + 4 HNO 3 конц = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O
Кислородные соединения N+4 NO 2 – бурый, реакционноспособный, парамагнитный газ, ядовит N 2 O 4 – бесцветный, диамагнитный, Тпл=-11 о. С 2 NO 2 = N 2 O 4 (K = 0, 115 при 25 о. С) Cu + 4 HNO 3 конц = Cu(NO 3)2 + 2 NO 2 + 2 H 2 O
 Кислородные соединения N+4 Диспропорционирование: 2 NO 2 + H 2 O = HNO 3 + HNO 2 (на холоду) 3 NO 2 + H 2 O = 2 HNO 3 + NO (при Т) 2 NO 2 + 2 OH- = NO 3 - + NO 2 - + H 2 O (p. H 7) 3 HNO 2 = NO 3 - + 2 NO (p. H<7)
Кислородные соединения N+4 Диспропорционирование: 2 NO 2 + H 2 O = HNO 3 + HNO 2 (на холоду) 3 NO 2 + H 2 O = 2 HNO 3 + NO (при Т) 2 NO 2 + 2 OH- = NO 3 - + NO 2 - + H 2 O (p. H 7) 3 HNO 2 = NO 3 - + 2 NO (p. H<7)
![Кислородные соединения N+5 N 2 O 5 – б/ц тв. , неустойчив, [NO 2]+[NO Кислородные соединения N+5 N 2 O 5 – б/ц тв. , неустойчив, [NO 2]+[NO](https://present5.com/presentation/35372537_156360255/image-20.jpg) Кислородные соединения N+5 N 2 O 5 – б/ц тв. , неустойчив, [NO 2]+[NO 3]-, в газе O 2 N-O-NO 2, окислитель сильный 2 HNO 3 конц + P 2 O 5 = 2 HPO 3 + N 2 O 5 HNO 3 – сильный окислитель Нитраты – сильные окислители в расплавах
Кислородные соединения N+5 N 2 O 5 – б/ц тв. , неустойчив, [NO 2]+[NO 3]-, в газе O 2 N-O-NO 2, окислитель сильный 2 HNO 3 конц + P 2 O 5 = 2 HPO 3 + N 2 O 5 HNO 3 – сильный окислитель Нитраты – сильные окислители в расплавах
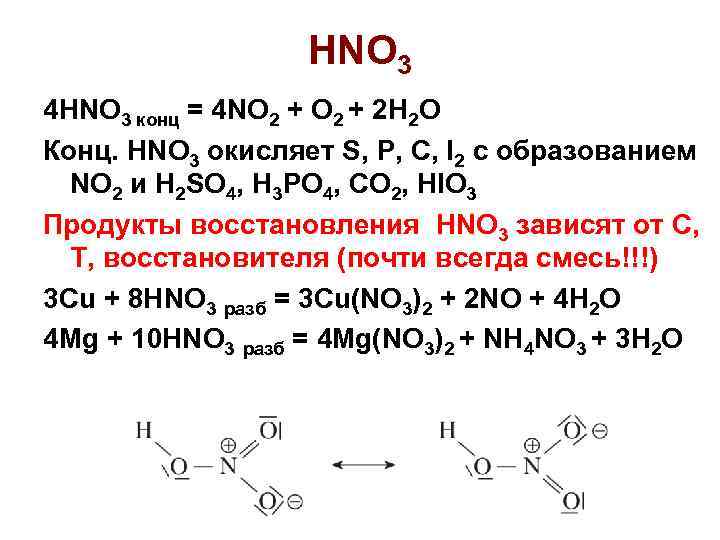 HNO 3 4 HNO 3 конц = 4 NO 2 + 2 H 2 O Конц. HNO 3 окисляет S, P, C, I 2 c образованием NO 2 и H 2 SO 4, H 3 PO 4, CO 2, HIO 3 Продукты восстановления HNO 3 зависят от C, T, восстановителя (почти всегда смесь!!!) 3 Cu + 8 HNO 3 разб = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O 4 Mg + 10 HNO 3 разб = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O
HNO 3 4 HNO 3 конц = 4 NO 2 + 2 H 2 O Конц. HNO 3 окисляет S, P, C, I 2 c образованием NO 2 и H 2 SO 4, H 3 PO 4, CO 2, HIO 3 Продукты восстановления HNO 3 зависят от C, T, восстановителя (почти всегда смесь!!!) 3 Cu + 8 HNO 3 разб = 3 Cu(NO 3)2 + 2 NO + 4 H 2 O 4 Mg + 10 HNO 3 разб = 4 Mg(NO 3)2 + NH 4 NO 3 + 3 H 2 O
 Разложение нитратов при T • NH 4 NO 3 = N 2 O + 2 H 2 O • Na. NO 3 = Na. NO 2 + 1/2 O 2 (Щ. и ЩЗ металлы) • Pb(NO 3)2 = Pb. O + 2 NO 2 + 1/2 O 2 (до H 2 в ЭРНМ) • Ag. NO 3 = Ag + NO 2 + 1/2 O 2 (после H 2 в ЭРНМ)
Разложение нитратов при T • NH 4 NO 3 = N 2 O + 2 H 2 O • Na. NO 3 = Na. NO 2 + 1/2 O 2 (Щ. и ЩЗ металлы) • Pb(NO 3)2 = Pb. O + 2 NO 2 + 1/2 O 2 (до H 2 в ЭРНМ) • Ag. NO 3 = Ag + NO 2 + 1/2 O 2 (после H 2 в ЭРНМ)
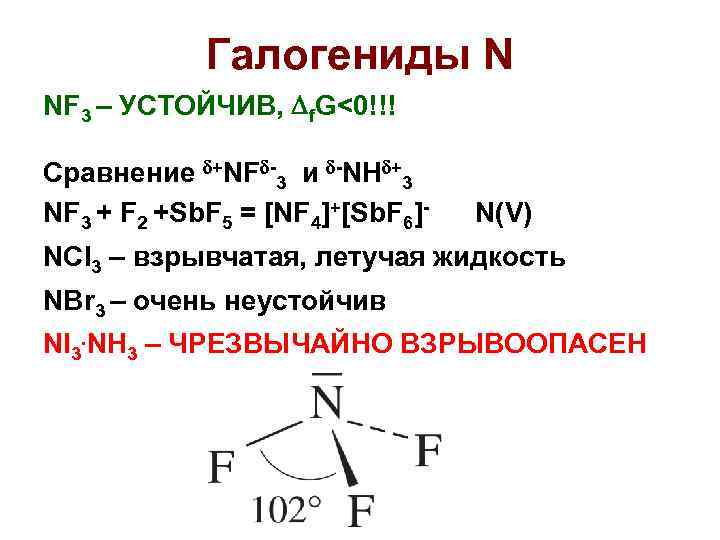 Галогениды N NF 3 – УСТОЙЧИВ, f. G<0!!! Сравнение +NF -3 и -NH +3 NF 3 + F 2 +Sb. F 5 = [NF 4]+[Sb. F 6]- N(V) NCl 3 – взрывчатая, летучая жидкость NBr 3 – очень неустойчив NI 3. NH 3 – ЧРЕЗВЫЧАЙНО ВЗРЫВООПАСЕН
Галогениды N NF 3 – УСТОЙЧИВ, f. G<0!!! Сравнение +NF -3 и -NH +3 NF 3 + F 2 +Sb. F 5 = [NF 4]+[Sb. F 6]- N(V) NCl 3 – взрывчатая, летучая жидкость NBr 3 – очень неустойчив NI 3. NH 3 – ЧРЕЗВЫЧАЙНО ВЗРЫВООПАСЕН
 N и P • Химия N и P резко отличаются • N в высших степенях окисления – сильные окислители, P – нет • N - 4 -ковалентный (октет), P – 5 ковалентный • Простые вещества: N 2 (тройная связь), P 4 - одинарные связи
N и P • Химия N и P резко отличаются • N в высших степенях окисления – сильные окислители, P – нет • N - 4 -ковалентный (октет), P – 5 ковалентный • Простые вещества: N 2 (тройная связь), P 4 - одинарные связи
 Э = P, As, Sb, Bi • Возрастание металлических свойств • Увеличение окислительных свойств P 5+ Bi 5+; соединения Bi 5+ - сильные окислители • Увеличение восстановит. свойств N 3 - Bi 3 -
Э = P, As, Sb, Bi • Возрастание металлических свойств • Увеличение окислительных свойств P 5+ Bi 5+; соединения Bi 5+ - сильные окислители • Увеличение восстановит. свойств N 3 - Bi 3 -
 Получение Р, As, Sb, Bi Ca 3(PO 4)2 + 5 C + 3 Si. O 2 = 1/2 P 4 +3 Ca. Si. O 3 (1500 o. C) 2 Э 2 S 3 + 9 O 2 = 2 Э 2 O 3 + 6 SO 2 Э 2 O 3 + 3 C = 3 CO + 2 Э
Получение Р, As, Sb, Bi Ca 3(PO 4)2 + 5 C + 3 Si. O 2 = 1/2 P 4 +3 Ca. Si. O 3 (1500 o. C) 2 Э 2 S 3 + 9 O 2 = 2 Э 2 O 3 + 6 SO 2 Э 2 O 3 + 3 C = 3 CO + 2 Э
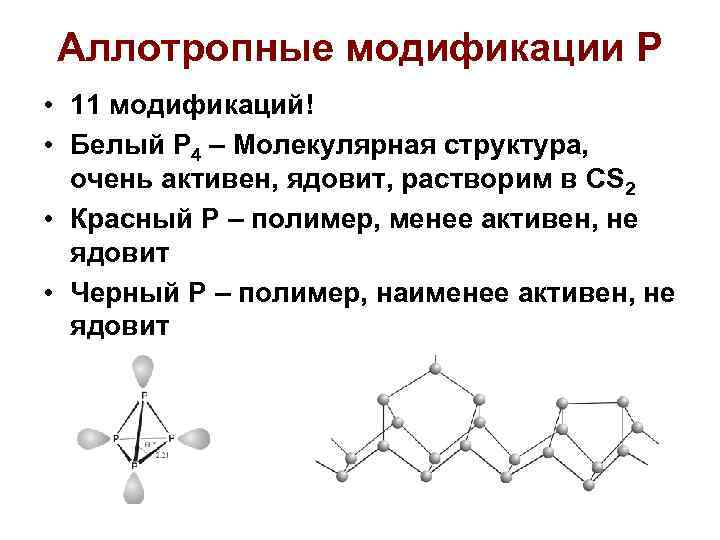 Аллотропные модификации Р • 11 модификаций! • Белый Р 4 – Молекулярная структура, очень активен, ядовит, растворим в CS 2 • Красный Р – полимер, менее активен, не ядовит • Черный Р – полимер, наименее активен, не ядовит
Аллотропные модификации Р • 11 модификаций! • Белый Р 4 – Молекулярная структура, очень активен, ядовит, растворим в CS 2 • Красный Р – полимер, менее активен, не ядовит • Черный Р – полимер, наименее активен, не ядовит
 Аллотропные модификации As, Sb, Bi • Желтый As 4 – молекулярная структура, очень активен, ядовит, растворим в CS 2; Серый As. • Металлическая модификация Sb; в парах Sb 4; известны желтая, черная. • Металлическая модификация Bi (рисунки)
Аллотропные модификации As, Sb, Bi • Желтый As 4 – молекулярная структура, очень активен, ядовит, растворим в CS 2; Серый As. • Металлическая модификация Sb; в парах Sb 4; известны желтая, черная. • Металлическая модификация Bi (рисунки)
 Свойства Р, As, Sb, Bi • Реакции с кислородом: P образует P 4 O 6 и P 4 O 10, остальные Э 2 О 3 (Э 4 О 6 в газе). • Реакции с хлором: P, As, Sb образует ЭCl 3 и ЭCl 5, Bi – Bi. Cl 3. As. Cl 5 и Sb. Cl 5 при нагревании разлагаются. • Реакции с щелочами (только P): P 4 + 3 KOHконц +3 H 2 O = 3 KH 2 PO 2 + PH 3 (при Т) • Реакции с кислотами окислителями: Э + 5 HNO 3 конц = H 3 ЭO 4 + 5 NO 2 + H 2 O(Э = P, As, Sb) 2 Sb + 6 H 2 SO 4 конц = Sb 2(SO 4)3 + 3 SO 2 +6 H 2 O Bi +4 HNO 3 = Bi(NO 3)3 + NO + 2 H 2 O
Свойства Р, As, Sb, Bi • Реакции с кислородом: P образует P 4 O 6 и P 4 O 10, остальные Э 2 О 3 (Э 4 О 6 в газе). • Реакции с хлором: P, As, Sb образует ЭCl 3 и ЭCl 5, Bi – Bi. Cl 3. As. Cl 5 и Sb. Cl 5 при нагревании разлагаются. • Реакции с щелочами (только P): P 4 + 3 KOHконц +3 H 2 O = 3 KH 2 PO 2 + PH 3 (при Т) • Реакции с кислотами окислителями: Э + 5 HNO 3 конц = H 3 ЭO 4 + 5 NO 2 + H 2 O(Э = P, As, Sb) 2 Sb + 6 H 2 SO 4 конц = Sb 2(SO 4)3 + 3 SO 2 +6 H 2 O Bi +4 HNO 3 = Bi(NO 3)3 + NO + 2 H 2 O
 Соединения с водородом • Названия: PH 3 – фосфин, Ca 3 P 2 – фосфид • 2 Э + 3 Ca = Ca 3 Э 2 (Э = P, As, Sb) Ca 3 Э 2 +3 H 2 O = 3 Ca(OH)2 +2 ЭH 3 Устойчивость в ряду PH 3 Bi. H 3 резко уменьшается, резко возрастают восстановительные св-ва Криминалистика: As 2 O 3 + 6 Zn + 6 H 2 SO 4 = 6 Zn. SO 4 + 2 As. H 3 + 3 H 2 O 2 As. H 3 = 3 H 2 + 2 As (600 о. С, блестящий налет)
Соединения с водородом • Названия: PH 3 – фосфин, Ca 3 P 2 – фосфид • 2 Э + 3 Ca = Ca 3 Э 2 (Э = P, As, Sb) Ca 3 Э 2 +3 H 2 O = 3 Ca(OH)2 +2 ЭH 3 Устойчивость в ряду PH 3 Bi. H 3 резко уменьшается, резко возрастают восстановительные св-ва Криминалистика: As 2 O 3 + 6 Zn + 6 H 2 SO 4 = 6 Zn. SO 4 + 2 As. H 3 + 3 H 2 O 2 As. H 3 = 3 H 2 + 2 As (600 о. С, блестящий налет)
 Соединения с водородом • Отсутствие донорных св-в в водных р-рах: PH 3 г + HI г = [PH 4]+IPH 4 I = PH 3 + HI (в H 2 O) Но R 3 Э (Э = P, As, Sb; R – алкилы или арилы) – являются донорами [Cl. Au. PPh 3], [Pt(PPh 3)2 Cl 2], [Pt(PPh 3)4] Стабилизируют низкие степени окисления
Соединения с водородом • Отсутствие донорных св-в в водных р-рах: PH 3 г + HI г = [PH 4]+IPH 4 I = PH 3 + HI (в H 2 O) Но R 3 Э (Э = P, As, Sb; R – алкилы или арилы) – являются донорами [Cl. Au. PPh 3], [Pt(PPh 3)2 Cl 2], [Pt(PPh 3)4] Стабилизируют низкие степени окисления
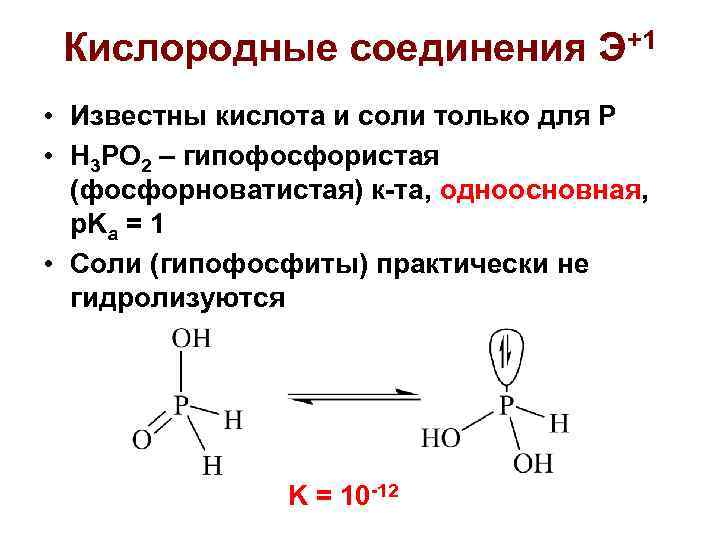 Кислородные соединения Э+1 • Известны кислота и соли только для Р • H 3 PO 2 – гипофосфористая (фосфорноватистая) к-та, одноосновная, p. Ka = 1 • Соли (гипофосфиты) практически не гидролизуются K = 10 -12
Кислородные соединения Э+1 • Известны кислота и соли только для Р • H 3 PO 2 – гипофосфористая (фосфорноватистая) к-та, одноосновная, p. Ka = 1 • Соли (гипофосфиты) практически не гидролизуются K = 10 -12
 Кислородные соединения Э+1 • Получение: 8 Pбелый +3 Ba(OH)2 + 6 H 2 O = 2 PH 3 + 3 Ba(H 2 PO 2)2 + H 2 SO 4 = Ba. SO 4↓ + 2 H 3 PO 2 • УДОБНЫЕ ВОССТАНОВИТЕЛИ Na. H 2 PO 2 +4 Ag. NO 3 +2 H 2 O = Na. H 2 PO 4+4 Ag +4 HNO 3
Кислородные соединения Э+1 • Получение: 8 Pбелый +3 Ba(OH)2 + 6 H 2 O = 2 PH 3 + 3 Ba(H 2 PO 2)2 + H 2 SO 4 = Ba. SO 4↓ + 2 H 3 PO 2 • УДОБНЫЕ ВОССТАНОВИТЕЛИ Na. H 2 PO 2 +4 Ag. NO 3 +2 H 2 O = Na. H 2 PO 4+4 Ag +4 HNO 3
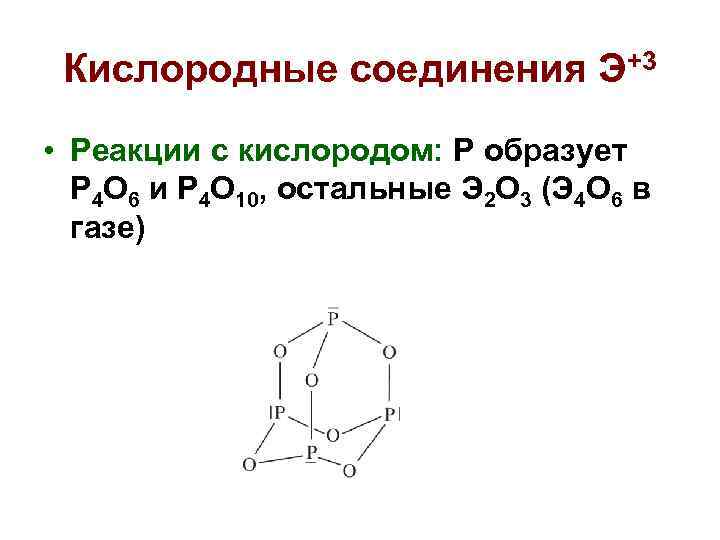 Кислородные соединения Э+3 • Реакции с кислородом: P образует P 4 O 6 и P 4 O 10, остальные Э 2 О 3 (Э 4 О 6 в газе)
Кислородные соединения Э+3 • Реакции с кислородом: P образует P 4 O 6 и P 4 O 10, остальные Э 2 О 3 (Э 4 О 6 в газе)
 Кислородные соединения Э+3 P 4 O 6 Sb 2 O 3 Bi 2 O 3 Св-ва Р-м, кисл. м/р, амф. н/р, осн. К-ты HAs. O 2, H 3 As. O 3 Sb(OH)3= Sb 2 O 3 x. H 2 O Bi(OH)3 As. Cl 3 Na. As. O 2 арсенит Sb. Cl 3, Bi. Cl 3 Na 3[Sb(OH)6] H 3 PO 2 Соли Na 2 HPO 3 фосфит As 2 O 3
Кислородные соединения Э+3 P 4 O 6 Sb 2 O 3 Bi 2 O 3 Св-ва Р-м, кисл. м/р, амф. н/р, осн. К-ты HAs. O 2, H 3 As. O 3 Sb(OH)3= Sb 2 O 3 x. H 2 O Bi(OH)3 As. Cl 3 Na. As. O 2 арсенит Sb. Cl 3, Bi. Cl 3 Na 3[Sb(OH)6] H 3 PO 2 Соли Na 2 HPO 3 фосфит As 2 O 3
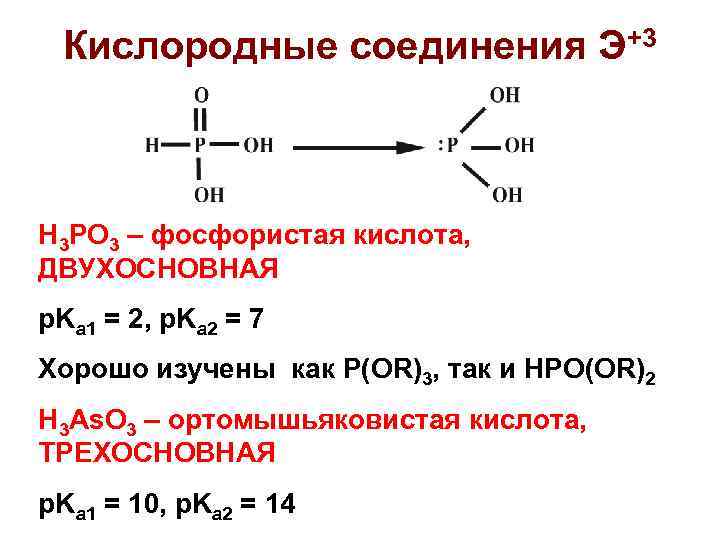 Кислородные соединения Э+3 H 3 PO 3 – фосфористая кислота, ДВУХОСНОВНАЯ p. Ka 1 = 2, p. Ka 2 = 7 Хорошо изучены как P(OR)3, так и HPO(OR)2 H 3 As. O 3 – ортомышьяковистая кислота, ТРЕХОСНОВНАЯ p. Ka 1 = 10, p. Ka 2 = 14
Кислородные соединения Э+3 H 3 PO 3 – фосфористая кислота, ДВУХОСНОВНАЯ p. Ka 1 = 2, p. Ka 2 = 7 Хорошо изучены как P(OR)3, так и HPO(OR)2 H 3 As. O 3 – ортомышьяковистая кислота, ТРЕХОСНОВНАЯ p. Ka 1 = 10, p. Ka 2 = 14
 Ox/red св-ва кислородных соединений Э+3 • Диспропорционирование H 3 PO 3 4 H 3 PO 3 = 3 H 3 PO 4 + PH 3 (при Т) • В кислой среде H 3 PO 3 восстановитель H 3 PO 3 + 2 Ag. NO 3 + H 2 O = H 3 PO 4 +2 Ag +2 HNO 3 • В щелочной среде Bi 3+ может быть окислен или восстановлен Bi(OH)3 + Cl 2 +3 KOH = KBi. O 3 + 2 KCl +3 H 2 O 2 Bi(OH)3 + 3[Sn(OH)4]2 - = 2 Bi + 3[Sn(OH)6]2 • В кислой среде Bi 3+ может быть восстановлен (но не окислен!) 2 Bi. Cl 3 + 3 Zn = 2 Bi + 3 Zn. Cl 2 (в среде HCl)
Ox/red св-ва кислородных соединений Э+3 • Диспропорционирование H 3 PO 3 4 H 3 PO 3 = 3 H 3 PO 4 + PH 3 (при Т) • В кислой среде H 3 PO 3 восстановитель H 3 PO 3 + 2 Ag. NO 3 + H 2 O = H 3 PO 4 +2 Ag +2 HNO 3 • В щелочной среде Bi 3+ может быть окислен или восстановлен Bi(OH)3 + Cl 2 +3 KOH = KBi. O 3 + 2 KCl +3 H 2 O 2 Bi(OH)3 + 3[Sn(OH)4]2 - = 2 Bi + 3[Sn(OH)6]2 • В кислой среде Bi 3+ может быть восстановлен (но не окислен!) 2 Bi. Cl 3 + 3 Zn = 2 Bi + 3 Zn. Cl 2 (в среде HCl)
 Кислородные соединения Э+5 P 4 O 10 As 2 O 5 Sb 2 O 5 Bi 2 O 5? Св-ва Р-м н/р К-ты H 3 PO 4 HAs. O 3 H 3 As. O 4 Sb 2 O 3. x. H 2 O нет Соли Na 3 PO 4 Na 3 As. O 4 Na 3 Sb. O 4 - орто Na. PO 3 Na. As. O 3 Na 2 Sb 2 O 7 - пиро Na. Sb. O 3 - мета Na. Bi. O 3
Кислородные соединения Э+5 P 4 O 10 As 2 O 5 Sb 2 O 5 Bi 2 O 5? Св-ва Р-м н/р К-ты H 3 PO 4 HAs. O 3 H 3 As. O 4 Sb 2 O 3. x. H 2 O нет Соли Na 3 PO 4 Na 3 As. O 4 Na 3 Sb. O 4 - орто Na. PO 3 Na. As. O 3 Na 2 Sb 2 O 7 - пиро Na. Sb. O 3 - мета Na. Bi. O 3
 Получение кислот Э+5 • P 4 O 10 + 6 H 2 O = 4 H 3 PO 4 • ЭCl 5 + 4 H 2 O = H 3 ЭO 4 + 5 HCl (Э=P, As, Sb) • Э + 5 HNO 3 конц = H 3 ЭO 4 + 5 NO 2 +H 2 O Bi + 6 HNO 3 конц = Bi(NO 3)3 + 3 NO 2 + 3 H 2 O
Получение кислот Э+5 • P 4 O 10 + 6 H 2 O = 4 H 3 PO 4 • ЭCl 5 + 4 H 2 O = H 3 ЭO 4 + 5 HCl (Э=P, As, Sb) • Э + 5 HNO 3 конц = H 3 ЭO 4 + 5 NO 2 +H 2 O Bi + 6 HNO 3 конц = Bi(NO 3)3 + 3 NO 2 + 3 H 2 O
 Ox свойства +5 Э • Соли Bi. O 3 - можно получить только в сильнощелочной среде, в кислой среде Bi. O 3 ОЧЕНЬ СИЛЬНЫЙ ОКИСЛИТЕЛЬ 2 KBi. O 3 + 4 H 2 SO 4 =Bi 2(SO 4)3 + O 2 + K 2 SO 4 + 4 H 2 O • Cоединения P 5+ не являтся окислителями • As 5+ и Sb 5+ слабые окислители и только в кислой среде H 3 As. O 4 + 2 HI = I 2 + HAs. O 2 + 2 H 2 O H 3 Sb. O 4 + 5 HClконц = Sb. Cl 3 + Cl 2 + 4 H 2 O Но в щелочной среде: I 2 + Na. As. O 2 + 4 Na. OH = Na 3 As. O 4 + 2 Na. I + 2 H 2 O
Ox свойства +5 Э • Соли Bi. O 3 - можно получить только в сильнощелочной среде, в кислой среде Bi. O 3 ОЧЕНЬ СИЛЬНЫЙ ОКИСЛИТЕЛЬ 2 KBi. O 3 + 4 H 2 SO 4 =Bi 2(SO 4)3 + O 2 + K 2 SO 4 + 4 H 2 O • Cоединения P 5+ не являтся окислителями • As 5+ и Sb 5+ слабые окислители и только в кислой среде H 3 As. O 4 + 2 HI = I 2 + HAs. O 2 + 2 H 2 O H 3 Sb. O 4 + 5 HClконц = Sb. Cl 3 + Cl 2 + 4 H 2 O Но в щелочной среде: I 2 + Na. As. O 2 + 4 Na. OH = Na 3 As. O 4 + 2 Na. I + 2 H 2 O
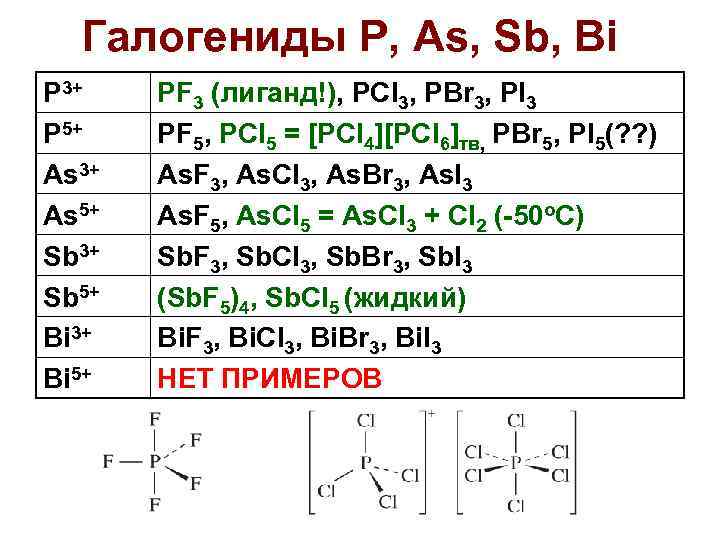 Галогениды P, As, Sb, Bi P 3+ P 5+ As 3+ As 5+ Sb 3+ Sb 5+ Bi 3+ Bi 5+ PF 3 (лиганд!), PCl 3, PBr 3, PI 3 PF 5, PCl 5 = [PCl 4][PCl 6]тв, PBr 5, PI 5(? ? ) As. F 3, As. Cl 3, As. Br 3, As. I 3 As. F 5, As. Cl 5 = As. Cl 3 + Cl 2 (-50 o. C) Sb. F 3, Sb. Cl 3, Sb. Br 3, Sb. I 3 (Sb. F 5)4, Sb. Cl 5 (жидкий) Bi. F 3, Bi. Cl 3, Bi. Br 3, Bi. I 3 НЕТ ПРИМЕРОВ
Галогениды P, As, Sb, Bi P 3+ P 5+ As 3+ As 5+ Sb 3+ Sb 5+ Bi 3+ Bi 5+ PF 3 (лиганд!), PCl 3, PBr 3, PI 3 PF 5, PCl 5 = [PCl 4][PCl 6]тв, PBr 5, PI 5(? ? ) As. F 3, As. Cl 3, As. Br 3, As. I 3 As. F 5, As. Cl 5 = As. Cl 3 + Cl 2 (-50 o. C) Sb. F 3, Sb. Cl 3, Sb. Br 3, Sb. I 3 (Sb. F 5)4, Sb. Cl 5 (жидкий) Bi. F 3, Bi. Cl 3, Bi. Br 3, Bi. I 3 НЕТ ПРИМЕРОВ
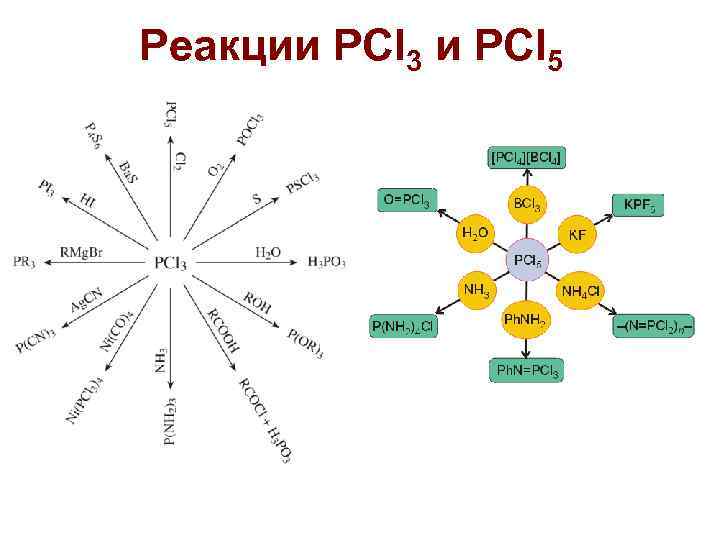 Реакции PCl 3 и PCl 5
Реакции PCl 3 и PCl 5
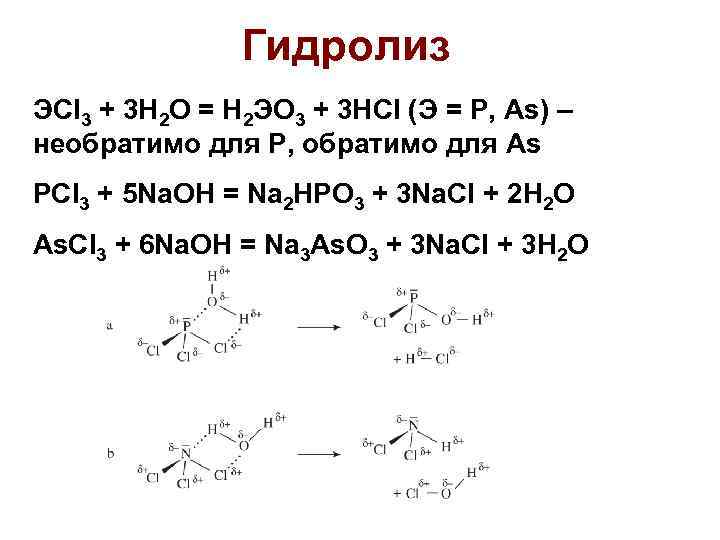 Гидролиз ЭCl 3 + 3 H 2 O = H 2 ЭO 3 + 3 HCl (Э = P, As) – необратимо для Р, обратимо для As PCl 3 + 5 Na. OH = Na 2 HPO 3 + 3 Na. Cl + 2 H 2 O As. Cl 3 + 6 Na. OH = Na 3 As. O 3 + 3 Na. Cl + 3 H 2 O
Гидролиз ЭCl 3 + 3 H 2 O = H 2 ЭO 3 + 3 HCl (Э = P, As) – необратимо для Р, обратимо для As PCl 3 + 5 Na. OH = Na 2 HPO 3 + 3 Na. Cl + 2 H 2 O As. Cl 3 + 6 Na. OH = Na 3 As. O 3 + 3 Na. Cl + 3 H 2 O
 Гидролиз 1) ЭCl 3 + H 2 O = Э(OH)Сl 2 + HCl Э(OH)Сl 2 + H 2 O = Э(OH)2 Сl + HCl Э(OH)2 Сl = H 2 O + (ЭО)Cl – соли стибила и висмутила 2) 2 Sb. Cl 3 + 3 Na 2 CO 3 + 3 H 2 O = 2 Sb(OH)3↓+ 3 CO 2 + 6 Na. Cl Sb. Cl 3 + 6 Na. OHизбыток = Na 3[Sb(OH)6] + 3 Na. Cl 3) Bi. Cl 3 + 3 Na. OH = Bi(OH)3↓ Bi(III) в кислых растворах [Bi 6(OH)12]6+
Гидролиз 1) ЭCl 3 + H 2 O = Э(OH)Сl 2 + HCl Э(OH)Сl 2 + H 2 O = Э(OH)2 Сl + HCl Э(OH)2 Сl = H 2 O + (ЭО)Cl – соли стибила и висмутила 2) 2 Sb. Cl 3 + 3 Na 2 CO 3 + 3 H 2 O = 2 Sb(OH)3↓+ 3 CO 2 + 6 Na. Cl Sb. Cl 3 + 6 Na. OHизбыток = Na 3[Sb(OH)6] + 3 Na. Cl 3) Bi. Cl 3 + 3 Na. OH = Bi(OH)3↓ Bi(III) в кислых растворах [Bi 6(OH)12]6+
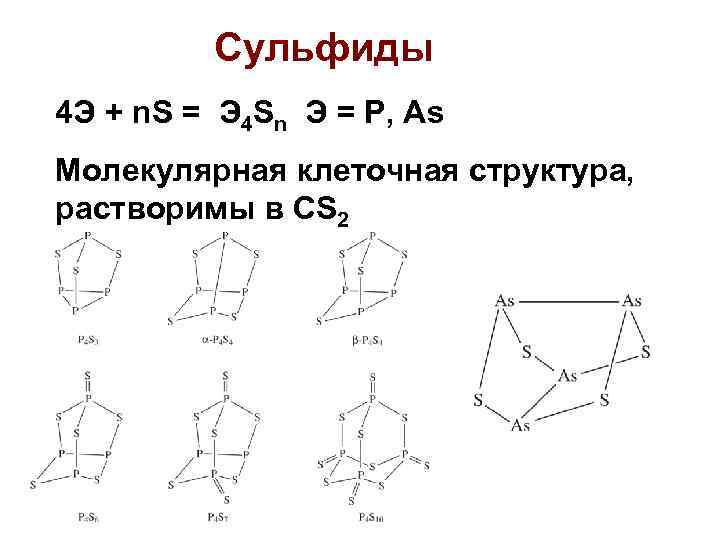 Сульфиды 4 Э + n. S = Э 4 Sn Э = P, As Молекулярная клеточная структура, растворимы в CS 2
Сульфиды 4 Э + n. S = Э 4 Sn Э = P, As Молекулярная клеточная структура, растворимы в CS 2
 Сульфиды • 2 ЭCl 3 + 3 H 2 S = Э 2 S 3↓ + 6 HCl (в р-ре HCl) Э = As, Sb, Bi • 2 ЭCl 5 + 5 H 2 S = Э 2 S 5↓ + 10 HCl (в р-ре HCl) Э = As, Sb (Bi 2 S 5 не существует) As 2 S 3, As 2 S 5 – желтые Sb 2 S 3, Sb 2 S 5 – оранжевые Bi 2 S 3 -черный
Сульфиды • 2 ЭCl 3 + 3 H 2 S = Э 2 S 3↓ + 6 HCl (в р-ре HCl) Э = As, Sb, Bi • 2 ЭCl 5 + 5 H 2 S = Э 2 S 5↓ + 10 HCl (в р-ре HCl) Э = As, Sb (Bi 2 S 5 не существует) As 2 S 3, As 2 S 5 – желтые Sb 2 S 3, Sb 2 S 5 – оранжевые Bi 2 S 3 -черный
 Сульфиды Ок-д. осн. Bi 2 O 3 Сульф. осн. Ок-д. кисл. Bi 2 S 3 P 2 O 5, As 2 O 3, As 2 O 5, Sb 2 O 5 Сульф. кис. P 2 S 5, As 2 S 3, As 2 S 5, Sb 2 S 5 Ок-д. амф. Sb 2 O 3 Сульф. амф Sb 2 S 3 1) As 2 O 3 тв + Na 2 O тв = 2 Na. As. O 2 - арсенит As 2 S 3 тв + Na 2 S р-р = 2 Na. As. S 2 - тиоарсенит 2) Bi 2 O 3 тв + Na 2 O тв = нет реакции Bi 2 S 3 тв + Na 2 S р-р = нет реакции
Сульфиды Ок-д. осн. Bi 2 O 3 Сульф. осн. Ок-д. кисл. Bi 2 S 3 P 2 O 5, As 2 O 3, As 2 O 5, Sb 2 O 5 Сульф. кис. P 2 S 5, As 2 S 3, As 2 S 5, Sb 2 S 5 Ок-д. амф. Sb 2 O 3 Сульф. амф Sb 2 S 3 1) As 2 O 3 тв + Na 2 O тв = 2 Na. As. O 2 - арсенит As 2 S 3 тв + Na 2 S р-р = 2 Na. As. S 2 - тиоарсенит 2) Bi 2 O 3 тв + Na 2 O тв = нет реакции Bi 2 S 3 тв + Na 2 S р-р = нет реакции
 Тиосоли • Э 3+ (Э = P, As, Sb): Na. ЭS 2 и Na 3 ЭS 3 • Э 5+ (Э = P, As, Sb): Na. ЭS 3 и Na 3 ЭS 4 • Получение сплавлением 3 Na + P + 3 S = Na 3 PS 3 3 Na + P + 4 S = Na 3 PS 4 • Получение в растворе Э 2 S 3↓+ Na 2 S = 2 Na. ЭS 2 Э 2 S 5↓+ Na 2 S = 2 Na. ЭS 3 Э 2 S 3↓+ Na 2 S 2 = 2 Na. ЭS 3 + 2 S • Реакции с кислотами Na. As. S 2 + HCl = As 2 S 3↓ + H 2 S + Na. Cl As 2 S 3 + 28 HNO 3 конц = 2 H 3 As. O 4 + 3 H 2 SO 4 +28 NO 2 +8 H 2 O
Тиосоли • Э 3+ (Э = P, As, Sb): Na. ЭS 2 и Na 3 ЭS 3 • Э 5+ (Э = P, As, Sb): Na. ЭS 3 и Na 3 ЭS 4 • Получение сплавлением 3 Na + P + 3 S = Na 3 PS 3 3 Na + P + 4 S = Na 3 PS 4 • Получение в растворе Э 2 S 3↓+ Na 2 S = 2 Na. ЭS 2 Э 2 S 5↓+ Na 2 S = 2 Na. ЭS 3 Э 2 S 3↓+ Na 2 S 2 = 2 Na. ЭS 3 + 2 S • Реакции с кислотами Na. As. S 2 + HCl = As 2 S 3↓ + H 2 S + Na. Cl As 2 S 3 + 28 HNO 3 конц = 2 H 3 As. O 4 + 3 H 2 SO 4 +28 NO 2 +8 H 2 O


