1 Новые методы исследования в гистологии.ppt
- Количество слайдов: 41
 Новые методы исследования в гистологии
Новые методы исследования в гистологии
 Оглавление 1. Микроскопические методы исследования Ú Световая микроскопия Ú Люминесцентная м. Ú Иммунофлюорисцентная м. Ú Фазово-контрастная м. Ú Темнопольная м. Ú Стереоскопическая м. Ú Ультрафиолетовая м. Ú Поляризационная м. Ú Интерференционная м.
Оглавление 1. Микроскопические методы исследования Ú Световая микроскопия Ú Люминесцентная м. Ú Иммунофлюорисцентная м. Ú Фазово-контрастная м. Ú Темнопольная м. Ú Стереоскопическая м. Ú Ультрафиолетовая м. Ú Поляризационная м. Ú Интерференционная м.
 2. Электронная микроскопия. А) Трансмиссионная (изучение объектов на просвет) Б) Сканирующая (изучение поверхности объектов)
2. Электронная микроскопия. А) Трансмиссионная (изучение объектов на просвет) Б) Сканирующая (изучение поверхности объектов)
 3. Новые методы исследования в гистологии Ú Лазерная сканирующая (конфокальная) микроскопия. Ú Сканирующая зондовая микроскопия (СЗМ) Ú Принципы АСМ Ú А) Контактные методы Ú Метод постоянной силы Ú Б) Полуконтактные методы Ú Метод отображения фазы Ú В) Многопроходные методики Ú ЭСМ (Электросиловая Микроскопия) Ú Метод зоны Кельвина Ú Сканирующая емкостная микроскопия Ú СМСМ (Статическая Магнитно-Силовая Микроскопия) Ú Диссипативная Силовая Микроскопия Ú Принципы спектроскопии Ú А) Силовая спектроскопия Ú Отображение Адгезионных Сил
3. Новые методы исследования в гистологии Ú Лазерная сканирующая (конфокальная) микроскопия. Ú Сканирующая зондовая микроскопия (СЗМ) Ú Принципы АСМ Ú А) Контактные методы Ú Метод постоянной силы Ú Б) Полуконтактные методы Ú Метод отображения фазы Ú В) Многопроходные методики Ú ЭСМ (Электросиловая Микроскопия) Ú Метод зоны Кельвина Ú Сканирующая емкостная микроскопия Ú СМСМ (Статическая Магнитно-Силовая Микроскопия) Ú Диссипативная Силовая Микроскопия Ú Принципы спектроскопии Ú А) Силовая спектроскопия Ú Отображение Адгезионных Сил
 Световая микроскопия Ú. Разрешающая способность 0, 2 мкм. Ú do =1/2λ, где λ- длинна волны (для видимого спектра 400 -800 НМ). Ú Объективы х10, х20, х40, х90. Ú Окуляры х5, х10, х15 и т. д. Ú Общее увеличение в 1500 -2000 раз. Ú При этом используются объективы двух типов: сухие и иммерсионные
Световая микроскопия Ú. Разрешающая способность 0, 2 мкм. Ú do =1/2λ, где λ- длинна волны (для видимого спектра 400 -800 НМ). Ú Объективы х10, х20, х40, х90. Ú Окуляры х5, х10, х15 и т. д. Ú Общее увеличение в 1500 -2000 раз. Ú При этом используются объективы двух типов: сухие и иммерсионные
 Люминесцентные (МЛ-2, МЛ-3) Ú Позволяют изучать живые неокрашенные объекты. Изучая объекты в отраженном и проходящем УФ-свете, можно наблюдать компоненты клеток, обладающих собственной флюоресценцией. Прямое окрашивание люминесцентными красителями (флюорохромами), позволяет более четко выявить такие структуры клеток, которые трудно изучать в световом микроскопе. Ú -иммунофлюорисценция можно наблюдать реакцию АГ-АТ на уровне одной клетки.
Люминесцентные (МЛ-2, МЛ-3) Ú Позволяют изучать живые неокрашенные объекты. Изучая объекты в отраженном и проходящем УФ-свете, можно наблюдать компоненты клеток, обладающих собственной флюоресценцией. Прямое окрашивание люминесцентными красителями (флюорохромами), позволяет более четко выявить такие структуры клеток, которые трудно изучать в световом микроскопе. Ú -иммунофлюорисценция можно наблюдать реакцию АГ-АТ на уровне одной клетки.
 Фазово-контрастный микроскоп Ú Для изучения живых неокрашенных объектов. Ú При этом можно получить контрастные изображения прозрачных и бесцветных объектов, не видимых при обычных методах микроскопирования.
Фазово-контрастный микроскоп Ú Для изучения живых неокрашенных объектов. Ú При этом можно получить контрастные изображения прозрачных и бесцветных объектов, не видимых при обычных методах микроскопирования.
 Темнопольный микроскоп Ú Являясь разновидностью метода фазового контраста, дает негативное, по сравнению с позитивным фазовым контрастом изображение.
Темнопольный микроскоп Ú Являясь разновидностью метода фазового контраста, дает негативное, по сравнению с позитивным фазовым контрастом изображение.
 Ú Стереоскопические микроскопы дают прямое объемное изображение Ú Ультрафиолетовый микроскоп (повышает разрешающую способность м-па до 0, 1 мкм) Ú Поляризационный м. (для исследования объектов с упорядоченным расположением молекул - скелет. мускулатура, коллагеновые волокна и т. д. ) Ú Интерференционные м. (для опред. сухого остатка в клетках, определение толщины объектов)
Ú Стереоскопические микроскопы дают прямое объемное изображение Ú Ультрафиолетовый микроскоп (повышает разрешающую способность м-па до 0, 1 мкм) Ú Поляризационный м. (для исследования объектов с упорядоченным расположением молекул - скелет. мускулатура, коллагеновые волокна и т. д. ) Ú Интерференционные м. (для опред. сухого остатка в клетках, определение толщины объектов)
 Лазерная сканирующая (конфокальная) микроскопия. Преимущества
Лазерная сканирующая (конфокальная) микроскопия. Преимущества
 Преимущества 1. Позволяет резко повысить качество микроскопии при работе с “толстыми” срезами 2. Построение 3 -х мерной модели 3. Получение оптических срезов 4. Позволяет оценить подвижность белков в клетке и константы реакций, в которых участвуют эти белки.
Преимущества 1. Позволяет резко повысить качество микроскопии при работе с “толстыми” срезами 2. Построение 3 -х мерной модели 3. Получение оптических срезов 4. Позволяет оценить подвижность белков в клетке и константы реакций, в которых участвуют эти белки.
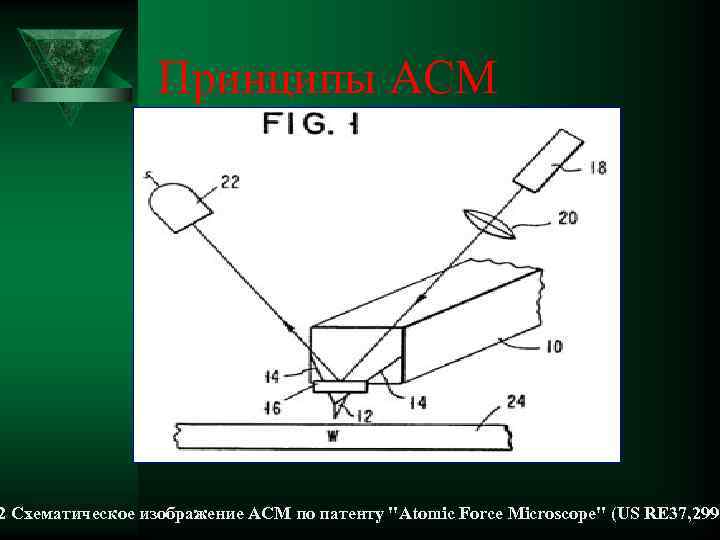 Принципы АСМ 2 Схематическое изображение АСМ по патенту "Atomic Force Microscope" (US RE 37, 299)
Принципы АСМ 2 Схематическое изображение АСМ по патенту "Atomic Force Microscope" (US RE 37, 299)
 СЗМ комплекс Рамановской спектроскопии Интегра Спектра
СЗМ комплекс Рамановской спектроскопии Интегра Спектра
 СЗМ комплекс для биологии Интегра Вита
СЗМ комплекс для биологии Интегра Вита
 СЗМ Solver PRO
СЗМ Solver PRO
 Клетка водоросли Mode: AСМ Рамановское (a), СЗМ ИНТЕГРА люминесцентное (b) модель: Спектра Размер АСМ (c) 26 x 31 µm скана:
Клетка водоросли Mode: AСМ Рамановское (a), СЗМ ИНТЕГРА люминесцентное (b) модель: Спектра Размер АСМ (c) 26 x 31 µm скана:
 Комплексы ДНК-авидин “Полуконтактный метод” Комплексы ДНК-авидин . на слюде. Короткие фрагменты ДНК молекулами биотина на их концах связаны с авидином
Комплексы ДНК-авидин “Полуконтактный метод” Комплексы ДНК-авидин . на слюде. Короткие фрагменты ДНК молекулами биотина на их концах связаны с авидином
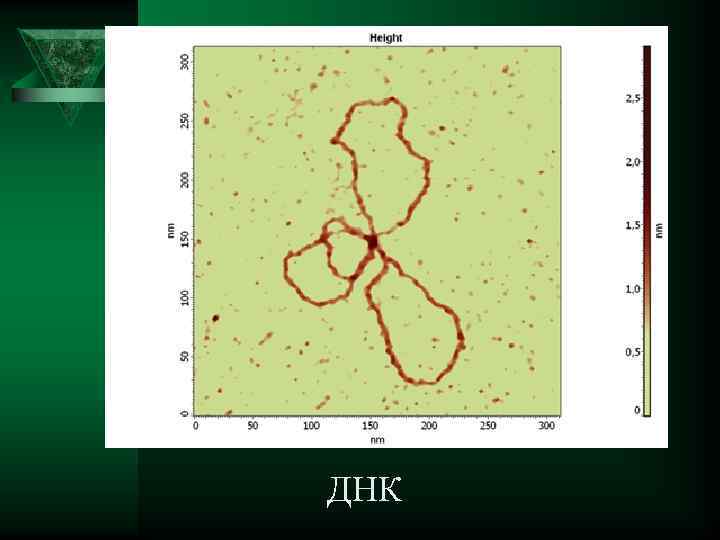 ДНК
ДНК
 Конденсированная ДНК
Конденсированная ДНК
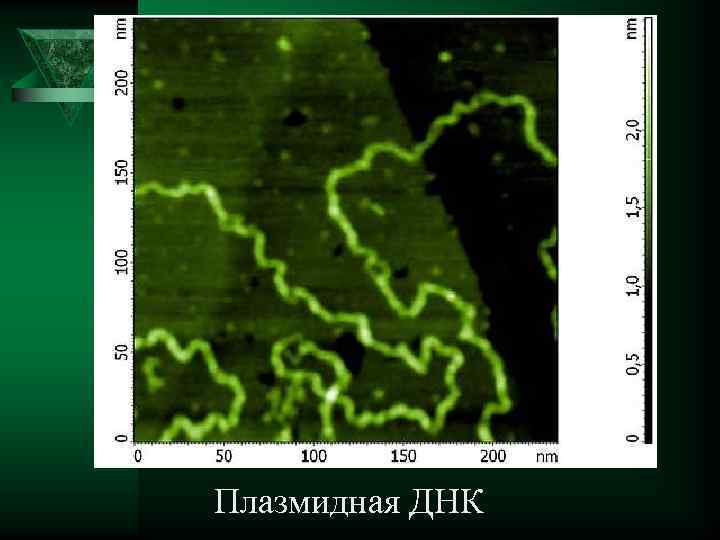 Плазмидная ДНК
Плазмидная ДНК
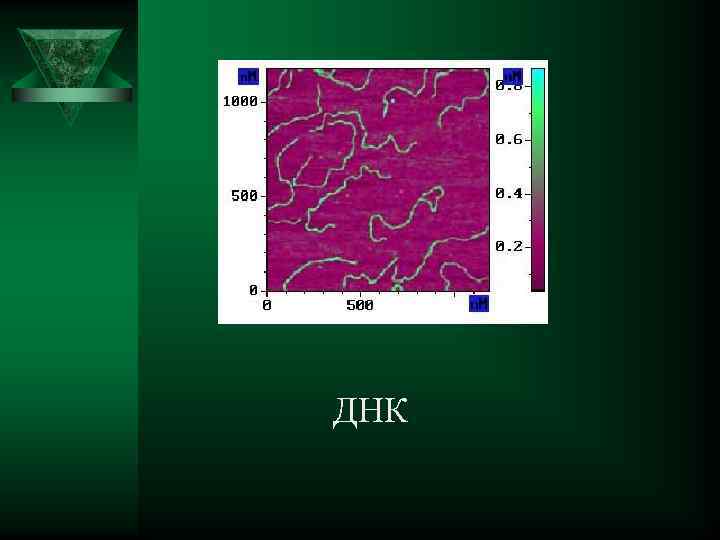 ДНК
ДНК
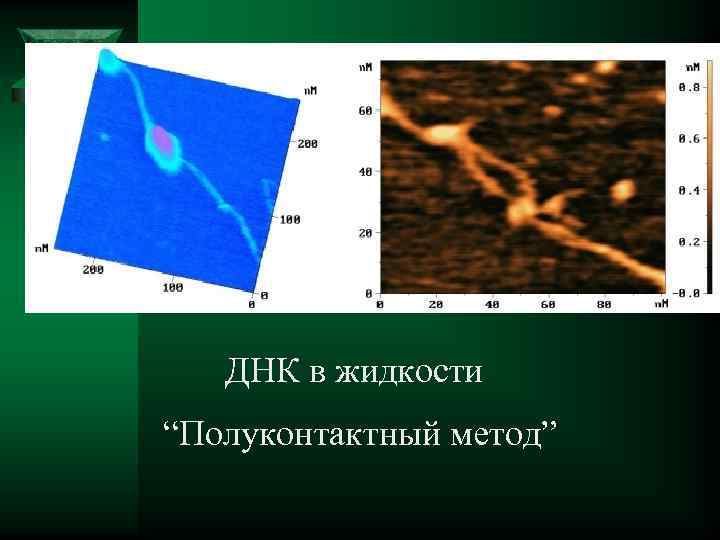 ДНК в жидкости “Полуконтактный метод”
ДНК в жидкости “Полуконтактный метод”
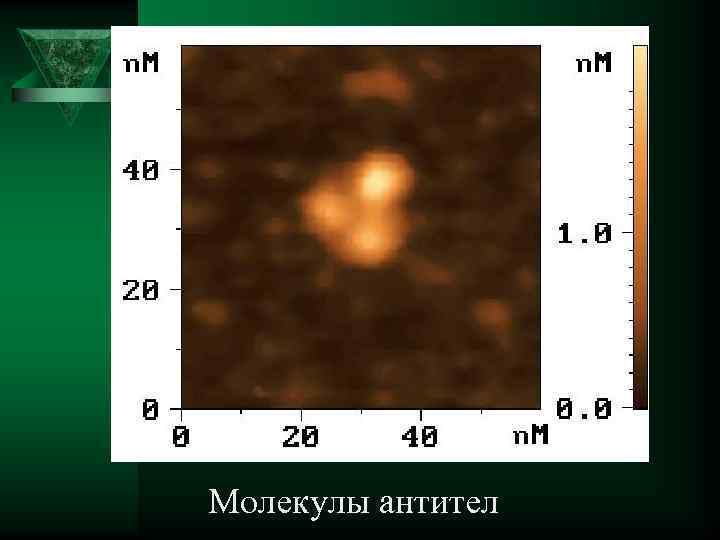 Молекулы антител
Молекулы антител
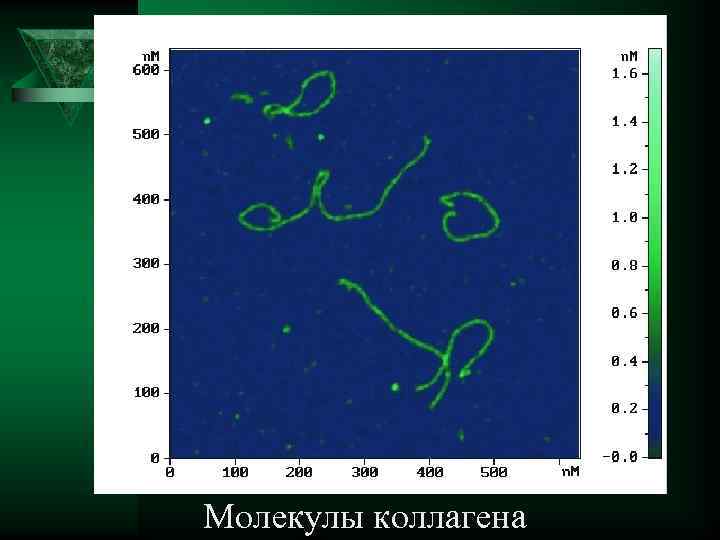 Молекулы коллагена
Молекулы коллагена
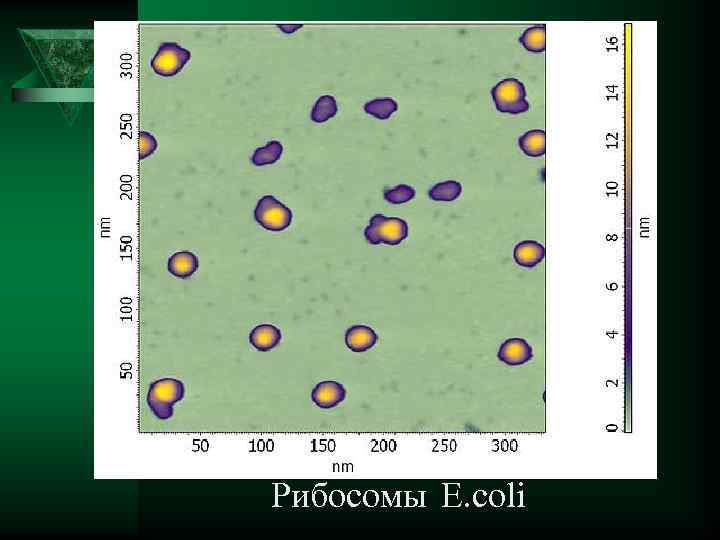 Рибосомы E. coli
Рибосомы E. coli
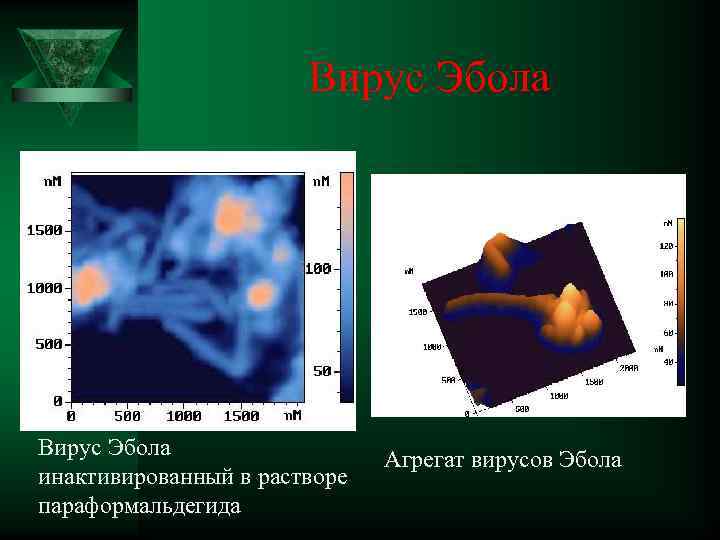 Вирус Эбола Ú Вирус Эбола инактивированный в растворе параформальдегида Вирус Эбола Агрегат вирусов Эбола инактивированный в растворе параформальдегида
Вирус Эбола Ú Вирус Эбола инактивированный в растворе параформальдегида Вирус Эбола Агрегат вирусов Эбола инактивированный в растворе параформальдегида
 Лимфоциты человеческой крови
Лимфоциты человеческой крови
 Human embryo fibroblast
Human embryo fibroblast
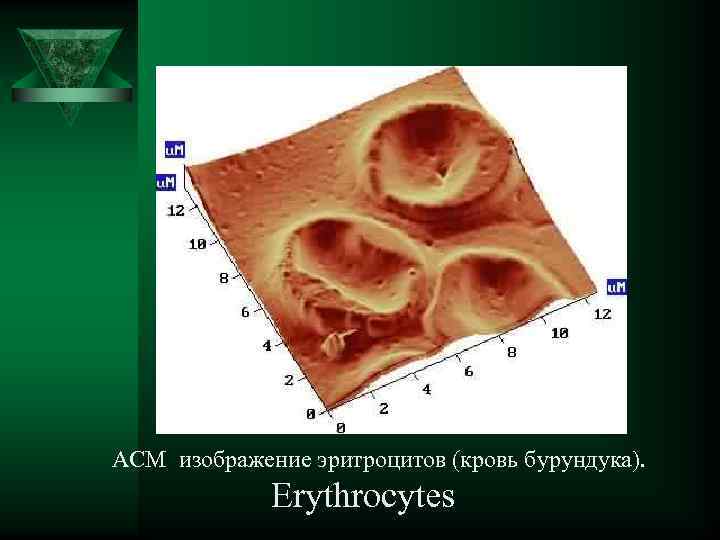 АСМ изображение эритроцитов (кровь бурундука). Erythrocytes
АСМ изображение эритроцитов (кровь бурундука). Erythrocytes
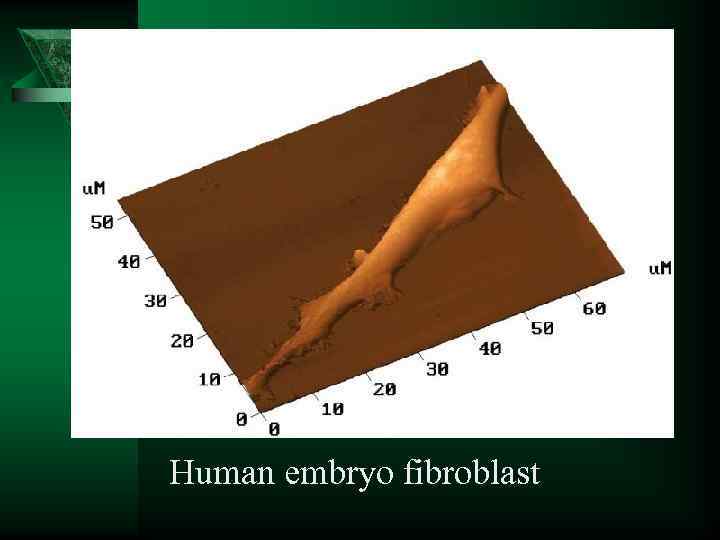 Human embryo fibroblast
Human embryo fibroblast
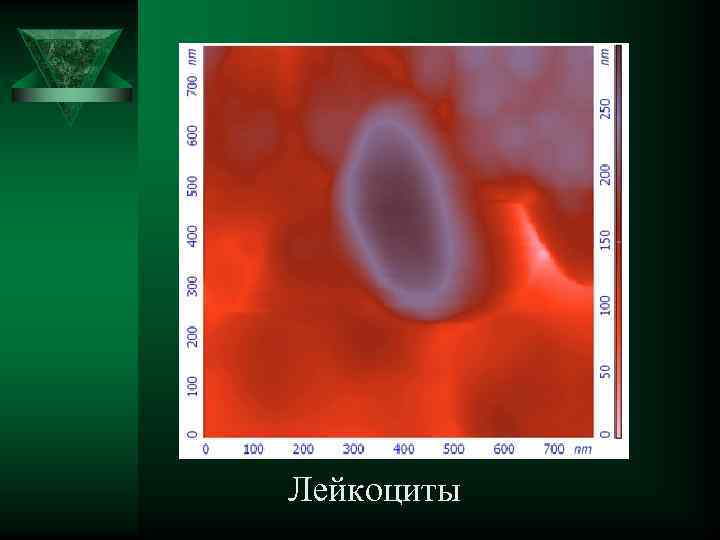 Лейкоциты
Лейкоциты
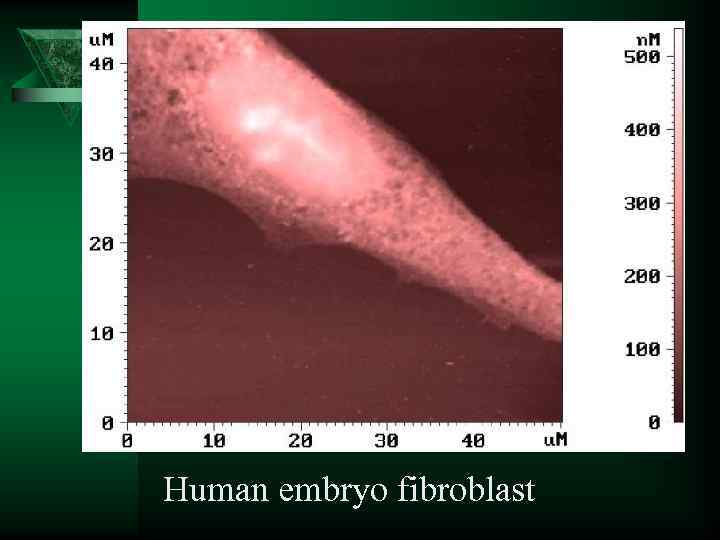 Human embryo fibroblast
Human embryo fibroblast
 Человеческий волос Изображение слева - рельеф поверхности(Метод Постоянной Силы), изображение справа - сигнал ошибки обратной связи(Контактный Метод Рассогласования).
Человеческий волос Изображение слева - рельеф поверхности(Метод Постоянной Силы), изображение справа - сигнал ошибки обратной связи(Контактный Метод Рассогласования).
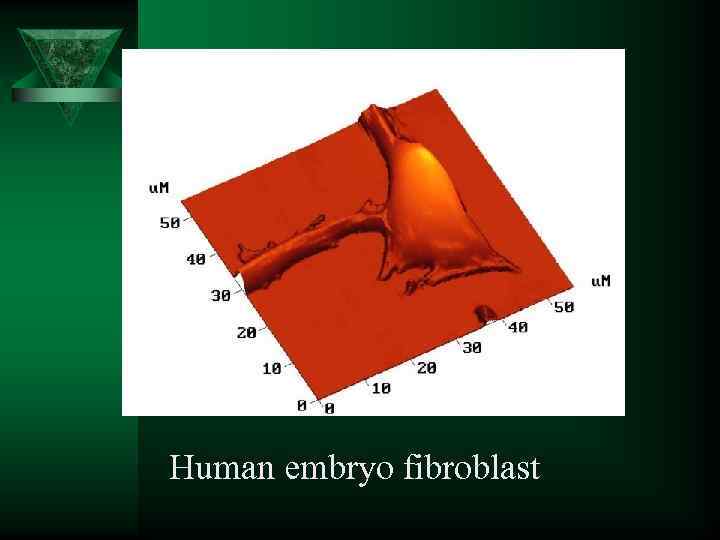 Human embryo fibroblast
Human embryo fibroblast
 Ультромикротомирование. Ú 1 — блок; Ú 2 — срез; Ú 3 — ванночка, наполненная жидкостью; Ú 4 — нож; Ú 5 — требуемый угол между ножом и блоком Установка стеклянного ножа для получения срезов
Ультромикротомирование. Ú 1 — блок; Ú 2 — срез; Ú 3 — ванночка, наполненная жидкостью; Ú 4 — нож; Ú 5 — требуемый угол между ножом и блоком Установка стеклянного ножа для получения срезов
 Использование полутонких срезов для прицельной заточки блока а— полутонкий срез (искомый участок располагается в области правого нижнего угла среза); б — срезанная поверхность блока с выбранным участком для окончательной заточки блока; в — окончательно прицельно заточенный блок для получения ультратонких срезов
Использование полутонких срезов для прицельной заточки блока а— полутонкий срез (искомый участок располагается в области правого нижнего угла среза); б — срезанная поверхность блока с выбранным участком для окончательной заточки блока; в — окончательно прицельно заточенный блок для получения ультратонких срезов
 Окрашивание срезов Ú 1. Полутонкие срезы, полученные на ультрамикротоме, переносят на предметное стекло в каплю 10 %-го эта-нола. Ú 2. Стекло подогревают на пламени спиртовки. При этом спирт испаряется и срезы приклеиваются к стеклу. Ú 3. На только что высушенные срезы наносят насыщенный спиртовой раствор моногидроксида натрия или калия. Травление заливочной среды проводят в течение 10 мин. Ú 4. Промывают в проточной воде. Ú 5. Окрашивают гематоксилином Эрлиха в течение 10— 20 мин при температуре 100— 110°С (можно окрашивать и в термостате при температуре 56— 58 °С). Ú 6. Промывают в теплой воде в течение 1— 2 мин. Ú 7. Окрашивают в 2 %-м спиртовом растворе эозина в течение 20— 30 мин при температуре 100— 110° С (можно и в термостате при 56— 58 °С). Ú 8. Дифференцируют и обезвоживают в спиртах восходящей крепости. Ú 9. Просветляют в карбол-ксилоле, ксилоле и заключают в канадский или пихтовый бальзам.
Окрашивание срезов Ú 1. Полутонкие срезы, полученные на ультрамикротоме, переносят на предметное стекло в каплю 10 %-го эта-нола. Ú 2. Стекло подогревают на пламени спиртовки. При этом спирт испаряется и срезы приклеиваются к стеклу. Ú 3. На только что высушенные срезы наносят насыщенный спиртовой раствор моногидроксида натрия или калия. Травление заливочной среды проводят в течение 10 мин. Ú 4. Промывают в проточной воде. Ú 5. Окрашивают гематоксилином Эрлиха в течение 10— 20 мин при температуре 100— 110°С (можно окрашивать и в термостате при температуре 56— 58 °С). Ú 6. Промывают в теплой воде в течение 1— 2 мин. Ú 7. Окрашивают в 2 %-м спиртовом растворе эозина в течение 20— 30 мин при температуре 100— 110° С (можно и в термостате при 56— 58 °С). Ú 8. Дифференцируют и обезвоживают в спиртах восходящей крепости. Ú 9. Просветляют в карбол-ксилоле, ксилоле и заключают в канадский или пихтовый бальзам.
 ПОДГОТОВКА КЛЕТОК, КЛЕТОЧНЫХ СУСПЕНЗИЙ И ТКАНЕВЫХ ФРАГМЕНТОВ ДЛЯ СКАНИРУЮЩЕЙ (РАСТРОВОЙ) ЭЛЕКТРОННОЙ МИКРОСКОПИИ I. Подготовка к РЭМ клеток, культивируемых на подложках (покровных стеклах и др. ) 1) Промывание (37°С) растворе Хенкса (не более 1 мин. ) 2) Фиксация 2% р-ре глютаральдегида (0, 15 М натрий- какодилатном буфере) Длительность фиксации 2— 3 ч при комнатной температуре; при необходимости фиксация продолжается в теч-ие суток и более в холодильнике (5— 6°С). 3) Отмывание культуры р-ре Хенкса в течение 2— 3 мин. 4) Постфиксация в 1% растворе четырехокиси осмия. 5) Отмывание культуры от осмиевого фиксатора в дистиллированной воде (в двух сменах по 10— 15 мин в каждой). 6) Обезвоживание клеток. 7) Высушивание клеток. 8) Покрытие клеток металлом. 9) Наблюдение: столик-держатель с культурой помещают в камеру объектов растрового электронного микроскопа и подвергают РЭМ при ускоряющем напряжении 10 к. В.
ПОДГОТОВКА КЛЕТОК, КЛЕТОЧНЫХ СУСПЕНЗИЙ И ТКАНЕВЫХ ФРАГМЕНТОВ ДЛЯ СКАНИРУЮЩЕЙ (РАСТРОВОЙ) ЭЛЕКТРОННОЙ МИКРОСКОПИИ I. Подготовка к РЭМ клеток, культивируемых на подложках (покровных стеклах и др. ) 1) Промывание (37°С) растворе Хенкса (не более 1 мин. ) 2) Фиксация 2% р-ре глютаральдегида (0, 15 М натрий- какодилатном буфере) Длительность фиксации 2— 3 ч при комнатной температуре; при необходимости фиксация продолжается в теч-ие суток и более в холодильнике (5— 6°С). 3) Отмывание культуры р-ре Хенкса в течение 2— 3 мин. 4) Постфиксация в 1% растворе четырехокиси осмия. 5) Отмывание культуры от осмиевого фиксатора в дистиллированной воде (в двух сменах по 10— 15 мин в каждой). 6) Обезвоживание клеток. 7) Высушивание клеток. 8) Покрытие клеток металлом. 9) Наблюдение: столик-держатель с культурой помещают в камеру объектов растрового электронного микроскопа и подвергают РЭМ при ускоряющем напряжении 10 к. В.
 II. Подготовка к РЭМ суспендированных клеток 1) Отделение клеток от суспензии путем центрифугирования (1000— 1200 об/мин в течение 3— 5 мин). 2) Промывание: клетки ресуспендируют в теплом (37°С) растворе Хенкса. 3) Фиксация: осажденные клетки ресуспендируют в теплом 2% растворе глютаральдегида. 4) Отмыванне от фиксатора: клетки отделяют от фиксатора центрифугированием, ресуспеидируют в растворе Хенкса (или Эрла) и вновь повторяют процедуру. 5) “Прикрепление” клеток к подложке. 6) Дальнейшую обработку пластинок с прикрепившимися клетками производят так же, как описано в разделе I, пп. 6— 9.
II. Подготовка к РЭМ суспендированных клеток 1) Отделение клеток от суспензии путем центрифугирования (1000— 1200 об/мин в течение 3— 5 мин). 2) Промывание: клетки ресуспендируют в теплом (37°С) растворе Хенкса. 3) Фиксация: осажденные клетки ресуспендируют в теплом 2% растворе глютаральдегида. 4) Отмыванне от фиксатора: клетки отделяют от фиксатора центрифугированием, ресуспеидируют в растворе Хенкса (или Эрла) и вновь повторяют процедуру. 5) “Прикрепление” клеток к подложке. 6) Дальнейшую обработку пластинок с прикрепившимися клетками производят так же, как описано в разделе I, пп. 6— 9.
 III. Подготовка к РЭМ мягких тканевых объектов Следует увеличить сроки процедур 1— 6. 1) При наличии в исходной суспензионной среде значительного содержания белка (плазма крови, асцитическая жидкость) процедуру промывания клеток можно повторить. 2) Пластинки до их использования сохраняют и смеси 96% зтанола с эфиром. 3) Постфиксация клеток во взвеси четырехокисью осмия пропускается, поскольку после осмирования клетки плохо прикрепляются к пластинкам из фольги.
III. Подготовка к РЭМ мягких тканевых объектов Следует увеличить сроки процедур 1— 6. 1) При наличии в исходной суспензионной среде значительного содержания белка (плазма крови, асцитическая жидкость) процедуру промывания клеток можно повторить. 2) Пластинки до их использования сохраняют и смеси 96% зтанола с эфиром. 3) Постфиксация клеток во взвеси четырехокисью осмия пропускается, поскольку после осмирования клетки плохо прикрепляются к пластинкам из фольги.
 Специальные (немикроскопические) методы исследования. 1. Цито- или гистохимия. 2. Цитофотометрия. 3. Авторадиография. 4. Рентгеноструктурный анализ. 5. Морфометрия. 6. Микроургия. 7. Метод культивирования клеток и тканей. 8. Ультрацентрофугирование. 9. Экспериментальный метод. 10. Метод трансплантации тканей и органов.
Специальные (немикроскопические) методы исследования. 1. Цито- или гистохимия. 2. Цитофотометрия. 3. Авторадиография. 4. Рентгеноструктурный анализ. 5. Морфометрия. 6. Микроургия. 7. Метод культивирования клеток и тканей. 8. Ультрацентрофугирование. 9. Экспериментальный метод. 10. Метод трансплантации тканей и органов.


