Алкены презентация.ppt
- Количество слайдов: 13

 Номенклатура Строение молекулы Изомерия 2/18/2018 Физические свойства Cn. H 2 n Химические свойства Получение Проверка знаний Применение 2
Номенклатура Строение молекулы Изомерия 2/18/2018 Физические свойства Cn. H 2 n Химические свойства Получение Проверка знаний Применение 2
 Cn. H 2 n Алкены – ациклические углеводороды, в молекуле которых кроме одинарных связей содержится одна двойная связь между атомами углерода. Общая формула: Сn. H 2 n 2/18/2018 3
Cn. H 2 n Алкены – ациклические углеводороды, в молекуле которых кроме одинарных связей содержится одна двойная связь между атомами углерода. Общая формула: Сn. H 2 n 2/18/2018 3
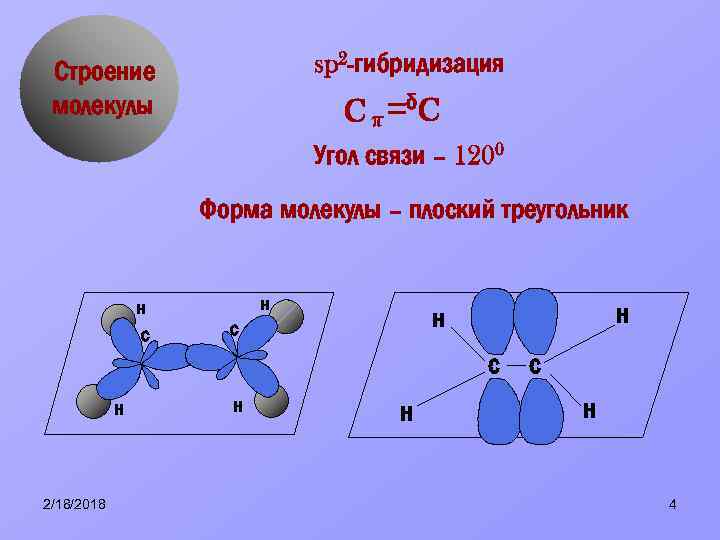 sp 2 -гибридизация Строение молекулы Cπ δC Угол связи – 1200 Форма молекулы – плоский треугольник н с н н н с с н 2/18/2018 н н с н 4
sp 2 -гибридизация Строение молекулы Cπ δC Угол связи – 1200 Форма молекулы – плоский треугольник н с н н н с с н 2/18/2018 н н с н 4
 1. Выбор главной цепи. С Н 3 С Н С Н 3 Номенклатура СН 3 2. Нумерация атомов главной цепи. 5 4 3 С Н С Н 2 1 С Н 3 СН 3 3. Формирование названия. С Н 3 С Н С Н 3 СН 3 2/18/2018 4 - метил пентен - 2 5
1. Выбор главной цепи. С Н 3 С Н С Н 3 Номенклатура СН 3 2. Нумерация атомов главной цепи. 5 4 3 С Н С Н 2 1 С Н 3 СН 3 3. Формирование названия. С Н 3 С Н С Н 3 СН 3 2/18/2018 4 - метил пентен - 2 5
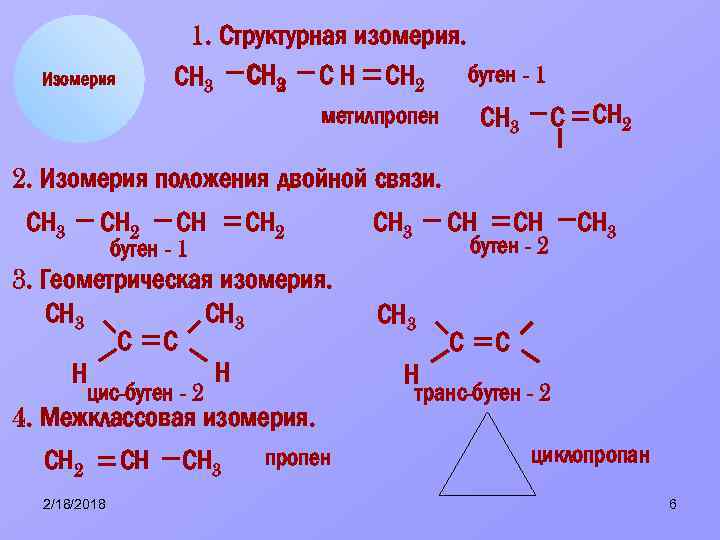 1. Структурная изомерия. бутен - 1 СН 3 С Н СН 2 2 метилпропен СН 3 С СН 2 Изомерия 2. Изомерия положения двойной связи. СН 3 СН 2 СН бутен - 1 СН 2 3. Геометрическая изомерия. СН 3 С С Н Н цис-бутен - 2 4. Межклассовая изомерия. СН 2 2/18/2018 СН СН 3 пропен СН 3 СН СН бутен - 2 СН 3 С Н транс-бутен - 2 циклопропан 6
1. Структурная изомерия. бутен - 1 СН 3 С Н СН 2 2 метилпропен СН 3 С СН 2 Изомерия 2. Изомерия положения двойной связи. СН 3 СН 2 СН бутен - 1 СН 2 3. Геометрическая изомерия. СН 3 С С Н Н цис-бутен - 2 4. Межклассовая изомерия. СН 2 2/18/2018 СН СН 3 пропен СН 3 СН СН бутен - 2 СН 3 С Н транс-бутен - 2 циклопропан 6
 Физические свойства Агрегатное состояние: С 2 Н 4 – С 4 Н 8 газообразные вещества; С 5 Н 10 – С 18 Н 36 с С 19 Н 38 жидкости; твердые вещества С увеличением молекулярной массы соединений температуры кипения и плавления закономерно повышаются. Этилен С 2 Н 4 Tпл = - 169, 20 С 2/18/2018 Г, З нефтяной, Tкип = - Ц 103, 70 С Плохо в Н 2 О 7
Физические свойства Агрегатное состояние: С 2 Н 4 – С 4 Н 8 газообразные вещества; С 5 Н 10 – С 18 Н 36 с С 19 Н 38 жидкости; твердые вещества С увеличением молекулярной массы соединений температуры кипения и плавления закономерно повышаются. Этилен С 2 Н 4 Tпл = - 169, 20 С 2/18/2018 Г, З нефтяной, Tкип = - Ц 103, 70 С Плохо в Н 2 О 7
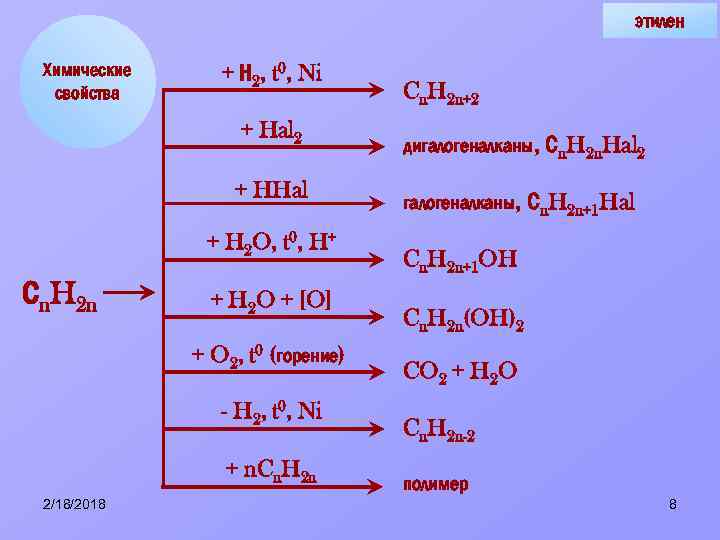 этилен Химические свойства + Н 2, t 0, Ni + Hal 2 + HHal + H 2 O, t 0, H+ Сn. H 2 n + H 2 O + [O] + O 2, t 0 (горение) - H 2, t 0, Ni + n. Cn. H 2 n 2/18/2018 Cn. H 2 n+2 дигалогеналканы, Сn. H 2 n. Hal 2 Сn. H 2 n+1 Hal Cn. H 2 n+1 OH Cn. H 2 n(OH)2 CO 2 + H 2 O Cn. H 2 n-2 полимер 8
этилен Химические свойства + Н 2, t 0, Ni + Hal 2 + HHal + H 2 O, t 0, H+ Сn. H 2 n + H 2 O + [O] + O 2, t 0 (горение) - H 2, t 0, Ni + n. Cn. H 2 n 2/18/2018 Cn. H 2 n+2 дигалогеналканы, Сn. H 2 n. Hal 2 Сn. H 2 n+1 Hal Cn. H 2 n+1 OH Cn. H 2 n(OH)2 CO 2 + H 2 O Cn. H 2 n-2 полимер 8
 главная 1. Гидрирование: СН 2 2. Галогенирование: СН 2 + Н 2 СН 2 3. Гидрогалогенирование: 4. Гидратация: СН 2 5. Мягкое окисление: 6. Горение: СН 2 n. СН 2 t, Н 3 РО 4 t, Ni СН 2. cat (… СН 2 Сl СН 2 ОН СН 2 2 Н 2 О СН СН 2 Вr CН 3 2 СО 2 СН 3 СН 2 Вr СН 2 + [О] +Н 2 О СН 2 + 3 О 2 8. Полимеризация: СН 3 СН 2 + НСl СН 2 + Н 2 О СН 2 2/18/2018 СН 2 + Br 2 СН 2 7. Дегидрирование: Pt, t СН 2 ОН ОН СН + Н 2 СН 2 …)n 9
главная 1. Гидрирование: СН 2 2. Галогенирование: СН 2 + Н 2 СН 2 3. Гидрогалогенирование: 4. Гидратация: СН 2 5. Мягкое окисление: 6. Горение: СН 2 n. СН 2 t, Н 3 РО 4 t, Ni СН 2. cat (… СН 2 Сl СН 2 ОН СН 2 2 Н 2 О СН СН 2 Вr CН 3 2 СО 2 СН 3 СН 2 Вr СН 2 + [О] +Н 2 О СН 2 + 3 О 2 8. Полимеризация: СН 3 СН 2 + НСl СН 2 + Н 2 О СН 2 2/18/2018 СН 2 + Br 2 СН 2 7. Дегидрирование: Pt, t СН 2 ОН ОН СН + Н 2 СН 2 …)n 9
 1. Крекинг нефтепродуктов: С 16 Н 34 С 8 Н 18 Получение + С 8 Н 16 2. Дегидрирование предельных углеводородов: СН 2 СН 3 СН СН 3. Дегидратация спиртов (отщепление воды): СН 3 + Н 2 Н 2 SО 4 , 140 – 1500 С СН 3 СН 2 ОН СН 2 + Н 2 О 4. Дегидрогалогенирование (отщепление галогеноводорода): спирт, t СН 3 СН СН СН 3 +Na. Br +Н 2 О СН 3 СН СН 2 СН 3 + Na. ОН Br 5. Дегалогенирование: СН 3 СН СН СН 3 +Zn Br 2/18/2018 СН 3 СН СН СН 3 +Zn. Br 2 Br. 10
1. Крекинг нефтепродуктов: С 16 Н 34 С 8 Н 18 Получение + С 8 Н 16 2. Дегидрирование предельных углеводородов: СН 2 СН 3 СН СН 3. Дегидратация спиртов (отщепление воды): СН 3 + Н 2 Н 2 SО 4 , 140 – 1500 С СН 3 СН 2 ОН СН 2 + Н 2 О 4. Дегидрогалогенирование (отщепление галогеноводорода): спирт, t СН 3 СН СН СН 3 +Na. Br +Н 2 О СН 3 СН СН 2 СН 3 + Na. ОН Br 5. Дегалогенирование: СН 3 СН СН СН 3 +Zn Br 2/18/2018 СН 3 СН СН СН 3 +Zn. Br 2 Br. 10
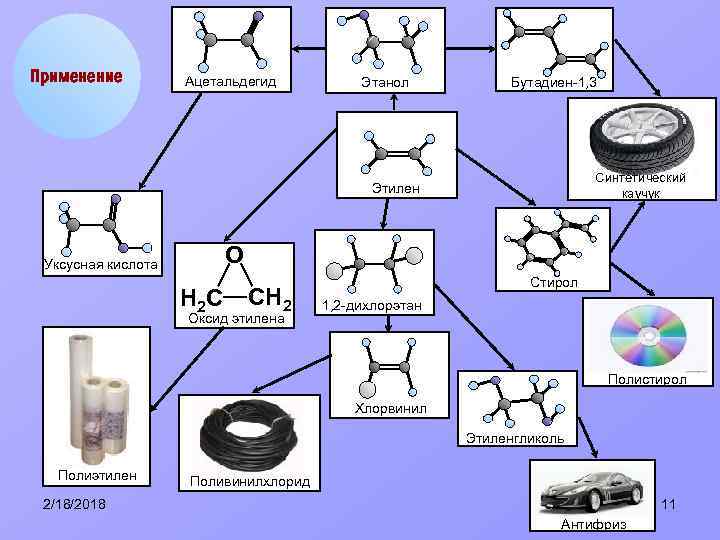 Применение Ацетальдегид Этанол Бутадиен-1, 3 Синтетический каучук Этилен О Уксусная кислота Н 2 С СН 2 Оксид этилена Стирол 1, 2 -дихлорэтан Полистирол Хлорвинил Этиленгликоль Полиэтилен Поливинилхлорид 2/18/2018 11 Антифриз
Применение Ацетальдегид Этанол Бутадиен-1, 3 Синтетический каучук Этилен О Уксусная кислота Н 2 С СН 2 Оксид этилена Стирол 1, 2 -дихлорэтан Полистирол Хлорвинил Этиленгликоль Полиэтилен Поливинилхлорид 2/18/2018 11 Антифриз
 Тип гибридизации Алкен массой 4, 2 г Алкенам тип характерны Какой не изомерии способен присоединить 8 г брома. атомов углерода Общая формула алкенов отсутствует у алкенов реакции Молекулярная формула алкена: в пропене Вопрос 1 Проверка знаний Вопрос 3 Вопрос 2 Вопрос 5 Вопрос 4 положения Попробуй 2 СПопробуй функциональной присоединения УРА!3 n 10 Н 20 2 n еще группы углеродного 2 Попробуй 2, sp. УРА! замещения А sp скелета Cn. С 6 Н 26, sp H 2 n+2 еще В sp , sp CH положения 2 Попробуй окисления Б кратной. УРА! СH 12 Н 2 n-6 sp, sp Cn 6 связи еще Попробуй геометрическая полимеризации С 122, sp Н 24 Г sp 2, sp. УРА! 3 Cn. Hеще 2 n-2 еще 2/18/2018 12
Тип гибридизации Алкен массой 4, 2 г Алкенам тип характерны Какой не изомерии способен присоединить 8 г брома. атомов углерода Общая формула алкенов отсутствует у алкенов реакции Молекулярная формула алкена: в пропене Вопрос 1 Проверка знаний Вопрос 3 Вопрос 2 Вопрос 5 Вопрос 4 положения Попробуй 2 СПопробуй функциональной присоединения УРА!3 n 10 Н 20 2 n еще группы углеродного 2 Попробуй 2, sp. УРА! замещения А sp скелета Cn. С 6 Н 26, sp H 2 n+2 еще В sp , sp CH положения 2 Попробуй окисления Б кратной. УРА! СH 12 Н 2 n-6 sp, sp Cn 6 связи еще Попробуй геометрическая полимеризации С 122, sp Н 24 Г sp 2, sp. УРА! 3 Cn. Hеще 2 n-2 еще 2/18/2018 12
 2/18/2018 13
2/18/2018 13


