Оксиды .pptx
- Количество слайдов: 41
 . Номенклатура. Классификация. Получение. Свойства. Применение
. Номенклатура. Классификация. Получение. Свойства. Применение
 «…учись, трудись – и ты познаешь…»
«…учись, трудись – и ты познаешь…»
 • Это соединения, состоящие из атомов двух элементов, одним из которых является кислород в степени окисления-2. Эх. Оу
• Это соединения, состоящие из атомов двух элементов, одним из которых является кислород в степени окисления-2. Эх. Оу
 • Оксиды – • соединения элементов с кислородом (кроме соединений фтора). Степень окисления кислорода в оксидах равна – II. Один из способов получения оксидов – реакция окисления (в Действие углекислотного огнетушителя
• Оксиды – • соединения элементов с кислородом (кроме соединений фтора). Степень окисления кислорода в оксидах равна – II. Один из способов получения оксидов – реакция окисления (в Действие углекислотного огнетушителя
 • А ну, друзья, снимите шляпу! Я дочь космического папы. Я вездесуща и легка, Я снег, я пот, я облака!
• А ну, друзья, снимите шляпу! Я дочь космического папы. Я вездесуща и легка, Я снег, я пот, я облака!
 • Содержание углекислого газа • • в атмосфере относительно невелико, всего 0, 04— 0, 03%. В воздухе, выдыхаемом человеком, углекислого газа 4%. Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.
• Содержание углекислого газа • • в атмосфере относительно невелико, всего 0, 04— 0, 03%. В воздухе, выдыхаемом человеком, углекислого газа 4%. Растения благодаря фотосинтезу усваивают углекислый газ из атмосферы, превращая минеральные вещества в органические — глюкозу, крахмал.
 • Один из распространенных оксидов – диоксид углерода CO 2 – содержится в составе вулканических газов.
• Один из распространенных оксидов – диоксид углерода CO 2 – содержится в составе вулканических газов.
 • Сухой лед в отличие от • • • водяного льда плотный. Он тонет в воде, резко охлаждая ее. Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда. Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого. Ценность сухого льда заключается не только в его охлаждающем действии но и в том, что продукты в углекислом газе не плесневеют, не гниют.
• Сухой лед в отличие от • • • водяного льда плотный. Он тонет в воде, резко охлаждая ее. Горящий бензин можно быстро потушить, бросив в пламя несколько кусочков сухого льда. Главное применение сухого льда — хранение и перевозка продуктов: рыбы, мяса, мороженого. Ценность сухого льда заключается не только в его охлаждающем действии но и в том, что продукты в углекислом газе не плесневеют, не гниют.
 • Чтоб появиться я сумел, прокаливают белый мел меня дает огонь в печи И пламя маленькой свечи. И стоит только сделать вдох, Чтоб я на свет явиться мог. Я в газированной воде, Я в хлебе, соде, я везде!CO 2 CO 2 CO 2
• Чтоб появиться я сумел, прокаливают белый мел меня дает огонь в печи И пламя маленькой свечи. И стоит только сделать вдох, Чтоб я на свет явиться мог. Я в газированной воде, Я в хлебе, соде, я везде!CO 2 CO 2 CO 2
 ОКСИД ХРОМА Cr 2 O 3 • Оксид хрома(III) – Cr O – кристаллы зеленого цвета, нерастворимые в воде. 2 • Cr O 3 используют как пигмент при изготовлении декоративного зеленого стекла и керамики. 2 3 • Паста ГОИ (“Государственный оптический институт”) на основе Cr 2 O 3 применяется для шлифовки и полировки
ОКСИД ХРОМА Cr 2 O 3 • Оксид хрома(III) – Cr O – кристаллы зеленого цвета, нерастворимые в воде. 2 • Cr O 3 используют как пигмент при изготовлении декоративного зеленого стекла и керамики. 2 3 • Паста ГОИ (“Государственный оптический институт”) на основе Cr 2 O 3 применяется для шлифовки и полировки
 Дамасская ваза XIV века Парфюмерный флакон работы Рене Лалика Русское стекло. Бокал. Вторая половина XVIII века
Дамасская ваза XIV века Парфюмерный флакон работы Рене Лалика Русское стекло. Бокал. Вторая половина XVIII века
 Нефелин Боксит
Нефелин Боксит

 керамик а Фарфор. Императорский Глазурованная посуда из белой фарфоровый завод. глины. Китай, 2 -1 «Птица» . тыс. до н. э. Музей исламского искусства. Каир. 1830 -е годы.
керамик а Фарфор. Императорский Глазурованная посуда из белой фарфоровый завод. глины. Китай, 2 -1 «Птица» . тыс. до н. э. Музей исламского искусства. Каир. 1830 -е годы.
 Оксид магния Mg. O • Оксид магния– основный оксид. • Магниевая лента, вступив в реакцию с кислородом воздуха, горит ярким белым пламенем.
Оксид магния Mg. O • Оксид магния– основный оксид. • Магниевая лента, вступив в реакцию с кислородом воздуха, горит ярким белым пламенем.
 • Плиний считал, что • горный хрусталь «рождается из небесной влаги и чистейшего снега» . Однако состав его иной: оксид кремния (IV) Si. O 2. Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид
• Плиний считал, что • горный хрусталь «рождается из небесной влаги и чистейшего снега» . Однако состав его иной: оксид кремния (IV) Si. O 2. Кварц, кремень, горный хрусталь, аметист, яшма, опал — все это оксид
 БЕЛИЛА • Оксид цинка Zn. O – вещество белого • • • цвета, используется для приготовления белой масляной краски (цинковые белила). Цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Фармацевты делают из оксида цинка вяжущий и подсушивающий порошок для наружного применения. Такими же ценными свойствами обладает оксид титана (IV) – Ti. O 2. Он тоже имеет красивый белый цвет и применяется для изготовления
БЕЛИЛА • Оксид цинка Zn. O – вещество белого • • • цвета, используется для приготовления белой масляной краски (цинковые белила). Цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Фармацевты делают из оксида цинка вяжущий и подсушивающий порошок для наружного применения. Такими же ценными свойствами обладает оксид титана (IV) – Ti. O 2. Он тоже имеет красивый белый цвет и применяется для изготовления

 СО 2 Si. O 2 Н 2 О Са. О СО
СО 2 Si. O 2 Н 2 О Са. О СО
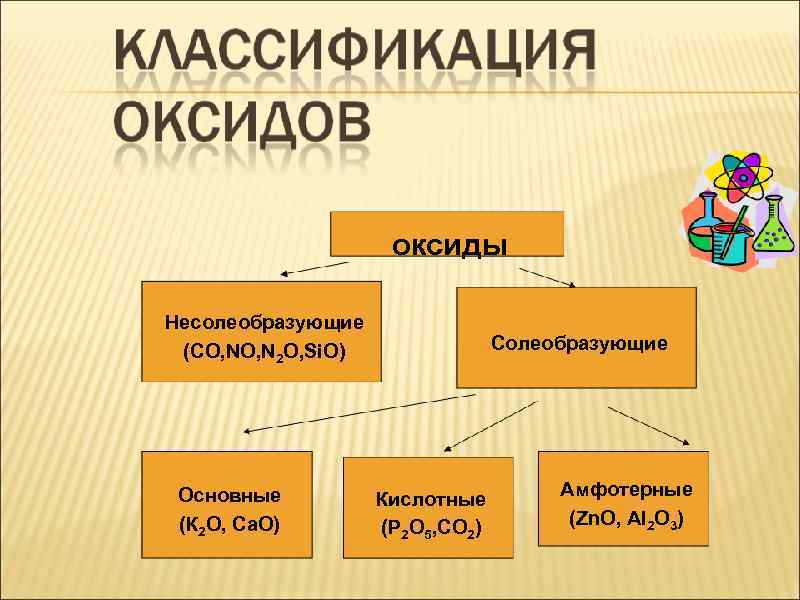 оксиды Несолеобразующие (СО, NO, N 2 O, Si. O) Основные (К 2 О, Са. О) Солеобразующие Кислотные (Р 2 О 5, СО 2) Амфотерные (Zn. O, Al 2 O 3)
оксиды Несолеобразующие (СО, NO, N 2 O, Si. O) Основные (К 2 О, Са. О) Солеобразующие Кислотные (Р 2 О 5, СО 2) Амфотерные (Zn. O, Al 2 O 3)
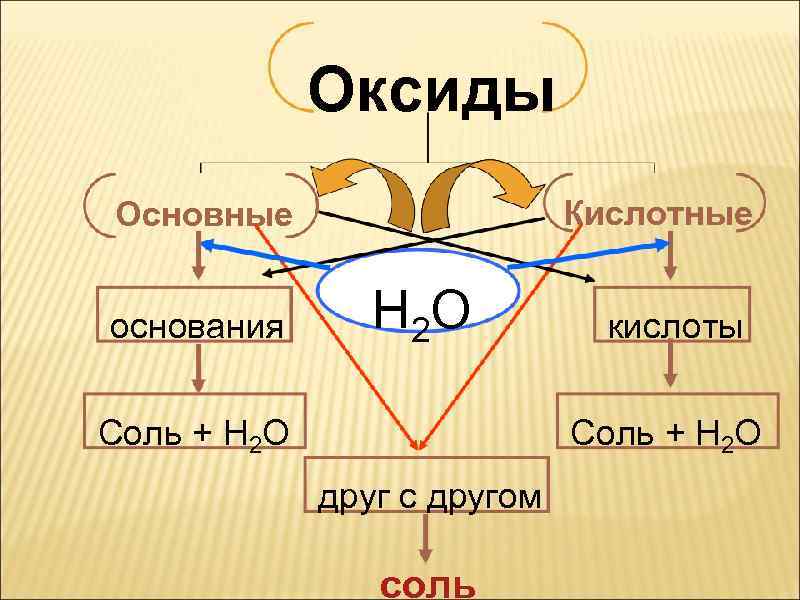 Оксиды Кислотные Основные основания Н 2 О Соль + Н 2 О кислоты Соль + Н 2 О друг с другом соль
Оксиды Кислотные Основные основания Н 2 О Соль + Н 2 О кислоты Соль + Н 2 О друг с другом соль
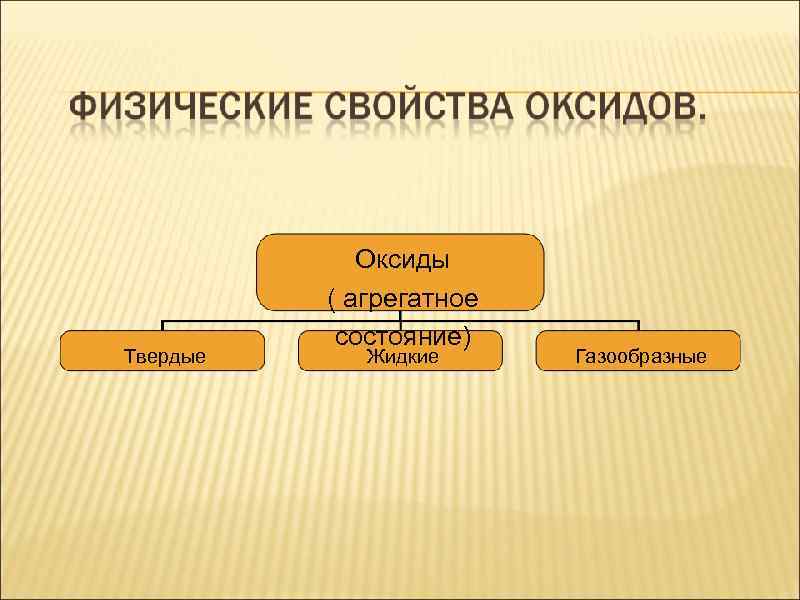 Твердые Оксиды ( агрегатное состояние) Жидкие Газообразные
Твердые Оксиды ( агрегатное состояние) Жидкие Газообразные




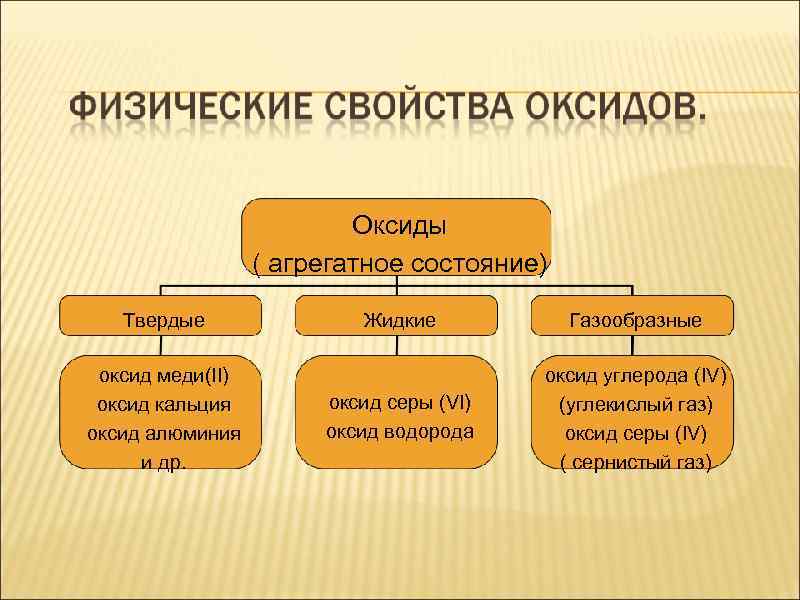 Оксиды ( агрегатное состояние) Твердые оксид меди(II) оксид кальция оксид алюминия и др. Жидкие Газообразные оксид серы (VI) оксид водорода оксид углерода (IV) (углекислый газ) оксид серы (IV) ( сернистый газ)
Оксиды ( агрегатное состояние) Твердые оксид меди(II) оксид кальция оксид алюминия и др. Жидкие Газообразные оксид серы (VI) оксид водорода оксид углерода (IV) (углекислый газ) оксид серы (IV) ( сернистый газ)
 Оксиды образуются: 1. При горении простых веществ.
Оксиды образуются: 1. При горении простых веществ.
 4 Р + 5 О 2 =2 Р 2 О 5
4 Р + 5 О 2 =2 Р 2 О 5

 Оксиды образуются: 2. При горении сложных веществ.
Оксиды образуются: 2. При горении сложных веществ.
 СН 4 + 2 О 2=СО 2 + 2 Н 2 О
СН 4 + 2 О 2=СО 2 + 2 Н 2 О
 Оксиды образуются: 2. При разложении сложных веществ: нерастворимых оснований.
Оксиды образуются: 2. При разложении сложных веществ: нерастворимых оснований.
 Сu(ОН)2= Cu. О + Н 2 О
Сu(ОН)2= Cu. О + Н 2 О
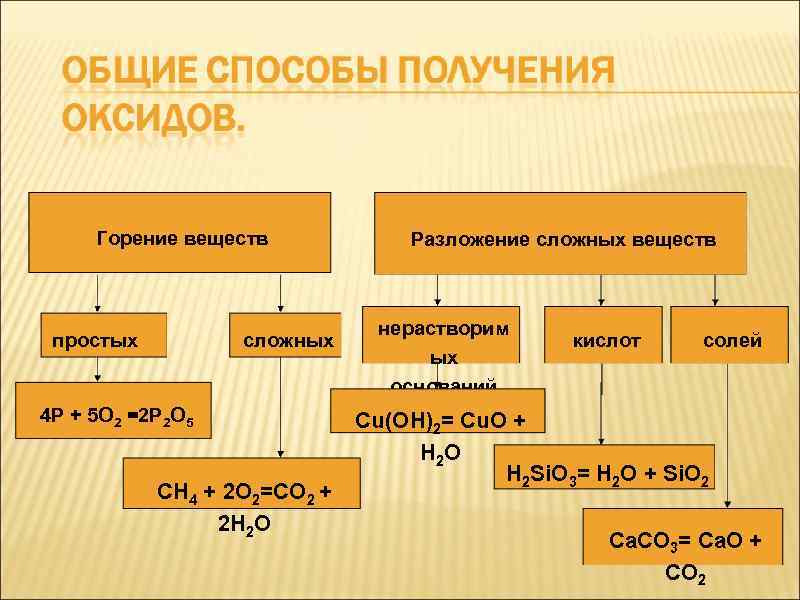 Горение веществ простых сложных 4 Р + 5 О 2 =2 Р 2 О 5 СН 4 + 2 О 2=СО 2 + 2 Н 2 О Разложение сложных веществ нерастворим ых оснований кислот солей Сu(ОН)2= Cu. О + Н 2 О Н 2 Si. О 3= Н 2 О + Si. О 2 Са. СО 3= Са. О + СО 2
Горение веществ простых сложных 4 Р + 5 О 2 =2 Р 2 О 5 СН 4 + 2 О 2=СО 2 + 2 Н 2 О Разложение сложных веществ нерастворим ых оснований кислот солей Сu(ОН)2= Cu. О + Н 2 О Н 2 Si. О 3= Н 2 О + Si. О 2 Са. СО 3= Са. О + СО 2
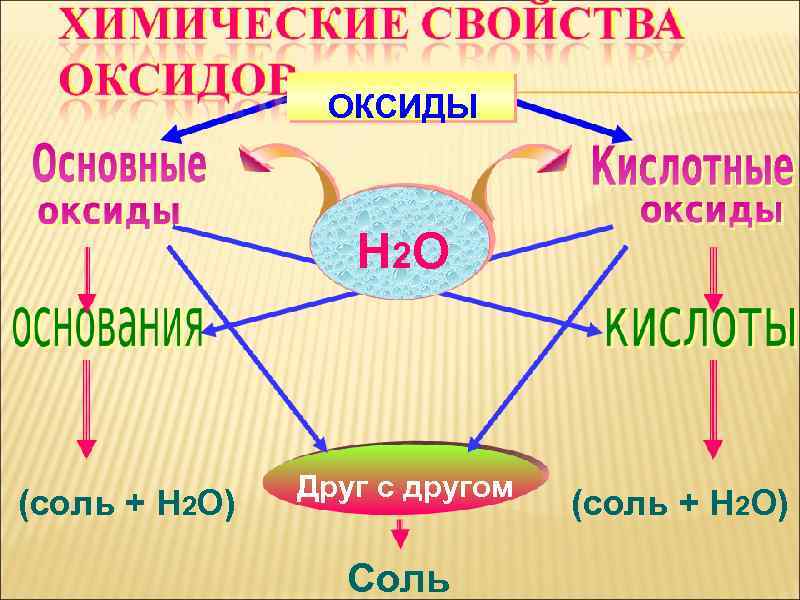 ОКСИДЫ Н 2 О (соль + Н 2 О) Друг с другом Соль (соль + Н 2 О)
ОКСИДЫ Н 2 О (соль + Н 2 О) Друг с другом Соль (соль + Н 2 О)
 ОКСИД + ВОДА = ГИДРОКСИД
ОКСИД + ВОДА = ГИДРОКСИД

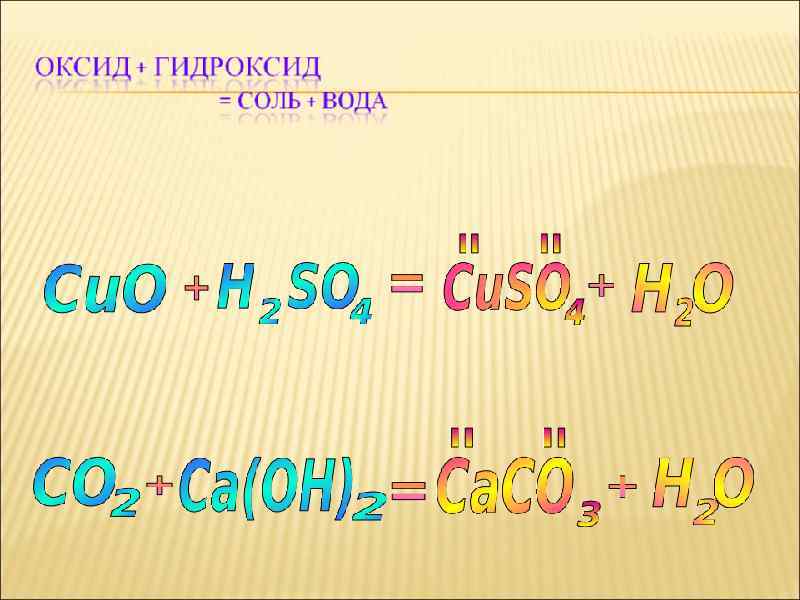
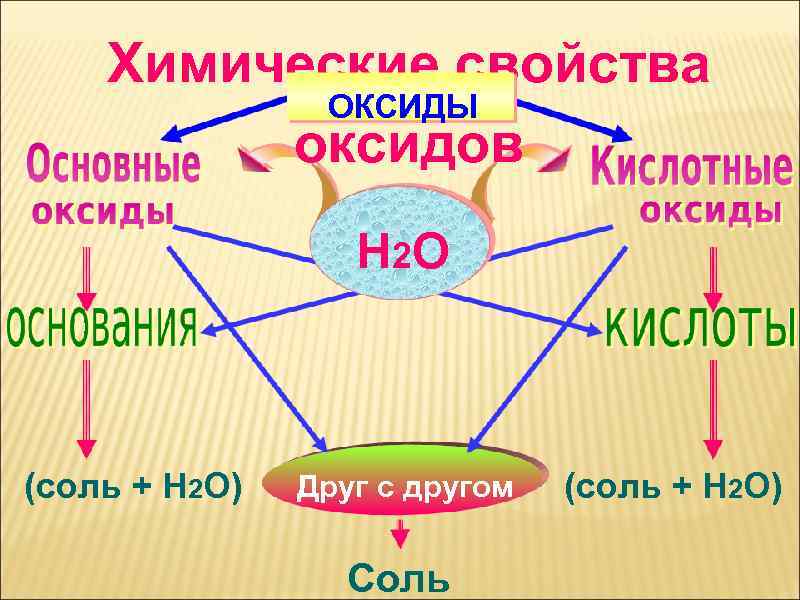 Химические свойства ОКСИДЫ оксидов Н 2 О (соль + Н 2 О) Друг с другом Соль (соль + Н 2 О)
Химические свойства ОКСИДЫ оксидов Н 2 О (соль + Н 2 О) Друг с другом Соль (соль + Н 2 О)
 1. Записать формулы исходных продуктов. 2. Под формулой кислотного оксида написать формулу соответствующей ему кислоты. 3. Составить формулу продукта реакции – соли, записав в ней на первое место знак металла из основного оксида, а на второе – кислотный остаток. 4. Указать валентности металла и кислотного остатка и расставить индексы. 5. Уравнять число атомов каждого элемента в правой и левой частях уравнения ОЛНИТЕЛЬНОЕ ЗАДАНИЕ Na 2 O + CO 2 H 2 CO 3 Na 2 3 CO
1. Записать формулы исходных продуктов. 2. Под формулой кислотного оксида написать формулу соответствующей ему кислоты. 3. Составить формулу продукта реакции – соли, записав в ней на первое место знак металла из основного оксида, а на второе – кислотный остаток. 4. Указать валентности металла и кислотного остатка и расставить индексы. 5. Уравнять число атомов каждого элемента в правой и левой частях уравнения ОЛНИТЕЛЬНОЕ ЗАДАНИЕ Na 2 O + CO 2 H 2 CO 3 Na 2 3 CO


