нитрилы. химические своства.pptx
- Количество слайдов: 14
 НИТРИЛЫ КИСЛОТ Выполнил: Лысова Дарья Факультет: МТ Группа: ХТ-401 Новосибирск 2015
НИТРИЛЫ КИСЛОТ Выполнил: Лысова Дарья Факультет: МТ Группа: ХТ-401 Новосибирск 2015
 НИТРИЛЫ, органическое соединение, содержащие одну или несколько цианогрупп —C≡N , связанных с органическим радикалом. Изомерны изонитрилам. Атомы С и N в цианогруппе имеют sp-гибридизацию; длины связей, например для CH 3 CN, 0, 1468 нм (С—С) и 0, 116 нм (C≡N ); средняя энергия связи C≡N 672 к. Дж/моль. Обладает отрицательным индукционным и мезомерным эффектами (-I, -M). Названия НИТРИЛЫ обычно производят от названия соответствующей карбоновой кислоты. Часто НИТРИЛЫ рассматривают как производные синильной кислоты - цианиды или цианозамещенные углеводороды.
НИТРИЛЫ, органическое соединение, содержащие одну или несколько цианогрупп —C≡N , связанных с органическим радикалом. Изомерны изонитрилам. Атомы С и N в цианогруппе имеют sp-гибридизацию; длины связей, например для CH 3 CN, 0, 1468 нм (С—С) и 0, 116 нм (C≡N ); средняя энергия связи C≡N 672 к. Дж/моль. Обладает отрицательным индукционным и мезомерным эффектами (-I, -M). Названия НИТРИЛЫ обычно производят от названия соответствующей карбоновой кислоты. Часто НИТРИЛЫ рассматривают как производные синильной кислоты - цианиды или цианозамещенные углеводороды.
 НАХОЖДЕНИЕ В ПРИРОДЕ
НАХОЖДЕНИЕ В ПРИРОДЕ
 ФИЗИЧЕСКИЕ СВОЙСТВА Нитрилы - бесцветные жидкости или твердые вещества. Насыщенные алифатические нитрилы вплоть до С 14 представляют собой жидкости с довольно приятным запахом, напоминающим эфир. Нитрилы выше С 14 твердые бесцветные вещества без запаха. Большинство нитрилов кипит без разложения при температурах ниже, чем соответствующие кислоты. НИТРИЛЫ плохо растворимы в воде (за исключением низших алифатических нитрилов), хорошо растворимы во многих органических растворителях.
ФИЗИЧЕСКИЕ СВОЙСТВА Нитрилы - бесцветные жидкости или твердые вещества. Насыщенные алифатические нитрилы вплоть до С 14 представляют собой жидкости с довольно приятным запахом, напоминающим эфир. Нитрилы выше С 14 твердые бесцветные вещества без запаха. Большинство нитрилов кипит без разложения при температурах ниже, чем соответствующие кислоты. НИТРИЛЫ плохо растворимы в воде (за исключением низших алифатических нитрилов), хорошо растворимы во многих органических растворителях.
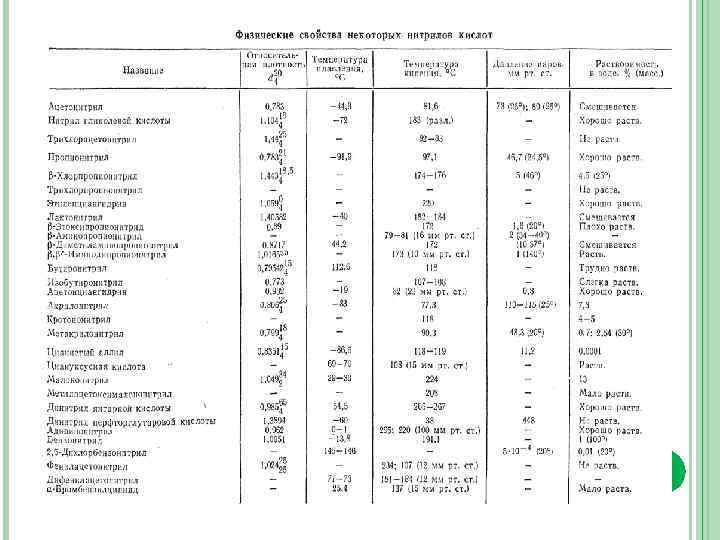
 ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ НИТРИЛОВ * При 41 °С. ** При 45 °С. *** При 12 мм рт. ст.
ФИЗИЧЕСКИЕ СВОЙСТВА НЕКОТОРЫХ НИТРИЛОВ * При 41 °С. ** При 45 °С. *** При 12 мм рт. ст.
 ХИМИЧЕСКИЕ СВОЙСТВА Цианогруппа характеризуется высокой степенью поляризации, следствием которой является образование частичного положительного заряда на углероде и отрицательного заряда – на азоте Это обусловливает, с одной стороны, восприимчивость углеродного центра к нуклеофильной атаке, с другой – основность атома азота.
ХИМИЧЕСКИЕ СВОЙСТВА Цианогруппа характеризуется высокой степенью поляризации, следствием которой является образование частичного положительного заряда на углероде и отрицательного заряда – на азоте Это обусловливает, с одной стороны, восприимчивость углеродного центра к нуклеофильной атаке, с другой – основность атома азота.
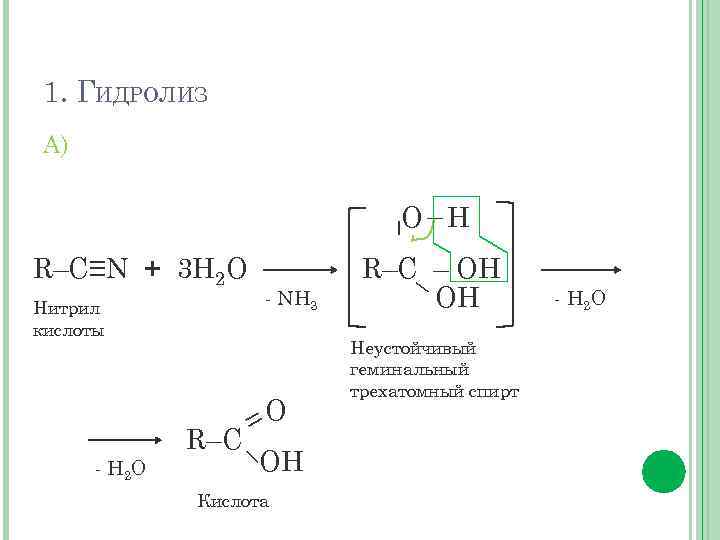 1. ГИДРОЛИЗ А) R–C≡N + 3 Н 2 О Нитрил кислоты - Н 2 О - NH 3 =O R–C– OH Кислота – – О Н R–C– – OH OH Неустойчивый геминальный трехатомный спирт - Н 2 О
1. ГИДРОЛИЗ А) R–C≡N + 3 Н 2 О Нитрил кислоты - Н 2 О - NH 3 =O R–C– OH Кислота – – О Н R–C– – OH OH Неустойчивый геминальный трехатомный спирт - Н 2 О
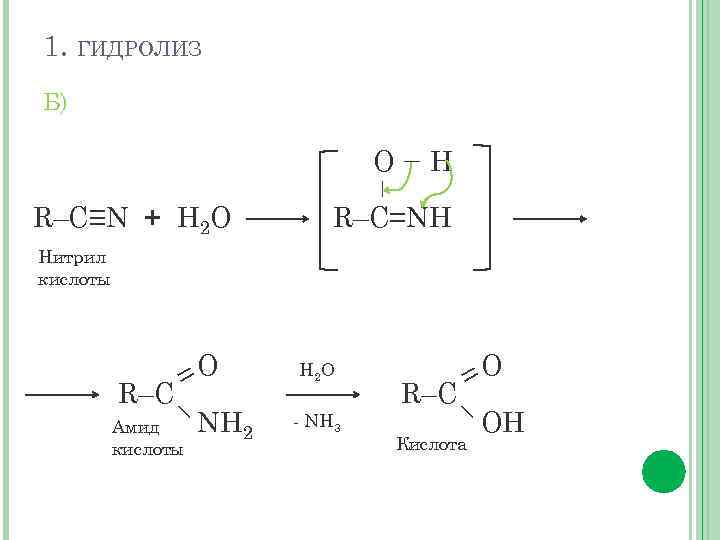 1. ГИДРОЛИЗ Б) – R–C≡N + Н 2 О – О Н R–C=NН Нитрил кислоты =O R–C– NH 2 Амид кислоты Н 2 О - NH 3 =O R–C– OH Кислота
1. ГИДРОЛИЗ Б) – R–C≡N + Н 2 О – О Н R–C=NН Нитрил кислоты =O R–C– NH 2 Амид кислоты Н 2 О - NH 3 =O R–C– OH Кислота
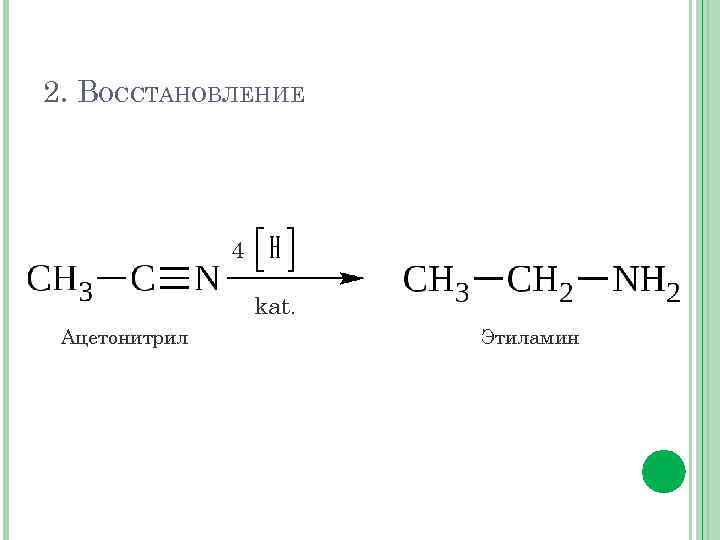 2. ВОССТАНОВЛЕНИЕ 4 kat. Ацетонитрил Этиламин
2. ВОССТАНОВЛЕНИЕ 4 kat. Ацетонитрил Этиламин
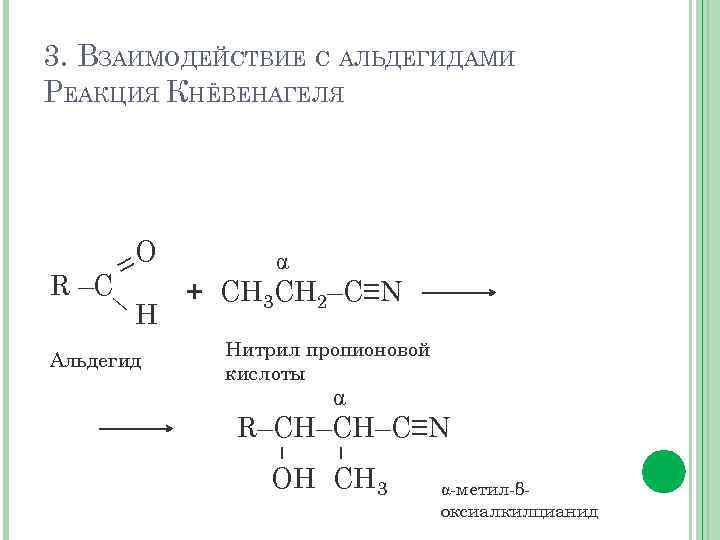 3. ВЗАИМОДЕЙСТВИЕ С АЛЬДЕГИДАМИ РЕАКЦИЯ КНЁВЕНАГЕЛЯ O = R –C— H Альдегид + СН 3 СН 2–C≡N Нитрил пропионовой кислоты R–CH–CH–C≡N – – OH СН 3 -метил-βоксиалкилцианид
3. ВЗАИМОДЕЙСТВИЕ С АЛЬДЕГИДАМИ РЕАКЦИЯ КНЁВЕНАГЕЛЯ O = R –C— H Альдегид + СН 3 СН 2–C≡N Нитрил пропионовой кислоты R–CH–CH–C≡N – – OH СН 3 -метил-βоксиалкилцианид
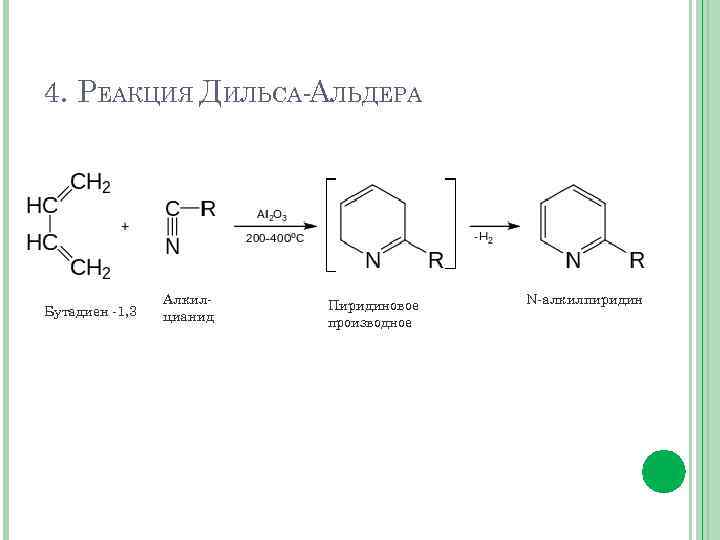 4. РЕАКЦИЯ ДИЛЬСА-АЛЬДЕРА Бутадиен -1, 3 Алкилцианид Пиридиновое производное N-алкилпиридин
4. РЕАКЦИЯ ДИЛЬСА-АЛЬДЕРА Бутадиен -1, 3 Алкилцианид Пиридиновое производное N-алкилпиридин
 ПРИМЕНЕНИЕ Нитрилы широко используются в органическом синтезе, многие реакции органических соединений с нитрилами применяются для наращивания углеродной цепи. Нитрилы используются в качестве растворителей, инициаторов радикально-цепной полимеризации, сырья для получения мономеров, лекарственных средств, пестицидов, пластификаторов. Наибольшее значение имеют ацетонитрил (растворитель, адсорбент при выделении бутадиена из смеси с бутенами), акрилонитрил (мономер для получения синтетического волокна), адиподинитрил (сырьё для синтеза адипиновой кислоты, капролактама, гексаметилендиамина), бензонитрил.
ПРИМЕНЕНИЕ Нитрилы широко используются в органическом синтезе, многие реакции органических соединений с нитрилами применяются для наращивания углеродной цепи. Нитрилы используются в качестве растворителей, инициаторов радикально-цепной полимеризации, сырья для получения мономеров, лекарственных средств, пестицидов, пластификаторов. Наибольшее значение имеют ацетонитрил (растворитель, адсорбент при выделении бутадиена из смеси с бутенами), акрилонитрил (мономер для получения синтетического волокна), адиподинитрил (сырьё для синтеза адипиновой кислоты, капролактама, гексаметилендиамина), бензонитрил.
 Анализ и применение. Для анализа НИТРИЛЫ используют физическиххимический методы, восстановление НИТРИЛЫ на капельном ртутном электроде позволяющее определять их в концентрации до 10 -3 -10 -5 %, а также химический методы, например щелочной гидролиз НИТРИЛЫ с последующей количественное определением NH 3. Применяют НИТРИЛЫ в качестве растворителей, инициаторов радикально-цепной полимеризации и теломеризации, сырья в производстве волокнообразующих полимеров и смол (см. Полиакрилонитрильные волокна, Полиамидные волокна), пластификаторов, лек. веществ и пестицидов. НИТРИЛЫ ядовиты и при работе требуют мер предосторожности (средства индивидуальной защиты, приточно-вытяжная вентиляция). НИТРИЛЫ или их отходы уничтожают щелочным гидролизом или при действии окислителей (растворы Н 2 О 2 или КМn. О 4). Механизм токсич. действия НИТРИЛЫ связан с их способностью нарушать функцию фермента цитохромоксидазы, подавляя процесс переноса кислорода из крови к клеткам организма. Отравление может произойти при вдыхании паров НИТРИЛЫ, при попадании их в желудочно-кишечный тракт или через кожу. Противоядия-амилнитрит, Na 2 S 2 O 3, глюкоза (см. Синильная кислота). Объем производства важнейших НИТРИЛЫ приближается к 5 млн. т/год. См. также Акрилонитрил, Адиподинитрил, Ацетонитемпературил, Бензонитрил и др.
Анализ и применение. Для анализа НИТРИЛЫ используют физическиххимический методы, восстановление НИТРИЛЫ на капельном ртутном электроде позволяющее определять их в концентрации до 10 -3 -10 -5 %, а также химический методы, например щелочной гидролиз НИТРИЛЫ с последующей количественное определением NH 3. Применяют НИТРИЛЫ в качестве растворителей, инициаторов радикально-цепной полимеризации и теломеризации, сырья в производстве волокнообразующих полимеров и смол (см. Полиакрилонитрильные волокна, Полиамидные волокна), пластификаторов, лек. веществ и пестицидов. НИТРИЛЫ ядовиты и при работе требуют мер предосторожности (средства индивидуальной защиты, приточно-вытяжная вентиляция). НИТРИЛЫ или их отходы уничтожают щелочным гидролизом или при действии окислителей (растворы Н 2 О 2 или КМn. О 4). Механизм токсич. действия НИТРИЛЫ связан с их способностью нарушать функцию фермента цитохромоксидазы, подавляя процесс переноса кислорода из крови к клеткам организма. Отравление может произойти при вдыхании паров НИТРИЛЫ, при попадании их в желудочно-кишечный тракт или через кожу. Противоядия-амилнитрит, Na 2 S 2 O 3, глюкоза (см. Синильная кислота). Объем производства важнейших НИТРИЛЫ приближается к 5 млн. т/год. См. также Акрилонитрил, Адиподинитрил, Ацетонитемпературил, Бензонитрил и др.


