 Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ступенів № 11 школи І-ІІІ Смілянської міської ради ст. № 11 Л. В. Заруби
Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ступенів № 11 школи І-ІІІ Смілянської міської ради ст. № 11 Л. В. Заруби
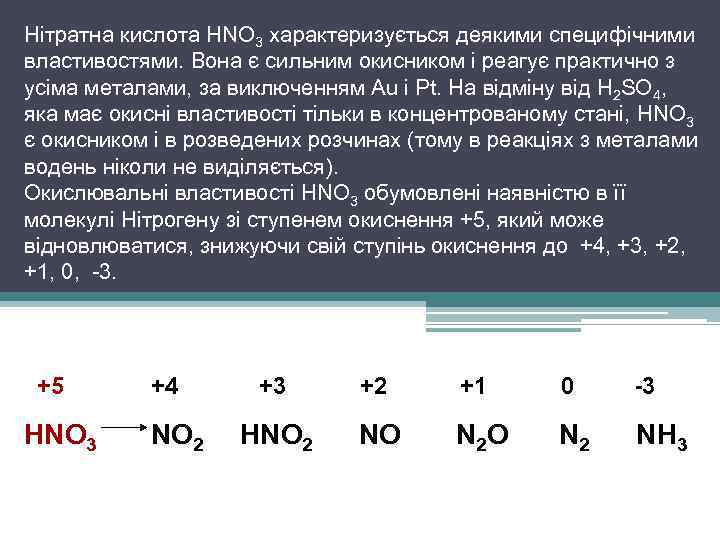 Нітратна кислота HNO 3 характеризується деякими специфічними властивостями. Вона є сильним окисником і реагує практично з усіма металами, за виключенням Au і Pt. На відміну від H 2 SO 4, яка має окисні властивості тільки в концентрованому стані, HNO 3 є окисником і в розведених розчинах (тому в реакціях з металами водень ніколи не виділяється). Окислювальні властивості HNO 3 обумовлені наявністю в її молекулі Нітрогену зі ступенем окиснення +5, який може відновлюватися, знижуючи свій ступінь окиснення до +4, +3, +2, +1, 0, -3. +5 HNO 3 +4 NO 2 +3 +2 +1 0 -3 HNO 2 NO N 2 NH 3
Нітратна кислота HNO 3 характеризується деякими специфічними властивостями. Вона є сильним окисником і реагує практично з усіма металами, за виключенням Au і Pt. На відміну від H 2 SO 4, яка має окисні властивості тільки в концентрованому стані, HNO 3 є окисником і в розведених розчинах (тому в реакціях з металами водень ніколи не виділяється). Окислювальні властивості HNO 3 обумовлені наявністю в її молекулі Нітрогену зі ступенем окиснення +5, який може відновлюватися, знижуючи свій ступінь окиснення до +4, +3, +2, +1, 0, -3. +5 HNO 3 +4 NO 2 +3 +2 +1 0 -3 HNO 2 NO N 2 NH 3
 Взаємодія HNO 3 з металами. 1) водень не утворюється, він окиснюється, утворюючи Н 2 О; 2) утворюється оксид металу, потім розчиняється в HNO 3 і утворюється сіль нітратної кислоти; 3) утворюється продукт відновлення HNO 3 Ме + HNO 3 Ме(NO 3)n+ + Н 2 О
Взаємодія HNO 3 з металами. 1) водень не утворюється, він окиснюється, утворюючи Н 2 О; 2) утворюється оксид металу, потім розчиняється в HNO 3 і утворюється сіль нітратної кислоти; 3) утворюється продукт відновлення HNO 3 Ме + HNO 3 Ме(NO 3)n+ + Н 2 О
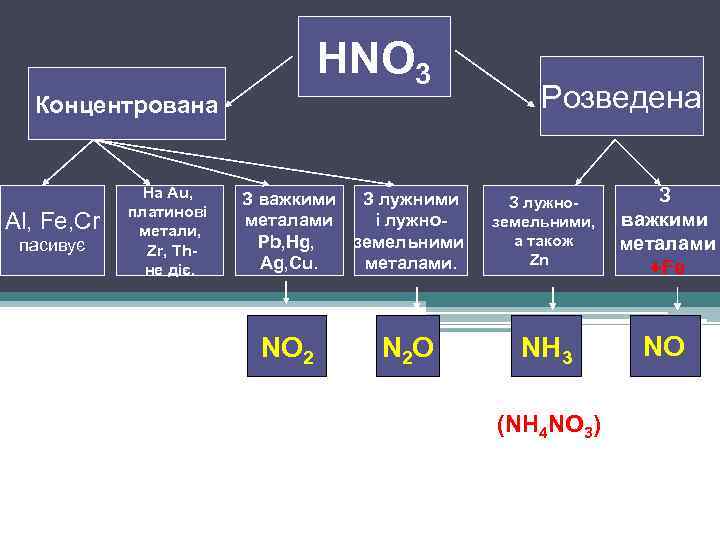 HNO 3 Концентрована Al, Fe, Cr пасивує На Au, платинові метали, Zr, Thне діє. З важкими З лужними металами і лужно. Pb, Hg, земельними Ag, Cu. металами. NO 2 N 2 O Розведена З лужноземельними, а також Zn З важкими металами +Fe NH 3 NO (NH 4 NO 3)
HNO 3 Концентрована Al, Fe, Cr пасивує На Au, платинові метали, Zr, Thне діє. З важкими З лужними металами і лужно. Pb, Hg, земельними Ag, Cu. металами. NO 2 N 2 O Розведена З лужноземельними, а також Zn З важкими металами +Fe NH 3 NO (NH 4 NO 3)
 Взаємодія HNO 3 з міддю Cu + 4 HNO 3 → Cu(NO 3)2 + 2 NO 2↑+ H 2 O бурий газ
Взаємодія HNO 3 з міддю Cu + 4 HNO 3 → Cu(NO 3)2 + 2 NO 2↑+ H 2 O бурий газ
 Взаємодія HNO 3 з неметалами Нітратна кислота окиснює неметали: S → до Н 2 SО 4 Р → до Н 3 РО 4 As → до Н 3 As. О 4 Сама відновлюється: концентрована до - NO 2, розведена до - NO. Якщо в пробірку з HNO 3 конц кинути тліючу вуглинку, вона згорить, перетворившись в СО 2. Іншими продуктами будуть NO 2 і H 2 O. t С + 4 HNO 3 конц→ СО 2 + 4 NO 2 + 2 H 2 O
Взаємодія HNO 3 з неметалами Нітратна кислота окиснює неметали: S → до Н 2 SО 4 Р → до Н 3 РО 4 As → до Н 3 As. О 4 Сама відновлюється: концентрована до - NO 2, розведена до - NO. Якщо в пробірку з HNO 3 конц кинути тліючу вуглинку, вона згорить, перетворившись в СО 2. Іншими продуктами будуть NO 2 і H 2 O. t С + 4 HNO 3 конц→ СО 2 + 4 NO 2 + 2 H 2 O