Презентация 1. бох.ppt
- Количество слайдов: 36

Неорганика, органика и биоорганика

В 1807 г. шведский химик Иенс Якоб Берцелиус первым предложил делить все вещества на 2 класса. Вещества, которые можно добыть из живых организмов, он назвал органическими, а все остальные – неорганическими. Считалось, что первые – продукт жизни, а вторые – нет.

В 1827 г. немецкий химик Фридрих Велер, прокипятив неорганическое вещество – цианат аммония – обнаружил, что оно превратилось в органическое вещество – мочевину. О своём открытии Велер сообщил научному миру в 1828 г.
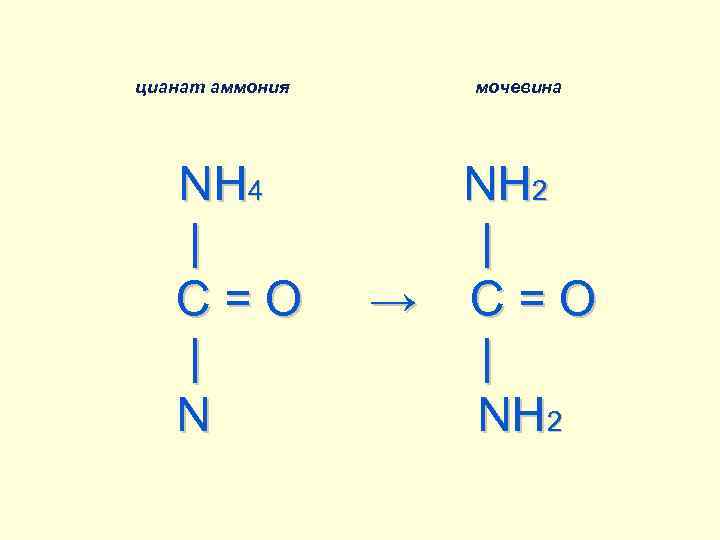
цианат аммония мочевинa NH 4 NH 2 | C = O → C = O | N NH 2
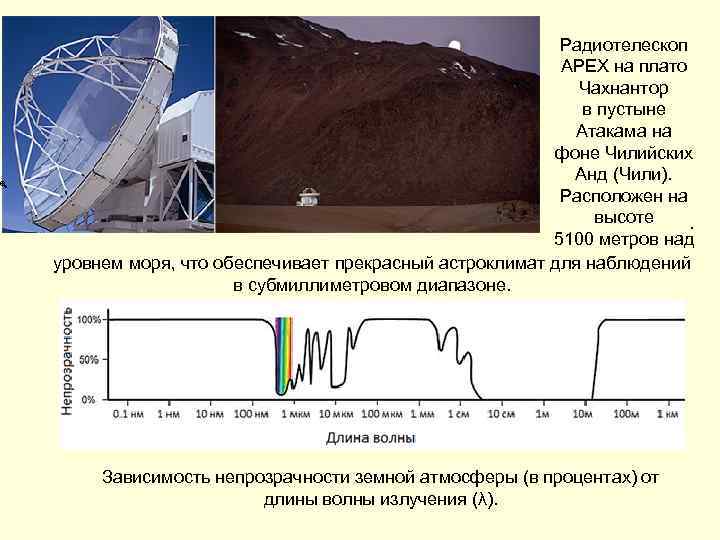
Радиотелескоп APEX на плато Чахнантор в пустыне Атакама на фоне Чилийских Анд (Чили). Расположен на высоте 5100 метров над уровнем моря, что обеспечивает прекрасный астроклимат для наблюдений в субмиллиметровом диапазоне. . Зависимость непрозрачности земной атмосферы (в процентах) от длины волны излучения (λ).
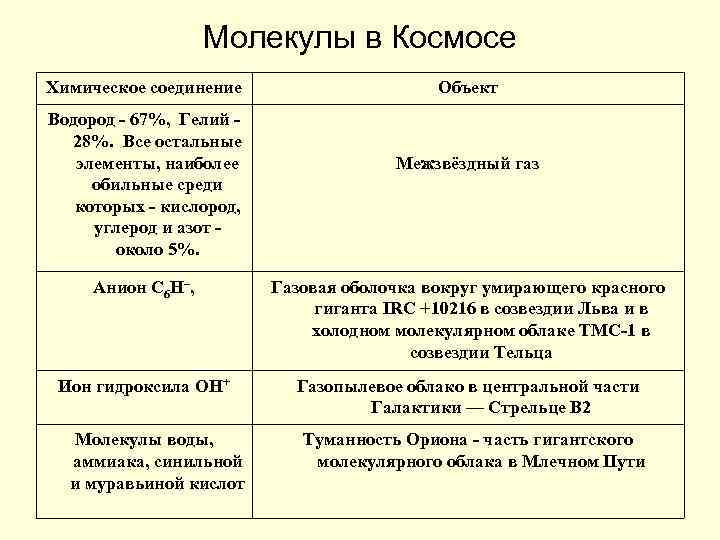
Молекулы в Космосе Химическое соединение Водород - 67%, Гелий - 28%. Все остальные элементы, наиболее обильные среди которых - кислород, углерод и азот - около 5%. Объект Межзвёздный газ Анион C 6 H–, Газовая оболочка вокруг умирающего красного гиганта IRC +10216 в созвездии Льва и в холодном молекулярном облаке TMC-1 в созвездии Тельца Ион гидроксила ОН+ Газопылевое облако в центральной части Галактики — Стрельце B 2 Молекулы воды, аммиака, синильной и муравьиной кислот Туманность Ориона - часть гигантского молекулярного облака в Млечном Пути

Молекулы в Космосе Антрацен, Нафталин Молекулярные облака в направлении звезды Cernis 52 в созвездии Персея Водный лед и органика Поверхность астероидов 65 Кибела и 24 Фемида Формальдегид H 2 CO; окись углерода CO; метанол (древесный спирт) CH 3 OH; этиловый (винный) спирт CH 3 CH 2 OH Эмиссионные туманности, в основном Большая туманность в Мече Ориона Этилформиат (C 2 H 5 OCHO), Пропилцианид (C 3 H 7 CN), Глицин Молекулы сахара (glycolaldehyde) Центр Млечного Пути Газо-пылевое облако Sagittarius B 2,
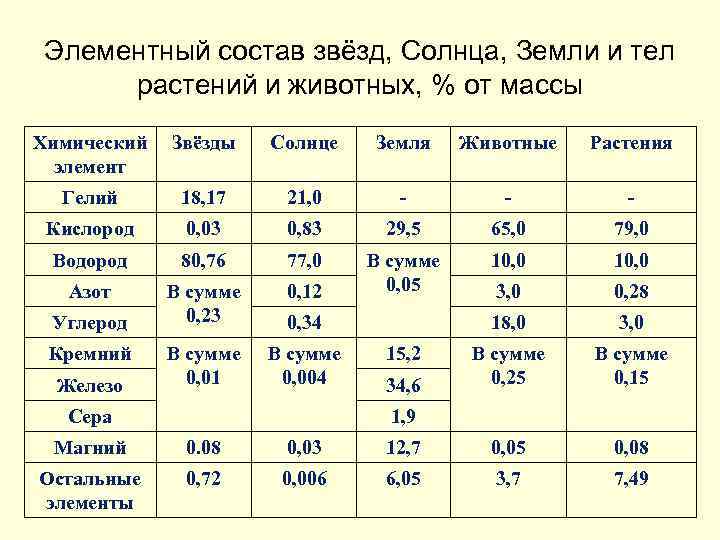
Элементный состав звёзд, Солнца, Земли и тел растений и животных, % от массы Химический Звёзды элемент Солнце Земля Животные Растения Гелий 18, 17 21, 0 - - - Кислород 0, 03 0, 83 29, 5 65, 0 79, 0 Водород 80, 76 77, 0 10, 0 Азот В сумме 0, 23 0, 12 В сумме 0, 05 3, 0 0, 28 18, 0 3, 0 В сумме 0, 01 В сумме 0, 004 В сумме 0, 25 В сумме 0, 15 Углерод Кремний Железо 0, 34 Сера 15, 2 34, 6 1, 9 Магний 0. 08 0, 03 12, 7 0, 05 0, 08 Остальные элементы 0, 72 0, 006 6, 05 3, 7 7, 49
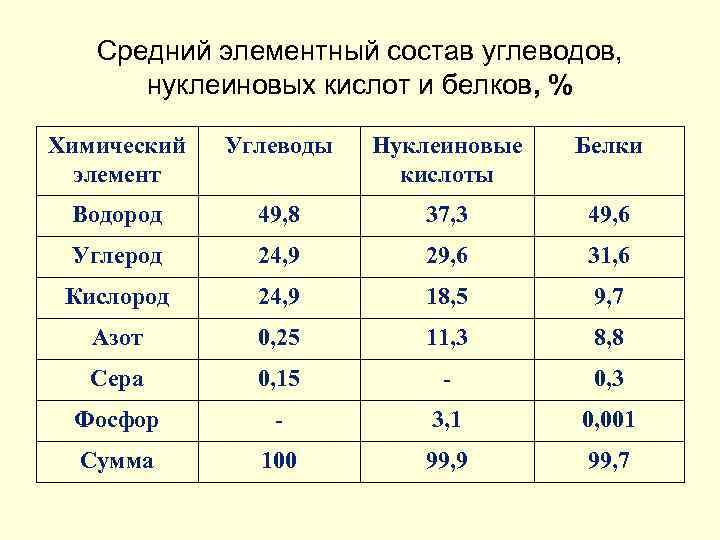
Средний элементный состав углеводов, нуклеиновых кислот и белков, % Химический элемент Углеводы Нуклеиновые кислоты Белки Водород 49, 8 37, 3 49, 6 Углерод 24, 9 29, 6 31, 6 Кислород 24, 9 18, 5 9, 7 Азот 0, 25 11, 3 8, 8 Сера 0, 15 - 0, 3 Фосфор - 3, 1 0, 001 Сумма 100 99, 9 99, 7

Концевые группы, наиболее часто встречающиеся в биоорганических соединениях

Один атом может очень резко изменить свойства молекул. Так, молекулы голубого пигмента васильков и красного пигмента маков различаются всего лишь двумя из атомов – водородом и кислородом.
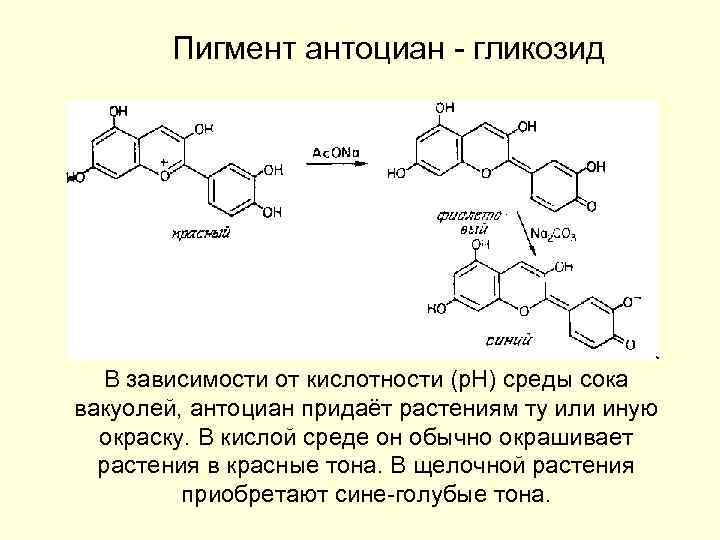
Пигмент антоциан - гликозид В зависимости от кислотности (р. Н) среды сока вакуолей, антоциан придаёт растениям ту или иную окраcку. В кислой среде он обычно окрашивает растения в красные тона. В щелочной растения приобретают сине-голубые тона.

Энергия межатомного взаимодействия для различных типов связей
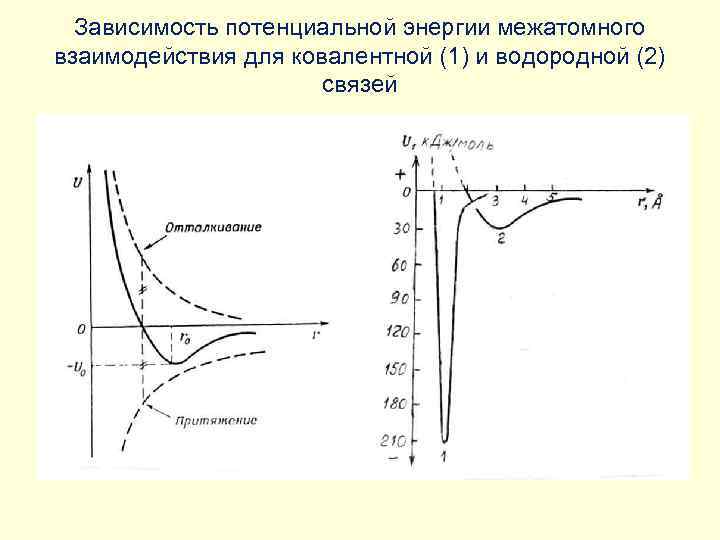
Зависимость потенциальной энергии межатомного взаимодействия для ковалентной (1) и водородной (2) связей
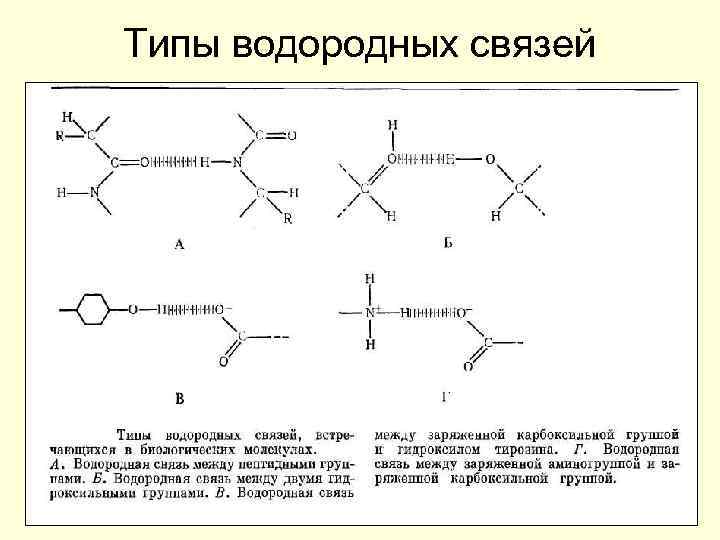
Типы водородных связей

Свойства водородных связей

Вода – пространственный полимер
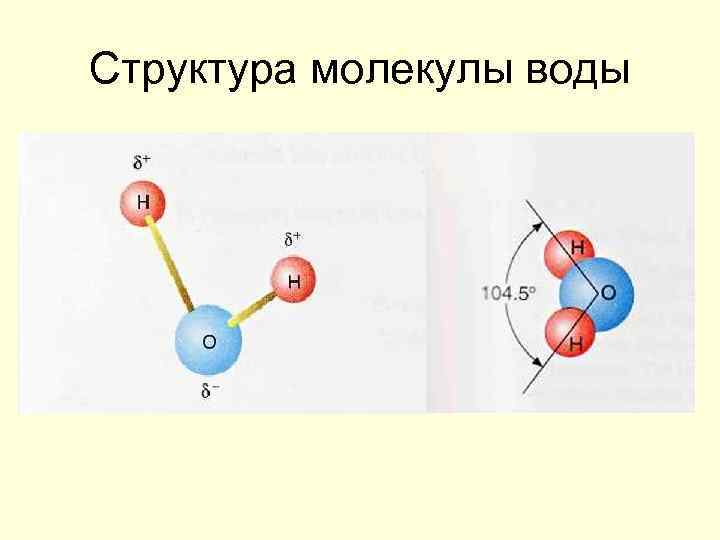
Структура молекулы воды
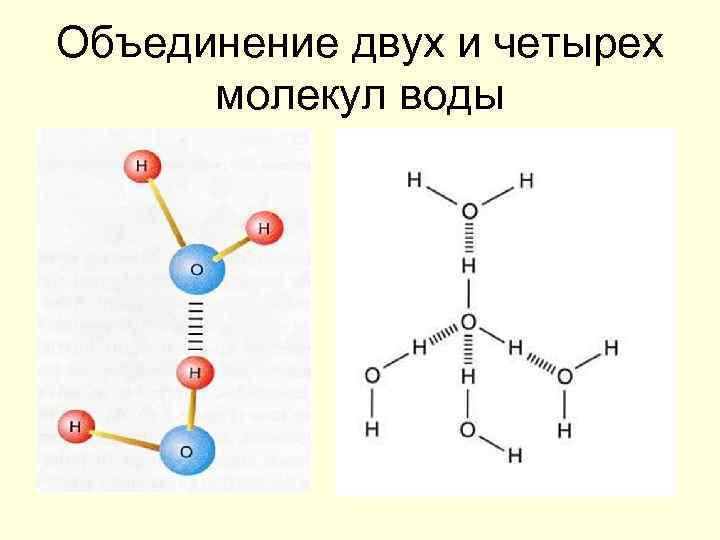
Объединение двух и четырех молекул воды
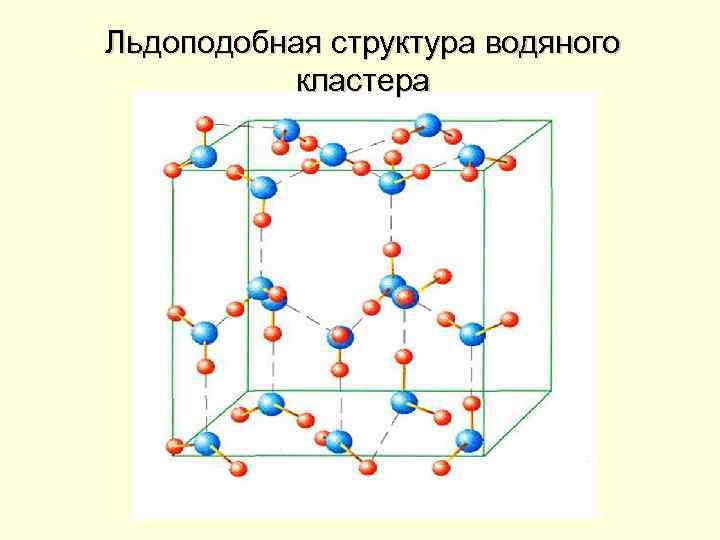
Льдоподобная структура водяного кластера
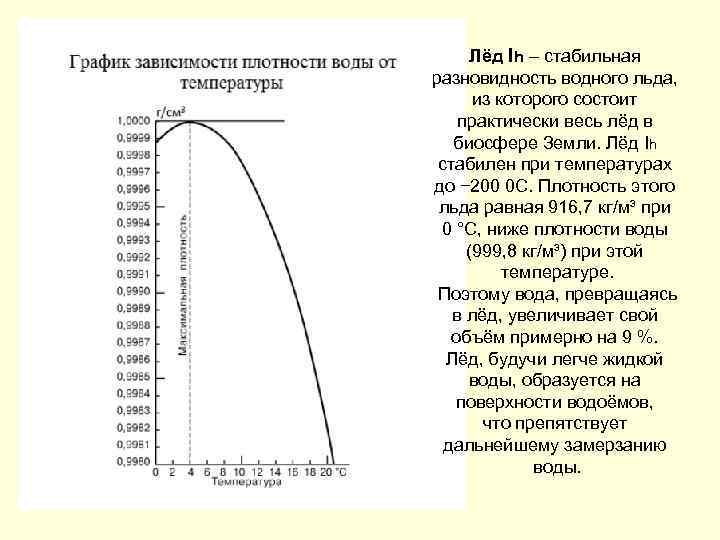
Лёд Ih – стабильная разновидность водного льда, из которого состоит практически весь лёд в биосфере Земли. Лёд Ih стабилен при температурах до − 200 0 С. Плотность этого льда равная 916, 7 кг/м³ при 0 °C, ниже плотности воды (999, 8 кг/м³) при этой температуре. Поэтому вода, превращаясь в лёд, увеличивает свой объём примерно на 9 %. Лёд, будучи легче жидкой воды, образуется на поверхности водоёмов, что препятствует дальнейшему замерзанию воды.
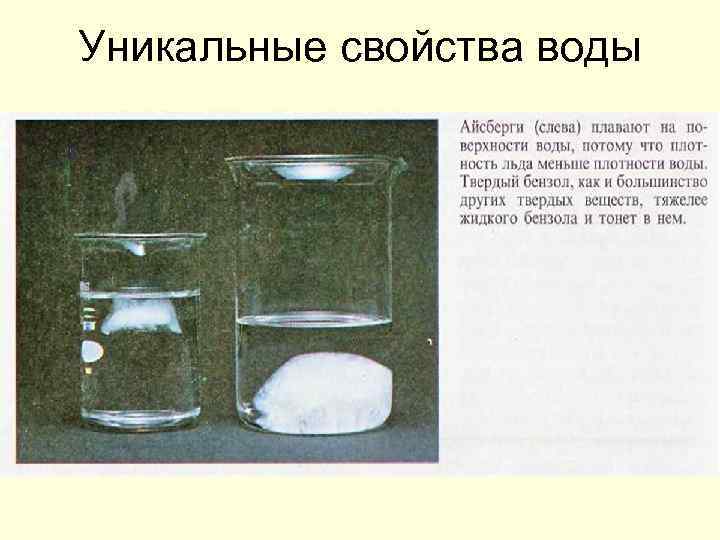
Уникальные свойства воды

Толстый слой воды или льда имеет голубоватую окраску, как этот ледник в Глэйшер-Бей на Аляске
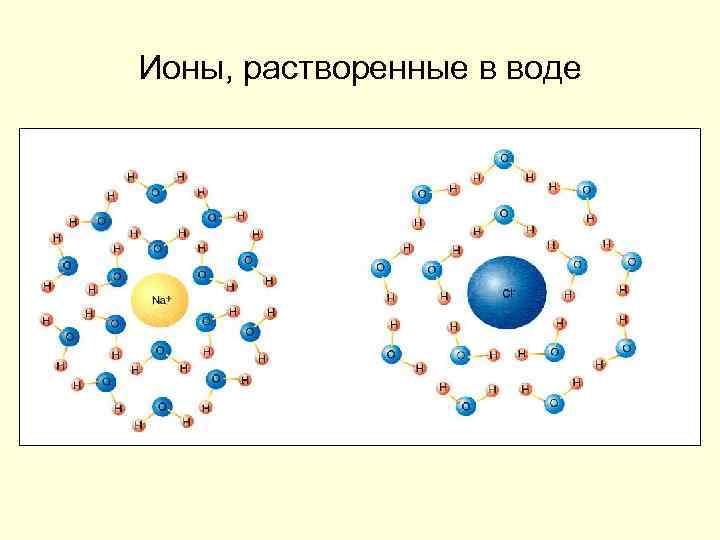
Ионы, растворенные в воде
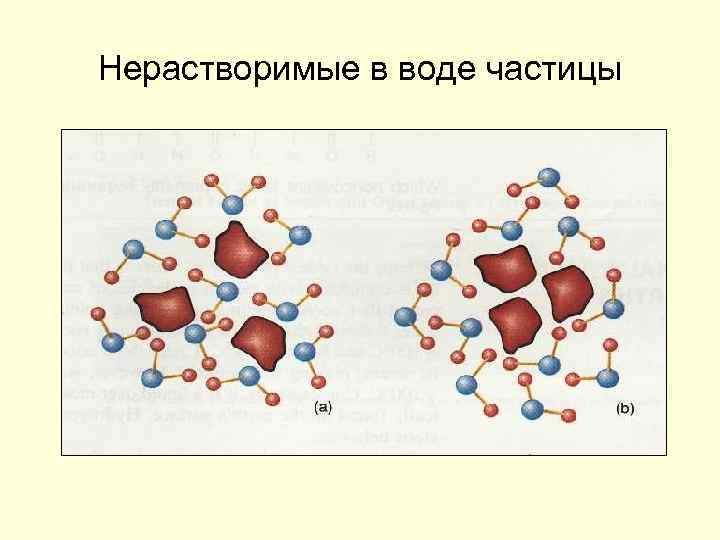
Нерастворимые в воде частицы
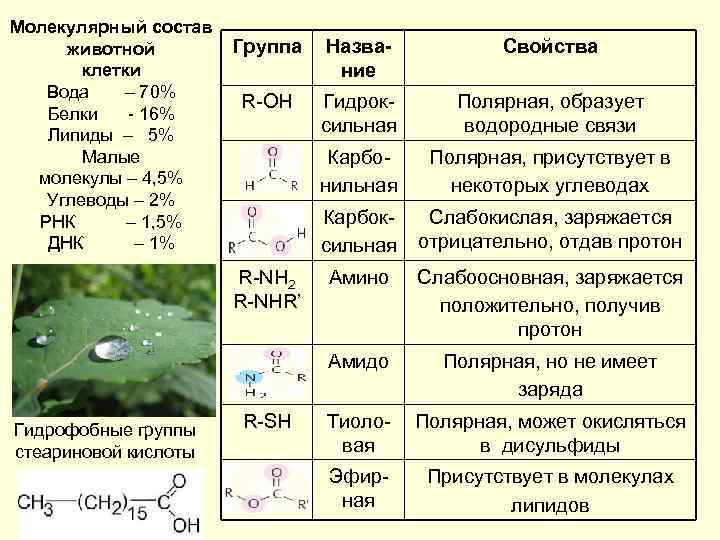
Молекулярный состав животной клетки Вода – 70% Белки - 16% Липиды – 5% Малые молекулы – 4, 5% Углеводы – 2% РНК – 1, 5% ДНК – 1% Группа Название Свойства R-OH Гидроксильная Полярная, образует водородные связи Карбонильная Полярная, присутствует в некоторых углеводах Карбоксильная Слабокислая, заряжается отрицательно, отдав протон Амино Слабоосновная, заряжается положительно, получив протон Амидо Полярная, но не имеет заряда Тиоловая Полярная, может окисляться в дисульфиды Эфирная Присутствует в молекулах липидов R-NH 2 R-NHR’ Гидрофобные группы стеариновой кислоты R-SH

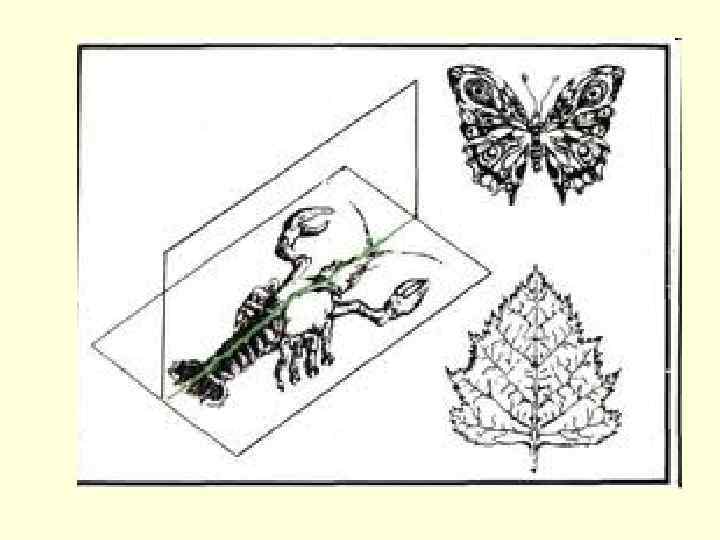
Симметрия молекул


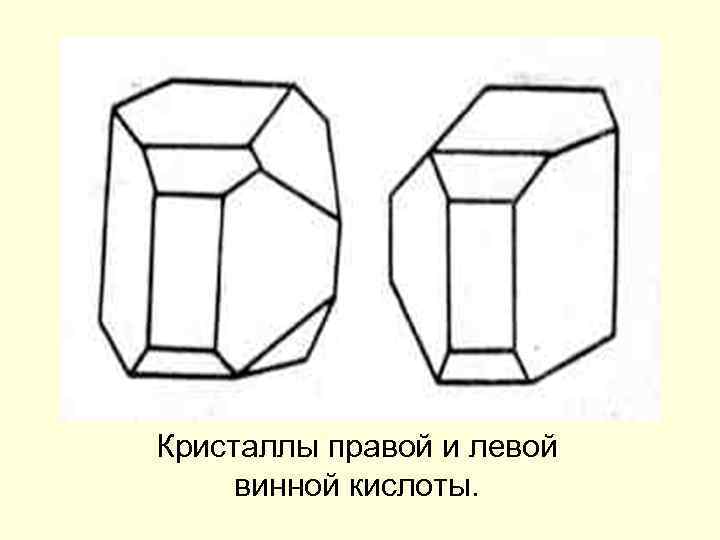
Кристаллы правой и левой винной кислоты.
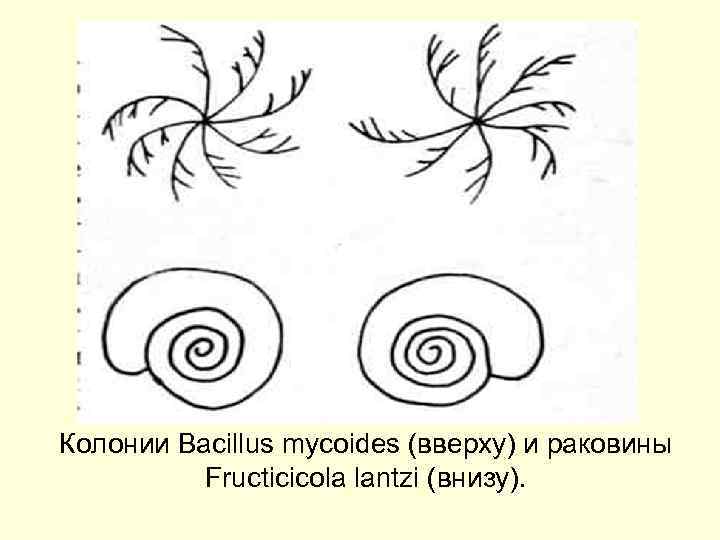
Колонии Bacillus mycoides (вверху) и раковины Fructicicola lantzi (внизу).
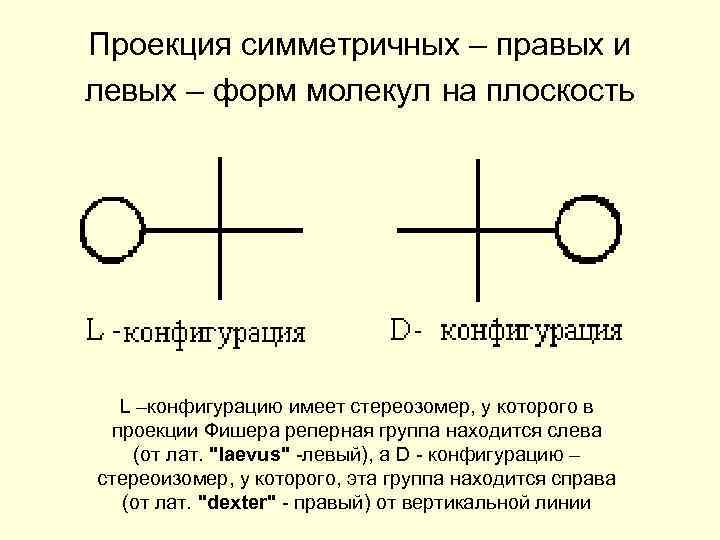
Проекция симметричных – правых и левых – форм молекул на плоскость L –конфигурацию имеет стереозомер, у которого в проекции Фишера реперная группа находится слева (от лат. "laevus" -левый), а D - конфигурацию – стереоизомер, у которого, эта группа находится справа (от лат. "dexter" - правый) от вертикальной линии
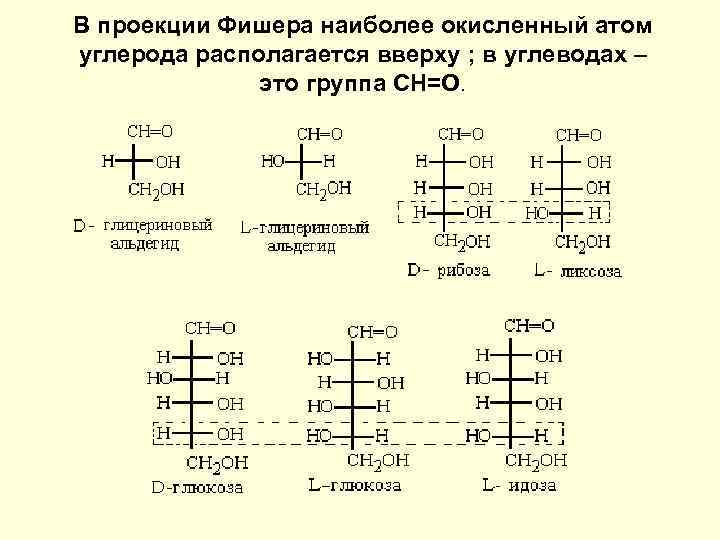
В проекции Фишера наиболее окисленный атом углерода располагается вверху ; в углеводах – это группа СН=О.
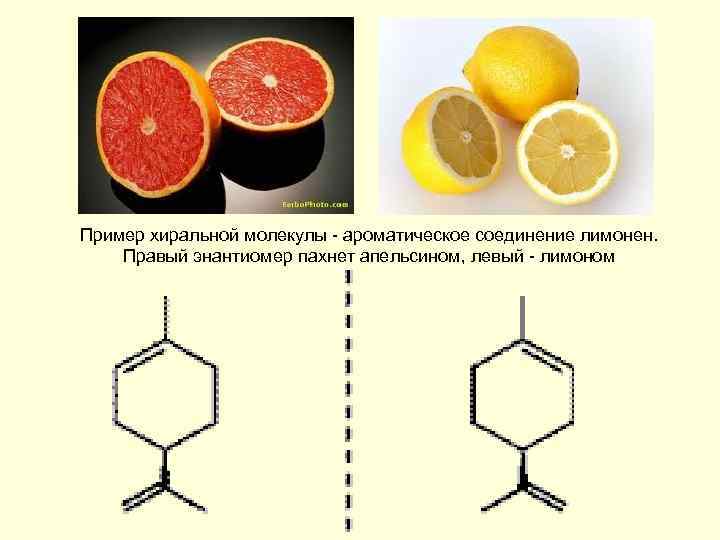
Пример хиральной молекулы - ароматическое соединение лимонен. Правый энантиомер пахнет апельсином, левый - лимоном

Уильям Ноулз Барри Шарплесс Риоджи Нойори. Нобелевская премия по химии 2001 года У. Ноулз в 1968 году создал хиральные катализаторы, позволяющие в реакции гидрогенирования (присоединения водорода к атомам углерода) получать молекулы в основном той же хиральности, что и катализатор. На основе этих катализаторов удалось разработать промышленный процесс производства L-DOPA –лекарства от болезни Паркинсона. Р. Нойори в 1980 году смог усовершенствовать катализаторы Ноулза, так что реакции с их участием стали давать почти исключительно один энантиомер. Это позволило наладить производство некоторых антибиотиков и ароматизаторов, молекулы которых действенны только в одной хиральной форме. В том же году Б. Шарплесс получил катализаторы для другого важного класса химических реакций - окисления, также позволяющие синтезировать продукты заданной хиральности. На основе процессов направленного окисления сейчас производят бета-блокаторы - медикаменты, защищающие сердце от излишнего возбуждения. Хиральные катализаторы применяются также для синтеза вкусовых добавок и инсектицидов
Презентация 1. бох.ppt