 Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на атомы металлов, и кислотного остатка. 900 igr. net H+n R-n, где R- кислотный остаток ; n- число атомов водорода, равное валентности кислотного остатка.
Неорганические кислоты- это сложные неорганические вещества, молекулы которых содержат один или несколько атомов водорода, способных замещаться на атомы металлов, и кислотного остатка. 900 igr. net H+n R-n, где R- кислотный остаток ; n- число атомов водорода, равное валентности кислотного остатка.
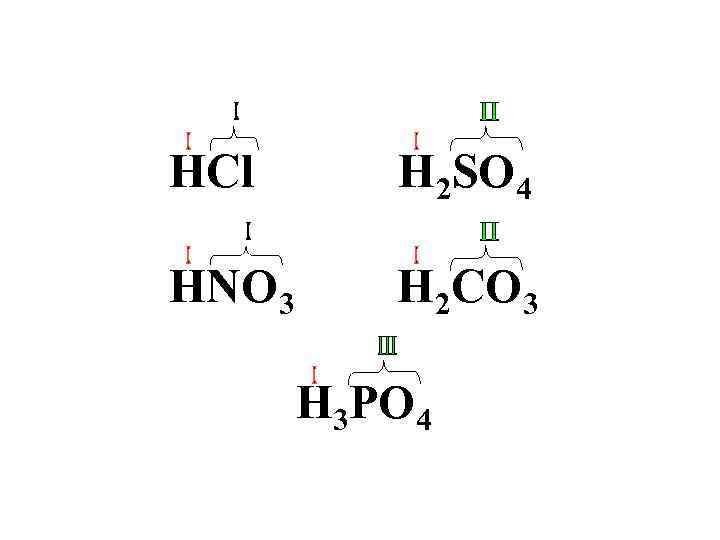 HCl H 2 SO 4 HNO 3 H 2 CO 3 H 3 PO 4
HCl H 2 SO 4 HNO 3 H 2 CO 3 H 3 PO 4
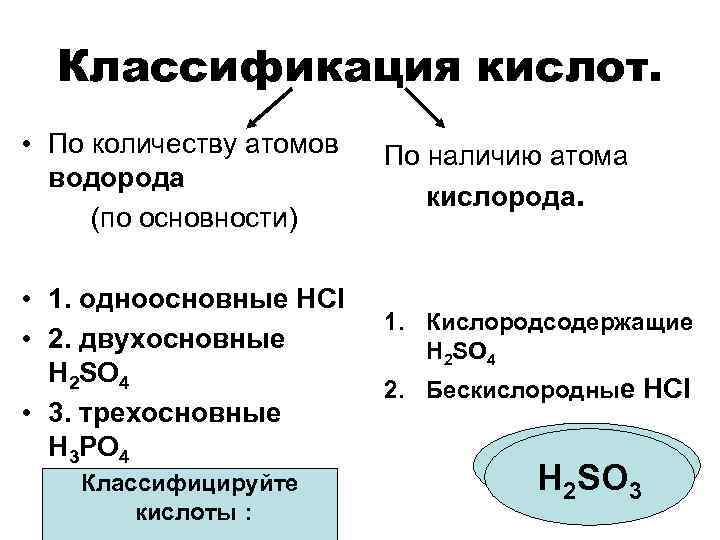 Классификация кислот. • По количеству атомов водорода (по основности) • 1. одноосновные HCl • 2. двухосновные H 2 SO 4 • 3. трехосновные H 3 PO 4 Классифицируйте кислоты : По наличию атома кислорода. 1. Кислородсодержащие H 2 SO 4 2. Бескислородные HCl HHF 3 2 SO
Классификация кислот. • По количеству атомов водорода (по основности) • 1. одноосновные HCl • 2. двухосновные H 2 SO 4 • 3. трехосновные H 3 PO 4 Классифицируйте кислоты : По наличию атома кислорода. 1. Кислородсодержащие H 2 SO 4 2. Бескислородные HCl HHF 3 2 SO
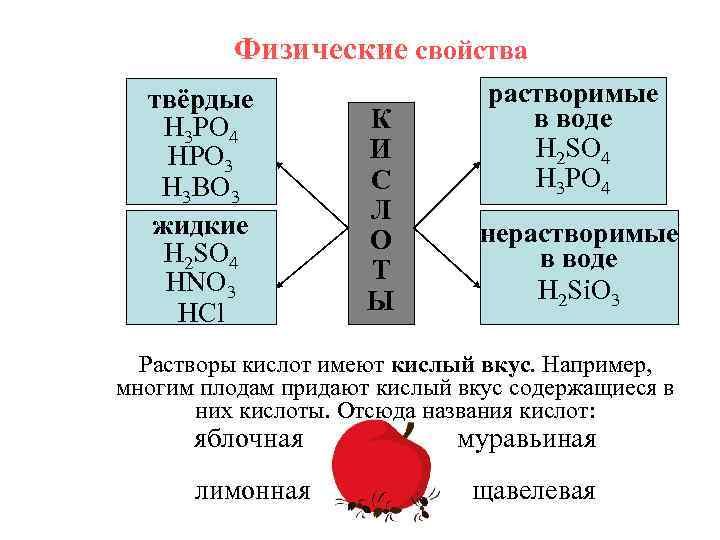 Физические свойства твёрдые H 3 PO 4 HPO 3 H 3 BO 3 жидкие H 2 SO 4 HNO 3 HCl К И С Л О Т Ы растворимые в воде H 2 SO 4 H 3 PO 4 нерастворимые в воде H 2 Si. O 3 Растворы кислот имеют кислый вкус. Например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: яблочная муравьиная лимонная щавелевая
Физические свойства твёрдые H 3 PO 4 HPO 3 H 3 BO 3 жидкие H 2 SO 4 HNO 3 HCl К И С Л О Т Ы растворимые в воде H 2 SO 4 H 3 PO 4 нерастворимые в воде H 2 Si. O 3 Растворы кислот имеют кислый вкус. Например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда названия кислот: яблочная муравьиная лимонная щавелевая
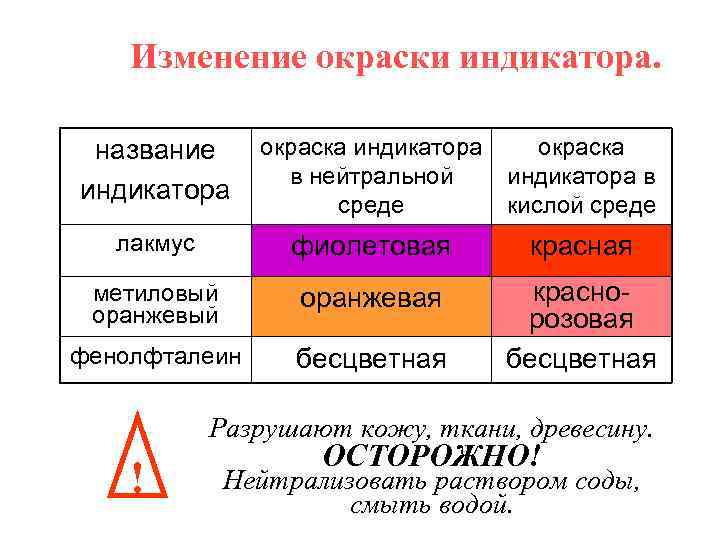 Изменение окраски индикатора. название индикатора окраска индикатора в нейтральной среде окраска индикатора в кислой среде лакмус фиолетовая красная метиловый оранжевая фенолфталеин бесцветная краснорозовая бесцветная Разрушают кожу, ткани, древесину. ! ОСТОРОЖНО! Нейтрализовать раствором соды, смыть водой.
Изменение окраски индикатора. название индикатора окраска индикатора в нейтральной среде окраска индикатора в кислой среде лакмус фиолетовая красная метиловый оранжевая фенолфталеин бесцветная краснорозовая бесцветная Разрушают кожу, ткани, древесину. ! ОСТОРОЖНО! Нейтрализовать раствором соды, смыть водой.
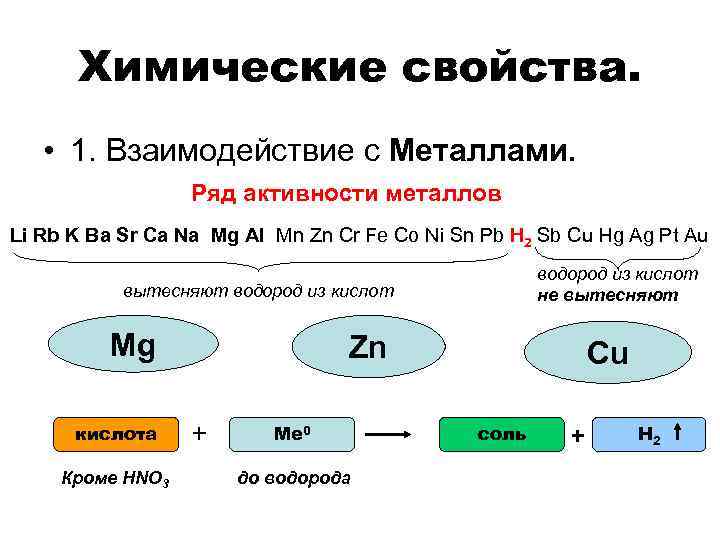 Химические свойства. • 1. Взаимодействие с Металлами. Ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H 2 Sb Cu Hg Ag Pt Au водород из кислот не вытесняют водород из кислот Mg кислота Кроме HNO 3 Zn + Ме 0 до водорода Сu соль + Н 2
Химические свойства. • 1. Взаимодействие с Металлами. Ряд активности металлов Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Co Ni Sn Pb H 2 Sb Cu Hg Ag Pt Au водород из кислот не вытесняют водород из кислот Mg кислота Кроме HNO 3 Zn + Ме 0 до водорода Сu соль + Н 2
 Русский химик, академик Петербургской Академии наук. Основоположник физической химии. В 1863 г. составил вытеснительный ряд металлов, который называется по имени ученого.
Русский химик, академик Петербургской Академии наук. Основоположник физической химии. В 1863 г. составил вытеснительный ряд металлов, который называется по имени ученого.
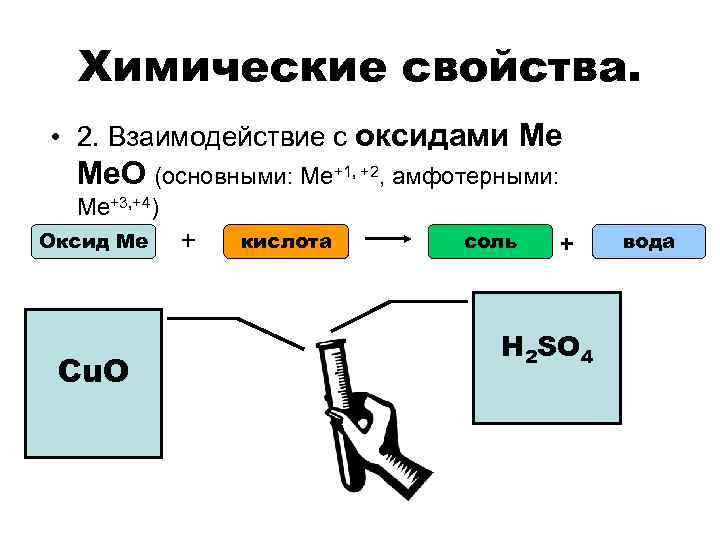 Химические свойства. • 2. Взаимодействие с оксидами Ме Ме. О (основными: Ме+1, +2, амфотерными: Ме+3, +4) Оксид Ме Cu. O + кислота соль + H 2 SO 4 вода
Химические свойства. • 2. Взаимодействие с оксидами Ме Ме. О (основными: Ме+1, +2, амфотерными: Ме+3, +4) Оксид Ме Cu. O + кислота соль + H 2 SO 4 вода
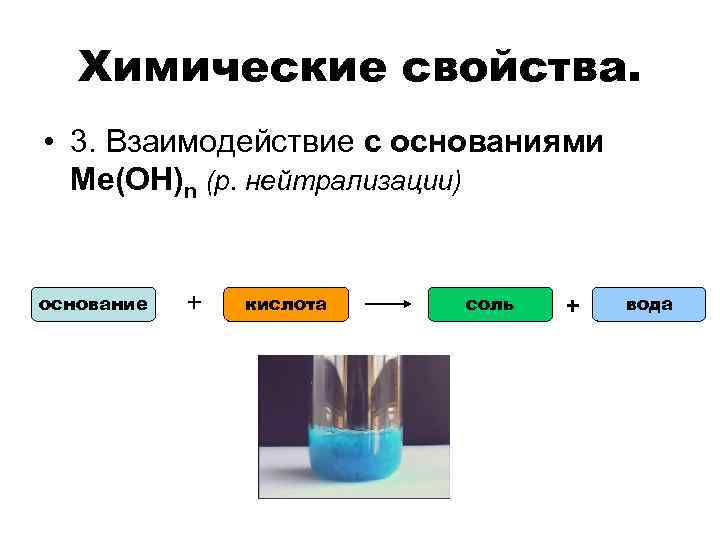 Химические свойства. • 3. Взаимодействие с основаниями Ме(ОН)n (р. нейтрализации) основание + кислота соль + вода
Химические свойства. • 3. Взаимодействие с основаниями Ме(ОН)n (р. нейтрализации) основание + кислота соль + вода
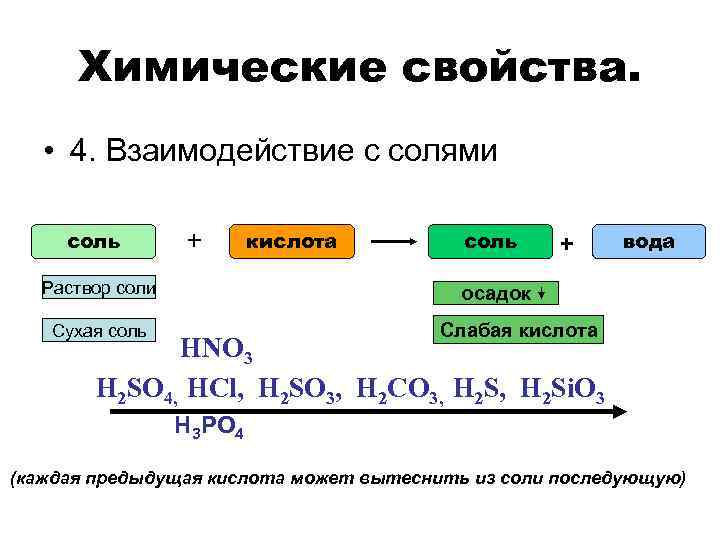 Химические свойства. • 4. Взаимодействие с солями соль + Раствор соли кислота соль + вода осадок Слабая кислота Сухая соль HNO 3 H 2 SO 4, HCl, H 2 SO 3, H 2 CO 3, H 2 Si. O 3 H 3 PO 4 (каждая предыдущая кислота может вытеснить из соли последующую)
Химические свойства. • 4. Взаимодействие с солями соль + Раствор соли кислота соль + вода осадок Слабая кислота Сухая соль HNO 3 H 2 SO 4, HCl, H 2 SO 3, H 2 CO 3, H 2 Si. O 3 H 3 PO 4 (каждая предыдущая кислота может вытеснить из соли последующую)
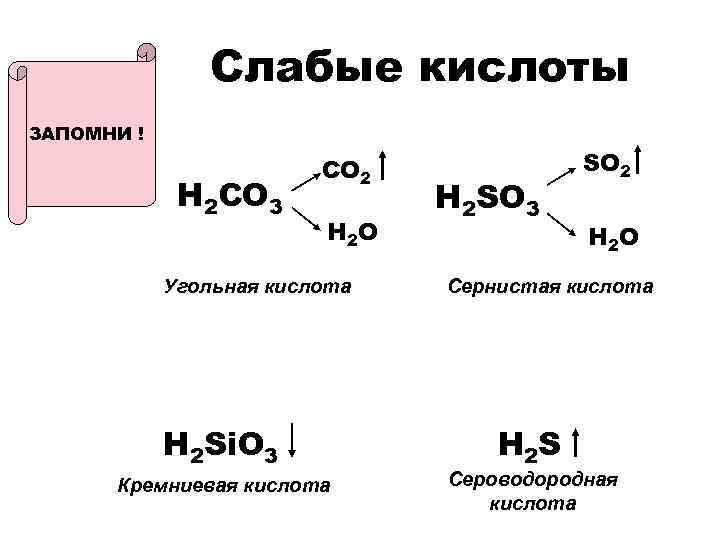 Слабые кислоты ЗАПОМНИ ! • H 2 CO 3 CO 2 H 2 O Угольная кислота H 2 Si. O 3 Кремниевая кислота H 2 SO 3 SO 2 H 2 O Сернистая кислота H 2 S Сероводородная кислота
Слабые кислоты ЗАПОМНИ ! • H 2 CO 3 CO 2 H 2 O Угольная кислота H 2 Si. O 3 Кремниевая кислота H 2 SO 3 SO 2 H 2 O Сернистая кислота H 2 S Сероводородная кислота
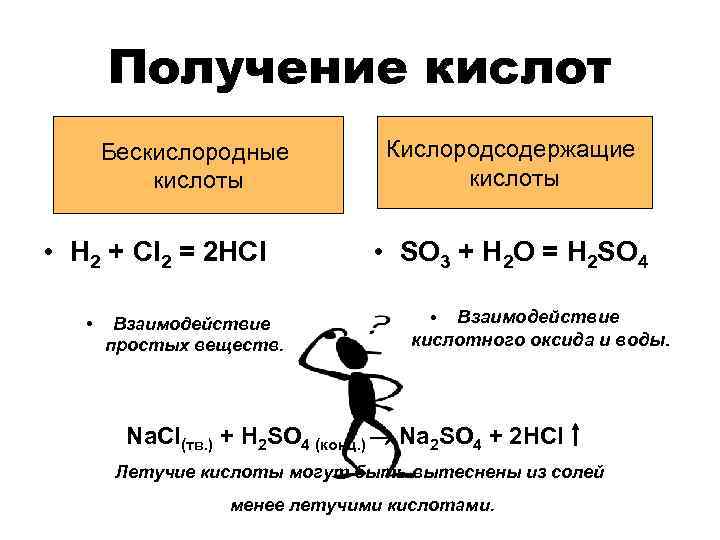 Получение кислот Бескислородные кислоты • H 2 + Cl 2 = 2 HCl • Взаимодействие простых веществ. Кислородсодержащие кислоты • SO 3 + H 2 O = H 2 SO 4 • Взаимодействие кислотного оксида и воды. Na. Cl(тв. ) + H 2 SO 4 (конц. ) Na 2 SO 4 + 2 HCl Летучие кислоты могут быть вытеснены из солей менее летучими кислотами.
Получение кислот Бескислородные кислоты • H 2 + Cl 2 = 2 HCl • Взаимодействие простых веществ. Кислородсодержащие кислоты • SO 3 + H 2 O = H 2 SO 4 • Взаимодействие кислотного оксида и воды. Na. Cl(тв. ) + H 2 SO 4 (конц. ) Na 2 SO 4 + 2 HCl Летучие кислоты могут быть вытеснены из солей менее летучими кислотами.