0cd05ffd3c5c62ceca7715ba6c0d53f9.ppt
- Количество слайдов: 59

Необходимость применения внутривенного железа при анемии у онкологических больных к. м. н. Россоха Е. И.

Многочисленные наблюдательные и регистрационные исследования последних лет показали, что анемия является одним из частых осложнений онкологических заболеваний. Выраженность анемии может варьировать в зависимости: от распространенности неоплазии возраста пациента проводимого лечения. По данным одного из наиболее объемных регистрационных исследований ECAS включившего данные полугодового наблюдения 15 тыс. пациентов с различными новообразованиями в странах Евросоюза анемия была у 39% первичных пациентов и развивалась у 62% в процессе лечения. Количество онкологических пациентов, нуждающихся в коррекции анемии составляет около 1, 5 миллионов.

На протяжении заболевания и лечения у каждого четвертого больного со злокачественными опухолями развивается анемия. При постановке диагноза анемия регистрируется в 20 -60% наблюдений. Редко - при меланоме, саркоме мягких тканей, мозговых опухолях. 40 -60% при раке предстательной железы, яичников, легких. 60 -80% гематологические опухоли. B. Coiffer (2001 -2004)

В ноябре 2000 г в США создан Национальный совет противодействия анемии (National Anemia Action Council, NAAC). В комитет включены 30 экспертов. В 2004 г. Монография «Анемия –скрытая эпидемия? » .

Анемия, развивающаяся на фоне опухоли, называется раково-зависимой анемией или анемией злокачественных новообразований (АЗН). Данный вид анемии является одной из разновидностей хронических болезней, которая встречается при многих заболеваниях, таких как ревматоидный артрит, хронические инфекционные заболевания, туберкулез, системная грибковая инфекция. Gartwright G. E. 1966 г

Гипоксия способна изменять биологию опухоли. Клетка, находящаяся в состоянии кислородного голодания, с одной стороны, меняет пути метаболизма, включает механизмы приспособления, что способствует ее росту и метастазированию Глубокая гипоксия также приводит к увеличению частоты изменений хромосом - спонтанных мутаций, одна из которых являются поломки гена р53, определяющего апоптоз. Торможение апоптоза может значительно уменьшить чувствительность опухоли к цитостатической и лучевой терапии
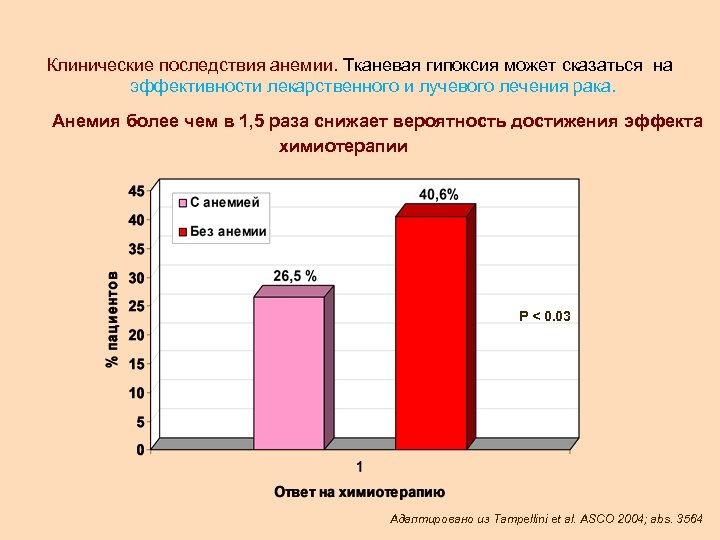
Клинические последствия анемии. Тканевая гипоксия может сказаться на эффективности лекарственного и лучевого лечения рака. Анемия более чем в 1, 5 раза снижает вероятность достижения эффекта химиотерапии P < 0. 03 Адаптировано из Tampellini et al. ASCO 2004; abs. 3564

При анемии возрастает риск смерти У пациентов с уровнем Hb < 9, 0 г/дл относительный риск смерти в 2, 11 раза выше, чем у пациентов с уровнем Hb 11 -12 г/дл 1. Анемия осложняет течение и прогноз ССЗ*, и тесно с ними связана. ГЛЖ выявляется у 74% больных, впервые начинающих диализ². ᄉ 1 Ofsthun N, et al, The effects of higher hemoglobin levels on mortality and hospitalizaitin hemodialysis patients. Kidney Int. 2003; 63: 1908 -1914. ᄉ 2 Levin A, et al. Am J Kidney Dis 1999; 43(1); 125 -134 * Сердечно-сосудистые заболевания

По данным мета-анализа 60 РКИ, анемия у онкологических больных увеличивает риск смерти в среднем на 65% ! анализ данных, содержащихся в 40 публикациях, для оценки влияния анемии на выживаемость онкологических больных. Этот анализ показал, что медиана ежегодного риска смерти больных с анемией в целом на 65% выше, чем больных без анемии. Различие зависело от локализации опухоли и колебалось от 19% при раке легкого до 75% у больных с опухолями головы и шеи

Федеральная целевая программа «Предупреждение и борьба с онкологическими заболеваниями до 2020 года» Основные цели программы: • • Снижение смертности на 4%. Увеличение продолжительности жизни за счет внедрения современных методов профилактики, ранней диагностики злокачественных новообразований, лечения и реабилитации онкологических больных, совершенствования материально-технической базы онкологических учреждений и учреждений общей лечебной сети Федеральная целевая программа «Предупреждение и борьба с онкологическими заболеваниями до 2020 года»
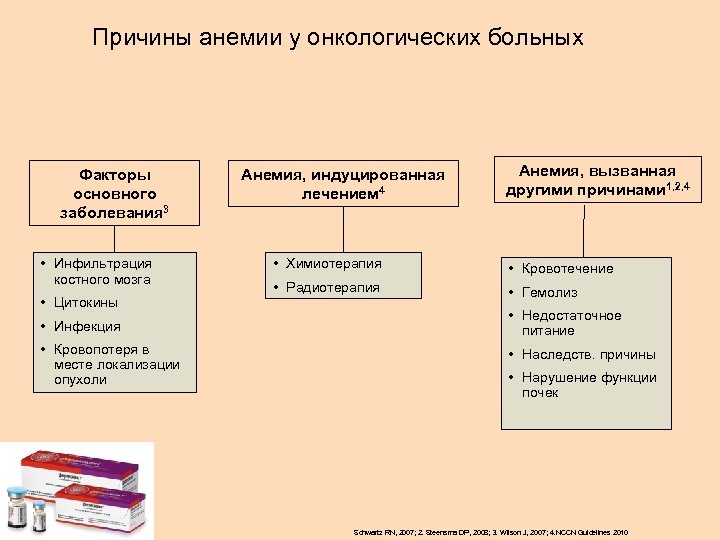
Причины анемии у онкологических больных Факторы основного заболевания 3 • Инфильтрация костного мозга • Цитокины • Инфекция • Кровопотеря в месте локализации опухоли Анемия, индуцированная лечением 4 Анемия, вызванная другими причинами 1, 2, 4 • Химиотерапия • Кровотечение • Радиотерапия • Гемолиз • Недостаточное питание • Наследств. причины • Нарушение функции почек Schwartz RN, 2007; 2. Steensma DP, 2008; 3. Wilson J, 2007; 4. NCCN Guidelines 2010

Наличие анемии является показанием для ее лечения.

. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ по лекарственному лечению злокачественных опухолей. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ЛЕЧЕНИЮ АНЕМИИ У БОЛЬНЫХ ЗЛОКАЧЕСТВЕННЫМИ НОВООБРАЗОВАНИЯМИ Ноябрь 2014 г (RUSSCO).

Цель: помощь клиницистам в подборе оптимальной терапии для конкретного больного. В сборнике представлены современные клинические рекомендации по поддерживающей терапии в онкологии, разработанные группами экспертов российского Общества онкологов-химиотерапевтов (RUSSCO). Настоящие рекомендации основаны на принципах доказательной медицины и являются практическим руководством для врачей-онкологов

Терапия анемии у онкологических пациентов Виды терапии преимущества и недостатки Переливание крови • немедленная коррекция анемии 1, но высокий риск инфицирования Пероральное железо • Повышенный уровень гепцидина препятствует всасыванию железа из ЖКТ ЭПО без препаратов железа • 50 -70% уровень ответа на терапию 2, 3, 4, 5 • Снижение потребности в трансфузиях5, 6, 7 • Улучшение качества жизни 5, 6, 7, 8 ЭПО с перор. преп. железа ЭПО с в/в препаратами железа • Побочные эффекты1, 8, 13 • Малоэффективны с терапией ЭПО • До 90% уровень ответа 12 • Коррекция железодефицита 9 -12 • Снижение потребности в трансфузиях9 • Улучшение качества жизни 10 1. NCCN Guidelines 2010; 2. Glaspy J, 1997; 3. Demetri GD, 1998; 4. Gabrilove JL, 2001; 5: Littlewood TJ, 2001; 6. Vansteenkiste J, 2002; 7. Bohlius J, 2006; 8. Bokemeyer C, 2007; 9. Bastit L, 2008; 10. Auerbach M, 2004; 11. Pedrazzoli P, 2008; 12 Henry DH, 2007; 13. Aapro M, 2008

Преимущества и недостатки транфузионной терапии Преимущества 1. Немедленный эффект 2. Невысокая стоимость лечения Недостатки 1. Риск аллергических и трансфузионных реакций острый или хронический гемолиз 2. Риск инфекций 3. Иммунная супрессия. 4. Отказ некоторых пациентов от трансфузий 5. Снабжение донорской кровью ограничено ежегодно недостаток крови в России может достигнуть 1, 9 млн литров в год 6. Уход за трансфузионной системой, требующий времени

Средство «скорой помощи» при острой выраженной анемии. гемотрансфузии при снижении концентрации гемоглобина менее 7080 г/л показаны в случае острых постгеморрагических анемий, при одномоментном снижении гематокрита до 25% и менее. Показания – IV ст анемии (приказ № 363 от 25. 11. 02 МЗ РФ об утверждении инструкции по применению компонентов крови) периливание эритроцитов возможно в случаи потери 1/3 общего объема циркулирующей крови и снижения уровня гемоглобина менее 7 г/л Кратковременность эффекта. Без повторных, иногда множественных гемотрансфузий анемизация быстро прогрессирует.

МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ПРИКАЗ от 2 апреля 2013 года N 183 н Об утверждении правил клинического использования донорской крови и (или) ее компонентов В соответствии с пунктом 7 части 2 статьи 9 Федерального закона от 20 июля 2012 года N 125 -ФЗ "О донорстве крови и ее компонентов" (Собрание законодательства Российской Федерации, 2012, N 30, ст. 4176) приказываю: Утвердить прилагаемые Правила клинического использования донорской крови и (или) ее компонентов.

ВОЗ рекомендует максимально регламентировать заместительные гемотрансфузии и использовать альтернативные методики коррекции Hb. Традиционный метод коррекции сниженного Hb и жизнеугрожающих ситуаций, связанных с кровопотерей (обширные операции и травма), – заместительные трансфузии эритромассы – не являются безопасным и эффективным методом у онкологических больных. (из рекомендаций RUSSCO)

При хронических анемиях главной задачей является устранение причины, вызвавшей анемию, и гемотрансфузии назначаются только для коррекции важнейших симптомов, обусловленных гипоксией вследствие снижения гемоглобина и не поддающихся основной патогенетической терапии.

Патогенетическое лечение Факторы, отвечающие за развитие анемии у пациентов с опухолевой патологией: - относительный или абсолютный дефицит эндогенного эритропоэтина. Следовательно, применение рч-ЭПО позволяет скоррегировать анемию и снизить риск развития осложнений (включая возможные последствия гематрансфузий - абсолютный или функциональный дефицит железа у больных злокачественными опухолями. 2013 г-это год внутривенных препаратов железа для коррекции ЖДА у онкологических больных. Две крупные конференции ESMO MASCC подтвердили актуальность этой проблемы.

Новая редакция ESMO 2010 г NCCN 2012 г по использованию эпоэтина и дарбоэтина у взрослых пациентов -ЭПА могут применяться только у больных с анемией, являющейся осложнением химиотерапии при уровне Hb менее 10 г/дл. Цель лечения-предотвращение гемотрансфузий и возможных осложнений. -Больным , не получающим химиотерапию ЭСА не показаны ввиду возможного повышения риска смерти. -Алгоритм назначения ЭСА проводится согласно рекомендациям. -Пациентам с потенциально излечимыми опухолями следует избегать применения ЭСА. -Перед проведением терапии препаратами , стимулирующими эритропоэз, необходимо устранить дефицит железа в организме. -У больных с анемией и дефицитом железа внутривенное введение железа приводит к более выраженному повышению уровня гемоглобина , чем в отсутствие препаратов железа или при назначении железа перорально.

Рекомендации RUSSCO Применение ЭСП может считаться целесообразным у больных с умеренной анемией (концентрация Hb менее 100 г / л), получающих химиотерапию, при наличии симптомов анемии или для предотвращения дальнейшего снижения концентрации Hb, а также у больных с быстро снижающейся концентрацией гемоглобина вследствие химиотерапии [I, A]. У больных, не получающих химиотерапию, применение ЭСП нецелесообразно, поскольку не исключен негативный эффект на показатели выживаемости при назначении ЭСП при концентрации Hb выше 120 г / л [I, A]

Безопасность применения ЭСП у онкологических больных с точки зрения общей и безрецидивной выживаемости сегодня активно изучается, однако результаты исследований неоднозначны. Существует 3 метаанализа, показывающих негативное влияние ЭСП на общую выживаемость, и 2 метаанализа, не выявивших подобного влияния. Во всех этих метаанализах не было выявлено значимого негативного влияния применения ЭСП у больных, получающих химиотерапию. Большинство экспертов считает нецелесообразным применение ЭСП у больных, не получающих химиотерапию, за исключением пациентов с МДС.

Относительный риск тромбоэмболических осложнений повышается на 67 % при использовании ЭСП по сравнению с плацебо (ОР 1, 67; 95 % ДИ: 1, 35 -2, 06) Использование ЭСП должно быть тщательно обдумано у больных с высоким риском тромбоэмболических осложнений, например с тромбозом в анамнезе, после хирургического пособия, при длительной иммобилизации или ограниченной активности,

СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЭСП Данных относительно различий эффективности и безопасности между различными ЭСП не существует [I]. Тем не менее, в Российской Федерации отсутствует законодательная необходимость проведения клинических исследований для биоаналогов, и к ним применяются такие же требования, как к дженерикам. В связи с высокой сложностью молекул биоаналогов и возможностью существенных изменений эффективности и иммуногенности применении биоаналогов, по сравнению с оригинальными молекулами, совет экспертов предупреждает о необходимости осторожности приприменении препаратов, не прошедших формализованные исследования. Из рекомендацим RUSSCO.

Новая редакция ASCO|ASH 2010 г по использованию эпоэтина и дарбоэтина у взрослых пациентов Прием препаратов железа рекомендован при использовании эритропоэтинов при дефиците железа. В/венное введение железа рекомендовано как стандарт терапии, доказано клиническими исследованиями.

Патогенетическое лечение Факторы, отвечающие за развитие анемии у пациентов с опухолевой патологией: - 2013 г-это год внутривенных препаратов железа для коррекции ЖДА у онкологических больных. Две крупные конференции ESMO MASCC подтвердили актуальность этой проблемы. Открытие новой возможности лечение анемии у онкологических больных с помощью препаратов внутривенного железа.

По данным работы H. Ludwig и соавторов дефицит железа у онкологичеких больных состовляет более 50 %.
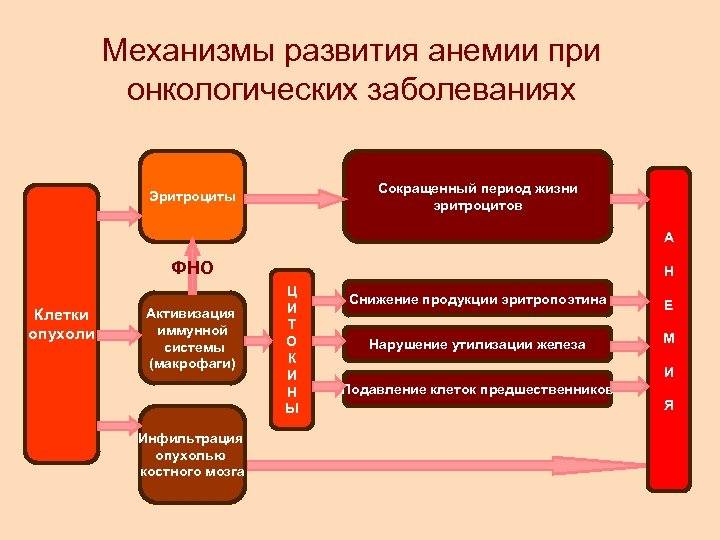
Механизмы развития анемии при онкологических заболеваниях Сокращенный период жизни эритроцитов Эритроциты А ФНО Клетки опухоли Активизация иммунной системы (макрофаги) Инфильтрация опухолью костного мозга Н Ц И Т О К И Н Ы Снижение продукции эритропоэтина Е Нарушение утилизации железа М И Подавление клеток предшественников Я

Анемия в онкологии полиэтиологична кровотечения различного генеза дефицит нутритивных факторов эритропоэза (витаминов и железа) новообразования лимфатической системы часто сопровождаются аутоиммунным гемолизом. метастазы в костный мозг, снижают кроветворения. цитостатическая терапия, особенно с включением препаратов платины. у значительной части больных (по некоторым данным, до 60%) снижение гемоглобина происходит без видимых причин. Такая «неспровоцированная» анемия опухолевого или хронического заболевания может определяться гиперпродукцией провоспалительных цитокинов (интерлейкин-1, интерлейкин-6, фактор некроза опухоли и интерферон g) Данные цитокины обладают негативным влиянием на различные этапы продукции эритроцитов костным мозгом, длительность их жизни и обмен железа В ряде исследований было показано, что средняя продолжительность жизни эритроцитов у пациентов с опухолевыми заболеваниями снижается в 1, 5 -2 раза.

За последние 15 лет открыто большое количество пептидов, которые позволили лучше понять патогенез нарушений метаболизма железа при различных заболеваниях. Главное открытие: печеночный пептид гепсидин. Гепсидин является пептидным гормоном продуцируемый печенью и состоит из 25 аминокислот. Он был открыт в 2000 г. и описан в работе Krause A. Гепсидин основной регулятор метаболизма железа и является ключевым в развитии анемии у онкологических больных. Гепсидин является негативным регулятором поступления железа из клеток. Любые хронические заболевания, включая злокачественные опухоли способствуют выработке цитокинов, особенно IL 6, что приводит к синтезу гепсидина, который играет важную роль в метаболизме железа

Гепсидин вызывает Деградацию ферропортина, главного экспорта железа из макрофагов Препятствует повторному использованию железа из фагоцитарных эритроцитов, повышению его внутриклеточной концентрации. Уменьшает интестинальную абсорбцию железа. Снижает всасывание железа.
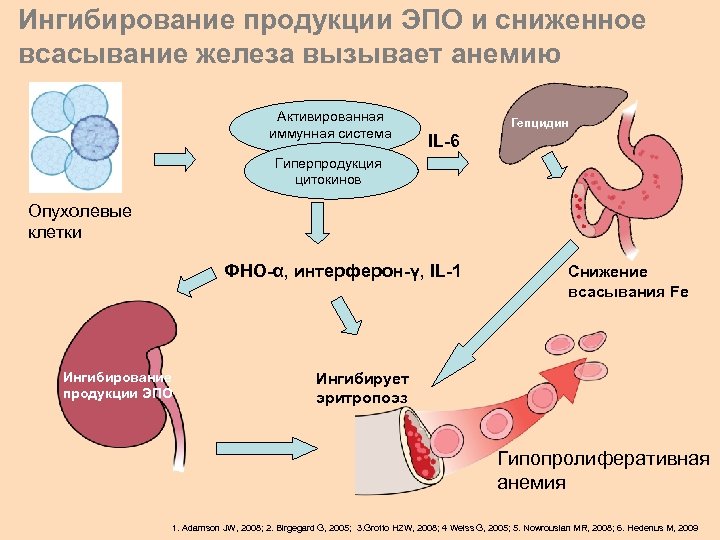
Ингибирование продукции ЭПО и сниженное всасывание железа вызывает анемию Активированная иммунная система Гепцидин IL-6 Гиперпродукция цитокинов Опухолевые клетки ФНО-α, интерферон-γ, IL-1 Ингибирование продукции ЭПО Снижение всасывания Fe Ингибирует эритропоэз Гипопролиферативная анемия 1. Adamson JW, 2008; 2. Birgegard G, 2005; 3. Grotto HZW, 2008; 4 Weiss G, 2005; 5. Nowrousian MR, 2008; 6. Hedenus M, 2009

Появился новый термин: функциональный дефицит железа Дефицит железа у онкологических больных Абсолютный (алиментарное снижение поступления железа) Функциональный (блокирование выхода железа из депо за счет гепсидина)

Понимание патогенеза привело к тому, что стали необходимы препараты, которые помогут «обманывать» этот функциональный блок, устранять дефицит сывороточного железа для удовлетворения потребности костного мозга для эффективного гемопоэза.

Учитывая развитие ФДЖ у онкологических больных, патогенетически оправдано введение железа внутривенно, т. е. переводя его непосредственно в транспортную форму и доставляя в органы эритропоэза. Это позволяет обойти «блокаду» макрофагов, вызываемую гепсидином.

Общие эффекты Восполнение железа Метаболизм железа-непрерывный цикл распределения железа в организме. Поступление железа должно быть =выведению Регуляторы: -Ферропортин. -Гепсидин. В процессе абсорбции, железо соединяется с кислородом и переносится в плазму крови за счет связывания с трансферрином. Далее железо и трансферрин используются для синтеза гемоглобина (молекула, которая переносит кислород в крови) и миоглобина (помогает мышечным клеткам запасать кислород. )

Характеристика ЖДА ü ü снижение уровня гемоглобина менее 110 г/л; снижение цветного показателя - 0, 7 -0, 4; снижение сывороточного железа менее 9 мкмоль/л; повышение общей железосвязывающей способности сыворотки более 84, 6 мкмоль/л; ü снижение сывороточного ферритина: при латентном дефиците железа - менее 30 мкг/л, при анемии – менее 15 мкг/л; ü уменьшение уровня насыщения трансферрина менее 20%.

Дефицит железа определяется по степени насыщения трансферина железом. У больных с абсолютным и функциональным дефицитом железа он составляет менее 20%. При абсолютном дефиците железа отмечается истощение запасов железа и низкий уровень ферретина (менее 100 мкг/л). При функциональном дефиците железа –нормальный или даже повышенный уровень ферритина (более 100 мкг/л).

Алгоритм исследования обмена железа должен включать определение НТЖ (насыщение трансферина железом) и СФ (сывороточный ферритин). Ориентировочными показателями являются содержание СФ менее 100 нг/мл и НТЖ менее 20%. У онкологических больных при содержании СФ менее 100 нг/мл речь идет об абсолютном дефиците железа и необходимости терапии препаратами железа, предпочтительно внутривенно, т. к. пероральное железо плохо всасывается и не восполняет недостаток железа. При более высоком СФ (100 -800 нг/мл) и НТЖ менее 20% можно думать о функциональном дефиците железа, и лечение ЭСП необходимо дополнить внутривенными препаратами железа. Рекомендации RUSSCO.
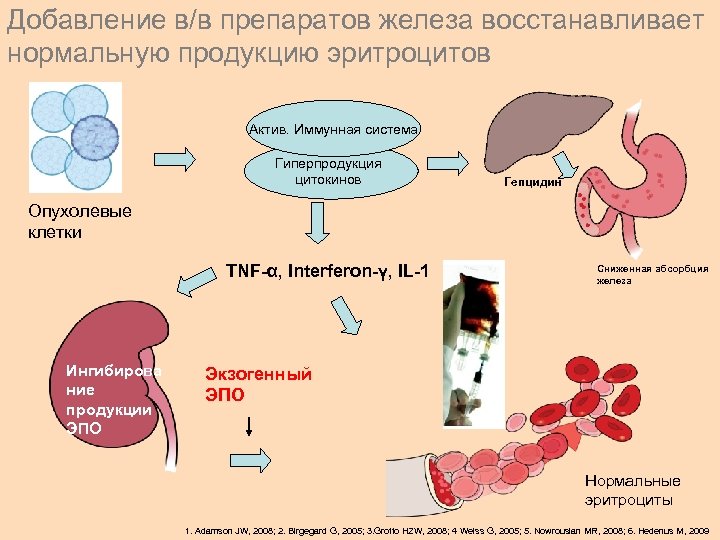
Добавление в/в препаратов железа восстанавливает нормальную продукцию эритроцитов Activated immune Актив. Иммунная система system Гиперпродукция цитокинов Гепцидин Опухолевые клетки TNF-α, Interferon-γ, IL-1 Ингибирова ние продукции ЭПО Сниженная абсорбция железа Экзогенный ЭПО Нормальные эритроциты 1. Adamson JW, 2008; 2. Birgegard G, 2005; 3. Grotto HZW, 2008; 4 Weiss G, 2005; 5. Nowrousian MR, 2008; 6. Hedenus M, 2009

Лечение ЖДА у онкологических больных внутривенными препаратами железа Показания ü необходимость быстрого восстановления уровня железа в сыворотке крови и запасов железа (при тяжелой ЖДА с Нв менее 100 г/л); ü хроническая кровопотеря, не компенсируемая приемом пероральных препаратов железа; ü синдром нарушения всасывания железа в кишечнике (острые и хронические энтериты, обширные резекции тонкой кишки); ü непереносимость препаратов железа для приема внутрь (тошнота, рвота, запоры, поносы); ü эрозивные процессы в желудке и 12 -перстной кишке;

Безопасность препаратов в/в железа

Семь крупных рандомизированных контролируемых клинических исследований не показали различий в частоте возникновения нежелательных явлений между группами, получавшими железо внутривенно, и контрольными группами

Все внутривенные препараты представляют собой сферические железо-углеводные коллоиды. В центре каждой макромолекулы находится полиядерный железо-(III)-оксигидроксид со структурой, похожей на структуру ферритина. Этот центр окружен углеводной оболочкой, которая придает комплексу высокую стабильность, замедляет высвобождение железа и поддерживает образующиеся формы в коллоидной суспензии. Размеры ядра и сами оболочки различаются. В качестве оболочек используют: карбоксимальтозу, сахарозу, полимеры или декстраны.

Препараты для внутривенного введения применяемые в России -карбоксимальтозат железа ( Феринжект) -сахарат железа (Венофер) -глюконат железа Феррлецит) -декстран железа (Космо. Фер)

Комплексы с низкой молекулярной массой, такие как глюконат железа, менеее стабильны и быстро высвобождают в плазму железо, которое в свободном виде вызывает повреждение тканей. Значительная часть дозы выводится почками в первые 4 часа после приема препаратаи железо не используется для эритропоэза. Декстраны железа обладают высокой молекулярной массой и стабильностью, их недостатком является повышенный риск аллергических реакций.

Использование препаратов, содержащих декстран, возможно только в стационаре, с условием доступности оказания противошоковой терапии. Пациенты должны находиться под пристальным наблюдением врача во время введения препарата и непосредственно после него в течение 1 часа.

Идеальный препарат железа для парентерального введения должен обладать ü низкой иммуногенностью; ü отсутствием острой токсичности, связанной с выделением ионизированного железа; ü низким риском печеночной токсичности; ü удобной схемой и оптимальной разовой дозой; ü высокой скоростью внутривенного введения. ü Этим требованиям соответствует карбоксимальтозат железа Феринжект

Феринжект® показания к применению ü лечение железодефицитной анемии при неэффективности или невозможности применения пероральных препаратов железа ü при непереносимости других парентеральных препаратов железа ü диагноз должен быть подтвержден лабораторными исследованиями

Феринжект отвечает на неудовлетворенные клинические потребности в терапии в/в препаратами железа ü не вызывает реакций гиперчувствительности ü характерных для применения декстранов (не содержит декстрана) ü имеет низкую вероятность развития интоксикации железом; химические характеристики железо- углеводистого комплекса обеспечивают медленное высвобождение железа, что позволяет избежать токсичных эффектов ü не требует введения тест-дозы ü позволяет вводить до 1000 мг железа в виде разовой быстрой инфузии за 15 мин ü болюсная инъекция (быстрое введение) до 200 мг железа
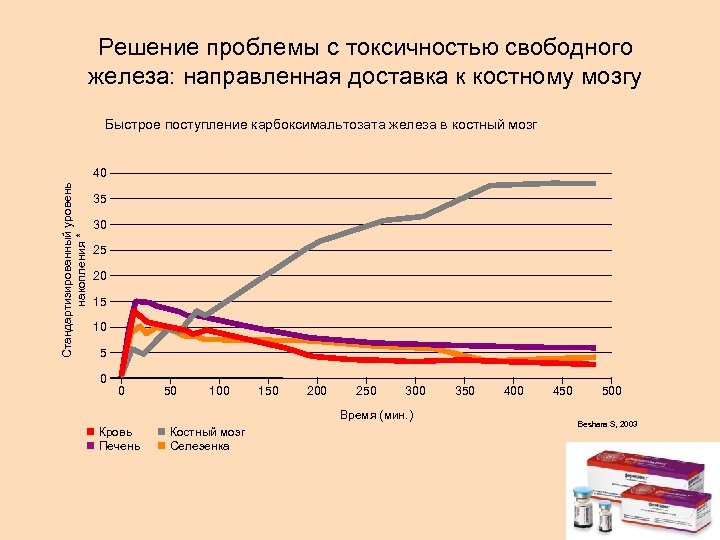
Решение проблемы с токсичностью свободного железа: направленная доставка к костному мозгу Стандартизированный уровень накопления * Быстрое поступление карбоксимальтозата железа в костный мозг 40 35 30 25 20 15 10 5 0 0 50 100 150 200 250 300 Время (мин. ) Кровь Печень Костный мозг Селезенка 350 400 450 500 Beshara S, 2003

Внутривенная инфузия

Внутривенная инъекция
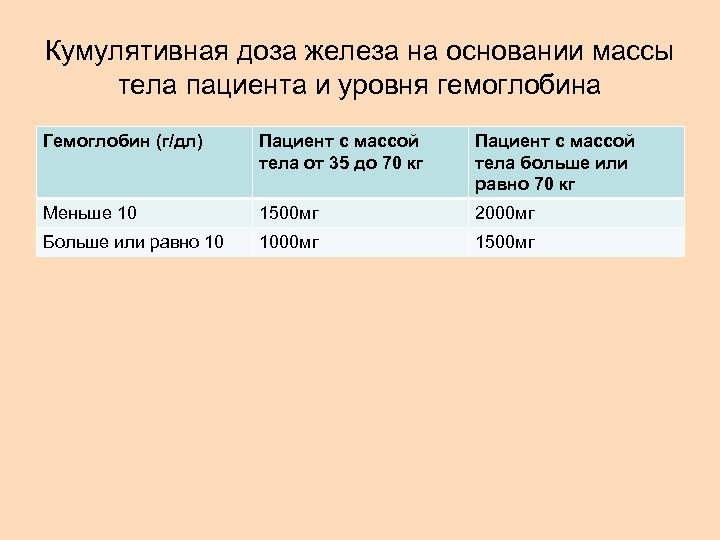
Кумулятивная доза железа на основании массы тела пациента и уровня гемоглобина Гемоглобин (г/дл) Пациент с массой тела от 35 до 70 кг Пациент с массой тела больше или равно 70 кг Меньше 10 1500 мг 2000 мг Больше или равно 10 1000 мг 1500 мг

Максимально переносимая разовая доза: Однократая доза препарата не должна превышать 1000 мг железа (20 мл) в сутки. Дозу 1000 мг железа (20 мл) нельзя вводить более 1 раза в неделю. Феринжект может вводиться струйно в максимально однократной дозе 4 мл (200 мг железа) в день, но не чаще 3 раз в неделю.
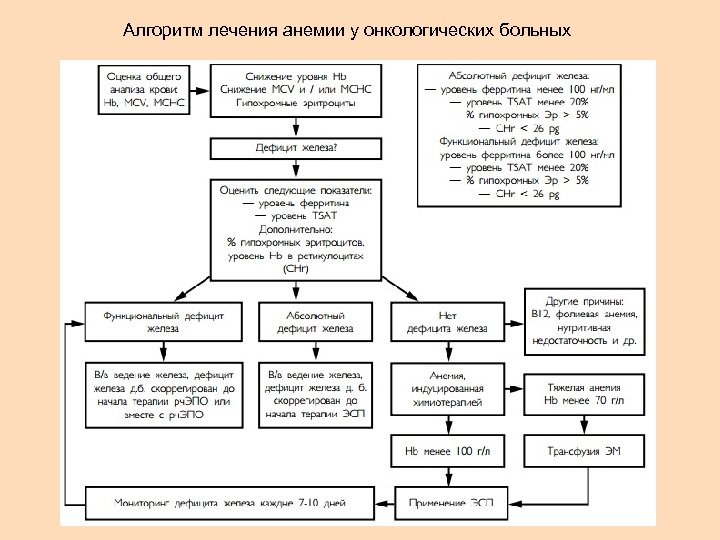
Алгоритм лечения анемии у онкологических больных

Спасибо за внимание!
0cd05ffd3c5c62ceca7715ba6c0d53f9.ppt