4.Алкены.pptx
- Количество слайдов: 49
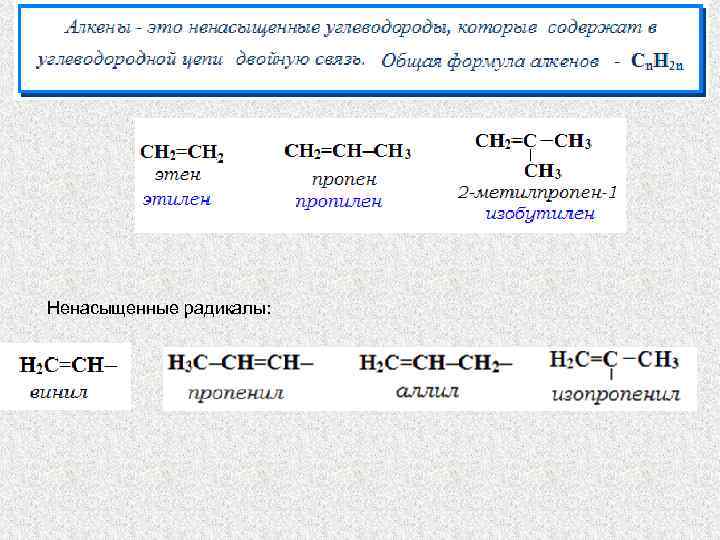 Ненасыщенные радикалы:
Ненасыщенные радикалы:
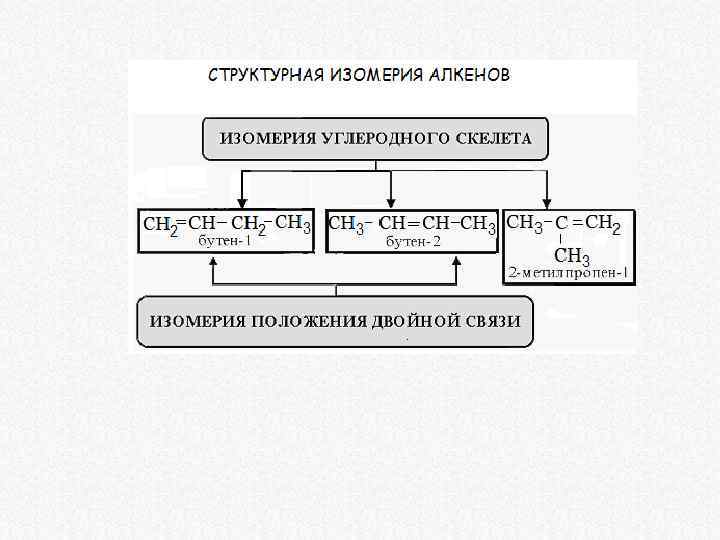
 Геометрическая изомерия алкенов
Геометрическая изомерия алкенов
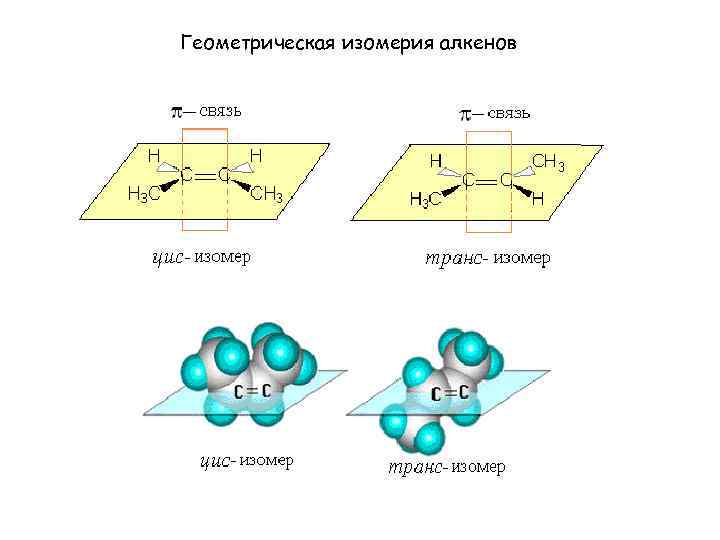
 СН 2 = СН 2
СН 2 = СН 2
 Реакционная способность алкенов Почему алкены реакционноспособнее, чем алканы? • -связь слабее, чем -связь • электроны двойной С=С-связи доступнее для атаки реагентами, чем электроны одинарной связи. Поэтому большинство реакций начинается с атаки -связи электрофилами (Е+ - электронообедненные частицы: катионы, свободные радикалы или карбены). Последующее протекание реакции происходит либо с расщеплением -связи и образованием двух новых -связей (реакции присоединения), либо с разрывом как -, так и -связей.
Реакционная способность алкенов Почему алкены реакционноспособнее, чем алканы? • -связь слабее, чем -связь • электроны двойной С=С-связи доступнее для атаки реагентами, чем электроны одинарной связи. Поэтому большинство реакций начинается с атаки -связи электрофилами (Е+ - электронообедненные частицы: катионы, свободные радикалы или карбены). Последующее протекание реакции происходит либо с расщеплением -связи и образованием двух новых -связей (реакции присоединения), либо с разрывом как -, так и -связей.
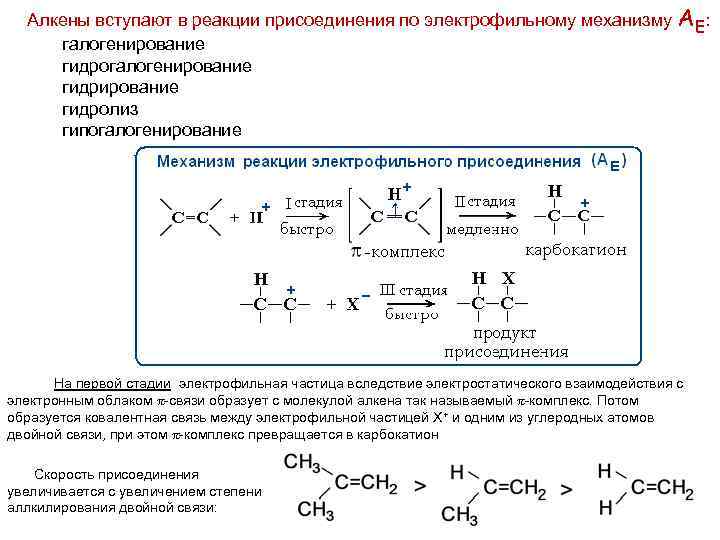 Алкены вступают в реакции присоединения по электрофильному механизму галогенирование гидрогалогенирование гидролиз гипогалогенирование А Е: На первой стадии электрофильная частица вследствие электростатического взаимодействия с электронным облаком -связи образует с молекулой алкена так называемый -комплекс. Потом образуется ковалентная связь между электрофильной частицей Х+ и одним из углеродных атомов двойной связи, при этом -комплекс превращается в карбокатион Скорость присоединения увеличивается с увеличением степени аллкилирования двойной связи:
Алкены вступают в реакции присоединения по электрофильному механизму галогенирование гидрогалогенирование гидролиз гипогалогенирование А Е: На первой стадии электрофильная частица вследствие электростатического взаимодействия с электронным облаком -связи образует с молекулой алкена так называемый -комплекс. Потом образуется ковалентная связь между электрофильной частицей Х+ и одним из углеродных атомов двойной связи, при этом -комплекс превращается в карбокатион Скорость присоединения увеличивается с увеличением степени аллкилирования двойной связи:
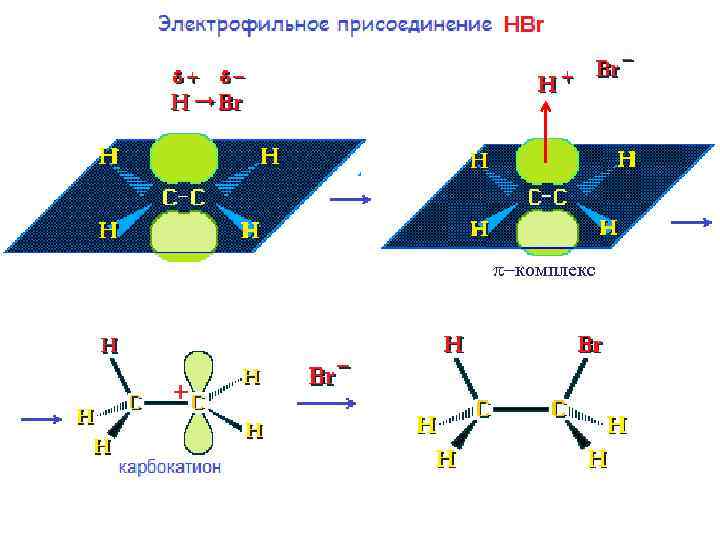 -комплекс
-комплекс
 Галогенирование: Скорость присоединения галогена зависит от строения алкена и природы галогена. Фтор разрушает молекулы олефинов, йод не присоединяется к двойной связи. Алкены (и циклоалкены) при комнатной температуре легко реагируют с растворами Br 2 или Cl 2 в инертном растворителе (реакция обесцвечивания бромной воды является качественной реакцией на кратную связь): Гидрирование: Это реакции присоединения водорода к двойным связям ненасыщенных соединений. При гидрировании алкенов двойная связь С=С разрывается с образованием двух -связей и превращением алкена в алкан. Чаще всего алкены гидрируют молекулярным водородом в присутствии катализаторов (Ni, Pt и Pd) – каталитическое гидрирование:
Галогенирование: Скорость присоединения галогена зависит от строения алкена и природы галогена. Фтор разрушает молекулы олефинов, йод не присоединяется к двойной связи. Алкены (и циклоалкены) при комнатной температуре легко реагируют с растворами Br 2 или Cl 2 в инертном растворителе (реакция обесцвечивания бромной воды является качественной реакцией на кратную связь): Гидрирование: Это реакции присоединения водорода к двойным связям ненасыщенных соединений. При гидрировании алкенов двойная связь С=С разрывается с образованием двух -связей и превращением алкена в алкан. Чаще всего алкены гидрируют молекулярным водородом в присутствии катализаторов (Ni, Pt и Pd) – каталитическое гидрирование:
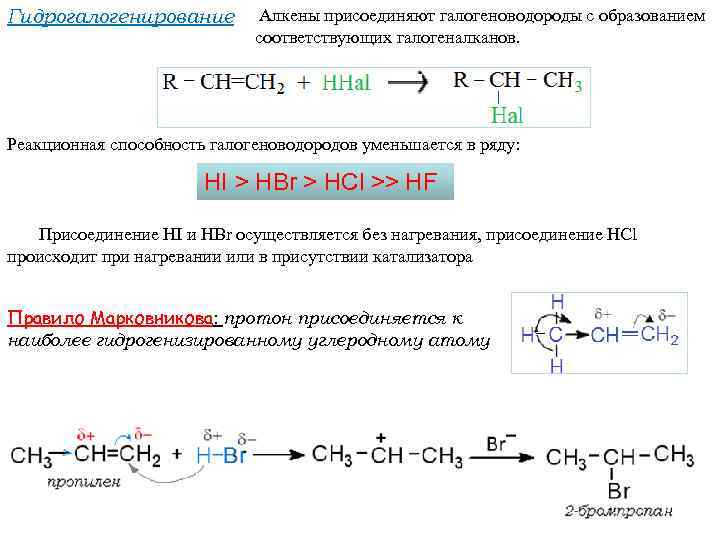 Гидрогалогенирование Алкены присоединяют галогеноводороды с образованием соответствующих галогеналканов. Реакционная способность галогеноводородов уменьшается в ряду: HI > HBr > HCl >> HF Присоединение НІ и HBr осуществляется без нагревания, присоединение HCl происходит при нагревании или в присутствии катализатора Правило Марковникова: протон присоединяется к наиболее гидрогенизированному углеродному атому
Гидрогалогенирование Алкены присоединяют галогеноводороды с образованием соответствующих галогеналканов. Реакционная способность галогеноводородов уменьшается в ряду: HI > HBr > HCl >> HF Присоединение НІ и HBr осуществляется без нагревания, присоединение HCl происходит при нагревании или в присутствии катализатора Правило Марковникова: протон присоединяется к наиболее гидрогенизированному углеродному атому
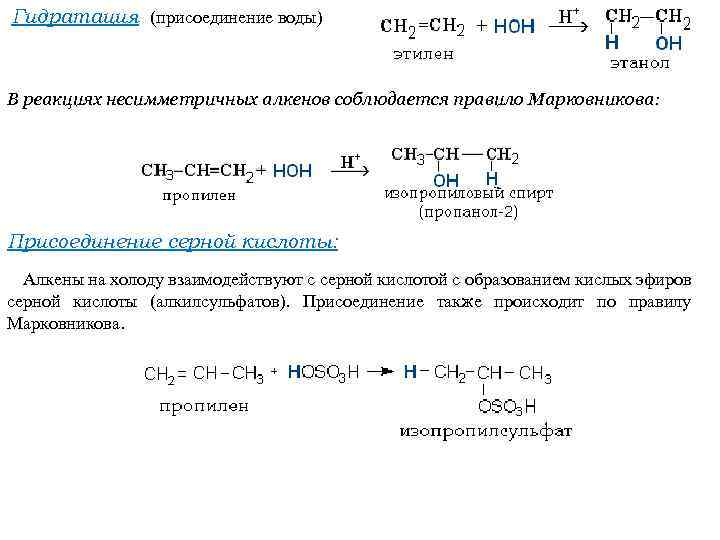 Гидратация (присоединение воды) В реакциях несимметричных алкенов соблюдается правило Марковникова: Присоединение серной кислоты: Алкены на холоду взаимодействуют с серной кислотой с образованием кислых эфиров серной кислоты (алкилсульфатов). Присоединение также происходит по правилу Марковникова.
Гидратация (присоединение воды) В реакциях несимметричных алкенов соблюдается правило Марковникова: Присоединение серной кислоты: Алкены на холоду взаимодействуют с серной кислотой с образованием кислых эфиров серной кислоты (алкилсульфатов). Присоединение также происходит по правилу Марковникова.
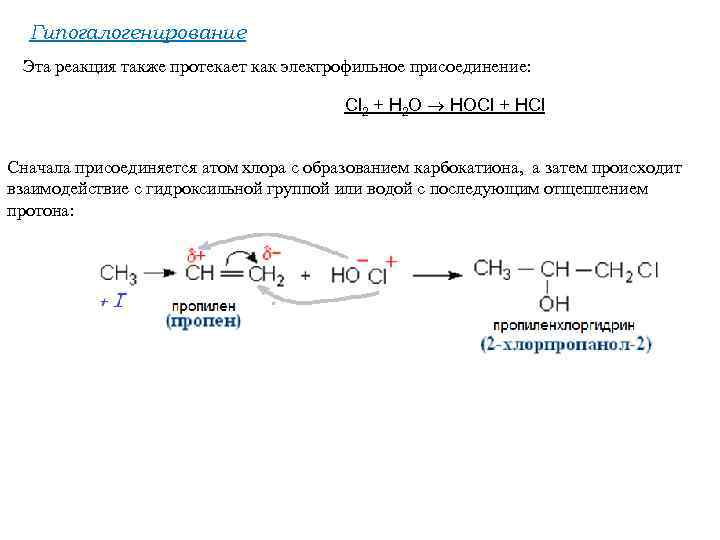 Гипогалогенирование Эта реакция также протекает как электрофильное присоединение: Cl 2 + H 2 O HOCl + HCl Cначала присоединяется атом хлора с образованием карбокатиона, а затем происходит взаимодействие с гидроксильной группой или водой с последующим отщеплением протона:
Гипогалогенирование Эта реакция также протекает как электрофильное присоединение: Cl 2 + H 2 O HOCl + HCl Cначала присоединяется атом хлора с образованием карбокатиона, а затем происходит взаимодействие с гидроксильной группой или водой с последующим отщеплением протона:
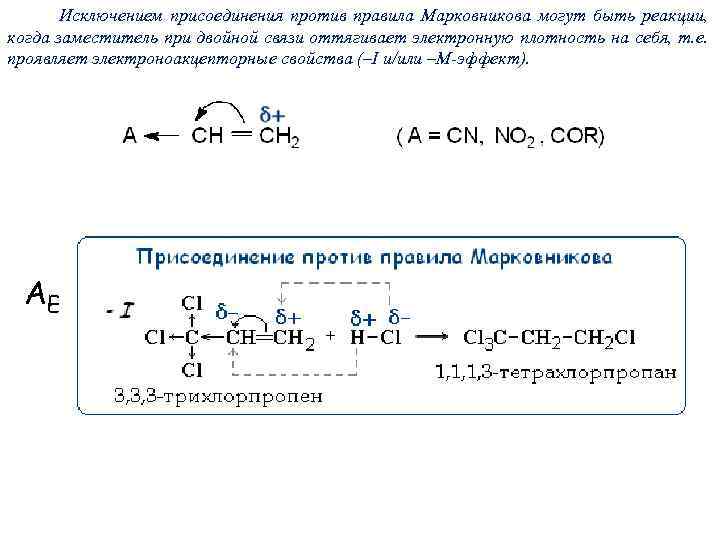 Исключением присоединения против правила Марковникова могут быть реакции, когда заместитель при двойной связи оттягивает электронную плотность на себя, т. е. проявляет электроноакцепторные свойства (–I и/или –М-эффект). AE
Исключением присоединения против правила Марковникова могут быть реакции, когда заместитель при двойной связи оттягивает электронную плотность на себя, т. е. проявляет электроноакцепторные свойства (–I и/или –М-эффект). AE
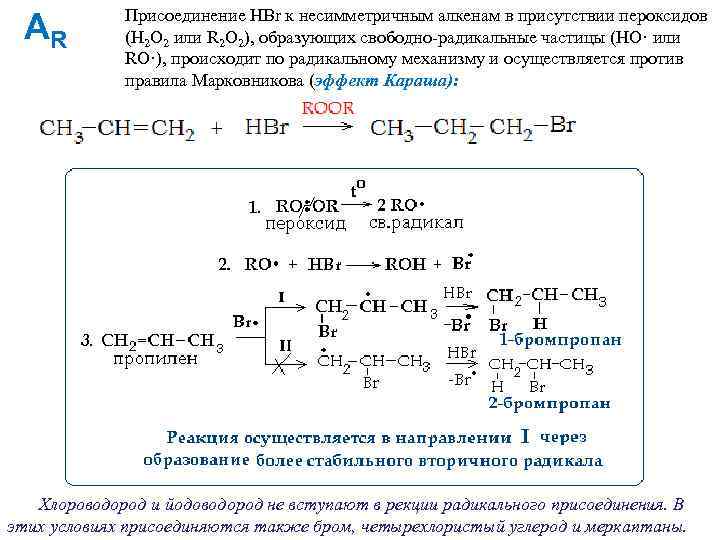 AR Присоединение HBr к несимметричным алкенам в присутствии пероксидов (H 2 O 2 или R 2 O 2), образующих свободно-радикальные частицы (НО· или RО·), происходит по радикальному механизму и осуществляется против правила Марковникова (эффект Караша): Хлороводород и йодоводород не вступают в рекции радикального присоединения. В этих условиях присоединяются также бром, четырехлористый углерод и меркаптаны.
AR Присоединение HBr к несимметричным алкенам в присутствии пероксидов (H 2 O 2 или R 2 O 2), образующих свободно-радикальные частицы (НО· или RО·), происходит по радикальному механизму и осуществляется против правила Марковникова (эффект Караша): Хлороводород и йодоводород не вступают в рекции радикального присоединения. В этих условиях присоединяются также бром, четырехлористый углерод и меркаптаны.
 По аналогичному механизму к двойной связи присоединяются сероводород (H 2 S), тиолы (RSH), дисульфиды (R-S-S-R), четыреххлористый (CCl 4) четыреххлористый углерод (CBr 4):
По аналогичному механизму к двойной связи присоединяются сероводород (H 2 S), тиолы (RSH), дисульфиды (R-S-S-R), четыреххлористый (CCl 4) четыреххлористый углерод (CBr 4):
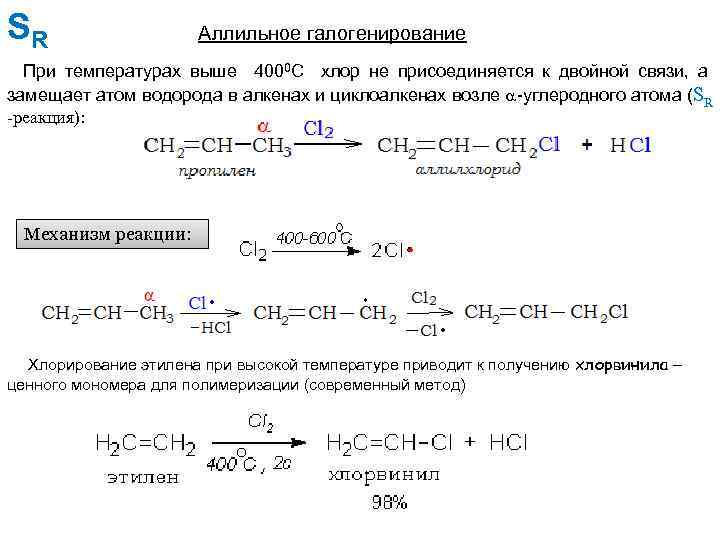 SR Аллильное галогенирование При температурах выше 4000 С хлор не присоединяется к двойной связи, а замещает атом водорода в алкенах и циклоалкенах возле -углеродного атома (SR -реакция): Механизм реакции: Хлорирование этилена при высокой температуре приводит к получению хлорвинила – ценного мономера для полимеризации (современный метод)
SR Аллильное галогенирование При температурах выше 4000 С хлор не присоединяется к двойной связи, а замещает атом водорода в алкенах и циклоалкенах возле -углеродного атома (SR -реакция): Механизм реакции: Хлорирование этилена при высокой температуре приводит к получению хлорвинила – ценного мономера для полимеризации (современный метод)
 Гидроформилирование (оксо-синтез) Оксо-синтез (гидроформилирование) – реакция присоединения оксида углерода и водорода по двойной связи с образованием альдегидов, содержащих на один атом углерода больше, чем исходный олефин. Алкены при нагревании до 140 -180 о. С под давлением (190 -210 атм. ) и в присутствии кобальтовых или никелевых катализаторов вступают в реакцию с синтез-газом с образованием смеси альдегидов с прямой и разветвленной углеродной цепью:
Гидроформилирование (оксо-синтез) Оксо-синтез (гидроформилирование) – реакция присоединения оксида углерода и водорода по двойной связи с образованием альдегидов, содержащих на один атом углерода больше, чем исходный олефин. Алкены при нагревании до 140 -180 о. С под давлением (190 -210 атм. ) и в присутствии кобальтовых или никелевых катализаторов вступают в реакцию с синтез-газом с образованием смеси альдегидов с прямой и разветвленной углеродной цепью:
 Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера): Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям: Полимеризацию может вызвать повышение температуры, сверхвысокое давление, облучение, действие свободных радикалов или катализаторов.
Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера): Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям: Полимеризацию может вызвать повышение температуры, сверхвысокое давление, облучение, действие свободных радикалов или катализаторов.
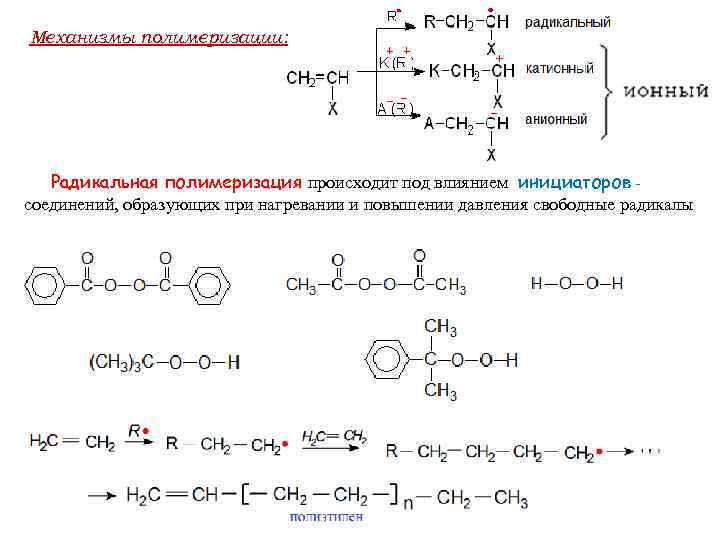 Механизмы полимеризации: Радикальная полимеризация происходит под влиянием инициаторов соединений, образующих при нагревании и повышении давления свободные радикалы
Механизмы полимеризации: Радикальная полимеризация происходит под влиянием инициаторов соединений, образующих при нагревании и повышении давления свободные радикалы
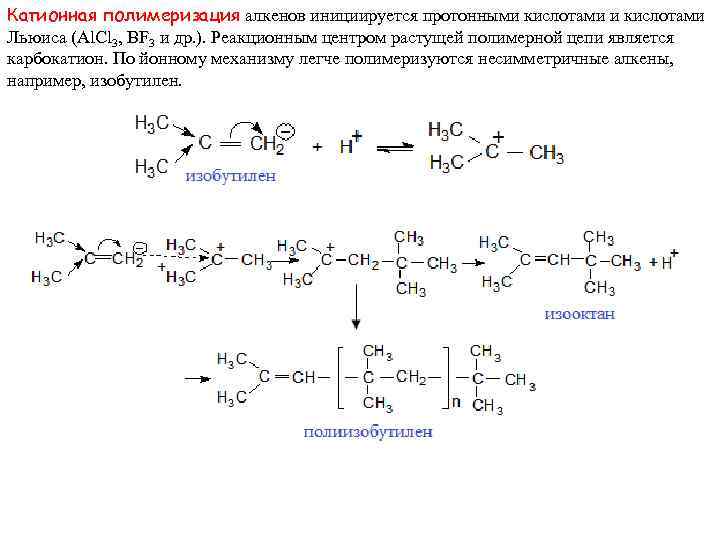 Катионная полимеризация алкенов инициируется протонными кислотами Льюиса (Al. Cl 3, BF 3 и др. ). Реакционным центром растущей полимерной цепи является карбокатион. По йонному механизму легче полимеризуются несимметричные алкены, например, изобутилен.
Катионная полимеризация алкенов инициируется протонными кислотами Льюиса (Al. Cl 3, BF 3 и др. ). Реакционным центром растущей полимерной цепи является карбокатион. По йонному механизму легче полимеризуются несимметричные алкены, например, изобутилен.
 Анионная полимеризация. Реакции нуклеофильного присоединения нехарактерны для алкенов и могут быть осуществимы только при наличии сильного электроноакцепторного заместителя у винильного углеродного атома: В качестве инициаторов анионной полимеризации используют сильные основания: амиды и алкоголяты щелочных металлов, реактивы Гриньяра, щелочные металлы и др. Анионная полимеризация в последнее время широко используется для получения полистирола, полиакрилонитрила, полиакрилатов и т. д.
Анионная полимеризация. Реакции нуклеофильного присоединения нехарактерны для алкенов и могут быть осуществимы только при наличии сильного электроноакцепторного заместителя у винильного углеродного атома: В качестве инициаторов анионной полимеризации используют сильные основания: амиды и алкоголяты щелочных металлов, реактивы Гриньяра, щелочные металлы и др. Анионная полимеризация в последнее время широко используется для получения полистирола, полиакрилонитрила, полиакрилатов и т. д.
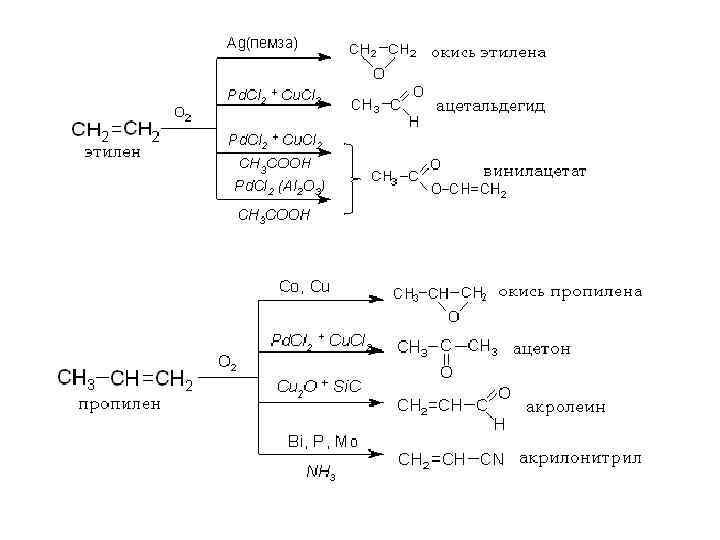
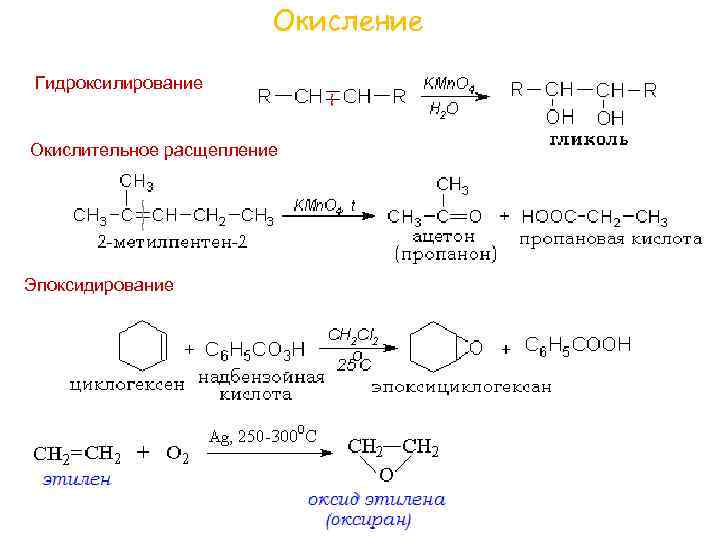 Окисление Гидроксилирование Окислительное расщепление Эпоксидирование
Окисление Гидроксилирование Окислительное расщепление Эпоксидирование
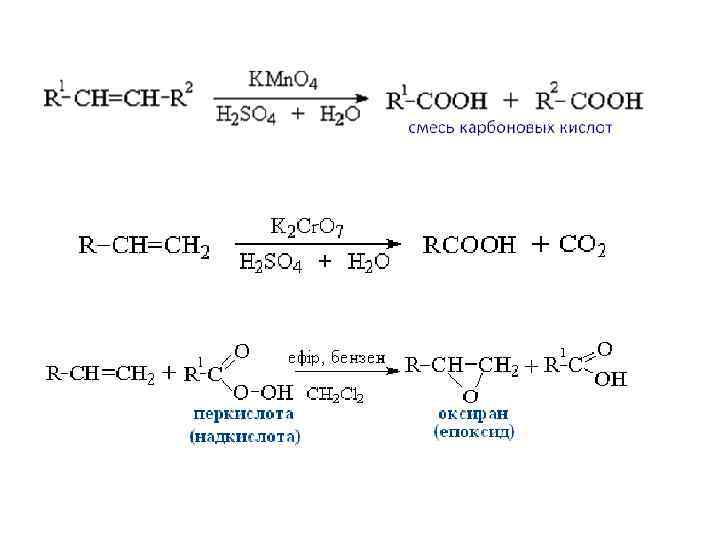
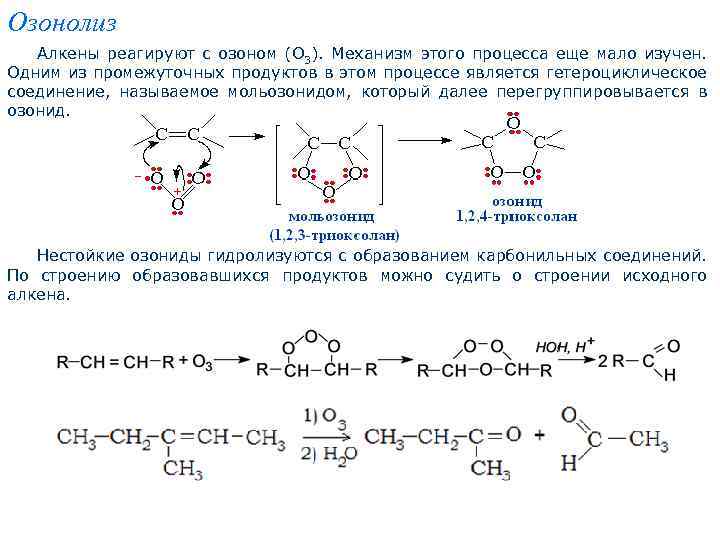 Озонолиз Алкены реагируют с озоном (О 3). Механизм этого процесса еще мало изучен. Одним из промежуточных продуктов в этом процессе является гетероциклическое соединение, называемое мольозонидом, который далее перегруппировывается в озонид. Нестойкие озониды гидролизуются с образованием карбонильных соединений. По строению образовавшихся продуктов можно судить о строении исходного алкена.
Озонолиз Алкены реагируют с озоном (О 3). Механизм этого процесса еще мало изучен. Одним из промежуточных продуктов в этом процессе является гетероциклическое соединение, называемое мольозонидом, который далее перегруппировывается в озонид. Нестойкие озониды гидролизуются с образованием карбонильных соединений. По строению образовавшихся продуктов можно судить о строении исходного алкена.
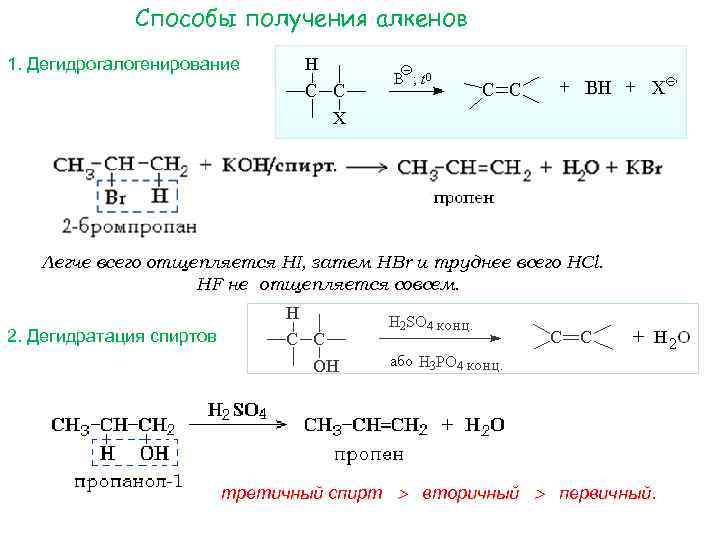 Способы получения алкенов 1. Дегидрогалогенирование Легче всего отщепляется HI, затем HBr и труднее всего HCl. HF не отщепляется совсем. 2. Дегидратация спиртов третичный спирт вторичный первичный.
Способы получения алкенов 1. Дегидрогалогенирование Легче всего отщепляется HI, затем HBr и труднее всего HCl. HF не отщепляется совсем. 2. Дегидратация спиртов третичный спирт вторичный первичный.
 Правило Зайцева: В реакциях дегидрогалогенирования и дегидратации отщепление атома водорода преимущественно происходит от наименее гидрогенизированного атома углерода.
Правило Зайцева: В реакциях дегидрогалогенирования и дегидратации отщепление атома водорода преимущественно происходит от наименее гидрогенизированного атома углерода.
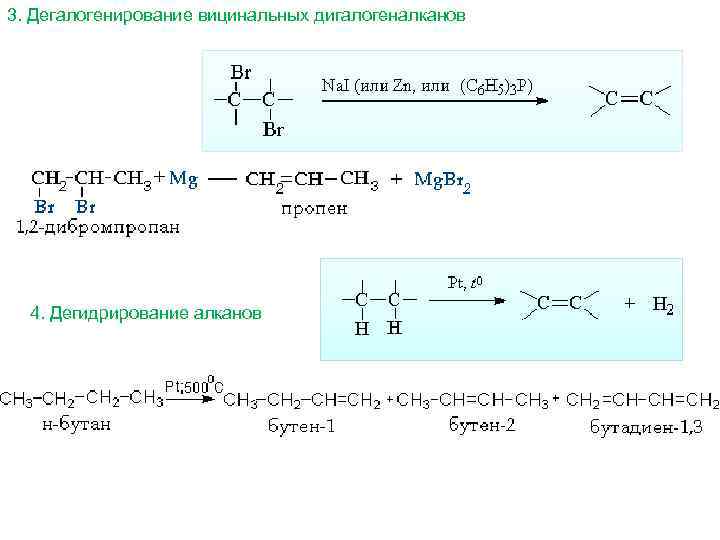 3. Дегалогенирование вицинальных дигалогеналканов 4. Дегидрирование алканов
3. Дегалогенирование вицинальных дигалогеналканов 4. Дегидрирование алканов
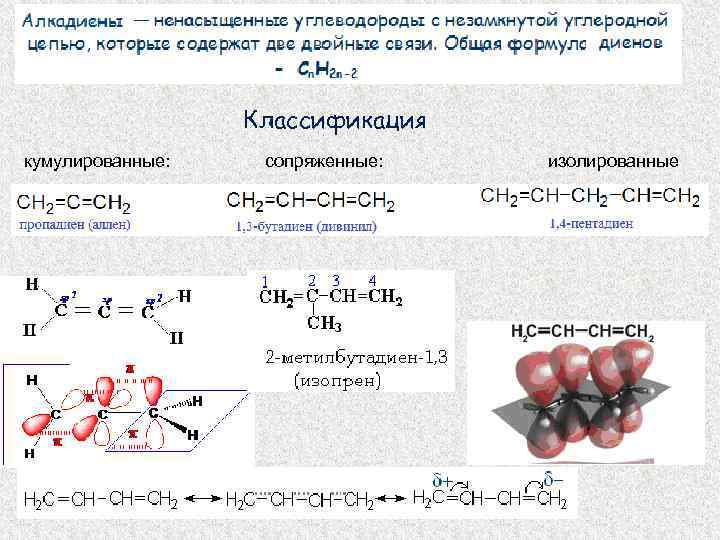 Классификация кумулированные: сопряженные: изолированные
Классификация кумулированные: сопряженные: изолированные
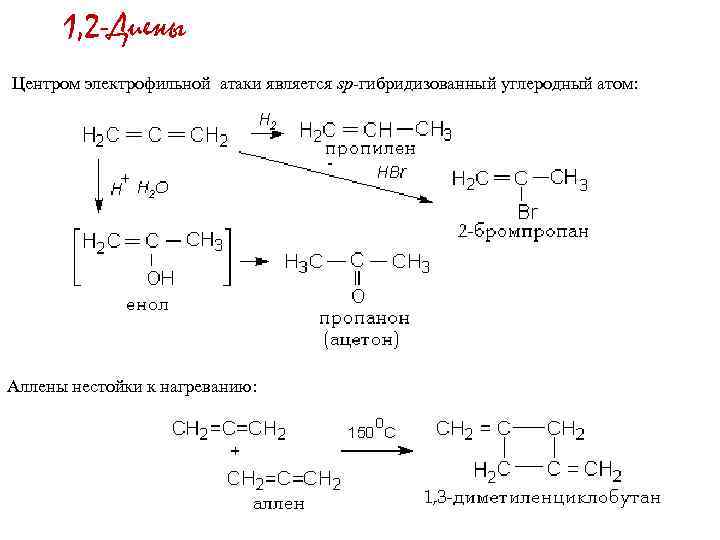 1, 2 -Диены Центром электрофильной атаки является sp-гибридизованный углеродный атом: Аллены нестойки к нагреванию:
1, 2 -Диены Центром электрофильной атаки является sp-гибридизованный углеродный атом: Аллены нестойки к нагреванию:
 Сопряженные диены Изомерия Структурная изомерия 1. Изомерия положения сопряженных двойных связей: 2. Изомерия углеродного скелета:
Сопряженные диены Изомерия Структурная изомерия 1. Изомерия положения сопряженных двойных связей: 2. Изомерия углеродного скелета:
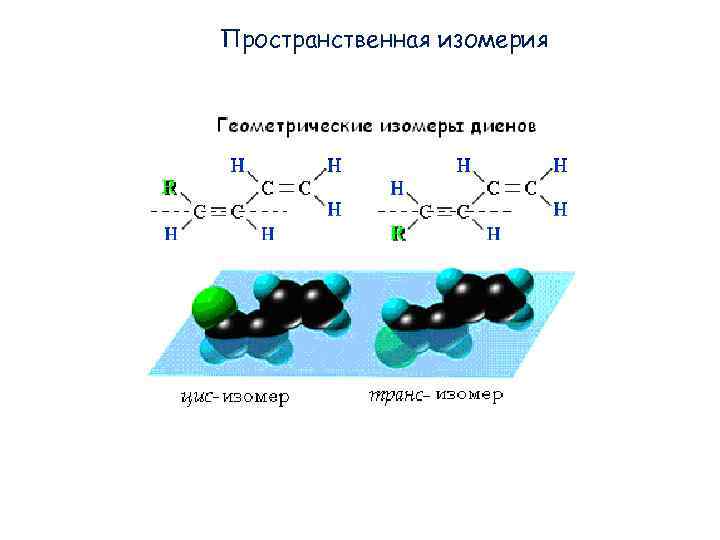 Пространственная изомерия
Пространственная изомерия
 Реакции электрофильного присоединения к сопряженным диенам Для сопряженных диенов также, как и для алкенов, характерны реакции присоединения и полимеризации. Но диены более реакционноспособны и способны к образованию двух продуктов электрофильного присоединения. 1. Гидрирование В отличие от алкенов сопряженные диены способны присоединять водород в момент выделения:
Реакции электрофильного присоединения к сопряженным диенам Для сопряженных диенов также, как и для алкенов, характерны реакции присоединения и полимеризации. Но диены более реакционноспособны и способны к образованию двух продуктов электрофильного присоединения. 1. Гидрирование В отличие от алкенов сопряженные диены способны присоединять водород в момент выделения:
 2. Галогенирование 1, 4 -присоединение: 1, 2 -присоединение: При 40 о. С соотношение продуктов реакции 1, 2 - и 1, 4 – 20 : 80%; при низких температурах преимущественно образуется продукт 1, 2 -присоединения.
2. Галогенирование 1, 4 -присоединение: 1, 2 -присоединение: При 40 о. С соотношение продуктов реакции 1, 2 - и 1, 4 – 20 : 80%; при низких температурах преимущественно образуется продукт 1, 2 -присоединения.
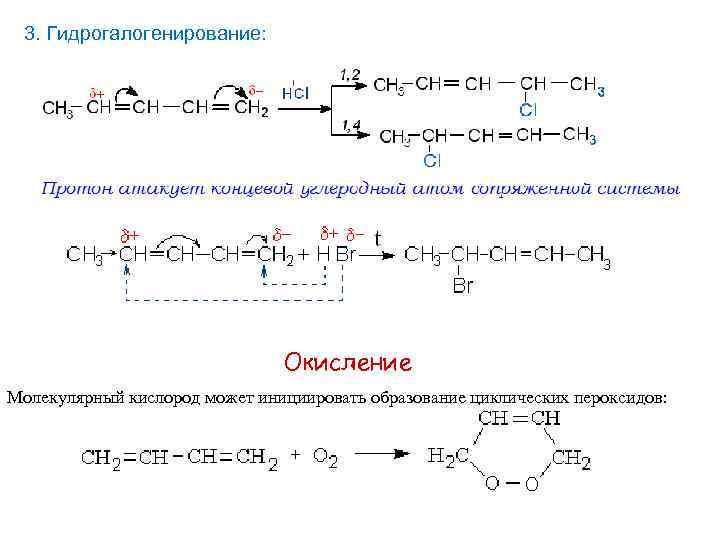 3. Гидрогалогенирование: Окисление Молекулярный кислород может инициировать образование циклических пероксидов:
3. Гидрогалогенирование: Окисление Молекулярный кислород может инициировать образование циклических пероксидов:
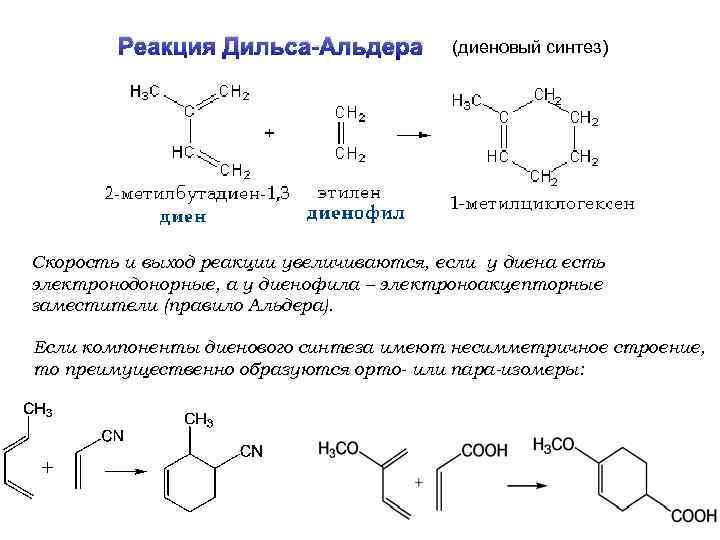 Реакция Дильса-Альдера (диеновый синтез) Скорость и выход реакции увеличиваются, если у диена есть электронодонорные, а у диенофила – электроноакцепторные заместители (правило Альдера). Если компоненты диенового синтеза имеют несимметричное строение, то преимущественно образуются орто- или пара-изомеры:
Реакция Дильса-Альдера (диеновый синтез) Скорость и выход реакции увеличиваются, если у диена есть электронодонорные, а у диенофила – электроноакцепторные заместители (правило Альдера). Если компоненты диенового синтеза имеют несимметричное строение, то преимущественно образуются орто- или пара-изомеры:
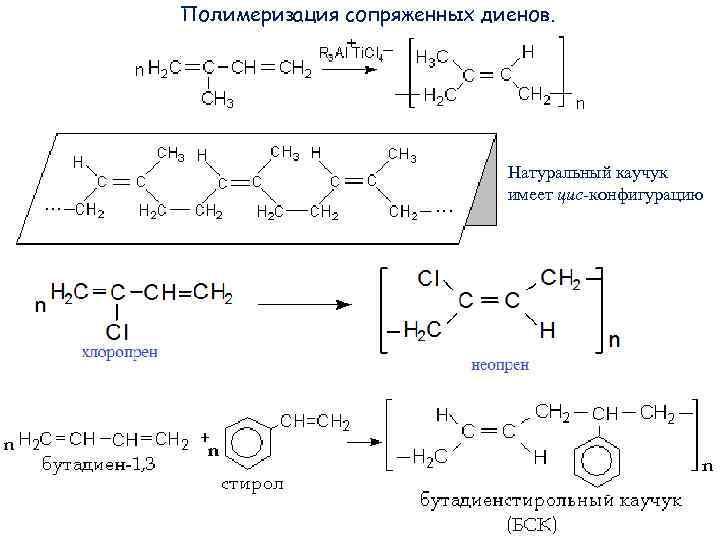 Полимеризация сопряженных диенов. Натуральный каучук имеет цис-конфигурацию
Полимеризация сопряженных диенов. Натуральный каучук имеет цис-конфигурацию
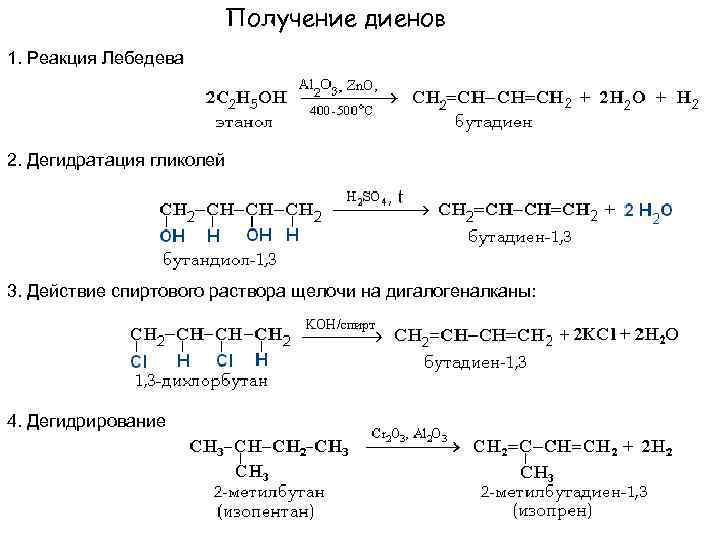 Получение диенов 1. Реакция Лебедева 2. Дегидратация гликолей 3. Действие спиртового раствора щелочи на дигалогеналканы: 4. Дегидрирование
Получение диенов 1. Реакция Лебедева 2. Дегидратация гликолей 3. Действие спиртового раствора щелочи на дигалогеналканы: 4. Дегидрирование
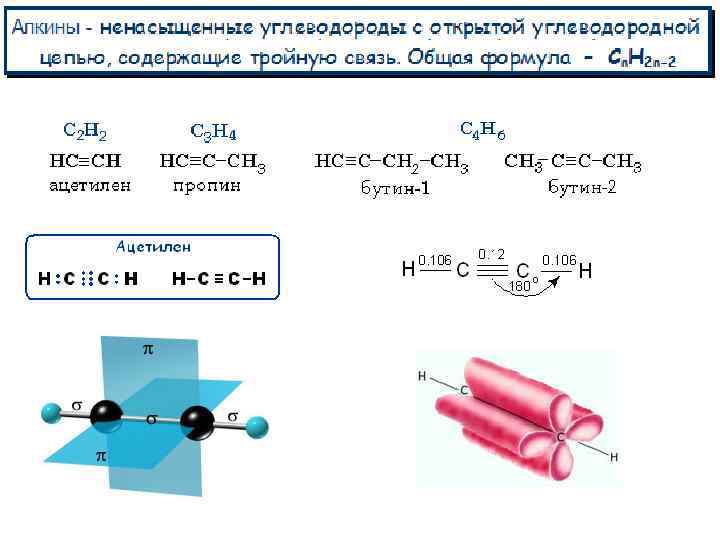
 Структурная изомерия 1. Изомерия положения тройной связи (начиная с С 4 Н 6): 2. Изомерия углеродного скелета (начиная с С 5 Н 8):
Структурная изомерия 1. Изомерия положения тройной связи (начиная с С 4 Н 6): 2. Изомерия углеродного скелета (начиная с С 5 Н 8):
 Строение и реакционная способность алкинов 1. p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения АЕ к алкинам протекают медленнее, чем к алкенам. 2 p-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения АN. Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. 3. Повышенная полярность связи С(sp)-Н приводит к облегчению ее гетеролитического разрыва с отщеплением протона Н+. Таким образом, алкины с концевой тройной связью проявляют кислотные свойства и способны вступать в реакции с образованием солей.
Строение и реакционная способность алкинов 1. p-Электроны более короткой тройной связи прочнее удерживаются ядрами атомов углерода и обладают меньшей поляризуемостью (подвижностью). Поэтому реакции электрофильного присоединения АЕ к алкинам протекают медленнее, чем к алкенам. 2 p-Электронное облако тройной связи сосредоточено в основном в межъядерном пространстве и в меньшей степени экранирует ядра углеродных атомов с внешней стороны. Следствием этого является доступность ядер углерода при атаке нуклеофильными реагентами и способность алкинов вступать в реакции нуклеофильного присоединения АN. Связь атома водорода с углеродом в sp-гибридизованном состоянии значительно более полярна по сравнению с С-Н-связями в алканах и алкенах. 3. Повышенная полярность связи С(sp)-Н приводит к облегчению ее гетеролитического разрыва с отщеплением протона Н+. Таким образом, алкины с концевой тройной связью проявляют кислотные свойства и способны вступать в реакции с образованием солей.
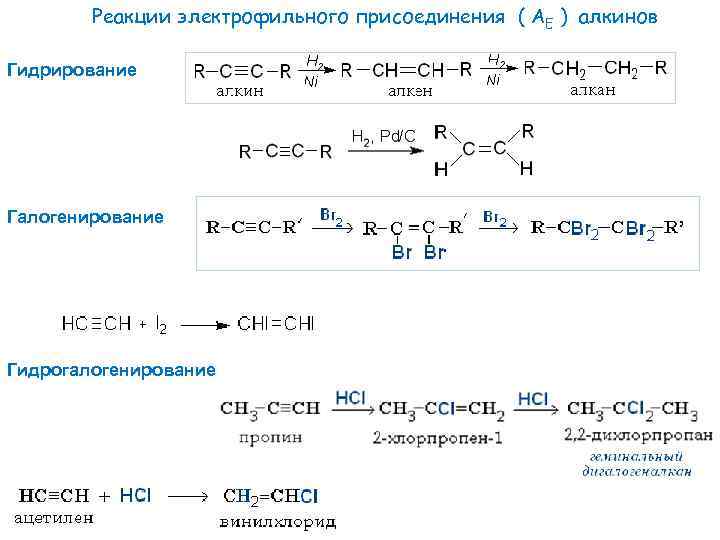 Реакции электрофильного присоединения ( АE ) алкинов Гидрирование Галогенирование Гидрогалогенирование
Реакции электрофильного присоединения ( АE ) алкинов Гидрирование Галогенирование Гидрогалогенирование
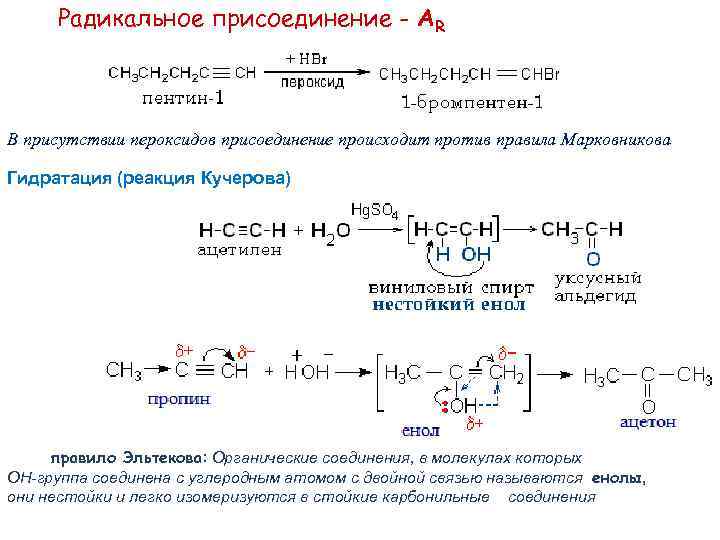 Радикальное присоединение - АR В присутствии пероксидов присоединение происходит против правила Марковникова Гидратация (реакция Кучерова) правило Эльтекова: Органические соединения, в молекулах которых ОН-группа соединена с углеродным атомом с двойной связью называются енолы, они нестойки и легко изомеризуются в стойкие карбонильные соединения
Радикальное присоединение - АR В присутствии пероксидов присоединение происходит против правила Марковникова Гидратация (реакция Кучерова) правило Эльтекова: Органические соединения, в молекулах которых ОН-группа соединена с углеродным атомом с двойной связью называются енолы, они нестойки и легко изомеризуются в стойкие карбонильные соединения
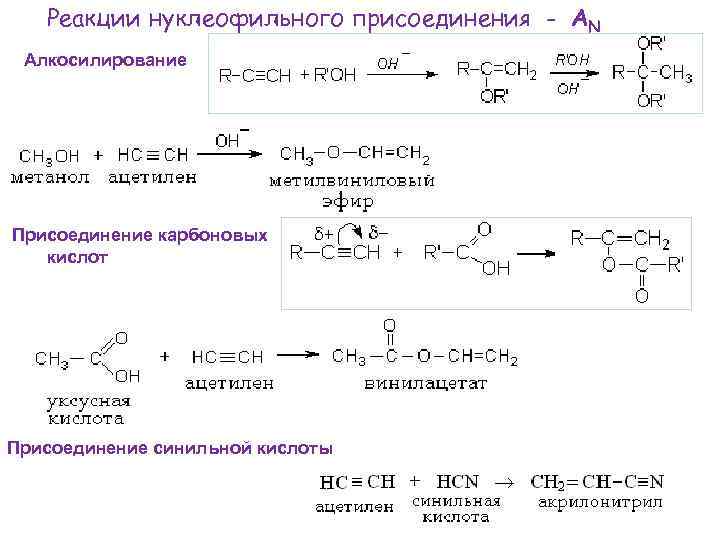 Реакции нуклеофильного присоединения - АN Алкосилирование Присоединение карбоновых кислот Присоединение синильной кислоты
Реакции нуклеофильного присоединения - АN Алкосилирование Присоединение карбоновых кислот Присоединение синильной кислоты
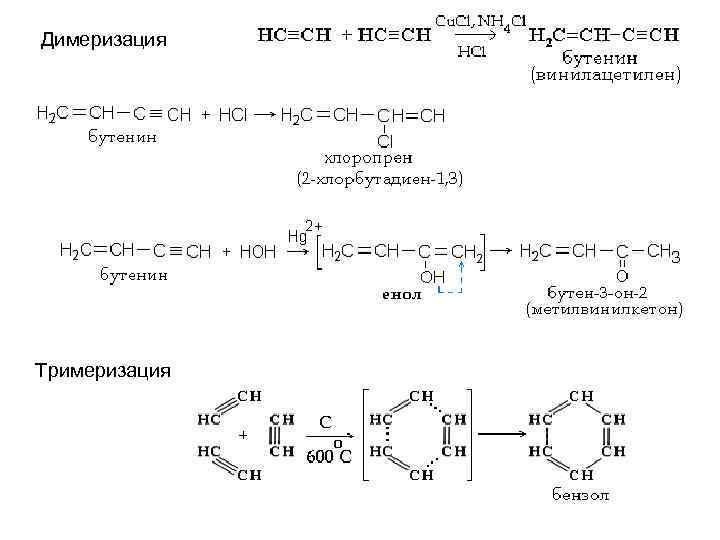 Димеризация Тримеризация
Димеризация Тримеризация
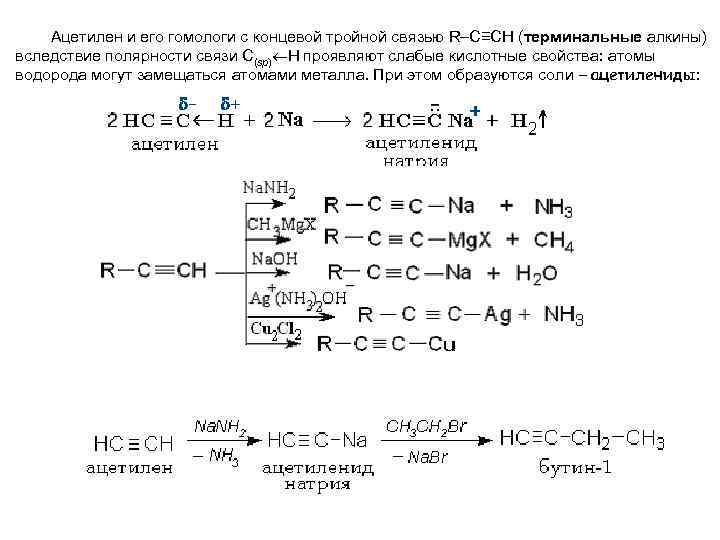 Ацетилен и его гомологи с концевой тройной связью R–C≡CH (терминальные алкины) вследствие полярности связи С(sp) Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды:
Ацетилен и его гомологи с концевой тройной связью R–C≡CH (терминальные алкины) вследствие полярности связи С(sp) Н проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды:
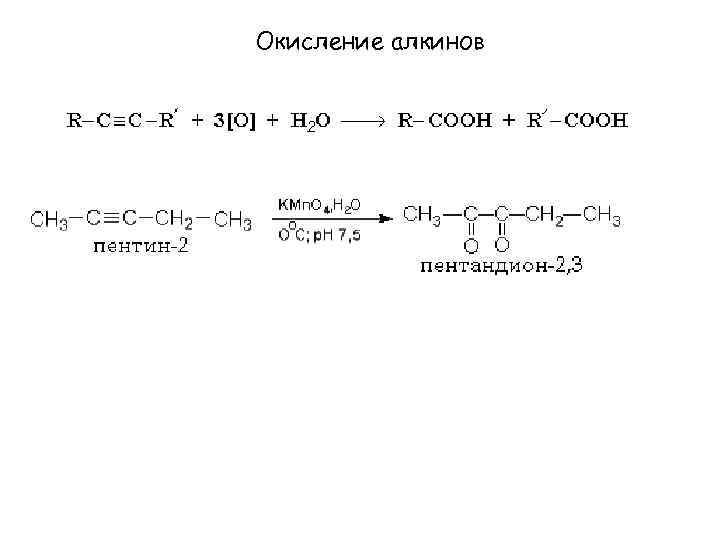 Окисление алкинов
Окисление алкинов
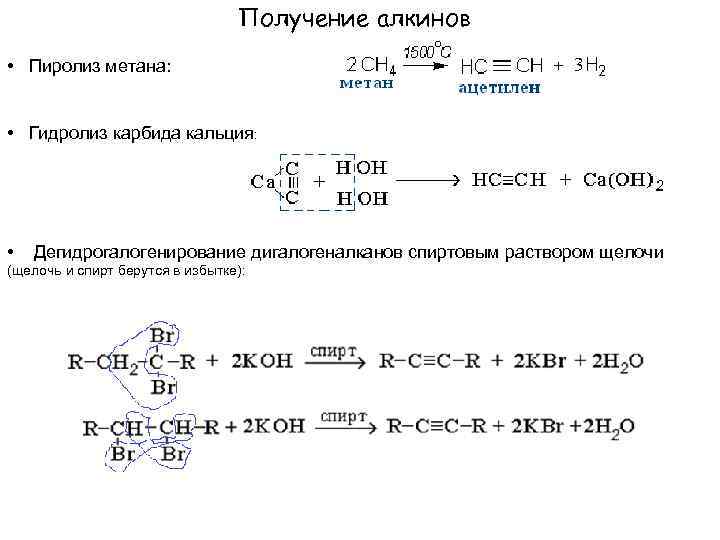 Получение алкинов • Пиролиз метана: • Гидролиз карбида кальция: • Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке):
Получение алкинов • Пиролиз метана: • Гидролиз карбида кальция: • Дегидрогалогенирование дигалогеналканов спиртовым раствором щелочи (щелочь и спирт берутся в избытке):
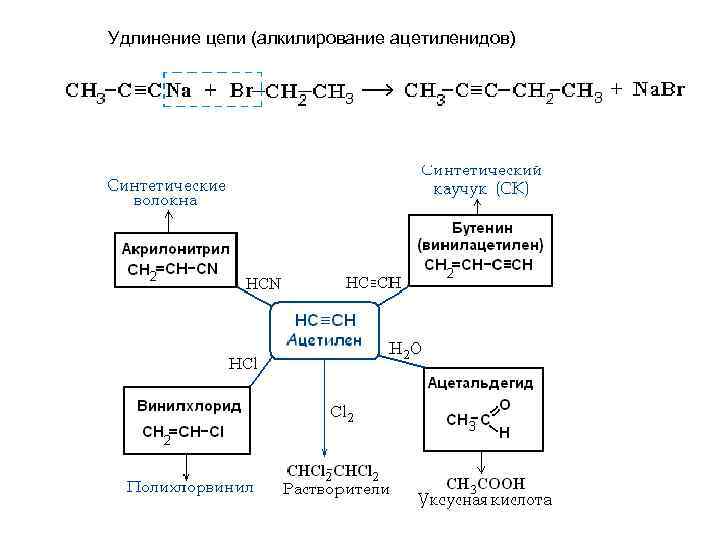 Удлинение цепи (алкилирование ацетиленидов)
Удлинение цепи (алкилирование ацетиленидов)


