146.ppt
- Количество слайдов: 28
 Неметаллы VIIАподгруппы
Неметаллы VIIАподгруппы
 Неметаллы VIIАподгруппы Элементы VIIА-подгруппы являются типичными неметаллами с высокой электроотрицательностью. Простые вещества являются сильными окислителями. Они состоят из двухатомных молекул, в которых атомы связаны ковалентной связью. Основные вопросы, рассматриваемые в лекции þ Общая характеристика неметаллов VIIА-подгруппы. Электронное строение, характерные степени окисления. þ Простые вещества þ Природные соединения þ Соединения галогенов § Галогенводородные кислоты и их соли § Бинарные кислородные соединения § Кислородсодержащие кислоты и их соли þ Окислительно-восстановительные свойства соединений. Реакции диспропорционирования. Диаграммы Латимера
Неметаллы VIIАподгруппы Элементы VIIА-подгруппы являются типичными неметаллами с высокой электроотрицательностью. Простые вещества являются сильными окислителями. Они состоят из двухатомных молекул, в которых атомы связаны ковалентной связью. Основные вопросы, рассматриваемые в лекции þ Общая характеристика неметаллов VIIА-подгруппы. Электронное строение, характерные степени окисления. þ Простые вещества þ Природные соединения þ Соединения галогенов § Галогенводородные кислоты и их соли § Бинарные кислородные соединения § Кислородсодержащие кислоты и их соли þ Окислительно-восстановительные свойства соединений. Реакции диспропорционирования. Диаграммы Латимера
 VII II IV V VI F 2 фтор 9 18, 998 Cl 3 хлор 17 35, 453 Общая характеристика VIIА-подгруппу образуют р-элементы: F, Cl, Br, I, At. ns Валентные электроны: ns 2 np 5 np Mn 4 25 • Атомам не хватает всего одного электрона для 54, 938 формирования устойчивой восьмиэлектронной оболочки, Br 35 поэтому у них сильно выражена тенденция к присоединению 5 бром 79, 904 электрона. ns np Tc 6 43 98, 906 I 7 йдод 53 • Все элементы образуют простые однозарядные анионы Г –. 126, 905 75 Re • В форме простых анионов элементы VIIА-группы 8 находятся в природной воде и в кристаллах природных 186, 207 солей. At 85 9 астат [210]
VII II IV V VI F 2 фтор 9 18, 998 Cl 3 хлор 17 35, 453 Общая характеристика VIIА-подгруппу образуют р-элементы: F, Cl, Br, I, At. ns Валентные электроны: ns 2 np 5 np Mn 4 25 • Атомам не хватает всего одного электрона для 54, 938 формирования устойчивой восьмиэлектронной оболочки, Br 35 поэтому у них сильно выражена тенденция к присоединению 5 бром 79, 904 электрона. ns np Tc 6 43 98, 906 I 7 йдод 53 • Все элементы образуют простые однозарядные анионы Г –. 126, 905 75 Re • В форме простых анионов элементы VIIА-группы 8 находятся в природной воде и в кристаллах природных 186, 207 солей. At 85 9 астат [210]
 Общая характеристика • Общее групповое название элементов VIIА-группы «галогены» , т. е. «рождающие соли» , связано с тем, что большинство их соединений с металлами представляет собой типичные соли (Ca. F 2, Na. Cl, Mg. Br 2, KI), которые могут быть получены при непосредственном взаимодействии металла с галогеном. • Свободные галогены получают из природных солей, поэтому название «галогены» также переводят, как «рожденные из солей» . Минерал галит или каменная соль Na. Cl
Общая характеристика • Общее групповое название элементов VIIА-группы «галогены» , т. е. «рождающие соли» , связано с тем, что большинство их соединений с металлами представляет собой типичные соли (Ca. F 2, Na. Cl, Mg. Br 2, KI), которые могут быть получены при непосредственном взаимодействии металла с галогеном. • Свободные галогены получают из природных солей, поэтому название «галогены» также переводят, как «рожденные из солей» . Минерал галит или каменная соль Na. Cl
 Общая характеристика VII 2 III 3 4 IV 5 6 V 7 8 VI 9 9 Br 35 79, 904 II F 43 • Все остальные галогены проявляют положительные степени Tc окисления вплоть до максимальной +7. I 53 • Элемент второго периода – фтор наиболее сильно отличается от других элементов подгруппы. 18, 998 Cl 17 • Фтор – это самый электроотрицательный элемент. хлор Фтор не проявляет положительных степеней окисления. 35, 453 В любых соединениях, в том числе с кислородом, фтор 25 Mn находится в степени окисления (-1). ns np 54, 938 фтор бром 98, 906 иод 126, 905 75 Re 186, 207 At астат [210] 85 • Наиболее характерные степени окисления галогенов: F : -1, 0; Cl, Br, I: -1, 0, +1, +3, +5, +7. • У Cl известны оксиды, в которых он находится в степенях окисления: +4 и +6.
Общая характеристика VII 2 III 3 4 IV 5 6 V 7 8 VI 9 9 Br 35 79, 904 II F 43 • Все остальные галогены проявляют положительные степени Tc окисления вплоть до максимальной +7. I 53 • Элемент второго периода – фтор наиболее сильно отличается от других элементов подгруппы. 18, 998 Cl 17 • Фтор – это самый электроотрицательный элемент. хлор Фтор не проявляет положительных степеней окисления. 35, 453 В любых соединениях, в том числе с кислородом, фтор 25 Mn находится в степени окисления (-1). ns np 54, 938 фтор бром 98, 906 иод 126, 905 75 Re 186, 207 At астат [210] 85 • Наиболее характерные степени окисления галогенов: F : -1, 0; Cl, Br, I: -1, 0, +1, +3, +5, +7. • У Cl известны оксиды, в которых он находится в степенях окисления: +4 и +6.
 Общая характеристика Простые вещества и соединения галогенов в положительных степенях окисления являются сильными окислителями. • – 1 • 0 +1 +3 +5 Окислители +7 Практическое применение простых веществ и кислородных соединений галогенов связано главным образом с их окислительным действием.
Общая характеристика Простые вещества и соединения галогенов в положительных степенях окисления являются сильными окислителями. • – 1 • 0 +1 +3 +5 Окислители +7 Практическое применение простых веществ и кислородных соединений галогенов связано главным образом с их окислительным действием.
 Общая характеристика • • • Для простых веществ и соединений галогенов в промежуточных степенях окисления характерны реакции диспропорционирования. В этих реакциях галоген одновременно и понижает, и увеличивает свою промежуточную степень окисления. Диспропорционированию способствует щелочная среда. – 1 0 Cl– I– Cl 2 I 2 +1 +2 +3 +5 Например. Cl. O– IO 3– +7
Общая характеристика • • • Для простых веществ и соединений галогенов в промежуточных степенях окисления характерны реакции диспропорционирования. В этих реакциях галоген одновременно и понижает, и увеличивает свою промежуточную степень окисления. Диспропорционированию способствует щелочная среда. – 1 0 Cl– I– Cl 2 I 2 +1 +2 +3 +5 Например. Cl. O– IO 3– +7
 Природные соединения • Фтор и хлор принадлежат к двадцати самым распространенным элементам, значительно меньше в природе брома и иода. • Все галогены находятся в природе в степени окисления (– 1). • Фтор и хлор существуют в природе в виде минералов: • • Ca. F 2 – флюорит или плавиковый шпат Ca 5[(PO 4)3. F] – фторапатит Na 3[Al. F 6] – криолит Na. Cl – галит или каменная соль KCl – сильвин KCl. Na. Cl – сильвинит KCl. Mg. Cl 2. 6 H 2 O – карналлит Минерал галит или каменная соль Na. Cl Лишь йод встречается в виде соли KIO 3, которая как примесь входит в селитру (KNO 3).
Природные соединения • Фтор и хлор принадлежат к двадцати самым распространенным элементам, значительно меньше в природе брома и иода. • Все галогены находятся в природе в степени окисления (– 1). • Фтор и хлор существуют в природе в виде минералов: • • Ca. F 2 – флюорит или плавиковый шпат Ca 5[(PO 4)3. F] – фторапатит Na 3[Al. F 6] – криолит Na. Cl – галит или каменная соль KCl – сильвин KCl. Na. Cl – сильвинит KCl. Mg. Cl 2. 6 H 2 O – карналлит Минерал галит или каменная соль Na. Cl Лишь йод встречается в виде соли KIO 3, которая как примесь входит в селитру (KNO 3).
 Простые вещества • Простые вещества галогенов образованы молекулами Г 2. В простых веществах при переходе от F 2 к I 2 с увеличением числа электронных слоев и возрастанием поляризуемости атомов происходит усиление межмолекулярного взаимодействия, приводящее к изменению агрегатного состояния при стандартных условиях. При обычных условиях: • • Фтор – желтый газ, при – 181 о. С переходит в жидкое состояние. Хлор – желто-зеленый газ, переходит в жидкость при – 34 о. С. Бром – темно- красная, очень летучая жидкость, кипит при 58, 8 о. С. Йод – темно-фиолетовые кристаллы, со слабым «металлическим» блеском, • которые при нагревании легко возгоняется, образуя фиолетовые пары; при быстром охлаждении паров до 114 о. С образуется жидкость. Все простые вещества имеют резкий запах и являются ядовитыми. • •
Простые вещества • Простые вещества галогенов образованы молекулами Г 2. В простых веществах при переходе от F 2 к I 2 с увеличением числа электронных слоев и возрастанием поляризуемости атомов происходит усиление межмолекулярного взаимодействия, приводящее к изменению агрегатного состояния при стандартных условиях. При обычных условиях: • • Фтор – желтый газ, при – 181 о. С переходит в жидкое состояние. Хлор – желто-зеленый газ, переходит в жидкость при – 34 о. С. Бром – темно- красная, очень летучая жидкость, кипит при 58, 8 о. С. Йод – темно-фиолетовые кристаллы, со слабым «металлическим» блеском, • которые при нагревании легко возгоняется, образуя фиолетовые пары; при быстром охлаждении паров до 114 о. С образуется жидкость. Все простые вещества имеют резкий запах и являются ядовитыми. • •
 Простые вещества • Простые вещества галогенов образованы неполярными молекулами, они хорошо растворяются в неполярных органических растворителях. • В воде хлор, бром и йод ограниченно растворимы, их водные растворы называют хлорной, бромной и иодной водой. • Лучше других растворяется Br 2, концентрация брома в насыщенном растворе достигает 0, 2 моль/л, а хлора – 0, 1 моль/л. • Фтор разлагает воду: 2 F 2 + 2 H 2 O = O 2 + 4 HF
Простые вещества • Простые вещества галогенов образованы неполярными молекулами, они хорошо растворяются в неполярных органических растворителях. • В воде хлор, бром и йод ограниченно растворимы, их водные растворы называют хлорной, бромной и иодной водой. • Лучше других растворяется Br 2, концентрация брома в насыщенном растворе достигает 0, 2 моль/л, а хлора – 0, 1 моль/л. • Фтор разлагает воду: 2 F 2 + 2 H 2 O = O 2 + 4 HF
 Простые вещества • Галогены проявляют высокую окислительную активность и переходят в галогенидные анионы. Г 2 + 2 e– 2 Г– • Галогены энергично взаимодействуют с многими металлами, например: Mg + Cl 2 = Mg. Cl 2 Ti + 2 I 2 Ti. I 4 • Непосредственно взаимодействуют со многими неметаллами: водородом, фосфором, серой и др. H 2 + Cl 2 = 2 HCl 2 P + 3 Br 2 = 2 PBr 3 S + 3 F 2 = SF 6
Простые вещества • Галогены проявляют высокую окислительную активность и переходят в галогенидные анионы. Г 2 + 2 e– 2 Г– • Галогены энергично взаимодействуют с многими металлами, например: Mg + Cl 2 = Mg. Cl 2 Ti + 2 I 2 Ti. I 4 • Непосредственно взаимодействуют со многими неметаллами: водородом, фосфором, серой и др. H 2 + Cl 2 = 2 HCl 2 P + 3 Br 2 = 2 PBr 3 S + 3 F 2 = SF 6
 Простые вещества • Особенно высокой окислительной активностью обладает фтор. Фтор окисляет благородные металлы (Au, Pt). Pt + 3 F 2 = Pt. F 6 • Взаимодействует даже с некоторыми инертными газами (криптоном, ксеноном и радоном), например, Xe + 2 F 2 = Xe. F 4 • Галогены, соединяясь друг с другом, образуют интергалиды. • Например: Cl. F, Br. Cl, ICl, Cl. F 3, Br. F 5, IF 7, ICl 3. • В этих соединениях более легкий и более электроотрицательный галоген находится в степени окисления (– 1), а более тяжелый – в положительной степени окисления.
Простые вещества • Особенно высокой окислительной активностью обладает фтор. Фтор окисляет благородные металлы (Au, Pt). Pt + 3 F 2 = Pt. F 6 • Взаимодействует даже с некоторыми инертными газами (криптоном, ксеноном и радоном), например, Xe + 2 F 2 = Xe. F 4 • Галогены, соединяясь друг с другом, образуют интергалиды. • Например: Cl. F, Br. Cl, ICl, Cl. F 3, Br. F 5, IF 7, ICl 3. • В этих соединениях более легкий и более электроотрицательный галоген находится в степени окисления (– 1), а более тяжелый – в положительной степени окисления.
 Простые вещества • В ряду F 2, Cl 2, Br 2, I 2 окислительная способность ослабевает изза увеличения размера атомов и уменьшения электроотрицательности. Стандартные электродные потенциалы для простых о, В, для реакции Элемент Е веществ галогенов F Cl Br I O 2+ 4 e– + 4 H+ 2 H 2 O Ео, В для реакции 2 Г– +2 е – = Г 2 +2, 87 +1, 36 +1, 02 +0, 54 +1, 23 Уменьшение окислительной активности • F 2 и Cl 2 – окислители, способные окислить воду: вода горит в атмосфере F 2, а Cl 2 действует очень медленно и быстрее диспропорционирует.
Простые вещества • В ряду F 2, Cl 2, Br 2, I 2 окислительная способность ослабевает изза увеличения размера атомов и уменьшения электроотрицательности. Стандартные электродные потенциалы для простых о, В, для реакции Элемент Е веществ галогенов F Cl Br I O 2+ 4 e– + 4 H+ 2 H 2 O Ео, В для реакции 2 Г– +2 е – = Г 2 +2, 87 +1, 36 +1, 02 +0, 54 +1, 23 Уменьшение окислительной активности • F 2 и Cl 2 – окислители, способные окислить воду: вода горит в атмосфере F 2, а Cl 2 действует очень медленно и быстрее диспропорционирует.
 Простые вещества • Для простых веществ характерны реакции диспропорционирования. Cl 2 + H 2 O HCl + HOCl • В воде оно не доходит до конца, поэтому Cl 2 существует в водных растворах. • Еще большей устойчивостью в воде характеризуются Br 2 и I 2. • Диспропорционирование усиливается в щелочной среде. • При диспропорционировании хлора в щелочи образуются Cl– и Cl. O–. • При диспропорционировании йода в щелочи образуются I– и IO 3–. 3 I 2 + 6 Na. OH = 5 Na. I + Na. IO 3 + 3 H 2 O • Аналогично йоду диспропорционирует Br 2.
Простые вещества • Для простых веществ характерны реакции диспропорционирования. Cl 2 + H 2 O HCl + HOCl • В воде оно не доходит до конца, поэтому Cl 2 существует в водных растворах. • Еще большей устойчивостью в воде характеризуются Br 2 и I 2. • Диспропорционирование усиливается в щелочной среде. • При диспропорционировании хлора в щелочи образуются Cl– и Cl. O–. • При диспропорционировании йода в щелочи образуются I– и IO 3–. 3 I 2 + 6 Na. OH = 5 Na. I + Na. IO 3 + 3 H 2 O • Аналогично йоду диспропорционирует Br 2.
 Получение простых веществ • Все процессы получения свободных галогенов основаны на окислении галогенид-ионов. 2 Г – Г 2 + 2 e– • Фтор получают, пропуская электрический ток через безводный раствор соли KF в чистой жидкой плавиковой кислоте. • Плавиковую кислоту и фторид калия получают из флюорита Ca. F 2. • Основную массу хлора получают электролизом водного раствора Na. Cl. • Бром и иод получают, пропуская хлор через растворы бромидов и иодидов. 2 KI + Cl 2 = I 2 + 2 KCl
Получение простых веществ • Все процессы получения свободных галогенов основаны на окислении галогенид-ионов. 2 Г – Г 2 + 2 e– • Фтор получают, пропуская электрический ток через безводный раствор соли KF в чистой жидкой плавиковой кислоте. • Плавиковую кислоту и фторид калия получают из флюорита Ca. F 2. • Основную массу хлора получают электролизом водного раствора Na. Cl. • Бром и иод получают, пропуская хлор через растворы бромидов и иодидов. 2 KI + Cl 2 = I 2 + 2 KCl
 Соединения галогенов Галогенводородные кислоты и их соли • Наиболее устойчивыми соединениями галогенов являются соединения, содержащие галоген в степени окисления (– 1). • Галогенводороды: HCl, HBr, HI при стандартных условиях – бесцветные газы, состоящие из отдельных молекул. Фтороводород – бесцветная жидкость с температурой кипения 19, 50 С. Фтористый водород – ядовит. • Галогенводороды можно получить прямым синтезом из простых веществ. H 2 + F 2 = 2 HF • Галогенводороды можно получить и другими способами. HF получают в промышленности из флюорита (плавикового шпата). • При растворении галогенводородов в воде образуются кислоты.
Соединения галогенов Галогенводородные кислоты и их соли • Наиболее устойчивыми соединениями галогенов являются соединения, содержащие галоген в степени окисления (– 1). • Галогенводороды: HCl, HBr, HI при стандартных условиях – бесцветные газы, состоящие из отдельных молекул. Фтороводород – бесцветная жидкость с температурой кипения 19, 50 С. Фтористый водород – ядовит. • Галогенводороды можно получить прямым синтезом из простых веществ. H 2 + F 2 = 2 HF • Галогенводороды можно получить и другими способами. HF получают в промышленности из флюорита (плавикового шпата). • При растворении галогенводородов в воде образуются кислоты.
 Соединения галогенов Галогенводородные кислоты и их соли • Плавиковая кислота является слабой из-за высокой прочности связи H–F и из-за ассоциации молекул HF за счет водородных связей. Водородные связи сохраняются даже в продуктах нейтрализации плавиковой кислоты щелочью. Поэтому, в отличие от других одноосновных кислот, фтороводородная кислота образует кислые соли: KOH + (HF)2 KHF 2 + H 2 O • Дополнительным количеством щелочи KHF 2 можно перевести в KF. KHF 2 + KOH = 2 KF + H 2 O • Фтороводород и плавиковая кислота – очень едкие вещества. Их нельзя хранить в стеклянных сосудах, так как HF реагирует с диоксидом кремния, который входит в состав стекла: Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O
Соединения галогенов Галогенводородные кислоты и их соли • Плавиковая кислота является слабой из-за высокой прочности связи H–F и из-за ассоциации молекул HF за счет водородных связей. Водородные связи сохраняются даже в продуктах нейтрализации плавиковой кислоты щелочью. Поэтому, в отличие от других одноосновных кислот, фтороводородная кислота образует кислые соли: KOH + (HF)2 KHF 2 + H 2 O • Дополнительным количеством щелочи KHF 2 можно перевести в KF. KHF 2 + KOH = 2 KF + H 2 O • Фтороводород и плавиковая кислота – очень едкие вещества. Их нельзя хранить в стеклянных сосудах, так как HF реагирует с диоксидом кремния, который входит в состав стекла: Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O
 Соединения галогенов Галогенводородные кислоты и их соли • Хлороводород можно получить, действуя концентрированной серной кислотой на твердую соль Na. Cl. Поэтому хлороводородную кислоту и назвали соляной (получаемой из соли). Na. Cl + H 2 SO 4 = HCl + Na. HSO 4 • Этот способ еще используют в промышленности, но основным способом получения соляной кислоты является синтез из H 2 и Cl 2, с последующим растворением газа HCl в воде. H 2 + Cl 2 = 2 HCl • Соляная кислота является важным продуктом химической промышленности, обычно ее выпускают в виде 36% растворов. Эти растворы представляют собой бесцветные жидкости.
Соединения галогенов Галогенводородные кислоты и их соли • Хлороводород можно получить, действуя концентрированной серной кислотой на твердую соль Na. Cl. Поэтому хлороводородную кислоту и назвали соляной (получаемой из соли). Na. Cl + H 2 SO 4 = HCl + Na. HSO 4 • Этот способ еще используют в промышленности, но основным способом получения соляной кислоты является синтез из H 2 и Cl 2, с последующим растворением газа HCl в воде. H 2 + Cl 2 = 2 HCl • Соляная кислота является важным продуктом химической промышленности, обычно ее выпускают в виде 36% растворов. Эти растворы представляют собой бесцветные жидкости.
 Соединения галогенов Галогенводородные кислоты и их соли • HBr и HI нельзя получить действием серной кислоты на соответствующие соли из-за восстановительных свойств иодидов и бромидов, проявляемых по отношению к серной кислоте. Поэтому HBr и HI получают посредством гидролиза фторида и иодида фосфора: PI 3 + 3 H 2 O = 3 HI + H 3 PO 3 • Сила галогенводородных кислот увеличивается от HF к HI. • HF- слабая кислота; HCl, HBr, HI – сильные кислоты. • Все галогенводородные кислоты обладают общими свойствами кислот: • реагируют с основаниями, основными солями, основными оксидами, аммиаком и солями слабых кислот (например, карбонатами, сульфидами и др. ). • За счет катиона H+ галогенводородные кислоты способны окислять металлы, стоящие в ряду активности до водорода. Zn + 2 HCl = H 2 + Cl 2
Соединения галогенов Галогенводородные кислоты и их соли • HBr и HI нельзя получить действием серной кислоты на соответствующие соли из-за восстановительных свойств иодидов и бромидов, проявляемых по отношению к серной кислоте. Поэтому HBr и HI получают посредством гидролиза фторида и иодида фосфора: PI 3 + 3 H 2 O = 3 HI + H 3 PO 3 • Сила галогенводородных кислот увеличивается от HF к HI. • HF- слабая кислота; HCl, HBr, HI – сильные кислоты. • Все галогенводородные кислоты обладают общими свойствами кислот: • реагируют с основаниями, основными солями, основными оксидами, аммиаком и солями слабых кислот (например, карбонатами, сульфидами и др. ). • За счет катиона H+ галогенводородные кислоты способны окислять металлы, стоящие в ряду активности до водорода. Zn + 2 HCl = H 2 + Cl 2
 Соединения галогенов Соли галогенводородных кислот • Соли HF– фториды, HCl – хлориды, HBr –бромиды, HI –иодиды. • Галогенид-ионы являются донорами электронных пар (основаниями Льюиса). Они способны выполнять роль лигандов при образовании комплексных соединений с катионами многих металлов. • Например, ионы F– образуют прочные комплексы с ионами алюминия [Al. F 6]3–. Прочные фторидные комплексы образуют такие металлы как Ti, Zr, Hf, V, Nb, Ta, W. • Наиболее прочные хлоридные комплексы образуют благородные металлы: Pt, Pd, Ir, Rh, Au, Ag, например: H 2[Pt. Cl 6], H[Au. Cl 4], H[Ag. Cl 2].
Соединения галогенов Соли галогенводородных кислот • Соли HF– фториды, HCl – хлориды, HBr –бромиды, HI –иодиды. • Галогенид-ионы являются донорами электронных пар (основаниями Льюиса). Они способны выполнять роль лигандов при образовании комплексных соединений с катионами многих металлов. • Например, ионы F– образуют прочные комплексы с ионами алюминия [Al. F 6]3–. Прочные фторидные комплексы образуют такие металлы как Ti, Zr, Hf, V, Nb, Ta, W. • Наиболее прочные хлоридные комплексы образуют благородные металлы: Pt, Pd, Ir, Rh, Au, Ag, например: H 2[Pt. Cl 6], H[Au. Cl 4], H[Ag. Cl 2].
 Соединения галогенов Галогенводородные кислоты и их соли • Все галогенводороды и галогениды способны проявлять восстановительные свойства: 2 Г– Г 2 + 2 е– • В ряду F –, Cl –, Br –, I – восстановительные свойства усиливаются, этому способствует увеличение размера атома. • Наиболее сильным восстановителем из галогенид-ионов является иодид, самый слабый восстановитель – фторид-ион. • Для окисления хлоридных ионов требуются сильные окислители, например, Pb. O 2, Mn. O 2, KMn. O 4. 2 KMn. O 4 + 16 HCl = 5 Cl 2 + 2 Mn. Cl 2 + 8 H 2 O +2 KCl
Соединения галогенов Галогенводородные кислоты и их соли • Все галогенводороды и галогениды способны проявлять восстановительные свойства: 2 Г– Г 2 + 2 е– • В ряду F –, Cl –, Br –, I – восстановительные свойства усиливаются, этому способствует увеличение размера атома. • Наиболее сильным восстановителем из галогенид-ионов является иодид, самый слабый восстановитель – фторид-ион. • Для окисления хлоридных ионов требуются сильные окислители, например, Pb. O 2, Mn. O 2, KMn. O 4. 2 KMn. O 4 + 16 HCl = 5 Cl 2 + 2 Mn. Cl 2 + 8 H 2 O +2 KCl
 Соединения галогенов Кислородные соединения галогенов • Галогены с кислородом непосредственно не реагируют. • Самый активный из галогенов – фтор, способен окислить кислород из воды. • Дифторид кислорода OF 2 – бесцветный газ с характерным запахом. • Дифторид дикислорода O 2 F 2 – газ, очень неустойчивое соединение. • Другие галогены имеют электроотрицательность более низкую, чем кислород, и в соединениях с ним проявляют положительные степени окисления. • Оксиды галогенов - неустойчивые соединения. • При 25 о. С сравнительно стабильны: Cl 2 O, Cl. O 2, Cl 2 O 6, Cl 2 O 7; I 2 O 5 устойчив до 300 о. С. • Все оксиды галогенов обладают сильным окислительным действием. • Наиболее распространенными кислородными соединениями хлора, брома, иода являются кислородсодержащие кислоты и их соли.
Соединения галогенов Кислородные соединения галогенов • Галогены с кислородом непосредственно не реагируют. • Самый активный из галогенов – фтор, способен окислить кислород из воды. • Дифторид кислорода OF 2 – бесцветный газ с характерным запахом. • Дифторид дикислорода O 2 F 2 – газ, очень неустойчивое соединение. • Другие галогены имеют электроотрицательность более низкую, чем кислород, и в соединениях с ним проявляют положительные степени окисления. • Оксиды галогенов - неустойчивые соединения. • При 25 о. С сравнительно стабильны: Cl 2 O, Cl. O 2, Cl 2 O 6, Cl 2 O 7; I 2 O 5 устойчив до 300 о. С. • Все оксиды галогенов обладают сильным окислительным действием. • Наиболее распространенными кислородными соединениями хлора, брома, иода являются кислородсодержащие кислоты и их соли.
 Соединения галогенов Кислородные соединения галогенов • Кислородсодержащие кислоты галогенов – это одноосновные кислоты, с общей формулой HЭОх. • Их сила растет по мере увеличения числа кислородных атомов. Исключение составляет слабая йодная кислота H 5 IO 6. • При переходе от Cl к Br сила оксокислот ослабевает. • Сильными являются кислоты: HCl. O 4 , HBr. O 4, HCl. O 3, HBr. O 3, HIO 3. • Для Cl известны кислоты: § HCl. O (монооксохлорная или хлорноватистая), § HCl. O 2 (диоксохлорная или хлористая), § HCl. O 3 (триоксохлорная или хлорноватая), § HCl. O 4 (тетраоксохлорная или хлорная); • для Br – HBr. O, HBr. O 2, HBr. O 3, HBr. O 4; для I – HIO 3, H 5 IO 6.
Соединения галогенов Кислородные соединения галогенов • Кислородсодержащие кислоты галогенов – это одноосновные кислоты, с общей формулой HЭОх. • Их сила растет по мере увеличения числа кислородных атомов. Исключение составляет слабая йодная кислота H 5 IO 6. • При переходе от Cl к Br сила оксокислот ослабевает. • Сильными являются кислоты: HCl. O 4 , HBr. O 4, HCl. O 3, HBr. O 3, HIO 3. • Для Cl известны кислоты: § HCl. O (монооксохлорная или хлорноватистая), § HCl. O 2 (диоксохлорная или хлористая), § HCl. O 3 (триоксохлорная или хлорноватая), § HCl. O 4 (тетраоксохлорная или хлорная); • для Br – HBr. O, HBr. O 2, HBr. O 3, HBr. O 4; для I – HIO 3, H 5 IO 6.
 Соединения галогенов Кислородные соединения галогенов • Кислородсодержащие кислоты галогенов и их соли являются сильными окислителями, особенно в кислых растворах. • В качестве окислителя из кислородных солей галогенов шире всего используется сильный и быстрый окислитель гипохлорит, а также хлорат. • Оксиды, кислородные кислоты и оксоанионы способны к диспропорционированию. Исключение – соединения в степени окисления +7. • Соли кислородсодержащих кислот также могут при нагревании разлагаться с выделением O 2. Пример. 4 KCl. O 3 3 KCl. O 4 + KCl 2 KCl. O 3 = 3 O 2 + 2 KCl
Соединения галогенов Кислородные соединения галогенов • Кислородсодержащие кислоты галогенов и их соли являются сильными окислителями, особенно в кислых растворах. • В качестве окислителя из кислородных солей галогенов шире всего используется сильный и быстрый окислитель гипохлорит, а также хлорат. • Оксиды, кислородные кислоты и оксоанионы способны к диспропорционированию. Исключение – соединения в степени окисления +7. • Соли кислородсодержащих кислот также могут при нагревании разлагаться с выделением O 2. Пример. 4 KCl. O 3 3 KCl. O 4 + KCl 2 KCl. O 3 = 3 O 2 + 2 KCl
 Соединения галогенов Диаграммы Латимера. • При обсуждении окислительно-восстановительных свойств соединений химических элементов часто опираются на диаграммы Латимера. • Из этих диаграмм можно получить информацию лишь о принципиальной возможности окислительно-восстановительного превращения в стандартных условиях. • Для окислительно-восстановительных реакций в водных растворах часто характерны кинетические затруднения, поэтому можно и не получить продукты, образование которых вероятно с точки зрения термодинамики.
Соединения галогенов Диаграммы Латимера. • При обсуждении окислительно-восстановительных свойств соединений химических элементов часто опираются на диаграммы Латимера. • Из этих диаграмм можно получить информацию лишь о принципиальной возможности окислительно-восстановительного превращения в стандартных условиях. • Для окислительно-восстановительных реакций в водных растворах часто характерны кинетические затруднения, поэтому можно и не получить продукты, образование которых вероятно с точки зрения термодинамики.
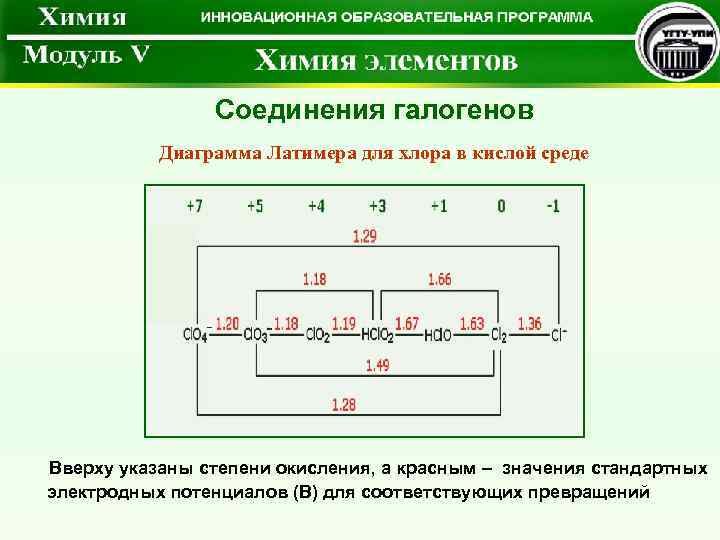 Соединения галогенов Диаграмма Латимера для хлора в кислой среде Вверху указаны степени окисления, а красным – значения стандартных электродных потенциалов (В) для соответствующих превращений
Соединения галогенов Диаграмма Латимера для хлора в кислой среде Вверху указаны степени окисления, а красным – значения стандартных электродных потенциалов (В) для соответствующих превращений
 Соединения галогенов Диаграмма Латимера для хлора в щелочной среде Вверху указаны степени окисления, а синим – значения стандартных электродных потенциалов (В) для соответствующих превращений
Соединения галогенов Диаграмма Латимера для хлора в щелочной среде Вверху указаны степени окисления, а синим – значения стандартных электродных потенциалов (В) для соответствующих превращений
 Рекомендуемая учебная литература § Степин Б. Д. , Цветков А. А. Неорганическая химия: Учебник для вузов / Б. Д. Степин, А. А. Цветков. – М. : Высш. шк. , 1994. - 608 с. : ил. § Карапетьянц М. Х. Общая и неорганическая химия: Учебник для студентов вузов / М. Х. Карапетьянц, С. И. Дракин. - 4 -е изд. , стер. - М. : Химия, 2000. - 592 с. : ил. § Угай Я. А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я. А. Угай. - 3 -е изд. , испр. - М. : Высш. шк. , 2007. - 527 с. : ил. § Никольский А. Б. , Суворов А. В. Химия. Учебник для вузов / А. Б. Никольский, А. В. Суворов. – СПб: Химиздат, 2001. - 512 с. : ил.
Рекомендуемая учебная литература § Степин Б. Д. , Цветков А. А. Неорганическая химия: Учебник для вузов / Б. Д. Степин, А. А. Цветков. – М. : Высш. шк. , 1994. - 608 с. : ил. § Карапетьянц М. Х. Общая и неорганическая химия: Учебник для студентов вузов / М. Х. Карапетьянц, С. И. Дракин. - 4 -е изд. , стер. - М. : Химия, 2000. - 592 с. : ил. § Угай Я. А. Общая и неорганическая химия: Учебник для студентов вузов, обучающихся по направлению и специальности "Химия" / Я. А. Угай. - 3 -е изд. , испр. - М. : Высш. шк. , 2007. - 527 с. : ил. § Никольский А. Б. , Суворов А. В. Химия. Учебник для вузов / А. Б. Никольский, А. В. Суворов. – СПб: Химиздат, 2001. - 512 с. : ил.


