Неметаллы.pptx
- Количество слайдов: 19
 НЕМЕТАЛЛЫ.
НЕМЕТАЛЛЫ.
 Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов ЭЛЕМЕНТЫ 109 НЕМЕТАЛЛЫ 22 МЕТАЛЛЫ 87
Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов ЭЛЕМЕНТЫ 109 НЕМЕТАЛЛЫ 22 МЕТАЛЛЫ 87
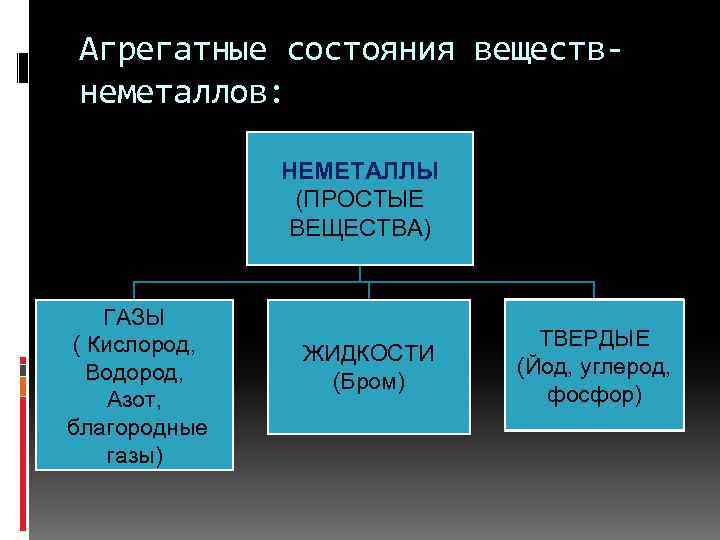 Агрегатные состояния веществнеметаллов: НЕМЕТАЛЛЫ (ПРОСТЫЕ ВЕЩЕСТВА) ГАЗЫ ( Кислород, Водород, Азот, благородные газы) ЖИДКОСТИ (Бром) ТВЕРДЫЕ (Йод, углерод, фосфор)
Агрегатные состояния веществнеметаллов: НЕМЕТАЛЛЫ (ПРОСТЫЕ ВЕЩЕСТВА) ГАЗЫ ( Кислород, Водород, Азот, благородные газы) ЖИДКОСТИ (Бром) ТВЕРДЫЕ (Йод, углерод, фосфор)
 He +2 ) 2 e- Ne +10)) Ar Kr VIII A группа 8 e- При обычных условиях Инертные это бесцветные газы с + 18 ))) 8 eнизкими температурами газы (благородные) кипения и плавления, без + 36 )))) 8 e- вкуса и запаха. Xe + 54 ))))) 8 e- Атомы имеют завершённый внешний уровень Rn + 86 )))))) 8 e. Каждая молекула инертного газа состоит из одного атома.
He +2 ) 2 e- Ne +10)) Ar Kr VIII A группа 8 e- При обычных условиях Инертные это бесцветные газы с + 18 ))) 8 eнизкими температурами газы (благородные) кипения и плавления, без + 36 )))) 8 e- вкуса и запаха. Xe + 54 ))))) 8 e- Атомы имеют завершённый внешний уровень Rn + 86 )))))) 8 e. Каждая молекула инертного газа состоит из одного атома.
 В электрическом разряде инертные газы дают характерное свечение.
В электрическом разряде инертные газы дают характерное свечение.
 Гелий возглавляет группу инертных газов в Периодической таблице. Он является одним из наиболее распространённых элементов во Вселенной, занимает второе место после водорода. Также гелий является вторым по лёгкости химическим элементом. Благодаря низкой плотности гелия при вдыхании его резко меняется тембр голоса.
Гелий возглавляет группу инертных газов в Периодической таблице. Он является одним из наиболее распространённых элементов во Вселенной, занимает второе место после водорода. Также гелий является вторым по лёгкости химическим элементом. Благодаря низкой плотности гелия при вдыхании его резко меняется тембр голоса.
 Поскольку гелий обладает низкой плотностью и не горюч, им заполняют метеорологические шары-зонды, аэростаты, дирижабли.
Поскольку гелий обладает низкой плотностью и не горюч, им заполняют метеорологические шары-зонды, аэростаты, дирижабли.
 – рождающие соли ГАЛОГЕНЫ
– рождающие соли ГАЛОГЕНЫ
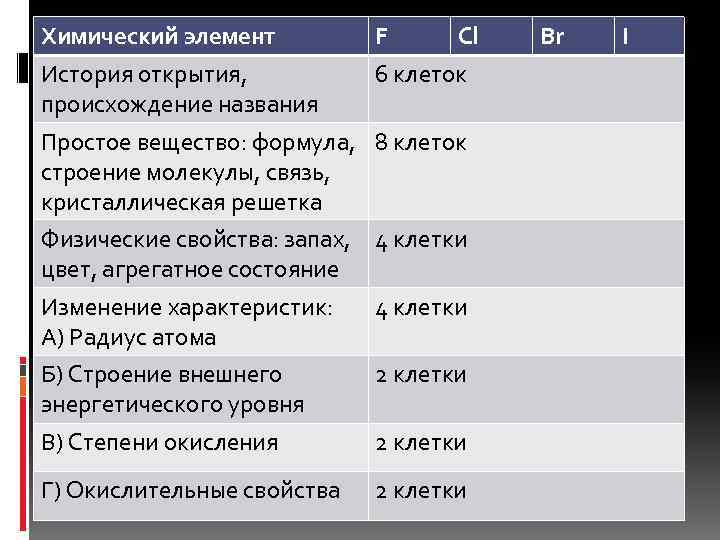 Химический элемент F Cl История открытия, происхождение названия 6 клеток Простое вещество: формула, 8 клеток строение молекулы, связь, кристаллическая решетка Физические свойства: запах, 4 клетки цвет, агрегатное состояние Изменение характеристик: А) Радиус атома 4 клетки Б) Строение внешнего энергетического уровня 2 клетки В) Степени окисления 2 клетки Г) Окислительные свойства 2 клетки Br I
Химический элемент F Cl История открытия, происхождение названия 6 клеток Простое вещество: формула, 8 клеток строение молекулы, связь, кристаллическая решетка Физические свойства: запах, 4 клетки цвет, агрегатное состояние Изменение характеристик: А) Радиус атома 4 клетки Б) Строение внешнего энергетического уровня 2 клетки В) Степени окисления 2 клетки Г) Окислительные свойства 2 клетки Br I
 История открытия: В 1886 году французскому химику Анри Муассану удалось получить фтор. От «Фторос» – «разрушение, гибель» В 1774 г. Карл Шееле открыл хлор. От “Хлорос” –как желто-зеленый. В 1826 г. Балар открыл бром. От “Бромос” - зловонный. В 1811 г. Куртуа открыл иод. От “Иодэс” –фиолетовый.
История открытия: В 1886 году французскому химику Анри Муассану удалось получить фтор. От «Фторос» – «разрушение, гибель» В 1774 г. Карл Шееле открыл хлор. От “Хлорос” –как желто-зеленый. В 1826 г. Балар открыл бром. От “Бромос” - зловонный. В 1811 г. Куртуа открыл иод. От “Иодэс” –фиолетовый.
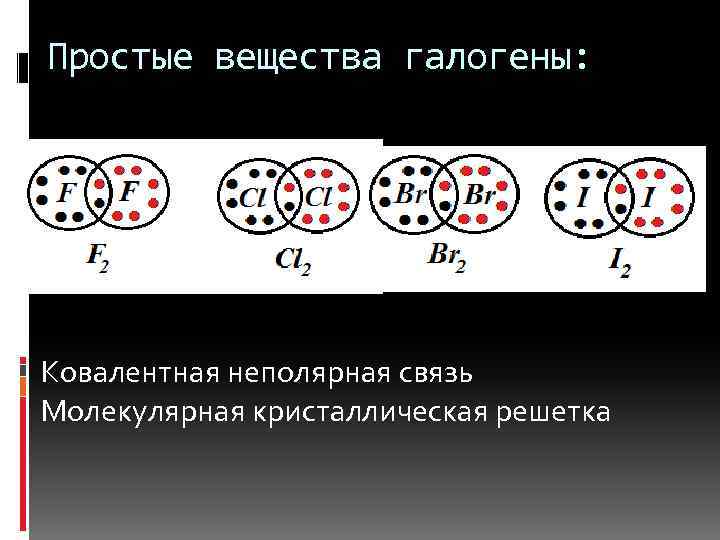 Простые вещества галогены: Ковалентная неполярная связь Молекулярная кристаллическая решетка
Простые вещества галогены: Ковалентная неполярная связь Молекулярная кристаллическая решетка
 Физические свойства галогенов: Фтор Хлор Бром Йод
Физические свойства галогенов: Фтор Хлор Бром Йод
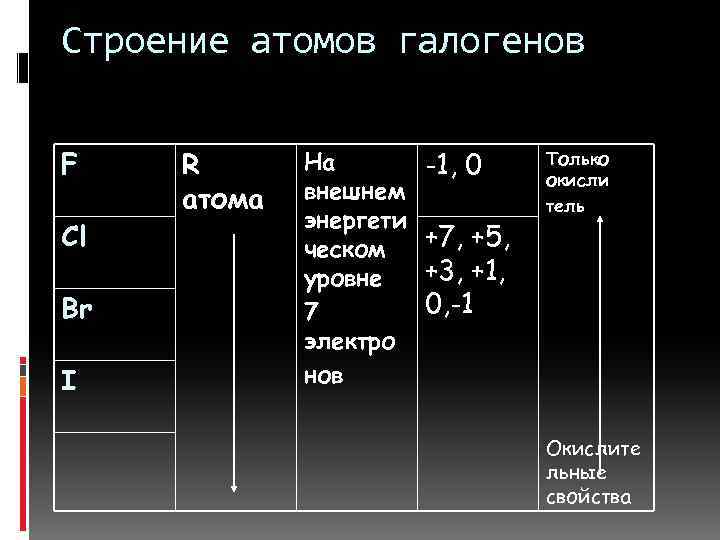 Строение атомов галогенов F Cl Br I R атома На внешнем энергети ческом уровне 7 электро нов -1, 0 +7, +5, +3, +1, 0, -1 Только окисли тель Окислите льные свойства
Строение атомов галогенов F Cl Br I R атома На внешнем энергети ческом уровне 7 электро нов -1, 0 +7, +5, +3, +1, 0, -1 Только окисли тель Окислите льные свойства
 Химические свойства неметаллов Окислители: взаимодействуют с металлами Восстановители ( кроме фтора, гелия, неона) взаимодействуют друг с другом Примечание : см. РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ НЕМЕТАЛЛОВ
Химические свойства неметаллов Окислители: взаимодействуют с металлами Восстановители ( кроме фтора, гелия, неона) взаимодействуют друг с другом Примечание : см. РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ НЕМЕТАЛЛОВ
 1) Взаимодействие с металлами: Zn 0 + F 20 → Zn+2 F 2 -1 Zn 0 - 2 e- → Zn+2 2 1 в-ль 2 0 + 2 e- → 2 F-1 2 1 о-ль F 2 Hg + S → Hg. S 2) Взаимодействие с неметаллами: 3 Н 20 + N 20 = 2 H 3+N-3 Н 20 - 2 е-→ 2 H+ 2 3 в-ль 6 0 + 6 е- → 2 N- 3 6 1 o-ль N 2
1) Взаимодействие с металлами: Zn 0 + F 20 → Zn+2 F 2 -1 Zn 0 - 2 e- → Zn+2 2 1 в-ль 2 0 + 2 e- → 2 F-1 2 1 о-ль F 2 Hg + S → Hg. S 2) Взаимодействие с неметаллами: 3 Н 20 + N 20 = 2 H 3+N-3 Н 20 - 2 е-→ 2 H+ 2 3 в-ль 6 0 + 6 е- → 2 N- 3 6 1 o-ль N 2
 Si + 2 Cl 2 = Si. Cl 4 3) Галогены способны вытеснять друга из соединений (кроме фтора). Галоген, располагающийся выше вытесняет те, что ниже (по ПСХЭ). Cl 2 + 2 HI → 2 HCl + I 2 Cl 2 + 2 KBr → 2 KCl + Br 2 4) Взаимодействие галогенов с водой: Cl 2 + Н 2 О HCl + HCl. O 5) Взаимодействие со сложными веществами:
Si + 2 Cl 2 = Si. Cl 4 3) Галогены способны вытеснять друга из соединений (кроме фтора). Галоген, располагающийся выше вытесняет те, что ниже (по ПСХЭ). Cl 2 + 2 HI → 2 HCl + I 2 Cl 2 + 2 KBr → 2 KCl + Br 2 4) Взаимодействие галогенов с водой: Cl 2 + Н 2 О HCl + HCl. O 5) Взаимодействие со сложными веществами:
 Подумайте…. Что образуется в данной реакции, оксид фтора или фторид кислорода? F 2 + O 2
Подумайте…. Что образуется в данной реакции, оксид фтора или фторид кислорода? F 2 + O 2
 Простые вещества: Металлы неметаллы 1. Твердые вещества (кроме ртути — Hg) 1, Твердые (сера — S, фосфор красный и фосфор белый — Р 4, иод — I 2, алмаз и графит — С), газообразные вещества (кислород — О 2, озон — О 3, азот — N 2, водород — Н 2, хлор — Сl 2, фтор — F 2, благородные газы) и жидкость (бром — Вг 2) 2. Имеют металлический блеск 2. Не имеют металлического блеска (исключение составляют иод — I 2, графит — С) 3. Электро-и теплопроводны 3. Большинство не проводит электрический ток (проводниками являются, например, кремний, графит) 4. Ковкие, пластичные, тягучие 4. В твердом состоянии — хрупкие
Простые вещества: Металлы неметаллы 1. Твердые вещества (кроме ртути — Hg) 1, Твердые (сера — S, фосфор красный и фосфор белый — Р 4, иод — I 2, алмаз и графит — С), газообразные вещества (кислород — О 2, озон — О 3, азот — N 2, водород — Н 2, хлор — Сl 2, фтор — F 2, благородные газы) и жидкость (бром — Вг 2) 2. Имеют металлический блеск 2. Не имеют металлического блеска (исключение составляют иод — I 2, графит — С) 3. Электро-и теплопроводны 3. Большинство не проводит электрический ток (проводниками являются, например, кремний, графит) 4. Ковкие, пластичные, тягучие 4. В твердом состоянии — хрупкие
 Домашнее задание: § 21, № 6, 7, с. 179
Домашнее задание: § 21, № 6, 7, с. 179


