lecture_3_2013.pptx
- Количество слайдов: 34
 Некоторые популярные лиганды в металлоорганической химии 1
Некоторые популярные лиганды в металлоорганической химии 1
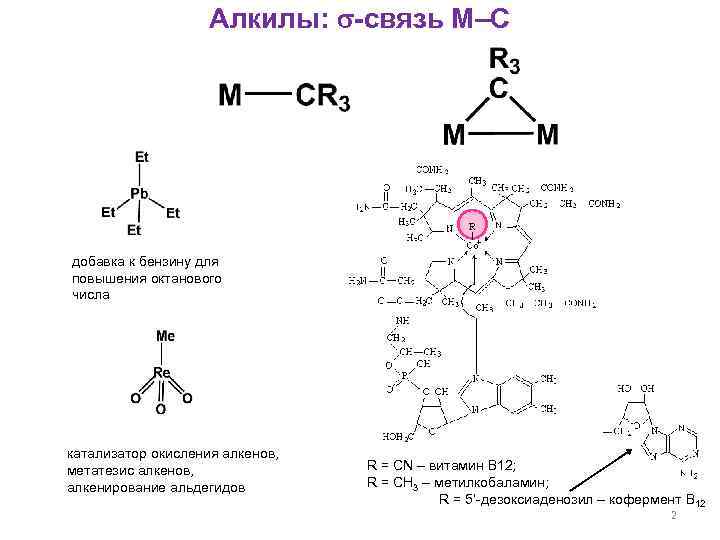 Алкилы: -связь М–С добавка к бензину для повышения октанового числа катализатор окисления алкенов, метатезис алкенов, алкенирование альдегидов R = CN – витамин B 12; R = CH 3 – метилкобаламин; R = 5’-дезоксиаденозил – кофермент B 12 2
Алкилы: -связь М–С добавка к бензину для повышения октанового числа катализатор окисления алкенов, метатезис алкенов, алкенирование альдегидов R = CN – витамин B 12; R = CH 3 – метилкобаламин; R = 5’-дезоксиаденозил – кофермент B 12 2
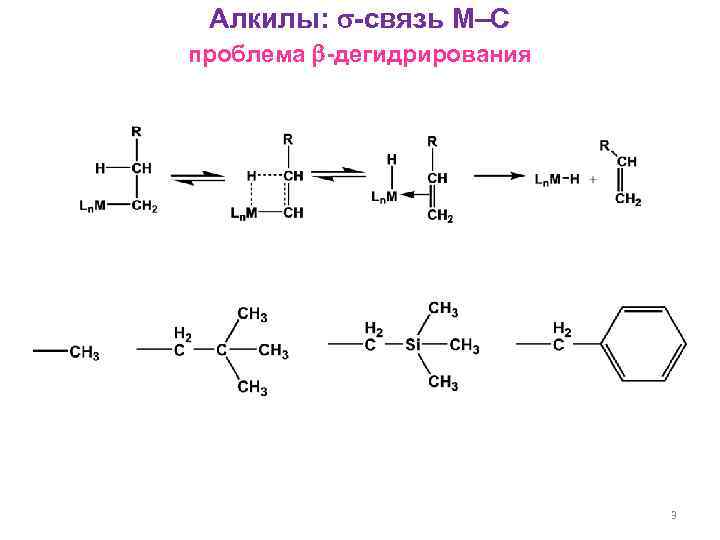 Алкилы: -связь М–С проблема -дегидрирования 3
Алкилы: -связь М–С проблема -дегидрирования 3
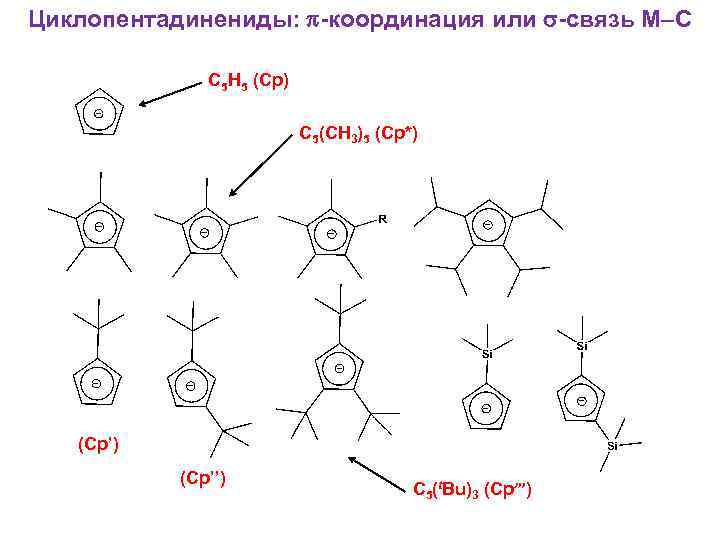 Циклопентадинениды: -координация или -связь M–C C 5 H 5 (Cp) C 5(CH 3)5 (Cp*) (Cp’’) C 5(t. Bu)3 (Cp’”)
Циклопентадинениды: -координация или -связь M–C C 5 H 5 (Cp) C 5(CH 3)5 (Cp*) (Cp’’) C 5(t. Bu)3 (Cp’”)
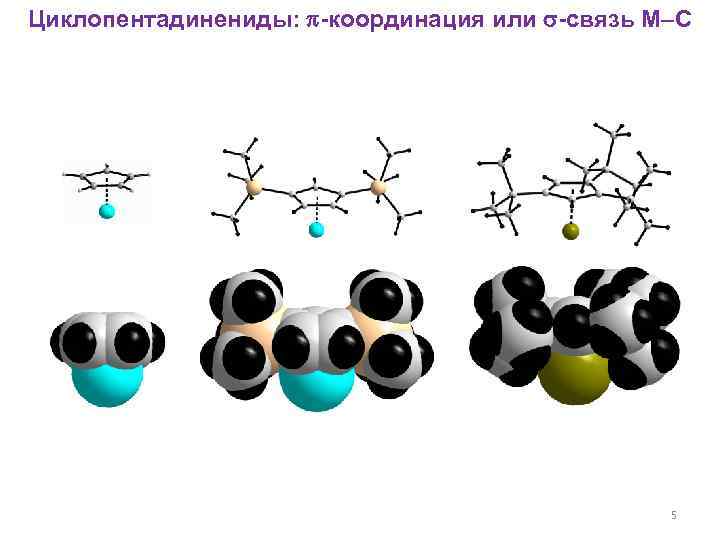 Циклопентадинениды: -координация или -связь M–C 5
Циклопентадинениды: -координация или -связь M–C 5
 Металлоорганические соединения металлов 1 группы (1 М) 6
Металлоорганические соединения металлов 1 группы (1 М) 6
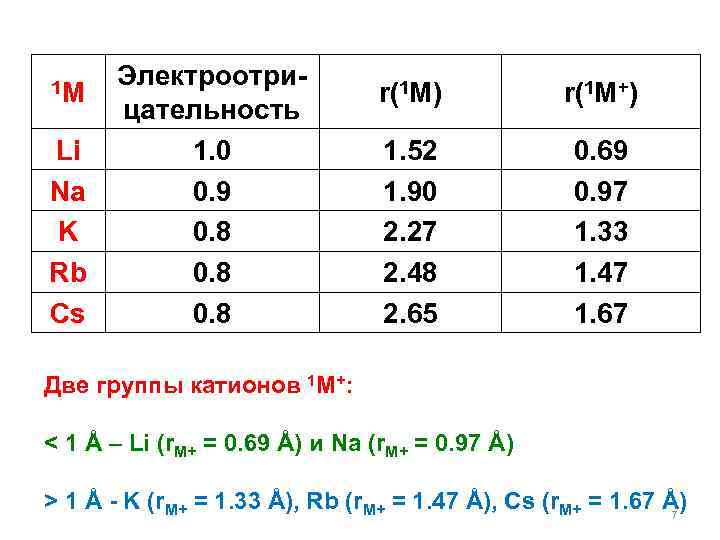 1 M Li Na K Rb Cs Электроотрицательность 1. 0 0. 9 0. 8 r(1 M) r(1 M+) 1. 52 1. 90 2. 27 2. 48 2. 65 0. 69 0. 97 1. 33 1. 47 1. 67 Две группы катионов 1 M+: < 1 Å – Li (r. M+ = 0. 69 Å) и Na (r. M+ = 0. 97 Å) > 1 Å - K (r. M+ = 1. 33 Å), Rb (r. M+ = 1. 47 Å), Cs (r. M+ = 1. 67 Å) 7
1 M Li Na K Rb Cs Электроотрицательность 1. 0 0. 9 0. 8 r(1 M) r(1 M+) 1. 52 1. 90 2. 27 2. 48 2. 65 0. 69 0. 97 1. 33 1. 47 1. 67 Две группы катионов 1 M+: < 1 Å – Li (r. M+ = 0. 69 Å) и Na (r. M+ = 0. 97 Å) > 1 Å - K (r. M+ = 1. 33 Å), Rb (r. M+ = 1. 47 Å), Cs (r. M+ = 1. 67 Å) 7
 Строение R 1 M 8
Строение R 1 M 8
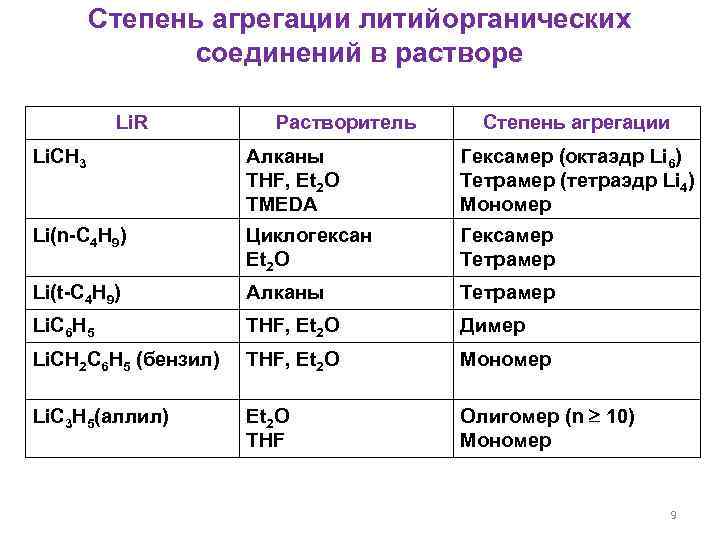 Степень агрегации литийорганических соединений в растворе Li. R Растворитель Степень агрегации Li. CH 3 Алканы THF, Et 2 O TMEDA Гексамер (октаэдр Li 6) Тетрамер (тетраэдр Li 4) Мономер Li(n-C 4 H 9) Циклогексан Et 2 O Гексамер Тетрамер Li(t-C 4 H 9) Алканы Тетрамер Li. C 6 H 5 THF, Et 2 O Димер Li. CH 2 C 6 H 5 (бензил) THF, Et 2 O Мономер Li. C 3 H 5(аллил) Et 2 O THF Олигомер (n 10) Мономер 9
Степень агрегации литийорганических соединений в растворе Li. R Растворитель Степень агрегации Li. CH 3 Алканы THF, Et 2 O TMEDA Гексамер (октаэдр Li 6) Тетрамер (тетраэдр Li 4) Мономер Li(n-C 4 H 9) Циклогексан Et 2 O Гексамер Тетрамер Li(t-C 4 H 9) Алканы Тетрамер Li. C 6 H 5 THF, Et 2 O Димер Li. CH 2 C 6 H 5 (бензил) THF, Et 2 O Мономер Li. C 3 H 5(аллил) Et 2 O THF Олигомер (n 10) Мономер 9
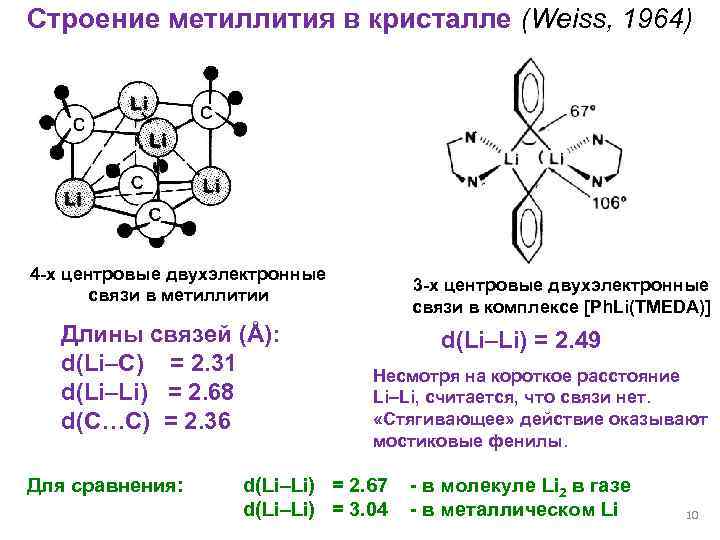 Строение метиллития в кристалле (Weiss, 1964) 4 -х центровые двухэлектронные связи в метиллитии Длины связей (Å): d(Li–C) = 2. 31 d(Li–Li) = 2. 68 d(C…С) = 2. 36 Для сравнения: 3 -х центровые двухэлектронные связи в комплексе [Ph. Li(TMEDA)] d(Li–Li) = 2. 49 Несмотря на короткое расстояние Li–Li, считается, что связи нет. «Стягивающее» действие оказывают мостиковые фенилы. d(Li–Li) = 2. 67 d(Li–Li) = 3. 04 - в молекуле Li 2 в газе - в металлическом Li 10
Строение метиллития в кристалле (Weiss, 1964) 4 -х центровые двухэлектронные связи в метиллитии Длины связей (Å): d(Li–C) = 2. 31 d(Li–Li) = 2. 68 d(C…С) = 2. 36 Для сравнения: 3 -х центровые двухэлектронные связи в комплексе [Ph. Li(TMEDA)] d(Li–Li) = 2. 49 Несмотря на короткое расстояние Li–Li, считается, что связи нет. «Стягивающее» действие оказывают мостиковые фенилы. d(Li–Li) = 2. 67 d(Li–Li) = 3. 04 - в молекуле Li 2 в газе - в металлическом Li 10
 Строение R 1 M Степень ионности связи M–C увеличивается с увеличением атомного номера металла Na. CH 3 имеет структуру Li. CH 3 M+(CH 3)– (M = K, Rb, Cs) – ионные соединения со структурой Ni. As (гексагональная, простр. группа Р 63/mmс) 11
Строение R 1 M Степень ионности связи M–C увеличивается с увеличением атомного номера металла Na. CH 3 имеет структуру Li. CH 3 M+(CH 3)– (M = K, Rb, Cs) – ионные соединения со структурой Ni. As (гексагональная, простр. группа Р 63/mmс) 11
![Строение Cp 1 M 2. 82 Å 1. 97 Å [Cp. Li] [Cp. K] Строение Cp 1 M 2. 82 Å 1. 97 Å [Cp. Li] [Cp. K]](https://present5.com/presentation/5652994_177566256/image-12.jpg) Строение Cp 1 M 2. 82 Å 1. 97 Å [Cp. Li] [Cp. K] 12
Строение Cp 1 M 2. 82 Å 1. 97 Å [Cp. Li] [Cp. K] 12
 Методы синтеза R 1 M 13
Методы синтеза R 1 M 13
![Методы синтеза RLi – [1 а], [1 б], [2], [3], [5], [6], [9] Наиболее Методы синтеза RLi – [1 а], [1 б], [2], [3], [5], [6], [9] Наиболее](https://present5.com/presentation/5652994_177566256/image-14.jpg) Методы синтеза RLi – [1 а], [1 б], [2], [3], [5], [6], [9] Наиболее популярен метод [1 а]. Метод [6] приобрел особую популярность в последние 2 десятилетия, поскольку раствор n-Bu. Li стал доступен коммерчески. CH 3 Br + 2 Li C 5 Me 5 H + n-Bu. Li Et 2 O, 20 o. C THF, – 78 o. C CH 3 Li + Li. Br [1 а] C 5 Me 5 Li + n-Bu. H [6] 14
Методы синтеза RLi – [1 а], [1 б], [2], [3], [5], [6], [9] Наиболее популярен метод [1 а]. Метод [6] приобрел особую популярность в последние 2 десятилетия, поскольку раствор n-Bu. Li стал доступен коммерчески. CH 3 Br + 2 Li C 5 Me 5 H + n-Bu. Li Et 2 O, 20 o. C THF, – 78 o. C CH 3 Li + Li. Br [1 а] C 5 Me 5 Li + n-Bu. H [6] 14
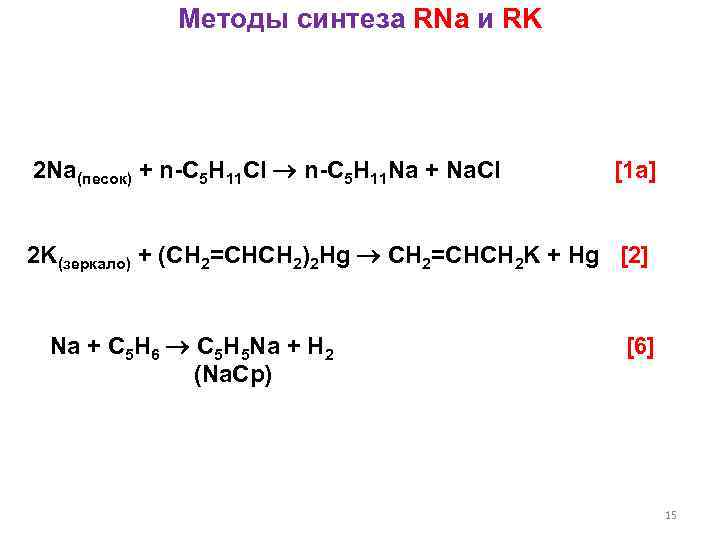 Методы синтеза RNa и RK 2 Na(песок) + n-C 5 H 11 Cl n-C 5 H 11 Na + Na. Cl [1 a] 2 K(зеркало) + (CH 2=CHCH 2)2 Hg CH 2=CHCH 2 K + Hg [2] Na + C 5 H 6 C 5 H 5 Na + H 2 (Na. Cp) [6] 15
Методы синтеза RNa и RK 2 Na(песок) + n-C 5 H 11 Cl n-C 5 H 11 Na + Na. Cl [1 a] 2 K(зеркало) + (CH 2=CHCH 2)2 Hg CH 2=CHCH 2 K + Hg [2] Na + C 5 H 6 C 5 H 5 Na + H 2 (Na. Cp) [6] 15
 Неустойчивость R 1 M в растворе Разрыв эфирной группировки в простых эфирах. Растворы в эфирах очень неустойчивы! Особенно в циклических (ТГФ)! Li. R + (R’CH 2)2 O R’CH 2 OLi + RH + R’CH=CH 2 См. таблицу. 16
Неустойчивость R 1 M в растворе Разрыв эфирной группировки в простых эфирах. Растворы в эфирах очень неустойчивы! Особенно в циклических (ТГФ)! Li. R + (R’CH 2)2 O R’CH 2 OLi + RH + R’CH=CH 2 См. таблицу. 16
 Условия, в которых время полуразложения RLi составляет 100 и более часов (Schlosser, 1994) o. C Et 2 O THF DME (диметоксиэтан) 17
Условия, в которых время полуразложения RLi составляет 100 и более часов (Schlosser, 1994) o. C Et 2 O THF DME (диметоксиэтан) 17
 Неустойчивость R 1 M в растворе Элиминирование алкена ( -дегидрирование) Li. CH 2–R CH 2=CH–R + Li. H при 50 – 150 о. С Исключение: (2 -Bu)Li – разлагается уже при 0 о. С Na. CH 2 CH 3 CH 2=CH 2 + Na. H (уже при комнатной темп. ) Самометаллированние: 2 Na. CH 2 CH 3 Na. CH 2–CH 2 Na + C 2 H 6 … RNa и RK могут металлировать даже предельные углеводороды, несмотря на то, что в них они не растворяются! 18
Неустойчивость R 1 M в растворе Элиминирование алкена ( -дегидрирование) Li. CH 2–R CH 2=CH–R + Li. H при 50 – 150 о. С Исключение: (2 -Bu)Li – разлагается уже при 0 о. С Na. CH 2 CH 3 CH 2=CH 2 + Na. H (уже при комнатной темп. ) Самометаллированние: 2 Na. CH 2 CH 3 Na. CH 2–CH 2 Na + C 2 H 6 … RNa и RK могут металлировать даже предельные углеводороды, несмотря на то, что в них они не растворяются! 18
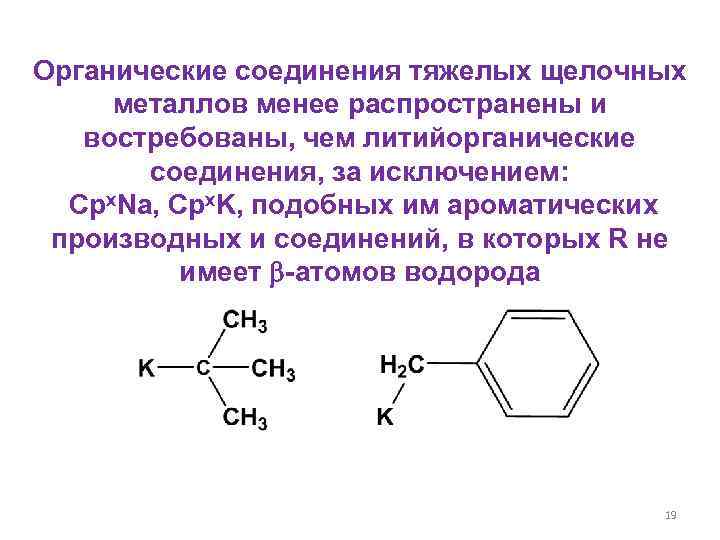 Органические соединения тяжелых щелочных металлов менее распространены и востребованы, чем литийорганические соединения, за исключением: Cpx. Na, Cpx. K, подобных им ароматических производных и соединений, в которых R не имеет -атомов водорода 19
Органические соединения тяжелых щелочных металлов менее распространены и востребованы, чем литийорганические соединения, за исключением: Cpx. Na, Cpx. K, подобных им ароматических производных и соединений, в которых R не имеет -атомов водорода 19
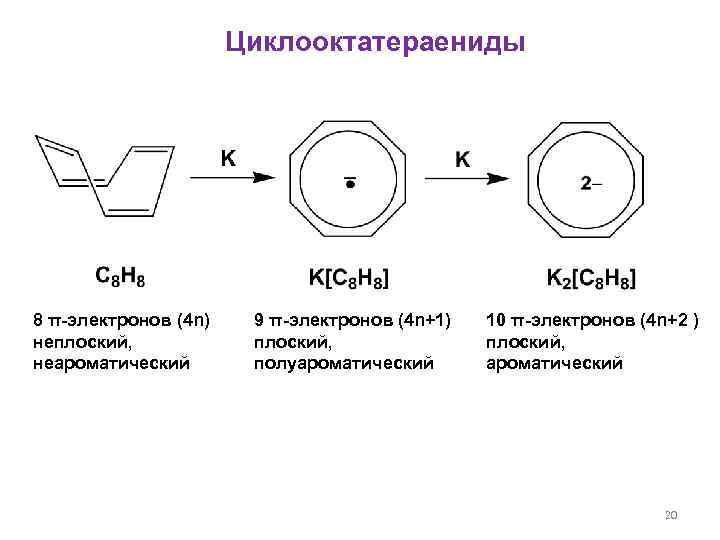 Циклооктатераениды 8 π-электронов (4 n) неплоский, неароматический 9 π-электронов (4 n+1) плоский, полуароматический 10 π-электронов (4 n+2 ) плоский, ароматический 20
Циклооктатераениды 8 π-электронов (4 n) неплоский, неароматический 9 π-электронов (4 n+1) плоский, полуароматический 10 π-электронов (4 n+2 ) плоский, ароматический 20
 Реакции R 1 M 21
Реакции R 1 M 21
 Реакционные центры в R 1 M –– 1 M + R Сильный нуклеофил + восстановитель: R e = R 2 R = R–R R = H + алкен Электрофильный центр возможна координация лигандов, прежде всего O- и N-донорных 22
Реакционные центры в R 1 M –– 1 M + R Сильный нуклеофил + восстановитель: R e = R 2 R = R–R R = H + алкен Электрофильный центр возможна координация лигандов, прежде всего O- и N-донорных 22
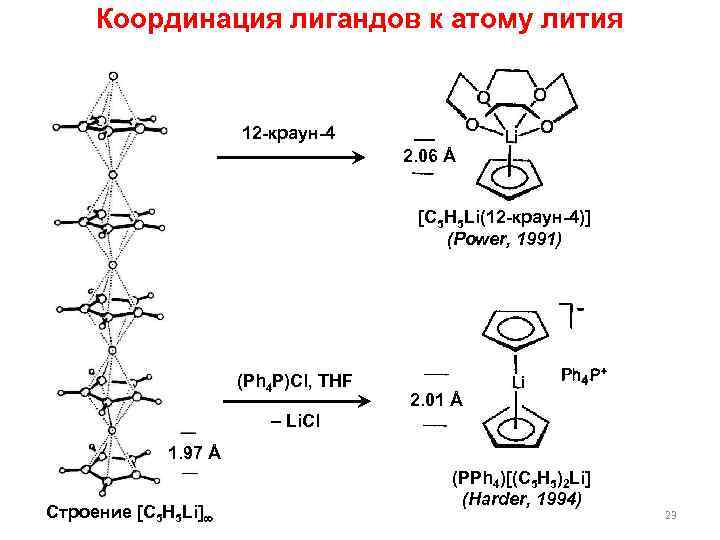 Координация лигандов к атому лития 12 -краун-4 2. 06 Å [C 5 H 5 Li(12 -краун-4)] (Power, 1991) (Ph 4 P)Cl, THF 2. 01 Å – Li. Cl 1. 97 Å Строение [C 5 H 5 Li] (PPh 4)[(C 5 H 5)2 Li] (Harder, 1994) 23
Координация лигандов к атому лития 12 -краун-4 2. 06 Å [C 5 H 5 Li(12 -краун-4)] (Power, 1991) (Ph 4 P)Cl, THF 2. 01 Å – Li. Cl 1. 97 Å Строение [C 5 H 5 Li] (PPh 4)[(C 5 H 5)2 Li] (Harder, 1994) 23
![Слой анионов в (PPh 4)[Cp 3 Cs 2] 3. 13 Å 24 Слой анионов в (PPh 4)[Cp 3 Cs 2] 3. 13 Å 24](https://present5.com/presentation/5652994_177566256/image-24.jpg) Слой анионов в (PPh 4)[Cp 3 Cs 2] 3. 13 Å 24
Слой анионов в (PPh 4)[Cp 3 Cs 2] 3. 13 Å 24
![Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Примеры: n. Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Примеры: n.](https://present5.com/presentation/5652994_177566256/image-25.jpg) Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Примеры: n. Li. R + MXn Rn. M + n. Li. X Me 3 Sb, Ph 4 Sn Li. R + MXn RMXn 1 + Li. X RMg. Cl, Me. Sn. Cl 3 Li. R + R’MXn 1 RR’MXn 2 + Li. X Ph(Me)Sn. Cl 2 (n+1)Li. R + MXn Li+[Rn. M] + n. Li. X [Ph 4 B] ate-комлексы 25
Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Примеры: n. Li. R + MXn Rn. M + n. Li. X Me 3 Sb, Ph 4 Sn Li. R + MXn RMXn 1 + Li. X RMg. Cl, Me. Sn. Cl 3 Li. R + R’MXn 1 RR’MXn 2 + Li. X Ph(Me)Sn. Cl 2 (n+1)Li. R + MXn Li+[Rn. M] + n. Li. X [Ph 4 B] ate-комлексы 25
![Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы: Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы:](https://present5.com/presentation/5652994_177566256/image-26.jpg) Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы: 1) R 1 M – сильные восстановители Li. Cp* + In. Cl Cp*In + Li. Cl (Cp* = C 5 Me 5) KCp* + In. Cl In + KCl + 1/2“(Cp*)2” 26
Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы: 1) R 1 M – сильные восстановители Li. Cp* + In. Cl Cp*In + Li. Cl (Cp* = C 5 Me 5) KCp* + In. Cl In + KCl + 1/2“(Cp*)2” 26
![Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы: Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы:](https://present5.com/presentation/5652994_177566256/image-27.jpg) Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы: 2) неосаждение галогенида 1 MX 2 4 + 4 MCl K 27
Нуклеофильное замещение галогенид-ионов были рассмотрены на второй лекции как метод синтеза [4] Возможные проблемы: 2) неосаждение галогенида 1 MX 2 4 + 4 MCl K 27
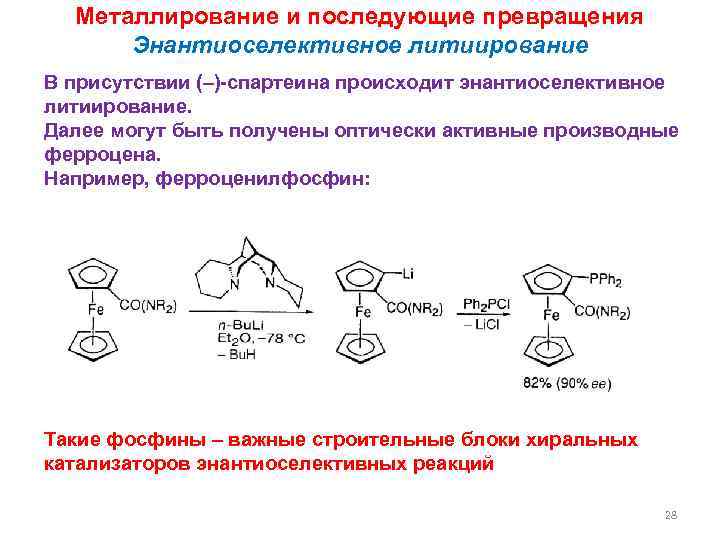 Металлирование и последующие превращения Энантиоселективное литиирование В присутствии (–)-спартеина происходит энантиоселективное литиирование. Далее могут быть получены оптически активные производные ферроцена. Например, ферроценилфосфин: Такие фосфины – важные строительные блоки хиральных катализаторов энантиоселективных реакций 28
Металлирование и последующие превращения Энантиоселективное литиирование В присутствии (–)-спартеина происходит энантиоселективное литиирование. Далее могут быть получены оптически активные производные ферроцена. Например, ферроценилфосфин: Такие фосфины – важные строительные блоки хиральных катализаторов энантиоселективных реакций 28
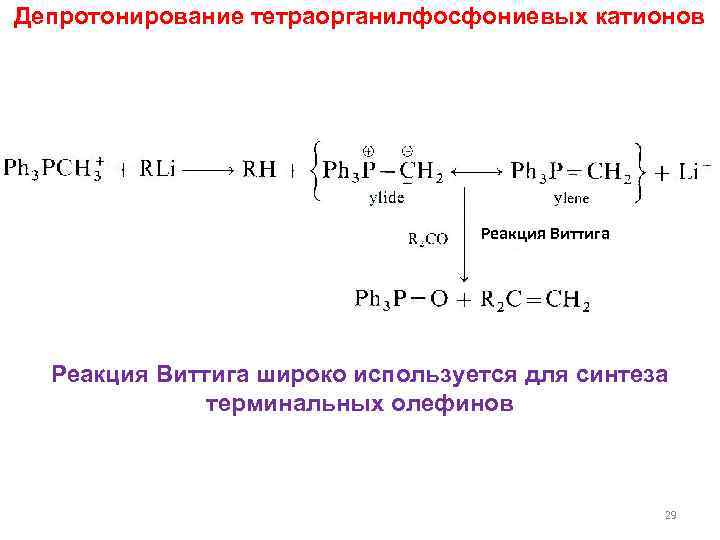 Депротонирование тетраорганилфосфониевых катионов Реакция Виттига широко используется для синтеза терминальных олефинов 29
Депротонирование тетраорганилфосфониевых катионов Реакция Виттига широко используется для синтеза терминальных олефинов 29
 Металлирование и последующие превращения Lochmann-Schlosser super. Base (LSB) n-Bu. Li/t-Bu. OK Работает как мощное и быстрое основание! Аллен Аллилкалий Просто с бутиллитием происходит присоединение Bu. Li по двойной связи! 30
Металлирование и последующие превращения Lochmann-Schlosser super. Base (LSB) n-Bu. Li/t-Bu. OK Работает как мощное и быстрое основание! Аллен Аллилкалий Просто с бутиллитием происходит присоединение Bu. Li по двойной связи! 30
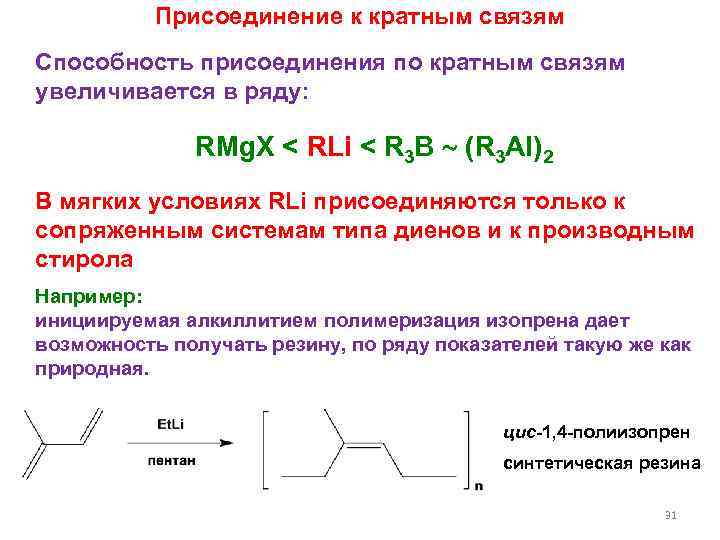 Присоединение к кратным связям Способность присоединения по кратным связям увеличивается в ряду: RMg. X < RLi < R 3 B (R 3 Al)2 В мягких условиях RLi присоединяются только к сопряженным системам типа диенов и к производным стирола Например: инициируемая алкиллитием полимеризация изопрена дает возможность получать резину, по ряду показателей такую же как природная. цис-1, 4 -полиизопрен синтетическая резина 31
Присоединение к кратным связям Способность присоединения по кратным связям увеличивается в ряду: RMg. X < RLi < R 3 B (R 3 Al)2 В мягких условиях RLi присоединяются только к сопряженным системам типа диенов и к производным стирола Например: инициируемая алкиллитием полимеризация изопрена дает возможность получать резину, по ряду показателей такую же как природная. цис-1, 4 -полиизопрен синтетическая резина 31
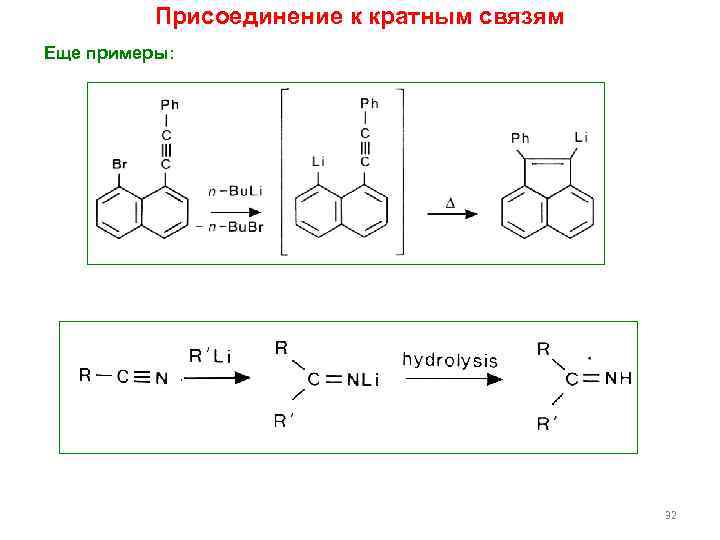 Присоединение к кратным связям Еще примеры: 32
Присоединение к кратным связям Еще примеры: 32
 Металлирование и последующие превращения Генерация монохлоркарбена … последующие реакции Прямых доказательств образования монохлоркарбена нет. Непонятно, детальным реагентом является он или же Li. CHCl 2. 33
Металлирование и последующие превращения Генерация монохлоркарбена … последующие реакции Прямых доказательств образования монохлоркарбена нет. Непонятно, детальным реагентом является он или же Li. CHCl 2. 33
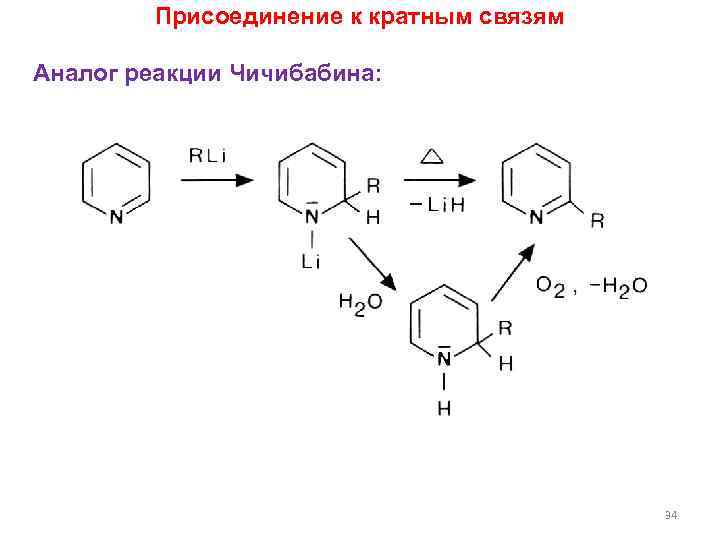 Присоединение к кратным связям Аналог реакции Чичибабина: 34
Присоединение к кратным связям Аналог реакции Чичибабина: 34


