нейромышечные заболевания Соломин.ppt
- Количество слайдов: 102

Нейромышечные заболевания нервной системы у детей. Доцент кафедры неврологии, мануальной терапии, рефлексотерапии НГИУВа, к. м. н. Соломин С. А.

1. 2. 3. 4. 5. 6. 7. План лекции: Нейромышечные заболевания нервной системы Общая характеристика заболеваний. клинически и генетически гетерогенная группа Классификация. наследственно-дегенеративных заболеваний, в основе которых лежит генетически Патогенез и патоморфология. детерминированное поражение определенной Клиническая картина, примеры, анатомической структуры нейромышечного фотографии больных. аппарата и характеризующаяся прогрессирующей мышечной слабостью и Дополнительные методы атрофиями. обследования. Лечение. Литература.

Актуальность проблемы НМЗ • БОЛЬШАЯ СОЦИАЛЬНАЯ ЗНАЧИМОСТЬ Текст слайда Ø высокая распространенность данной группы заболеваний в популяции Ø тяжелая инвалидизация больных

Актуальность проблемы НМЗ Ø низкая выявляемость ранних симптомов заболевания, Ø высокая частота ошибочного диагноза, как • позитивного, так и негативного, Текст слайда Ø недооценка клинических и нейрофизиологических диагностических критериев сопряжены с поздней диагностикой НМЗ, неадекватной тактикой лечения, что в конечном итоге приводит к развитию тяжелой инвалидизации. Вместе с тем литературные данные последних лет констатируют, что в 65– 80 % случаев рано выявленная нейромышечная патология при активном наблюдении и адекватном лечении может принимать доброкачественное течение.

Согласно международной базе данных генетической информации (2012) известно более 7500 наследственных синдромов, из них более 500 протекают с поражением нервной системы, включая около 200 нозологических форм нейромышечной патологии

Распространенность прогрессирующих мышечных дистрофий (ПМД) 200 случаев на 1 000 населения, что позволяет относить их к наиболее часто встречающимся формам наследственной патологии. ПМД Дюшенна — 9, 6 на 100 000 населения мужского пола, ПМД Беккера — 5, 0 на 100 000 тыс. , ПМД Эмери — Дрейфуса — 2 на 100 000 тыс. , конечностно-поясных форм ПМД — 1, 5– 2, 5 на 100 000 тыс. , ПМД Ландузи — Дежерина — 2, 9 на 100 000 тыс. , врожденная ПМД Фукуяма — 1 : 10 000 новорожденных , ПМД Грефе — 0, 9 на 100 000 тыс. , дистальная ПМД — 0, 4 на 100 000 спинальная мышечная атрофия (СМА) 2– 3– 9 на 100 тыс. населения, среди новорожденных — 1 на 10 тыс. Частота гетерозиготного носительства высокая — 1 на 40– 60 человек , наследственные мотосенсорные полиневропатии не менее 1 случая на 3000– 3500 человек

Ошибочная диагностика По-прежнему число случаев ошибочной диагностики при первичном обращении больных с НМЗ остается довольно высоким. Наиболее частым ошибочным диагнозом у детских неврологов является перинатальная энцефалопатия, детский церебральный паралич, аномалия развития головного мозга. Основанием для этих диагнозов нередко являются нарушения течения перинатального периода, задержка двигательного (72, 9 %) и психоречевого (37, 1 %) развития. В структуре ошибочного диагноза доминируют: хронический гепатит, кардиомиопатия, рахит, алиментарная гипотрофия, астенический синдром, гиповитаминоз. Нередко у многих детей с НМЗ при первых симптомах заболевания на первый план выступает костно-суставная патология, что служит поводом для обращения больных к ортопеду. Однако клинический диагноз специалистов основывается лишь на локальных изменениях костносуставной системы с выставлением таких диагнозов: плоскостопие, вальгусная деформация стоп, врожденная косолапость, дисплазия тазобедренных суставов, контрактуры голеностопных суставов, сколиоз.

Актуальность проблемы НМЗ Øширокая распространенность, Øтенденция к накоплению генетических мутаций в каждом последующем поколении, Øснижение качества жизни, Ø развитие ранней и тяжелой инвалидизации. Недооценка значимости НМЗ приводит к поздней диагностике прогностически важных состояний, неполноценности профилактических мероприятий, неэффективному лечению пациентов и, как следствие, к тяжелой инвалидизации.

Возникшее противоречие между субъективизмом отдельных авторов, предлагавших различные классификации в оценке нозологической значимости конкретных симптомов и необходимостью создания универсальной и объективной классификации нейромышечных заболеваний было разрешено в последние десятилетия, ознаменовавшиеся открытием большого числа генов и хромосомных локусов этих генов. Тем самым в классификацию был привнесен молекулярно-генетический принцип, предполагающий установление четкой взаимосвязи между конкретной клинической формой и мутацией в определенном гене. В результате разработки молекулярно-генетической классификации нейромышечных заболеваний стало возможным в рамках каждого типа наследования или каждого общего фенотипа выделять самостоятельные генетические формы с помощью ДНК-анализа.

Разумеется, молекулярно-генетический принцип классификации нейромышечных заболеваний нельзя противопоставлять клиническому подходу. В ряде случаев задача идентификации конкретной мутации в определенном гене может быть трудновыполнимой (особенно в короткие сроки), а нередко и невозможной в силу технических, материальных или иных проблем. При этом отнюдь не отменяется необходимость квалифицировать определенным образом тот или иной синдром в общем ряду нейромышечной патологии. Следовательно, при создании адаптированной и информативной классификации интересы широкого круга неврологов и клиническая практика диктуют необходимость найти такое рациональное сочетание фенотипических, молекулярно-генетических и нейрофизиологических признаков, которое позволило бы четко дифференцировать эти заболевания на самостоятельные подтипы и отдельные нозологические формы либо группы близких форм.

Адаптированный клинический вариант классификации нейромышечных заболеваний 1. Прогрессирующие мышечные дистрофии 1. 1. Х-сцепленные мышечные дистрофии 1. 1. 1. Миодистрофия Дюшенна и Беккера (дистрофинопатии - MIM 310 200) 1. 1. Дистрофинопатия у девочек с синдромом Тернера 1. 1. 2. Миодистрофия Эмери - Дрейфуса (эмеринопатии - MIM 310 300) 1. 1. 3. Лопаточно-плечевой синдром с деменцией 1. 1. 4. Миодистрофия Мэбри 1. 1. 5. Миодистрофия Роттауфа - Мортье - Бейера 1. 1. 6. Тазово-бедренная миодистрофия Лейдена - Мебиуса 1. 2. Аутосомные мышечные дистрофии 1. 2. 1. Лице-лопаточно-плечевая миодистрофия Ландузи - Дежерина (MIM 158 900) 1. 2. 1. 1. Инфантильная форма лице-лопаточно-плечевой миодистрофии 1. 2. 2. Скапулоперонеальная миодистрофия Давиденкова (MIM 1 813 500) 1. 2. 3. Конечностно-поясная миодистрофия (КПМД) Эрба - Рота 1. 2. 3. 1. КПМД 1 А (миотилинопатии - MIM 159 100) 1. 2. 3. 2. КПМД 1 Е (c парезом гортани, глотки и дистальных мышц) 1. 2. 3. 3. КПМД 2 А (калпаинопатии - MIM 253 600) 1. 2. 3. 4. КПМД 2 В (дисферлинопатии - MIM 253 601) 1. 2. 3. 5. КПМД 2 с (саркогликанопатии - тяжелая детская аутосомно-рецессивная миопатия - MIM 253 700) 1. 2. 3. 6. КПМД 2 d (саркогликанопатии - тяжелая детская аутосомно-рецессивная миопатия -MIM 600 119) 1. 2. 3. 7. Мышечная дистрофия плечевого и тазового пояса с буллезным эпидермолизом (MIM 226 670) 1. 2. 4. Миодистрофия Бетлема (MIM 158 810) 1. 2. 5. Дистальные миодистрофии (MIM 125 660) 1. 2. 5. 1. Дистальная миодистрофия с началом в грудном возрасте 1. 2. 5. 2. Дистальная миодистрофия с началом в детстве 1. 2. 5. 3. Дистальная миодистрофия с поздним дебютом (тип Веландер) 1. 2. 5. 4. Дистальная миодистрофия с ранним началом у взрослых (тип Миоши) 1. 2. 5. 5. Дистальная миодистрофия с накоплением десминовых включений (MIM 601 419) 1. 2. 6. Окулофарингеальная миодистрофия (MIM 164 300) 1. 2. 7. Окулярная миодистрофия (прогрессирующая наружная офтальмоплегия Грефе)

Адаптированный клинический вариант классификации нейромышечных заболеваний • Текст слайда 2. Врожденные миодистрофии 2. 1. Врожденная миодистрофия c поражением головного мозга и глаз (тип Фукуямы - MIM 253 800) 2. 2. Врожденная миодистрофия с лейкодистрофией 2. 3. Цереброокулярная миодистрофия (MIM 164 300)

Адаптированный клинический вариант классификации нейромышечных заболеваний амиотрофии • 3. Спинальныеспинальные амиотрофии детского возраста Текст слайда 3. 1. Проксимальные 3. 1. 1. Острая злокачественная инфантильная спинальная амиотрофия Верднига - Гофмана (спинальная амиотрофия 1 -го типа) (MIM 253 300) 3. 1. 2. Хроническая инфантильная спинальная амиотрофия (спинальная амиотрофия 2 -го типа) (MIM 253 550) 3. 1. 3. Ювенильная спинальная амиотрофия (болезнь Кугельберга - Веландер) (MIM 253 400) 3. 2. Редкие формы спинальных амиотрофий в детском возрасте 3. 2. 1. Инфантильная нейрональная дегенерация 3. 2. 2. Врожденная форма болезни Пелицеуса - Мерцбахера 3. 2. 3. Врожденная цервикальная спинальная амиотрофия 3. 2. 4. Атипичный вариант GM-ганглиозидоза 3. 2. 5. Детский прогрессирующий бульбарный паралич (синдром Фацио - Лонде) 3. 2. 6. Понтобульбарный паралич с глухотой (синдром Виалетто - Ван Лэре) 3. 3. Спинальные амиотрофии взрослых 3. 3. 1. Бульбоспинальная амиотрофия Кеннеди (MIM 313 200) 3. 3. 2. Дистальная спинальная амиотрофия 3. 3. 3. Сегментарная спинальная амиотрофия 3. 3. 4. Мономиелическая спинальная амиотрофия 3. 3. 5. Скапулоперонеальная спинальная амиотрофия Старка - Кайзера 3. 3. 6. Лице-лопаточно-плечевая спинальная амиотрофия Феничела 3. 3. 7. Окулофарингеальная спинальная амиотрофия

Адаптированный клинический вариант классификации нейромышечных заболеваний • 4. Наследственные нейропатии, сопровождающиеся амиотрофиями Текст слайда 4. 1. Наследственные мотосенсорные нейропатии 4. 1. 1. Наследственная мотосенсорная нейропатия, тип 1. Аутосомно-доминантная формa (MIM 118 220, 145 900) 4. 1. 2. Наследственная мотосенсорная нейропатия, тип 1. Аутосомно-рецессивная форма (MIM 214 400) 4. 1. 3. Наследственная мотосенсорная нейропатия, тип 2. Аутосомно-рецессивная форма (MIM 601 382) 4. 1. 4. Наследственная мотосенсорная нейропатия, тип 3. Болезнь Дежерина - Сотта (MIM 3 028 020) 4. 1. 5. Х-сцепленная наследственная мотосенсорная нейропатия (MIM 302 800) 4. 2. Наследственные сенсорные нейропатии 4. 2. 1. Аутосомно-доминантная сенсорная нейропатия (MIM 162 400) 4. 2. 2. Наследственная сенсорная и автономная нейропатия, тип 2 4. 2. 3. Синдром семейной дизавтономии. Синдром Райли - Дея. Наследственная сенсорная и вегетативная нейропатия, тип 3 4. 2. 4. Врожденная сенсорная нейропатия с ангидрозом. Синдром семейной дизавтономии, тип 2 4. 3. Варианты наследственных мотосенсорных нейропатий 4. 3. 1. Синдром Бернгардта 4. 3. 2. Синдром Генелла 4. 3. 3. Синдром Герингама 4. 3. 4. Синдром Давиденкова 4. 3. 5. Синдром Штарк - Кезера 4. 3. 6. Синдром Маватари и Катаямы 4. 3. 7. Синдром Тевенара (или нейропатия Денни - Брауна)

Адаптированный клинический вариант классификации нейромышечных заболеваний • 5. Врожденныеслайда 117 000) Текст структурные миопатии 5. 1. Болезнь центрального стержня (MIM 5. 2. Болезнь множественных центральных стержней 5. 3. Врожденная миопатия с диспропорцией типов волокон 5. 4. Миотубулярная (центронуклеарная) миопатия (MIM 310 400) 5. 4. 1. Центронуклеарная миопатия с рецессивным, сцепленным с Х-хромосомой типом 5. 4. 2. Центронуклеарная миопатия с аутосомно-доминантным типом наследования 5. 4. 3. Центронуклеарная миопатия с аутосомно-рецессивным типом наследования 5. 5. Немалиновая (палочковидная) миопатия 5. 5. 1. Врожденная быстропрогрессирующая немалиновая миопатия (фатальная) 5. 5. 2. Врожденная медленнопрогрессирующая немалиновая миопатия (MIM 256 030) 5. 5. 3. Немалиновая миопатия с дебютом у взрослых 5. 6. Врожденная миопатия с внутрицитоплазматическими включениями в виде редуцированных телец 5. 7. Миопатия с накоплением телец, сходных с отпечатками пальцев 5. 8. Саркотубулярная миопатия

Адаптированный клинический вариант классификации нейромышечных заболеваний • Текст слайда 6. Синдром ригидного позвоночника 7. Множественный врожденный артрогриппоз При диагностике прогрессирующих мышечных дистрофий, без сомнения, необходимо исключить воспалительные миопатии, а также разные формы наследственных миотонических и парамиотонических синдромов и миоплегии.

Адаптированный клинический вариант классификации нейромышечных заболеваний 8. Метаболические миопатии 8. 1. Миопатические синдромы при гликогенозах 8. 1. 1. Дефицит кислой мальтазы (болезнь Помпе) 8. 1. 2. Дефицит миофосфорилазы (болезнь Мак-Ардла) (MIM 232 600) 8. 1. 3. Дефицит фосфофруктокиназы (болезнь Тарди) 8. 1. 4. Дефицит глюкозо-6 -фосфатазы (болезнь Гирке) 8. 1. 5. Дефицит амило-1, 6 -глюкозидазы (болезнь Кори) 8. 1. 6. Дефицит альфа-1, 4 -глюкан-6 -глюкозилтрансферазы (болезнь Андерсена) 8. 1. 7. Дефицит фосфорилазы печени (болезнь Херса) 8. 1. 8. Дефицит фосфогексоизомеразы (болезнь Сатояши) 8. 1. 9. Дефицит фосфорилазокиназы печени (болезнь Хьюга) 8. 1. 10. Дефицит гликоген-синтетазы (болезнь Спенсера - Пита) 8. 2. Митохондриальные болезни, обусловленные мутациями митохондриальной ДНК 8. 2. 1. Синдром Кернса - Сейра (MIM 530 000) 8. 2. 2. Синдром Пирсона (MIM 557 000) 8. 2. 3. Синдром МЕLAS (Mitochondrial Encephalomyopathy with Lactic Acidosis and Stroke-Like Episodes) - митохондриальная энцефаломиопатия с лактат-ацидозом и инсультоподобными эпизодами 8. 2. 4. Синдром МЕRRF (Mioclonic Epilepsy With Ragged Fipes) миоклонус - эпилепсия с разорванными красными волокнами 8. 2. 5. Наследственная атрофия зрительных нервов (синдром Лебера) 8. 2. 6. Синдром NARP 8. 3. Митохондриальные болезни, обусловленные мутациями • Текст слайда 8. 3. 1. Заболевания, связанные с дефектами дыхательной цепи 8. 3. 1. 1. Дефицит комплекса 1 (NADH: СОQ-редуктаза) 8. 3. 1. 2. Дефицит комплекса 2 (сукцинат-СОQ-редуктаза) 8. 3. 1. 3. Дефицит комплекса 3 (СOQ-цитохром-С-оксидоредуктаза) 8. 3. 1. 4. Дефицит комплекса 4 (цитохром-С-оксидаза) 8. 3. 1. 4. 1. Фатальная инфантильная митохондриальная миопатия 8. 3. 1. 4. 2. Доброкачественная инфантильная митохондриальная миопатия 8. 3. 1. 4. 3. Трихополиодистрофия (болезнь Менкеса) 8. 3. 1. 4. 4. Митохондриальные энцефаломиелопатии: - подострая некротизирующая энцефаломиелопатия (болезнь Лея) - прогрессирующая склерозирующая полидистрофия (болезнь Альперса) 8. 3. 1. 5. Дефицит комплекса 5 8. 3. 1. 6. Дефицит коэнзима Q 8. 3. 2. Заболевания, связанные с нарушениями метаболизма молочной и пировиноградной кислот 8. 3. 3. Заболевания, обусловленные дефектами бета-окисления жирных кислот 8. 3. 4. Ферментопатии цикла Кребса 8. 3. 4. 1. Дефицит фумаразы 8. 3. 4. 2. Дефицит сукцинатдегидрогеназы 8. 3. 4. 3. Дефицит альфа-кетоглутаратдегидрогеназы 8. 3. 5. Синдромы дефицита карнитина и ферментов, участвующих в его метаболизме 8. 3. 5. 1. Дефицит карнитин-пальмитилтрансферазы-1 (MIM 255 110) 8. 3. 5. 2. Дефицит карнитин-ацилкарнитин-транслоказы 8. 3. 5. 3. Дефицит карнитин-пальмитоилтрансферазы-2 8. 3. 5. 4. Почечный дефект транспортной системы карнитина

Адаптированный клинический вариант классификации нейромышечных заболеваний • 10. Воспалительные миопатии Текст слайда 10. 1. Полимиозит 10. 2. Дерматомиозит 10. 3. Острый инфекционный миозит 10. 4. Миозит с включениями телец 10. 5. Х-сцепленная вакуольная миопатия 10. 6. Гранулематозный миозит

Адаптированный клинический вариант классификации нейромышечных заболеваний • 11. Наследственные миотонические синдромы и пароксизмальные миоплегии Текст слайда 11. 1. Стационарные, медленнопрогрессирующие миотонии 11. 1. 1. Врожденная миотония Томсена (аутосомно-доминантный тип наследования) (MIM 160 800) 11. 1. 2. Врожденная миотония Томсена - Беккера (аутососомно-рецессивный тип наследования) (MIM 255 700) 11. 1. 3. Приобретенная миотония Тальма 11. 1. 4. Атрофическая (дистрофическая) миотония, миотоническая дистрофия Россолимо - Куршмана - Штейнерта Баттена (MIM 160 900) 11. 1. 5. Миотоническая дистрофия Беккера (аутосомно-рецессивный тип наследования) 11. 1. 6. Клинические варианты миотонических дистрофий (атрофическая миотония "без атрофий", моносимптомный вариант - миотоническая катаракта, неонатальная форма дистрофической миотонии) 11. 2. Периодические (рецидивирующие) формы миотонии 11. 2. 1. Интемиттирующая миотония Марциуса - Ганземанна (аутосомно-доминантный тип наследования) 11. 2. 2. Врожденная парамиотония с холодовыми парезами Эйленбурга (аутосомно-доминантный тип наследования) 11. 2. 3. Врожденная парамиотония без холодовых парезов де Ионга (аутосомно-доминантный тип наследования) 11. 2. 4. Эпизодическая наследственная миотоническая адинамия Беккера (аутосомно-доминантный тип наследования) 11. 3. Наследственные пароксизмальные миоплегии 11. 3. 1. Гипокалиемическая форма пароксизмальной миоплегии (MIM 170 400) 11. 3. 2. Гиперкалиемическая форма пароксизмальной миоплегии. Болезнь Гамсторп (MIM 170 500) 11. 3. 3. Нормокалиемическая форма пароксизмальной миоплегии (MIM 170 600)

Часто встречающиеся формы нейромышечных заболеваний

I. Миопатии: 1. Мышечная дистрофия Дюшенна. 2. Миопатия Эрба (конечностно-поясная • Текст слайда форма). 3. Лице-лопаточно-плечевая форма Ландузи. Дежерина. 4. Окулярная (офтальмоплегическая) миопатия. 5. Дистальная форма миопатии.

II. а Спинальные амиотрофии: 1. Спинальная амиотрофия Вердинга. Гоффманна. • Текст слайда 2. Прогрессирующая спинальная амиотрофия Кугельберга-Веландера. II. б Невральные амиотрофии. Невральная амиотрофия Шарко-Мари.

III. Миастения. IV. Миатония. Врожденная миатония (Болезнь Оппенгейма). V. Миотония Томсона. VI. Пароксизмальная миоплегия. VII. Эмеринопатия

Патоморфология миопатий: 1. Нарушение распределения типов • Текст слайда мышечных волокон. 2. Изменение размера мышечных волокон. 3. Нарушение строения мышечных волокон. 4. Патологические включения и образования в мышечных волокнах. 5. Патологические изменения скелетной мышечной ткани в целом.

Патоморфология амиотрофий: • Текст слайда Грубое поражение клеток передних рогов, передних корешков и периферических нервов спинного мозга: уменьшение количества клеток, их дегенеративные изменения в шейном и поясничном отделах

Патоморфология миастении: • Текст слайда 1. Нарушение синаптического проведения импульсов. 2. Эндокринные расстройства, особенно дисфункция вилочковой железы. 3. В тканях обнаруживается избыток холинэстеразы.

Патоморфология миатонии: • Текст слайда n Недоразвитие клеток передних рогов спинного мозга. n Дегенеративные изменения мышечных волокон.

Патогенез пароксизмальной миоплегии: n n n Нарушение синаптической передачи и недостаточная генерация потенциала концевых пластинок. Нарушение распространения потенциала действия вдоль мембраны. Неадекватное высвобождение ионов кальция из саркоплазматической сети в миофиламентное пространство вследствие недостаточной деполяризации Т-трубочек.
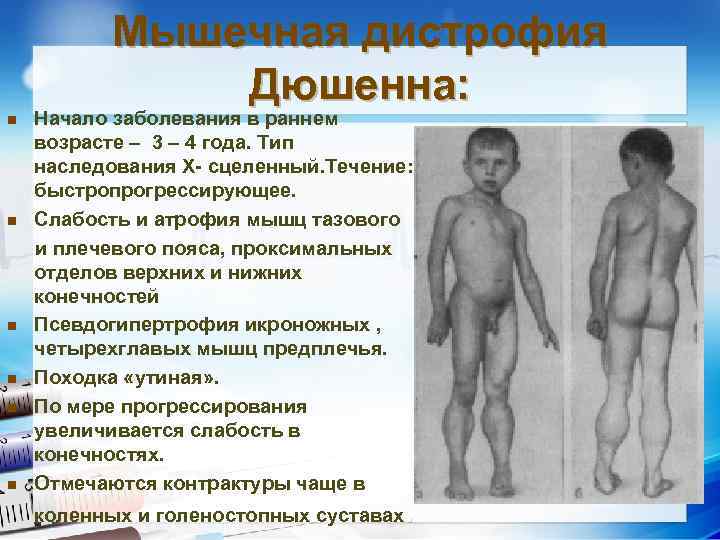
Мышечная дистрофия Дюшенна: Начало заболевания в раннем возрасте – 3 – 4 года. Тип наследования Х- сцеленный. Течение: быстропрогрессирующее. n Слабость и атрофия мышц тазового и плечевого пояса, проксимальных отделов верхних и нижних конечностей n Псевдогипертрофия икроножных , четырехглавых мышц предплечья. n Походка «утиная» . n По мере прогрессирования увеличивается слабость в конечностях. n Отмечаются контрактуры чаще в n коленных и голеностопных суставах.
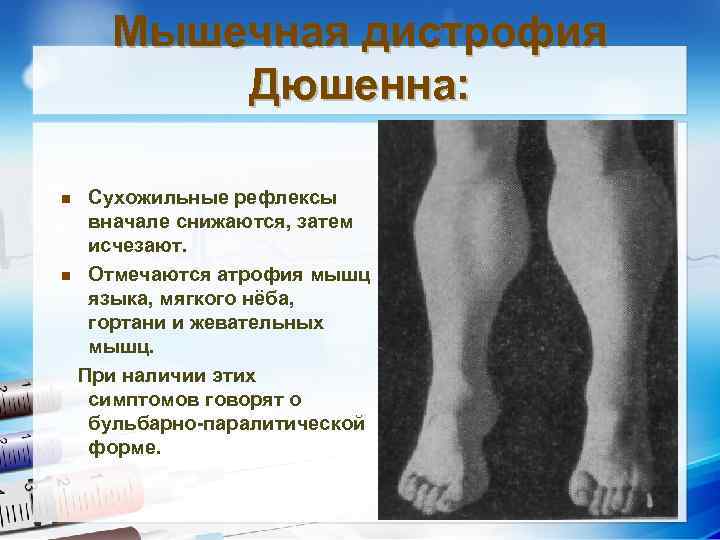
Мышечная дистрофия Дюшенна: Сухожильные рефлексы вначале снижаются, затем исчезают. n Отмечаются атрофия мышц языка, мягкого нёба, гортани и жевательных мышц. При наличии этих симптомов говорят о бульбарно-паралитической форме. n

На сегодняшний день миодистрофия Дюшенна не излечима. Наиболее перспективным направлением поиска эффективной терапии считается разработка методов, позволяющих повысить экспрессию дистрофина в скелетных мышцах больных. По общему мнению ученых, именно с генной терапией дистрофинопатий связаны наиболее серьезные надежды добиться уже в обозримом будущем первых реальных результатов в борьбе с этим тяжелейшим заболеванием. Попытки прямого введения в мышцу миобластов (дистрофинпозитивных клетокпредшественников) привели лишь к минимальной и кратковременной экспрессии дистрофина, главным образом вследствие ограниченной миграции вводимых клеток из места инъекции и плохой приживаемости донорских миобластов (Л. П. Горио, С. К. Евтушенко, 1998).
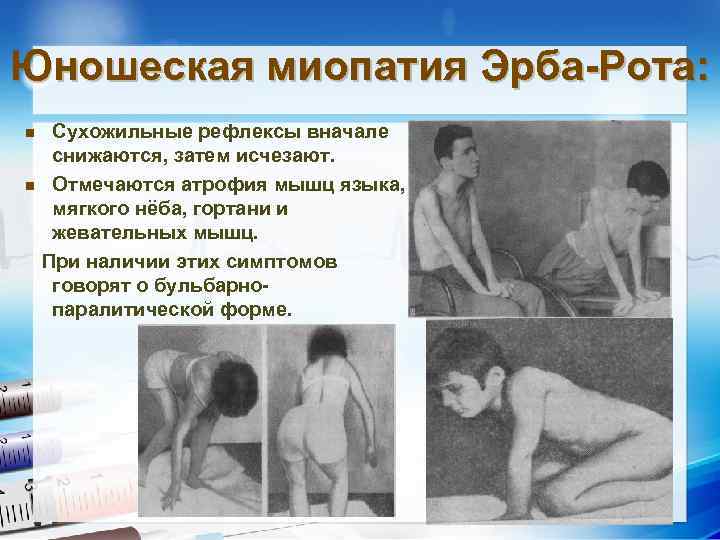
Юношеская миопатия Эрба-Рота: Сухожильные рефлексы вначале снижаются, затем исчезают. n Отмечаются атрофия мышц языка, мягкого нёба, гортани и жевательных мышц. При наличии этих симптомов говорят о бульбарнопаралитической форме. n
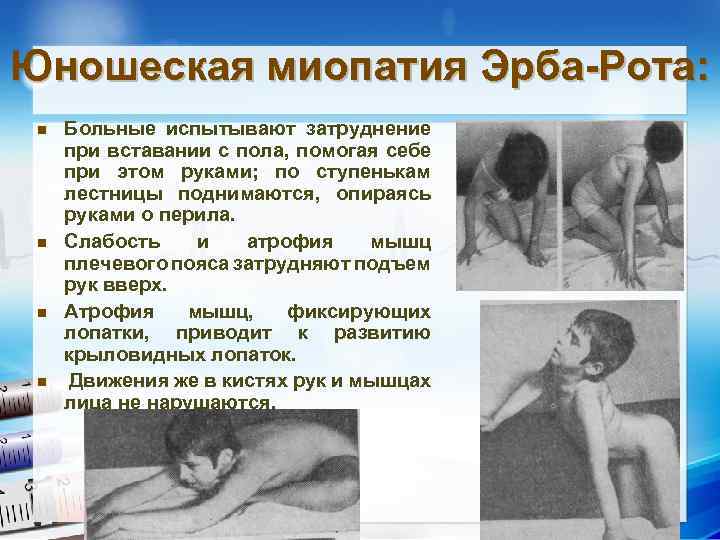
Юношеская миопатия Эрба-Рота: n n Больные испытывают затруднение при вставании с пола, помогая себе при этом руками; по ступенькам лестницы поднимаются, опираясь руками о перила. Слабость и атрофия мышц плечевого пояса затрудняют подъем рук вверх. Атрофия мышц, фиксирующих лопатки, приводит к развитию крыловидных лопаток. Движения же в кистях рук и мышцах лица не нарушаются.

Лице-лопаточно-плечевая форма Ландузи-Дежерина. n n Начало заболевания с 7 - 15 лет. Слабость и атрофии мышц лица и плечевого пояса. Характерна слабость мимической мускулатуры. Кожа лица гладкая, без складок.

Лице-лопаточно-плечевая форма Ландузи-Дежерина. Симптом «крыловидных лопаток» , горизонтальное расположение ключиц. n Характерны толстые, выпяченные вперед губы ( «губы тапира» ), «поперечная улыбка» . n Выраженный лагофтальм. n

Спинальная амиотрофия Вердига – Гоффмана. Выделяют формы: 1. 2. 3. Врожденная форма. Ранняя детская форма. Поздняя форма.

Спинальная амиотрофия Вердига – Гоффмана. Врожденная форма: n n n Начало внутриутробно. Слабое шевеление плода. При рождении вялый паралич в проксимальных отделах конечностей. Бульбарные расстройства: слабый крик, вялое сосание, снижение глоточного рефлекса. Задержка психического развития. Течение прогрессирующее.
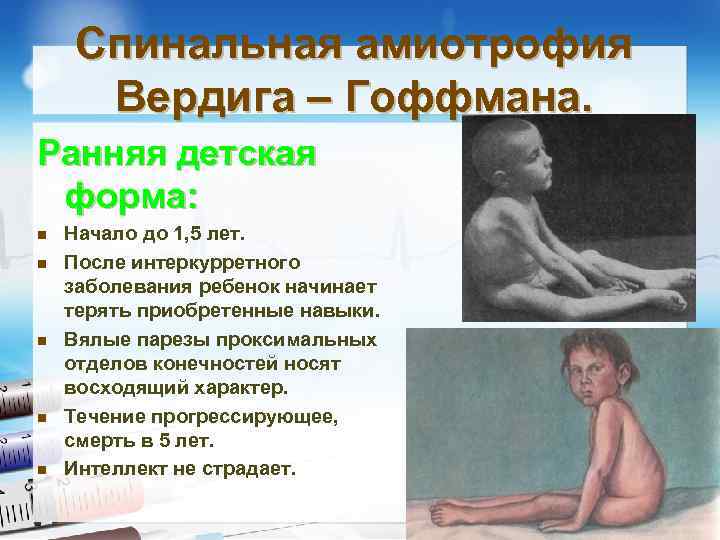
Спинальная амиотрофия Вердига – Гоффмана. Ранняя детская форма: n n n Начало до 1, 5 лет. После интеркурретного заболевания ребенок начинает терять приобретенные навыки. Вялые парезы проксимальных отделов конечностей носят восходящий характер. Течение прогрессирующее, смерть в 5 лет. Интеллект не страдает.
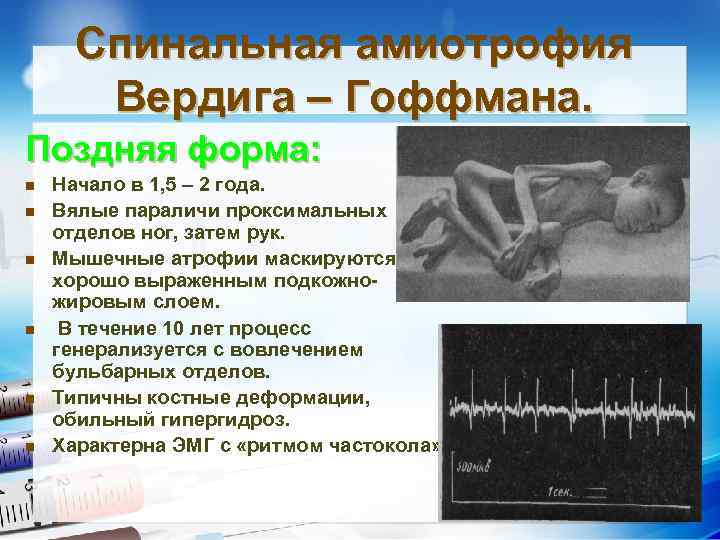
Спинальная амиотрофия Вердига – Гоффмана. Поздняя форма: n n n Начало в 1, 5 – 2 года. Вялые параличи проксимальных отделов ног, затем рук. Мышечные атрофии маскируются хорошо выраженным подкожножировым слоем. В течение 10 лет процесс генерализуется с вовлечением бульбарных отделов. Типичны костные деформации, обильный гипергидроз. Характерна ЭМГ с «ритмом частокола» .

Спинальная амиотрофия Кугельберга-Веландера (псевдомиопатическая). n n n Тип наследования аутосомно-рецессивный. Начало в 6 лет. Течение доброкачественное, ещё в 30 лет. сохраняют способность ходить. Вялые параличи развиваются сначала в проксимальных отделах ног, затем рук. Фасцикуляции в различных мышцах.

Невральная амиотрофия Шарко-Мари Тип наследования аутосомно-доминантный. n Начальные проявления с 13 -17 лет. n Характерны дистальные парезы, атрофии, сухожильная арефлексия более выраженная в ногах. n Расстройства чувствительности по дистальному типу. n Атрофия мышц голеней и нижней трети бедер. n Ноги по виду напоминают «ноги аиста» . n Могут присоединяться мозжечковые симптомы. n На ЭМГ картина снижения скорости нервного импульса. n

Невральная амиотрофия Шарко-Мари Течение заболевания медленно прогрессирующее. Основные клинические симптомы: жалобы на боли в мышцах голени, чаще после физической нагрузки, затруднения при беге или подъеме по лестнице, утомляемость, частые падения. n При ходьбе упор на передние отделы стоп. n Восходящий тип поражения. n Раньше других страдает вибрационная и тактильная чувствительность. n Характерная полая стопа с молоточкообразной деформацией пальцев стопы с формированием стопы Фридрейха n

Миастения: n n n Появляется утомляемость, распространяется на мышцы: губ, жевательные, глазодвигательные, глотательные. Наблюдается птоз, диплопия, поперечная улыбка (симптом Джоконды). Утомляемость появляется в мышцах конечностей. Наблюдается увеличение вилочковой железы. Заболевание имеет тенденцию к прогрессированию. Могут возникать расстройства дыхания, глотания.
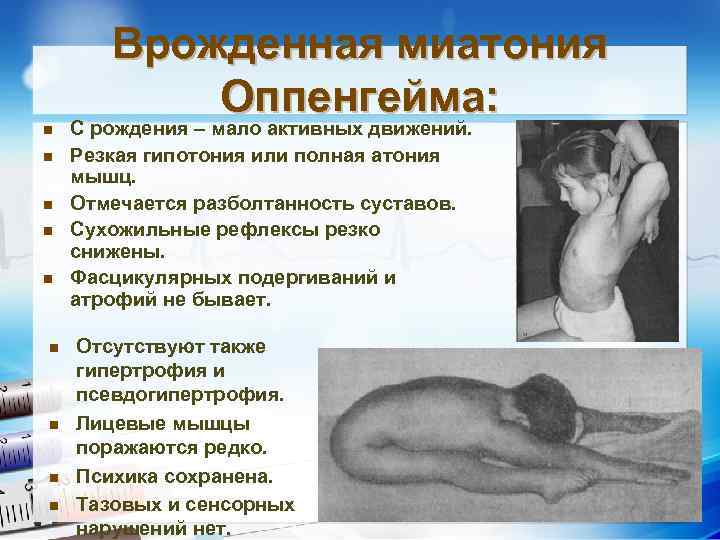
n n n n n Врожденная миатония Оппенгейма: С рождения – мало активных движений. Резкая гипотония или полная атония мышц. Отмечается разболтанность суставов. Сухожильные рефлексы резко снижены. Фасцикулярных подергиваний и атрофий не бывает. Отсутствуют также гипертрофия и псевдогипертрофия. Лицевые мышцы поражаются редко. Психика сохранена. Тазовых и сенсорных нарушений нет.
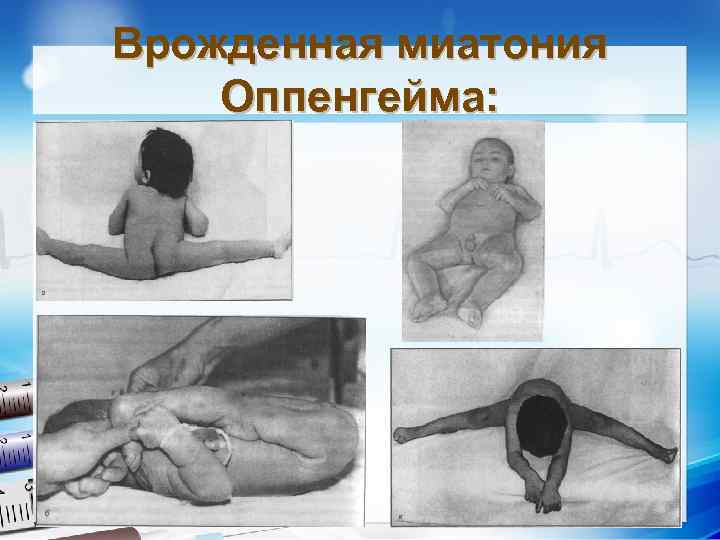
Врожденная миатония Оппенгейма:

Пароксизмальная миоплегия - генетически детерминированные нервно-мышечные заболевания, обусловленные нарушениями обмена калия и характеризующиеся приступами вялого паралича скелетных мышц вследствие утраты способности к возбуждению и сокращению. 1. 2. 3. Выделяют формы: Гипокалиемическая. Гиперкалиемическая. Нормокалиемическая.

Гипокалиемическая форма: Гипокалиемическая форма - 1. Начало от 10 до 16 лет. 2. Возникновение приступов часто связано с циклом сонбодрствование. 3. Сначала приступы редкие, затем учащаются и становятся ежедневными. 4. Приступы могут быть генерализованными или парциальными. 5. Продолжительность приступа от 30 мин до нескольких суток.

Гиперкалиемическая форма: Гиперкалиемическая форма 1. Начало от 10 до 18 лет. 2. Возникают приступы пароксизмального гиперкалиемического паралича, как правила днем. 3. Сопровождаются чувствительными, двигательными и вегетативными нарушениями. 4. Начальные признаки – парастезии в области лица, дистальных отделов конечностей. 5. В последующем развивается мышечная слабость, гипотония мышц, снижение сухожильных рефлексов. 6. Приступ сопровождается выраженными вегетативными нарушениями: профузным потом, сердцебиением, повышенной жаждой, подъемом АД. 7. Приступ продолжается от 1 ч. до нескольких дней.

Нормокалиемическая форма: 1. Начало в первые 10 лет жизни. 2. Сочетание признаков мышечной слабости и ограничения объема активных движений в конечностях. 3. Слабость в лицевой и жевательной мускулатуре. 4. Продолжительность пароксизмов – от нескольких суток до нескольких часов.

Пароксизмальная миоплегия 1. Начало от 10 до 16 лет. 2. Возникновение приступов часто связано с циклом сонбодрствование. 3. Сначала приступы редкие, затем учащаются и становятся ежедневными. 4. Приступы могут быть генерализованными или парциальными. 5. Продолжительность приступа от 30 мин до нескольких суток. 6. При парциальном приступе мышечная слабость и парез или плегия развивается на одной конечности, реже в обеих по геми- или паратипу. 7. При генерализованном приступе наблюдается тетрапарез или тетраплегия. 8. Могут быть вегетативные расстройства: гипергидроз, жажда, изменения АД и пульса, иногда тошнота, рвота.

Современный диагностический паттерн НМЗ логический Øклинико-синдромологический метод исследования Øклинико-генеалогический метод исследования Øмолекулярно-генетический метод исследования Øлабораторный (радиологический + функциональный) метод исследования Øгистологический метод исследования

Клинико-синдромологический метод критериями моторно-рефлекторных нарушений: логический Øсимметричная мышечная слабость и гипотрофия конечностей, клинически характеризующаяся нарушением функции ходьбы (утиная, перонеальная походка); затруднением бега, прыжков, ходьбы на пятках. Ø нередко отмечается нарушение письма, затруднение при застегивании пуговиц. Ø больные отмечают болезненные спазмы в мышцах голени, усиливающиеся после долгой ходьбы, дети часто спотыкаются, падают. Øнередко ведущей жалобой родителей является ходьба на носках.

Мышечная слабость или утомляемость Жалобы на утомляемость без признаков мышечной слабости чаще свидетельствуют о тревожности, церебрастеническом синдроме, эндокринном или системном заболевании. Для того чтобы отличить логический эти два симптома, необходимо оценить походку, попросить пройтись на носках, пятках, поприседать, встать с пола из положения лежа на животе, спине, сжать пальцы врача, поработать руками, поднятыми выше уровня плеч. Трудности при выполнении данных силовых упражнений, вероятнее всего, больше свидетельствуют в пользу мышечной слабости, чем в пользу утомляемости. Для уточнения распространенности мышечной слабости (ограниченной или генерализованной) и степени ее выраженности последовательно исследуют основные группы мышц. Оценка степени мышечной слабости с использованием стандартной шкалы позволяет точнее определить выраженность, локализацию мышечной слабости, сравнить ее при повторных исследованиях.

нейромышечная патология сопровождается или проявляется поражением какой-либо одной из систем организма и может логический характеризоваться следующими симптомокомплексами: üпоражение центральной и периферической нервной системы (нарушения психоречевого развития, судороги, атаксия, тремор, птоз, наружная офтальмоплегия, синдром полиневропатии); üпоражение сердца (гипертрофическая, дилатационная кардиопатия, нарушения функции автоматизма); üэндокринные расстройства; üпоражения слуха; üпоражения зрения; üжелудочно-кишечные нарушения; üпоражения внутренних органов.

Таким образом, несмотря на генетическую логический гетерогенность, основные клинические проявления различных форм НМЗ довольно похожи. Вместе с тем течение и прогноз НМЗ крайне вариабельны и определяются стадией заболевания. К сожалению, на сегодняшний день международных стандартизированных шкал определения стадии патологического процесса при НМЗ не существует.

Шкала нейропатических нарушений В связи с этим на базе Донецкого областного детского клинического центра нейрореабилитации была адаптирована и логический модифицирована международная шкала NIS LL (1996) (Neuropathy Impairment Score Low Limb — шкала нейропатических нарушений в нижних конечностях), которая включает оценку мышечной силы (0– 4 балла), сухожильных рефлексов (0– 2 балла); сенсорных нарушений (оценка поверхностной чувствительности (0– 5 баллов), вибрационной чувствительности (0– 5 баллов)), объема активных движений в голеностопных суставах (0– 5 баллов), функции ходьбы (0– 4 балла). На основании полученных результатов оценивается стадия патологического процесса: — 0, 5– 8 баллов — стадия начальных проявлений; — 8, 5– 17, 5 балла — стадия развернутых клинических проявлений; — 18 и выше — стадия декомпенсации.

Клинико-генеалогический метод позволяет верифицировать наследственный характер логический заболевания, установить тип наследования, гетерозиготное носительство, пенетрантность патологического гена и прогноз для будущего потомства. Выделяют частично доминантные типы исследований: üаутосомно-доминантный üаутосомно-рецессивный üХ-сцепленный частично

Молекулярно-генетический метод основан на картировании и поиске локусов, логический сцепленных с различными формами НМЗ, идентификации генов, детерминирующих развитие заболеваний, установлении биохимического дефекта. Т. С. Мищенко (2008) подчеркивает значимость определения специфических антител и маркеров, генетических мутаций и биохимических дефектов, что способствует постановке правильного диагноза и облегчает мониторинг эффективности лечения.

Лабораторный метод исследования включает биохимический скрининг, иммунологические и серологические исследования, используется при логический проведении дифференциальной диагностики НМЗ с митохондриальными заболеваниями, эндокринной патологией, аутоиммунными заболеваниями. Некоторые ферменты, в значительных концентрациях содержащиеся в мышечной саркоплазме, при повреждении могут просачиваться в кровь и таким образом служить индикаторами мышечного повреждения. Исследование креатинфосфокиназы (КФК) — наиболее чувствительный и специфичный в этом отношении тест, который отражает процесс некроза в скелетной мышце или миокарде. В то время как при периферических невропатиях и поражениях нервно-мышечного соединения активность КФК остается нормальной, при НМЗ и других заболеваниях мотонейронов спинного мозга уровень КФК может незначительно повышаться.

Другие методы обследования: n n n n Электронейромиография (ЭНМГ). Биопсия скелетной мышцы. Биохимический анализ крови (БАК). Компьютерная томография скелетных мышц. Электроэнцефалография (ЭЭГ). Электрокардиография (ЭКГ). Эхокардиография (Эхо-ЭГ).

Электронейромиография: Авторы отечественной и зарубежной литературы подчеркивают значимость электронейромиографического (ЭНМГ) исследования как простого, высокоинформативного и широко доступного метода, который позволяет не только идентифицировать уровень поражения двигательной единицы, но и на основании ЭНМГ-мониторинга оценить степень выраженности патологического процесса на различных стадиях заболевания.

Электронейромиография: По данным Л. Ф. Касаткиной (2010), основными задачами ЭНМГ-обследования являются: — определение уровня поражения двигательной единицы. — топика поражения нейромышечного аппарата с указанием распространенности (локальные, диффузные) и степени тяжести патофизиологических нарушений; — диагностика вовлеченности миелина или аксона с последующим выходом на нозологическую форму заболевания и селективным подбором патогенетически направленной терапии; — мониторинг патофизиологических нарушений нейромышечного аппарата. Контроль динамики нарушенных функций также является самостоятельной задачей, позволяющей проводить мониторинг нарушений нейромышечного аппарата, оценивать динамику субклинических проявлений заболеваний, даже когда клиническая динамика не определяется.

Электронейромиография: Выявление локализации поражения является наиболее частой задачей ЭНМГ-исследования. ЭНМГ позволяет локализовать следующие уровни поражения кортикомускулярного пути: надсегментарный, нейрональный, сегментарный, невральный, синаптический, миопатический. Диагностика поражения на каждом уровне может включать комплекс ЭНМГ-методик. Вместе с тем диагностика каждого уровня может иметь один наиболее информативный и адекватный метод, например, для диагностики надсегментарного уровня — поверхностная ЭМГ, для уровня ствола нерва — методика определения СПИ, для уровня мышечного волокна — игольчатая ЭМГ. Таким образом, на каждом этапе клинического обследования грамотное назначение ЭНМГ позволяет получить максимум информации.

Биопсия скелетной мышцы Показанием для проведения биопсии является : — наличие признаков мышечного поражения: мышечная слабость, дискомфорт, патологическая мышечная утомляемость; — повышенный уровень КФК; — миопатический уровень поражения по данным ЭНМГ; — дифференциация между сегментарной демиелинизацией и аксональной дегенерацией; — идентификация воспалительных невропатий; — наличие системного заболевания с миопатической манифестацией. Биопсию мышц проводить нецелесообразно, если нет возможности осуществить полноценное гистохимическое исследование ткани или если присутствуют четкие ЭНМГпаттерны.

Морфологические критерии мышечной патологии — нарушение распределения типов мышечных волокон; — изменение размера мышечных волокон; — нарушение строения мышечных волокон и их элементов; — патологические включения и образования в мышечных волокнах; — патологические изменения скелетной мышечной ткани в целом. Только обобщенный учет всех перечисленных характеристик и признаков позволяет поставить достоверный морфологический диагноз или максимально приблизиться к нему.

Метод ультразвукового исследования (УЗИ) мышц УЗИ мышц является неинвазивным методом оценки структуры и степени выраженности дистрофических и атрофических изменений мышц при отсутствии лучевой нагрузки при достаточно высокой информативности. Описание сонограммы включает визуальную оценку структуры мышцы (исчерченность, гомогенность), локализацию и тип изменений (воспалительные изменения, оссификаты, генерализованные или локальные, гомогенные, симметричные или нет), наличие фасцикуляций. В норме скелетные мышцы имеют фиброзно-адипозную сетку между мышечными волокнами и их пучками, которые при продольном сканировании проявляются эхогенными линиями. Фасции, разделяющие мышцы, проявляются гиперэхогенными линейными структурами. Эхогенность сокращенных мышц несколько меньше, чем у мышц в состоянии покоя.

Метод ультразвукового исследования (УЗИ) мышц üПри нейромышечных заболеваниях на сонограммах определяется однородность мышечной ткани с равномерным уплотнением и значительным увеличением уровня эхогенности, что характеризует разрастание соединительной ткани. üМышцы плохо дифференцированны, уменьшены в размере, в 60– 80 % случаев выявляется жировая инфильтрация. üОтсутствует характерный рисунок исчерченности, что свидетельствует о деструктурированности ткани. üСокращения мышц при активном напряжении визуализируются слабо. ü В состоянии покоя на сонограммах при спинальных амиотрофиях фиксируют фасцикуляции [25].

Магнитно-резонансная томография (МРТ) В связи с отсутствием побочного действия (ионизирующее облучение), хорошим разрешением и контрастированием мягких тканей магнитно-резонансная томография (МРТ) становится методом выбора для мышечной визуализации. В настоящее время МРисследование позволяет выполнить сканирование всего тела за относительно короткое время. МРТ является безопасным, быстрым и доступным методом, обеспечивающим полное картирование мышц у больных с НМЗ. Такая МРТ дает больше информации, чем выборочная, и, соответственно, может иметь большее значение для оценки тяжести вовлечения мышц и прогрессирования заболевания.

Стандарты лечения НМЗ На основе мировых, отечественных данных разработаны стандарты лечения. Лечение, которое проводится больным, является комплексным и включает: üпатогенетическую, специальную медикаментозную терапию с учетом степени тяжести заболевания (легкая, средняя, тяжелая), стадии (компенсации, субкомпенсации, декомпенсации), üфизиотерапевтические процедуры, üсинглетно-кислородную терапию, üлечебную физкультуру (дыхательная гимнастика, стренчгимнастика), üспециальную диету, üакупунктуру, üщадящий массаж функционально сохранных мышц.

Медикаментозное лечение назначается с учетом полученных результатов клинико-инструментального исследования и сопутствующей патологии (кардио-, пневмопатии). При доброкачественных формах ПМД (Говерса — Веландера, Давиденкова, Бетлема, Беккера, Эмери — Дрейфуса) в стадии стойкой компенсации, при легкой, легко-средней степени тяжести заболевания целесообразно назначение курсами препаратов «метаболического» действия, направленных на улучшение, поддержание обменных, «энергетических» процессов неповрежденных миоцитов, кардиомиоцитов. К таким препаратам относятся: АТФ-лонг, цитофлавин, кардонат, элькар, милдронат, магнерот, витамин Е, метионин. Назначается по 1 – 2 препарата курсами 2– 3 раза в год.

Медикаментозное лечение При наличии жалоб на боли в мышцах нижних конечностей, чувство «стягивания» мышц особенно хорошо зарекомендовал себя цитрулина малат. Препарат способствует «утилизации» молочной кислоты, одновременно обладая метаболическими свойствами. Данный препарат широко используют в профессиональном спорте при физическом перенапряжении, перед соревнованиями.

Медикаментозное лечение При доброкачественных формах в стадии субкомпенсации, при средней степени тяжести заболевания, на ранних стадиях патологического процесса в стадии компенсации при злокачественных (быстро прогрессирующих) формах ПМД (Дюшенна, Эрба — Рота) назначается 10% раствор карнитина хлорида (данный препарат обладает метаболическим, нейротрофическим, кардиотрофическим и антиоксидантным свойствами) c кокарбоксилазой, аскорбиновой кислотой в/в капельно на фоне в/м введения пиридоксина гидрохлорида и перорального приема метионина. 3– 4 курса № 10 в год с дальнейшим переходом на пероральный прием препарата кардонат в амбулаторных условиях длительностью до 2 мес. У детей до 5 лет предпочтение отдается жидким формам карнитинсодержащих препаратов ввиду удобства применения и лучшей переносимости. Для фармакопунктур используются антигомотоксические препараты, препараты нейротрофического действия (церебрум композитум, траумель и др. ).

Медикаментозное лечение На стадии развернутой клинической картины миодистрофии Дюшенна назначается иммуноглобулин человека нормальный в дозе 5, 0– 7, 0 мл/кг на инфузию. Весь объем иммуноглобулина растворяется в 4 раза изотоническим раствором и вводится со скоростью 15 капель в минуту. Количество инфузий — от 3 до 5. На фоне малых доз преднизолона по 5 мг 1 раз в день 3– 6 мес. Иммуноглобулин продемонстрировал достаточно высокую эффективность, было отмечено снижение показателей КФК, ЛДГ, АЛТ, АСТ в среднем на 20 %, дети отмечали нарастание силы, переносимости физических нагрузок. Кроме того, этим же детям назначаются поддерживающие дозы преднизолона 5– 10 мг утром 1– 3 месяца (курсами).

Преднизон Деструкция мышечных волокон — перманентный процесс, запускаемый определенными генами, характерный для определенной клинической картины НМЗ. Используемый в лечении миодистрофии Дюшенна (DMD) катаболический стероид преднизон (преднизолон) в настоящее время считается многообещающей моделью кортикотерапии, направленной на торможение мышечной дегенерации. Как известно, катаболические стероиды участвуют в ключевых реакциях гликолиза, мобилизуя энергию в ответ на стресс. В то же время точный механизм того, каким образом преднизон оказывает положительный эффект у пациентов с DMD, все еще неизвестен. Более вероятно механизм действия преднизолона связан с противовоспалительным или иммуносупрессорным эффектом. .

Побочные эффекты применения преднизона — задержка жидкости; — артериальная гипертензия (повышенное давление) — этот эффект наблюдается редко; — катаракта; — диабет — уровень глюкозы повышается вследствие глюкокортикоидного эффекта; — остеопороз развивается вследствие уменьшения всасывания кальция в кишечнике; увеличения диуреза; подавления функций остеобластов — клеток, способствующих синтезу костной массы; стимулирования функций другого типа костных клеток — остеокластов, стимулирующих костную резорбцию; — нанизм — может быть полезным побочным эффектом при DMD. Известно, что карлики с DMD имеют более мягкую форму болезни; — усиление аппетита — чтобы избежать ожирения, необходимо установить и соблюдать строгую диету; — поведенческие отклонения — редко; — иммуносупрессорные эффекты — могут быть минимизированы грамотной схемой вакцинации; — подавление половых гормонов — задерживается фаза полового созревания, особенно при длительном применении; — подавление функций надпочечников.

Иммуноглобулин Основные заболевания нервной системы, при которых эффект применения иммуноглобулина доказан: Øатаксия-телеангиэктазия (Луи Бар); Øсиндром Гийена — Барре; Øхронические демиелинизирующие воспалительные полиневропатии. Заболевания нервной системы, при которых применение иммуноглобулина эффективно: Øэнтеровирусный менингоэнцефалит; Øтяжелая миастения; Øмультифокальные нейропатии; Øантифосфолипидный синдром (ПНМК, инсульты, васкулопатии); рассеянный склероз; Øрефрактерные формы эпилепсии у детей. Заболевания нервной системы, при которых применение иммуноглобулина замедляет прогрессирование заболевания: Øмиодистрофия Дюшенна; Øдерматомиозит; Øдиабетическая полиневропатия.

Дефлазакорт — другой катаболический стероид, рекомендуемый для терапии мышечной дистрофии, особенно DMD. Дефлазакорт — производное преднизона со сравнимыми с ним противовоспалительными и иммуносупрессивными эффектами. Терапевтическая эквивалентность — около 1, 2 мг дефлазакорта на 1 мг преднизона. Как показали исследования, наилучшая рекомендованная доза — 0, 9 мг/кг в день. Побочные эффекты приеме дефлазакорта менее представленны, но все же процент развития катаракты выше, чем приеме преднизона. Некоторые группы ученых отстаивают прием дефлазакорта по ежедневной схеме вместо нерегулярной схемы приема преднизона, поскольку считают дефлазакорт более эффективным катаболическим стероидом. .

Лечение прогрессирующих мышечных амиотрофий: Для улучшения трофики: АТФ, глютаминовая кислота, метионин, лейцин. n Антихолинэстеразные препараты: прозерин, галантамин, дибазол. n ЛФК, массаж, хвойные ванны. n Витаминотерапия: Витамины группы Е, В, А, С. n

Лечение невральной амиотрофии Шарко-Мари: n n n Антихолинэстеразные препараты: прозерин, дибазол. Для улучшения трофики: АТФ. ЛФК, массаж, четырехкамерные ванны, тепловые процедуры.

Лечение миастении: Антихолинэстеразные препараты: прозерин, местинон, оксазил. n Препарат, увеличивающий нервномышечную передачу – хлористый калий. n Рентгенотерапия на область вилочковой железы. n Удаление ткани вилочковой железы. n Гормональная терапия. n

Лечение эмеринопатий доброкачественная мышечная дистрофия детского возраста. Наследуются по рецессивному, сцепленному с Х-хромосомой типу. Дебютируют между 4 -м и 15 -м годами жизни. Чаще всего первым симптомом выступает ходьба на пальцах. Ранними и типичными признаками этой формы являются сгибательные контрактуры в локтевых суставах и разгибателях кисти, ретракции ахилловых сухожилий, затем развиваются слабость и атрофия двуглавых и трехглавых мышц плеча, далее присоединяются мышцы плечевого пояса. Примерно в 20 летнем возрасте наступает относительная стабилизация. Витальный прогноз всецело зависит от степени вовлечения в патологический процесс сердечной мышцы (чаще определяется нарушение сердечной проводимости). Клинически близкой формой является миодистрофия Роттауфа - Мортье - Бейера. Характерной чертой болезни являются быстро прогрессирующие, ранние и выраженные сухожильные ретракции и контрактуры.

Лечение пароксизмальной миоплегии: В межприступный период: 1) Диета с высоким содержанием калия и ограничением углеводов и натрия. 2) Спиронолактон, по 100 мг внутрь 1 -2 раза в сутки. 3) Тиамин, 50 -100 мг/сут. 4) Лечение тиреотоксикоза. 5) Диклофенамид (25 -50 мг 3 раза в сутки внутрь) или ацетазоламид (250 -500 мг 4 -6 раз в сутки) с целью вызвать легкий метаболический ацидоз. n

Лечение пароксизмальной миоплегии: Во время приступа. Высокие дозы хлорида калия внутрь (10 -15 г в виде раствора) или в/в (40 -60 мэкв калия в 500 мл 5% глюкозы в течение нескольких часов) позволяют оборвать приступ. n

Генная терапия Возможности коррекции заболеваний, вызванных мутацией гена с помощью методов генной терапии, исследуются уже около двух десятков лет. Однако ученые столкнулись с рядом неразрешимых в настоящий момент проблем. В случае лечения больных миодистрофией оказалось, что ген белка дистрофина имеет слишком большие размеры, чтобы поместить его в обычный вирус и внести в клетки пациента. Сяо (Xiao), аспирант Фармацевтической школы Ишельмана (Eshelman School of Pharmacy) при Университете Северной Каролины, в 2005 году создал функциональный вариант гена маленького размера, так называемый мини-ген, который можно будет ввести в клетки с помощью вирусного вектора. В качестве последнего Сяо выбрал аденовирус. Однако, эти генетические подходы лечения не применимы к мышечным расстройствам, которые не имеют определенного генетического дефекта.

Генная терапия В то же время недавно внимание научной общественности было обращено на два инновационных генетических метода, один из которых основан на использовании искусственно сконструированного белка, содержащего так называемый домен «цинковые пальцы» (zinc-finger protein, ZPF), а другой — на применении ферментов-нуклеаз TALEN (Тranscription Activator. Like Effector Nuclease). Журнал Science (2013) отметил разработку этих генетических методов в списке десяти главных научных прорывов 2012 г. , дав им название «крылатые ракеты» , поскольку их использование позволяет специалистам точно определить специфическую область генома и сделать специфичный разрез двойной спирали ДНК. Предварительные результаты, полученные применении нового метода, безусловно, выглядят многообещающе.

Медикаментозное лечение Таким образом, среди различных уже проверенных лекарств и диетических добавок — аминокислоты, блокаторы кальциевых каналов, гормоны роста, блокаторы гормона роста, ингибиторы протеаз, сосудорасширяющие средства, коэнзимы Q 10, катаболические и анаболические стероиды, иммуносупрессанты, витамины, цитостатики и многие другие. В настоящее время в нашей стране ЕСТЬ антиоксиданты, нейротрофические и метаболические средства, катаболические стероиды, иммуноглобулины, которые по данным плацебоконтролируемых исследований, длительного катамнеза наблюдения показали определенную эффективность у пациентов с некоторыми формами мышечных дистрофий.

Физиотерапевтические процедуры ØНефункционирующие мышечные волокна крайне чувствительны к механическим и электрофизиологическим воздействиям. ØТочные механизмы этой повышенной чувствительности детально не изучались. ØПовреждающее действие электрического тока на денервированную мышцу является хорошо известным феном в физиологии. Ребенок с НМЗ нуждается в мягкой физиотерапии (Nelson textbook of pediatrics 15 th ed. / edited by Richard E. Behrman, Robert M. Kliegman, Ann M. Arvin; senior editor, Waldo E. Nelson. ) .

Синглетно-кислородная терапия (Valkion-терапия). В комплекс лечения пневмопатий у детей с НМЗ включена синглетно-кислородная терапия (Valkion-терапия). Физикохимическая концепция Valkion-терапии базируется на фотохимической сенсибилизации воздуха и воды с образованием вторичных долгоживущих физиологически-активных форм кислорода и оксида азота — Valkion-факторов, что способствует активации клеточного метаболизма, снижению гипоксии тканей, восстановлению слизистой бронхов, нормализации функции внешнего дыхания, улучшению дренажной функции бронхов. Используется следующая схема: 1 -й день — 100 мл воды, 5 мин ингаляции, 2– 3 -й день — 150 мл воды, 9 мин ингаляции, 4 -й и последующие дни — 200 мл воды, 14 мин ингаляции. За 30 минут до процедуры перорально дети принимали поливитамины, содержащие витамины А, Е и С. Курс № 10– 15, 3– 4 курса в год. .

Лечебная физическая культура Важное место в комплексной немедикаментозной терапии занимает дозированная лечебная физкультура, направленная на поддержание и максимальное сохранение функциональной способности не вовлеченных в патологический процесс мышц в каждом конкретном случае с учетом формы нейромышечного заболевания. Индивидуальные занятия лечебной физкультурой проводятся в среднем и медленном темпе в исходном положении сидя и лежа. В комплексе терапии клинико-неврологических проявлений при НМЗ используется метод стренч-гимнастики. Это комплекс упражнений, в основе которых лежит миотатический рефлекс, способствующий тому, что в насильственно растянутой мышце происходит сокращение мышечных волокон и она активизируется.

Сбалансированное лечебное питание жирные кислоты, витамины, микроэлементы: овощи, творог, рыба, печень, соевое мясо. Весной и осенью — курсовой прием поливитаминных препаратов и микроэлементов (активал, мультитабс, биовиталь, мильгамма, нейровитан, неуробекс).

Акупунктура В целях укрепления мышечного корсета спины используется фармакопунктура паравертебрально с применением микродоз (0, 1 мл на точку): Øкортексина Øцеребролизина Øактовегина Øнейромидина Øцианокобаламина При спинальных, невральных амиотрофиях используют нейромидин 0, 5%. При миодистрофии Дюшенна, сочетающейся с когнитивными нарушениями, применяется фармакопунктура с кортексином, (церебролизином). .

Массаж при нейромышечных заболеваниях существенно отличается от стандартных методик его проведения. Сила воздействия минимальна, акцент на улучшение трофики кожных покровов и сохранных мышц с применением актовегиновой мази, бальзама живокост, щадящее растягивание укороченных сухожилий с применением хондроксида, траумель С, поглаживание суставов, паравертебрально точечный гармонизирующий массаж. Длительность сеанса до 10 мин. Курс № 10. При наличии симптоматики слабости дыхательной мускулатуры выполняется массаж грудной клетки для облегчения дыхательных движений.

Лечение сопутствующих заболеваний Сопутствующая патология со стороны опорнодвигательного аппарата — деформация туловища, позвоночника (нейромышечный сколиоз) — увеличивает тяжесть дыхательных расстройств, в связи с чем в центре применяется механизированная кровать без подогрева, имитирующая легкую мануальную терапию. Для укрепления мышечного корсета спины паравертебрально применяется вакотрон — импульсная электротерапия током низкой частоты с использованием вакуумного электрода.

Лечение сопутствующих заболеваний Для профилактики миогенных контрактур применяются специальные шины, валики, фиксация конечностей в физиологическом положении на ночь с использованием эмалитовых туторов, с целью адаптации передвижения с оптимальной коррекцией деформаций используются стельки, ортопедическая обувь, надколенники, 1– 2 -часовое ношение реклинаторов, корсетов в моменты наибольшей нагрузки на позвоночный столб (сидение, ходьба и др. ). В стадии декомпенсации корсеты носят практически постоянно, поскольку клинически имеют место выраженная атония и гипотрофия мышечного корсета, влекущие за собой резкую деформацию позвоночного столба, приводящую к вторичной висцеропатии, ухудшению работы сердца, легких, что обусловливает еще большую декомпенсацию патологического процесса.

Лечение сопутствующих заболеваний Наличие остеопороза, выявленного у большинства больных с миопатиями и амиотрофиями, обусловливает назначение кальцийсодержащих препаратов (кальций D 3, кальцемин) длительностью до 6 мес. , затем 1 мес. перерыв, в этот промежуток — диета, обогащенная солями кальция (нежирный творог, сыворотка, измельченная яичная скорлупа, твердые сорта сыра), под обязательным контролем ионизированного кальция крови, денситометрии.

Лечение сопутствующих заболеваний В связи с частыми ОРВИ необходимо назначение препаратов, влияющих непосредственно на иммунокомпентные клетки и центральные механизмы регуляции иммунитета, через которые оказывается вторичное иммуностимулирующее влияние на организм. К таким препаратам относятся: бронхо-мунал П, рибомунил, иммунал, ИРС. Бронхо-мунал П (до 12 лет — по 3, 5 мг/сут, с 12 лет — по 7, 0 мг/сут) принимают в течение 10 дней, 20 дней перерыв. Курс № 3.

Применение бронхолитиков-адреномиметиков (сальбутамол, вентолин и др. ) у больных с крайне ограниченной двигательной функцией приводит к расслаблению гладкой мускулатуры, резко повышается уровень креатинкиназы, миоглобина, что может вызвать острую почечную недостаточность, а гипокалиемия — нарушение работы сердца. Поэтому данные препараты следует применять с осторожностью.

Лечение сопутствующих заболеваний У детей с прогрессирующими мышечными дистрофиями и амиотрофиями вследствие недостатка кислорода окисление пирувата прекращается, что приводит к накоплению молочной кислоты и ацидозу (анаэробный гликолиз). Препараты метаболического действия назначаются в сочетании или отдельно, курсами до 3 месяцев 2 раза в год: — карниэль Назначается препарат перорально за 30 минут до еды (дополнительно разбавлялся соком) в дозе 0, 5 мл/кг/сут (100 мг/кг/сут) в течение 3 месяцев, далее перерыв 2 мес. , курс повторялся; — стимол применяется в виде питьевого раствора в следующих дозировках: в возрасте 2– 5 лет — по 100 мг (1/2 пакетика) 2 р/сут, 5– 12 лет — по 200 мг (1 пакетик) 2 р/сут, старше 12 лет — по 200 мг (1 пакетик) 3 р/сут, 30 дней курсами (каждые 3 месяца).

Лечение сопутствующих заболеваний Проблема поражения сердечно-сосудистой системы при НМЗ актуальна, поскольку летальный исход большинства из них обусловлен вовлечением сердечной мышцы в патологический процесс. Тяжесть поражения сердечной мышцы прямо пропорциональна выраженности неврологической симптоматики. Показано курсовое внутривенное введение неотона (фосфокреатинин): в возрасте 5– 7 лет — 1, 0 г ; 7– 12 лет — 2, 0 г, старше 12 лет — 4, 0 г, в/в капельно медленно через день на изотоническом растворе № 5 с последующим переходом на курсовой прием одного из кардиотрофических препаратов (милдронат, предуктал М, калия оротат, рибоксин).

Лечение сопутствующих заболеваний Проблема поражения сердечно-сосудистой системы при НМЗ актуальна, поскольку летальный исход большинства из них обусловлен вовлечением сердечной мышцы в патологический процесс. Тяжесть поражения сердечной мышцы прямо пропорциональна выраженности неврологической симптоматики. Показано курсовое внутривенное введение неотона (фосфокреатинин): в возрасте 5– 7 лет — 1, 0 г ; 7– 12 лет — 2, 0 г, старше 12 лет — 4, 0 г, в/в капельно медленно через день на изотоническом растворе № 5 с последующим переходом на курсовой прием одного из кардиотрофических препаратов (милдронат, предуктал М, калия оротат, рибоксин).

Многие заболевания неизлечимы, но нет болезней, которые нельзя было бы лечить. Лорд Волтон

Спасибо за внимание!
нейромышечные заболевания Соломин.ppt