Khimia_4_2015_konspekt.pptx
- Количество слайдов: 26

© Негребецкий 1995 – 2016 Лекция № 4 Равновесия в растворах комплексных соединений. Гетерогенные равновесия. Окислительновосстановительные равновесия.

КРАТКИЙ ПУТЕВОДИТЕЛЬ Краткий путеводитель. I. Равновесия в растворах комплексов. 1. Номенклатура комплексных соединений 2. Строение комплексных соединений 3. Образование координационной связи 4. Лиганды – комплексообразующие агенты 5. Геометрическая изомерия комплексов II. Гетерогенные равновесия III. Окислительно-восстановительные равновесия 1. Ряд стандартных электродных потенциалов 2. Диффузионный электродный потенциал 3. Окислительно-восстановительный потенциал 4. Уравнение Нернста-Петерса 5. Стандартный биологический ОВ потенциал 6. Связь ∆G 0, Е 0 и Кс для ОВР 7. Определение направления ОВР

НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ International Union of Pure and Applied Chemistry (1957, 1970, 1990 г. ) http: //www. iupac. org/
![СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Комплексные соединения С внешней сферой K 4+[Fe(CN)6]4– [Cu(NH 3 )4 ] СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Комплексные соединения С внешней сферой K 4+[Fe(CN)6]4– [Cu(NH 3 )4 ]](https://present5.com/presentation/126115339_426989018/image-4.jpg)
СТРОЕНИЕ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Комплексные соединения С внешней сферой K 4+[Fe(CN)6]4– [Cu(NH 3 )4 ] 2+(OH–) 2 Без внешней сферы [Pt. Cl 2(NH 3)2]
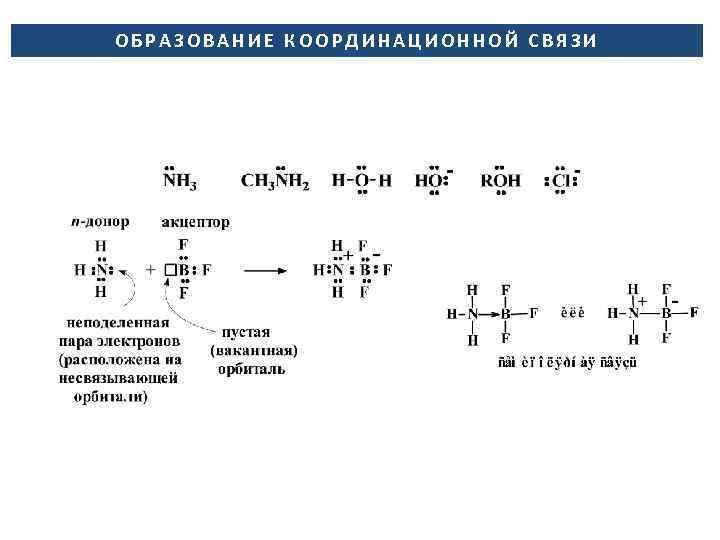
ОБРАЗОВАНИЕ КООРДИНАЦИОННОЙ СВЯЗИ

ЛИГАНДЫ – КОМПЛЕКСООБРАЗУЮЩИЕ АГЕНТЫ — Ионы или нейтральные молекулы, присоединенные к центральному атому (путем образования координационной связи за счет электронной пары координирующего атома) (Cl–, NH 3, H 2 O) монодентатные (H 2 NCH 2 NH 2) бидентатный
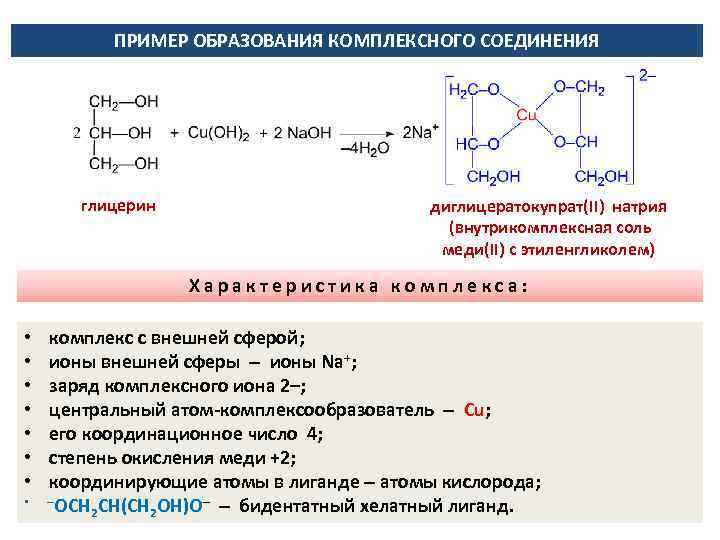
ПРИМЕР ОБРАЗОВАНИЯ КОМПЛЕКСНОГО СОЕДИНЕНИЯ глицерин диглицератокупрат(II) натрия (внутрикомплексная соль меди(II) с этиленгликолем) Характеристика комплекса: • комплекс с внешней сферой; • ионы внешней сферы ионы Na+; • заряд комплексного иона 2–; • центральный атом-комплексообразователь Сu; • его координационное число 4; • степень окисления меди +2; • координирующие атомы в лиганде атомы кислорода; • –ОСН СН(СН ОН)О– бидентатный хелатный лиганд. 2 2
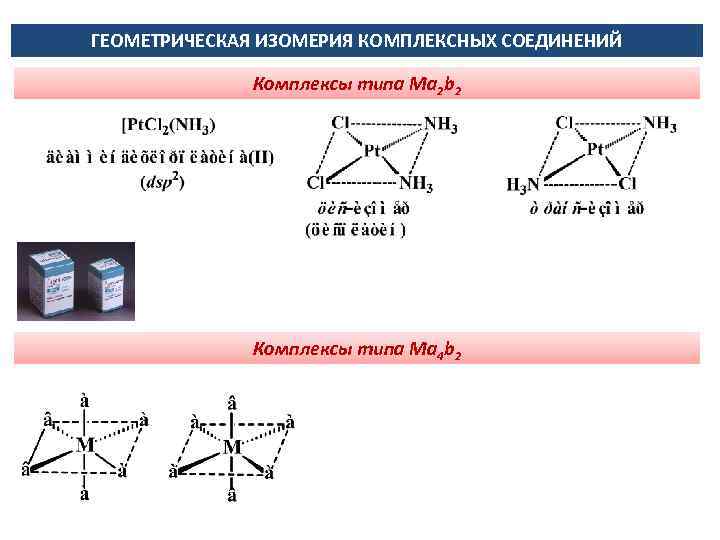
ГЕОМЕТРИЧЕСКАЯ ИЗОМЕРИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ Комплексы типа Ма 2 b 2 Комплексы типа Ма 4 b 2
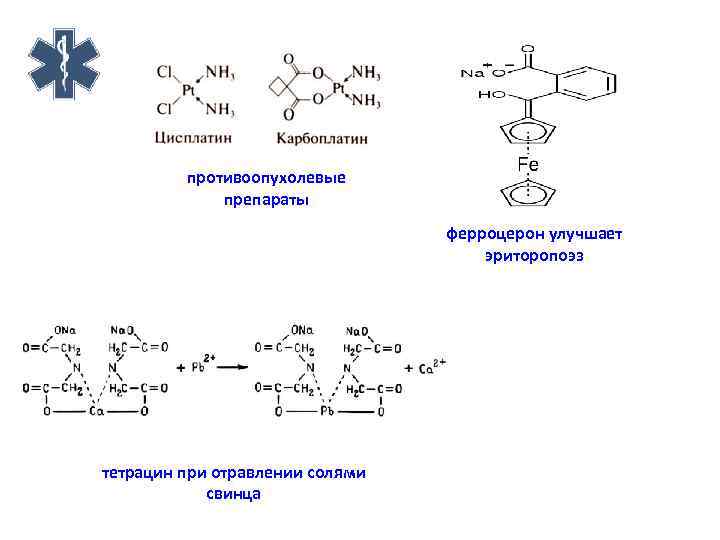
противоопухолевые препараты ферроцерон улучшает эриторопоэз тетрацин при отравлении солями свинца
![РАВНОВЕСИЯ В РАСТВОРАХ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ • Первичная диссоциация [Cu(NH 3)4]2+ SO 42– [Cu(NH 3)4]2+ РАВНОВЕСИЯ В РАСТВОРАХ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ • Первичная диссоциация [Cu(NH 3)4]2+ SO 42– [Cu(NH 3)4]2+](https://present5.com/presentation/126115339_426989018/image-10.jpg)
РАВНОВЕСИЯ В РАСТВОРАХ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ • Первичная диссоциация [Cu(NH 3)4]2+ SO 42– [Cu(NH 3)4]2+ + SO 42– • Вторичная диссоциация Ступенчатая диссоциация [Cu(NH 3)4]2+ [Cu(NH 3)3]2+ + NH 3 K 1 [Cu(NH 3)3]2+ [Cu(NH 3)2]2+ + NH 3 [Cu(NH 3)2]2+ [Cu. NH 3]2+ + NH 3 [Cu. NH 3]2+ Cu 2+ + NH 3 K 2 K 3 K 4
![Суммарное уравнение [Cu(NH 3)4]2+ Cu 2+ + 4 NH 3 K = Кнест = Суммарное уравнение [Cu(NH 3)4]2+ Cu 2+ + 4 NH 3 K = Кнест =](https://present5.com/presentation/126115339_426989018/image-11.jpg)
Суммарное уравнение [Cu(NH 3)4]2+ Cu 2+ + 4 NH 3 K = Кнест = К 1 • К 2 • К 3 • К 4 Константа нестойкости Чем меньше константа нестойкости, тем устойчивее комплекс [Ag(CN)2]– устойчивее [Ag(NH 3)2]+ Кнест = 1 • 10– 21 Кнест = 7 • 10– 8 Константа устойчивости Куст. ( n) — для обратной реакции комплексообразования (n число лигандов в составе комплекса) 2+ + 4 NH [Cu(NH ) ]2+ [Cu] 3 3 4 Чем больше константа устойчивости, тем устойчивее комплекс

РАВНОВЕСИЕ ТВЕРДОЕ ТЕЛО-РАСТВОР Ba. SO 4 (т) Ba 2+(aq) + SO 42–(aq) V =V Ag. Cl (т) Ag+(aq) + Cl–(aq) Составьте уравнение действующих масс для представленного гетерогенного равновесия

При постоянной Т и в отсутствие посторонних веществ: Am. Bn (т) m. An+ + n. Bm– КПР = [An+]m [Bm–]n = const v Распространенность химических элементов в живых организмах зависит от растворимости их соединений в воде и способности образовывать комплексы с биолигандами СМЕЩЕНИЕ ИОННОГО ГЕТЕРОГЕННОГО РАВНОВЕСИЯ • Условие образования осадка: КПР(экс) > КПР(табл) (перенасыщенный раствор) • Условие растворения осадка: КПР(экс) = КПР(табл) (насыщенный раствор) КПР(экс) < КПР(табл) (ненасыщенный раствор)

Пример 4. 3 Выпадет ли осадок Ba. CO 3 при сливании равных объемов 0. 001 М растворов Ba. Cl 2 и K 2 CO 3 (KПР(Ba. CO 3) = 5∙ 10 9) ? Решение

Пример 4. 2 Рассчитать растворимость Ag. Cl в чистой воде и в 0. 01 М растворе KCl (KПР(Ag. Cl) = 1. 8∙ 10 10) Решение Ag. Cl (т) Ag+(aq) + Cl–(aq) Растворимость в чистой воде (S 1) KПР(Ag. Cl) = [Ag+] ∙ [Cl ] = S 2 моль/л m(Ag. Cl) = с(Ag. Cl) ∙ M(Ag. Cl) = 1. 34∙ 10 5 ∙ 145. 5 = 1. 92∙ 10 3 г/л = 1. 92 мг/л Растворимость в 0. 01 М растворе KCl (S 2) KПР(Ag. Cl) = [Ag+] ∙ [Cl ], отсюда моль/л

ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РАВНОВЕСИЯ ОВР лежат в основе методов оксидиметрии (перманганатометрия, иодометрия, хроматометрия), используемых в клинической практике для определения в крови Са 2+, мочевой кислоты, холестерина, сахара, ферментов каталазы и пероксидазы В санитарно-гигиенической практике эти методы используются для определения окисляемости воды, содержания остаточного хлора в ней, активного хлора в дезинфицирующих средствах (хлорная известь, хлорамины)

ОБЩИЕ ПОЛОЖЕНИЯ Окислительно-восстановительные реакции протекают с Лев Владимирович Писаржевский 1874 – 1938 переносом электронов и с изменением степени окисления элементов реагирующих веществ Восстановитель (Red) – отдает е– (донор е–) Red 1 Ox 1 + ze– – процесс окисления Окислитель (Ox) – принимает е– (акцептор е–) Ox 2 + ze – Red 2 – процесс восстановления Red и Ox составляют сопряженную ОВ пару или систему

РЯД СТАНДАРТНЫХ ЭЛЕКТРОДНЫХ ПОТЕНЦИАЛОВ МЕТАЛЛ φ 0, B Li Na Zn Fe H - 3. 05 - 2. 71 - 0. 76 - 0. 44 0 M + 2 H+ M 2+ + H 2 Cu 0. 34 M 2+ + H 2 M + 2 H+ восстановительные свойства Ме уменьшаются окислительные свойства ионов металлов увеличиваются Ag 0. 80

УРАВНЕНИЕ НЕРНСТА Пример. Рассчитайте потенциал медной пластинки, если с(Cu 2+) = 0. 01 М, φо(Cu 2+/Cu) = 0. 34 В Cu 2+ + 2 e – Cu φ(Cu 2+/Cu) = 0. 34 + (0. 06/2)∙ lg 0. 01 = 0. 28 В
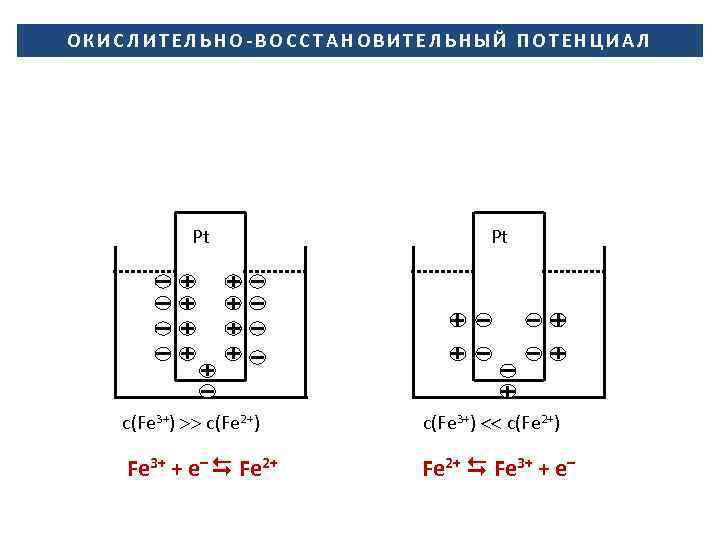
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЙ ПОТЕНЦИАЛ Pt c(Fe 3+) c(Fe 2+) Fe 3+ + e– Fe 2+ Pt c(Fe 3+) c(Fe 2+) Fe 2+ Fe 3+ + e–

У Р А В Н Е Н И Е Н Е Р Н С Т А -- П Е Т Е Р С А УРАВНЕНИЕ НЕРНСТА ПЕТЕРСА Для реакции: n Ox + m H+ + ze– y Red φо – стандартный окислительно-восстановительный (восстановительный) потенциал – потенциал ОВ электрода при a(Red) = a(Ox) = a(Н+) = 1 моль/л, Т = 298 К, Р = 101. 3 к. Па (табличные значения)

С Т А Н Д А Р Т Н Ы Й Б И О Л О Г И Ч Е С К И Й О В П О Т Е Н Ц И А Л φ0/ Для физиологических условий используется 0/ Для реакции: ПРИМЕР n Ox + m H+ + ze– y Red при а(Ox) = a(Red) ≠ 1 моль/л и р. Н = 7: CH 3 -C-COOH + 2 H+ + 2 e CH 3 -CH-COOH O Pyr OH Lac 0/ = 0 – 0. 06∙p. H = 0. 228 – 0. 420 = – 0. 192 В

СВЯЗЬ ∆G 0, Е 0 И КС ДЛЯ ОВР G 0 = – z. FE 0 (максимальная электрическая работа гальванического элемента) G 0 = – RT∙ln. Кс = – z. FE 0 Пример. Для реакции: Zn + Cu 2+ Zn 2+ + Cu Е 0 = 1. 1 В, ∆G 0 = – 2∙ 96500∙ 1. 1 = – 212 к. Дж, lg К = 37. 29, К = 2∙ 1037

ОПРЕДЕЛЕНИЕ НАПРАВЛЕНИЯ ОВР Пример. Можно ли в стандартных условиях окислить ионы Вr – до Br 2 газообразным хлором? 2 Br – + Сl 2 → Br 2 + 2 Cl – О(Cl 2/2 Cl –) = 1. 36 B, О(Br 2/2 Br –) = 1. 065 B, Оок. > Овос. , E = 1. 36 – 1. 065 = 0. 295 B – процесс возможен

Пример. Определите направление протекания реакции в стандартных биологических условиях СН 3 СН 2 ОН + НАД+ СН 3 С(О)Н + НАДН + Н+ НАД+ + Н+ + 2 е– НАДН (φ10/ = – 0. 32 В) (Ох) СН 3 С(О)Н + 2 Н+ + 2 е– СН 3 СН 2 ОН (φ20/ = – 0. 197 В) (Red) φ0/Ох < φ0/Red – в прямом направлении реакция не идет Е 0/ = – 0. 32 – (-0. 197) = – 0. 123 В (<0) ∆G 0/ = – 2∙ 96500∙(-0. 123) = 23. 7 к. Дж (>0) В стандартных биологических условиях эта реакция может протекать только в обратном направлении (←)
Khimia_4_2015_konspekt.pptx