
© Негребецкий 1995 – 2014 Лекция № 5 Строение органических соединений. Изомерия. Реакционная способность

ПЛАН ЛЕКЦИИ I. Строение органических соединений 1. Пространственное строение 2. Конформации 3. Конфигурация 4. Изомерия II. Основные закономерности протекания реакций 1. Способы разрыва химической связи 2. Классификация реакций 3. Понятие о механизме реакции 4. Энергетические диаграммы 5. Влияние различных факторов на механизм реакции
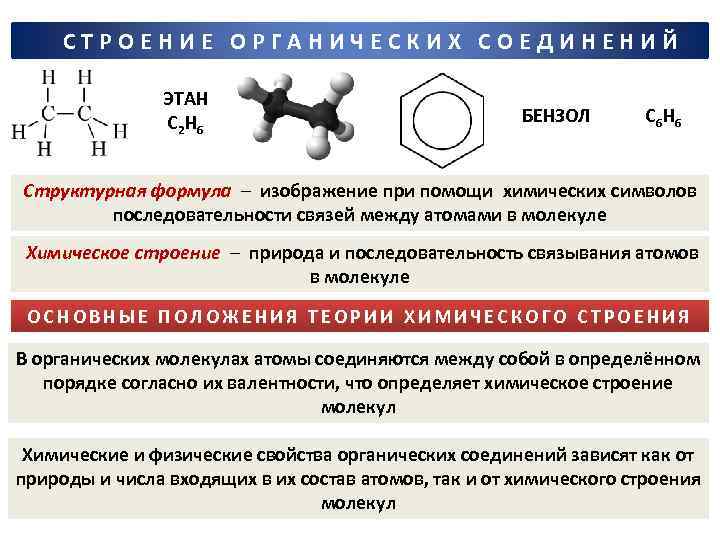
СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ ЭТАН С 2 Н 6 БЕНЗОЛ С 6 Н 6 Структурная формула ─ изображение при помощи химических символов последовательности связей между атомами в молекуле Химическое строение ─ природа и последовательность связывания атомов в молекуле ОСНОВНЫЕ ПОЛОЖЕНИЯ ТЕОРИИ ХИМИЧЕСКОГО СТРОЕНИЯ В органических молекулах атомы соединяются между собой в определённом порядке согласно их валентности, что определяет химическое строение молекул Химические и физические свойства органических соединений зависят как от природы и числа входящих в их состав атомов, так и от химического строения молекул

Структурные изомеры ─ соединения, имеющие одинаковый состав, но различное химическое строение бутан 2 -метилпропан Для каждой эмпирической формулы можно вывести определённое число теоретически возможных структур (изомеров) Каждое органическое соединение имеет одну формулу, которая даёт представление о свойствах этого соединения В молекулах существует взаимное влияние атомов как связанных, так и непосредственно не связанных друг с другом
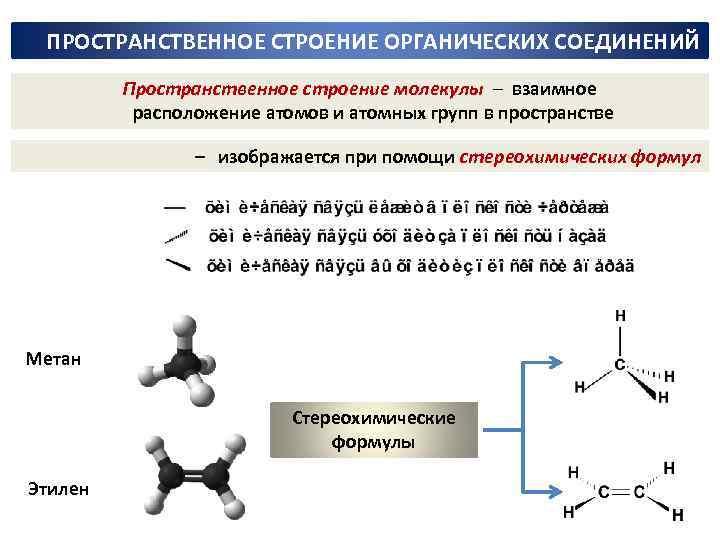
ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Пространственное строение молекулы ─ взаимное расположение атомов и атомных групп в пространстве – изображается при помощи стереохимических формул Метан Стереохимические формулы Этилен

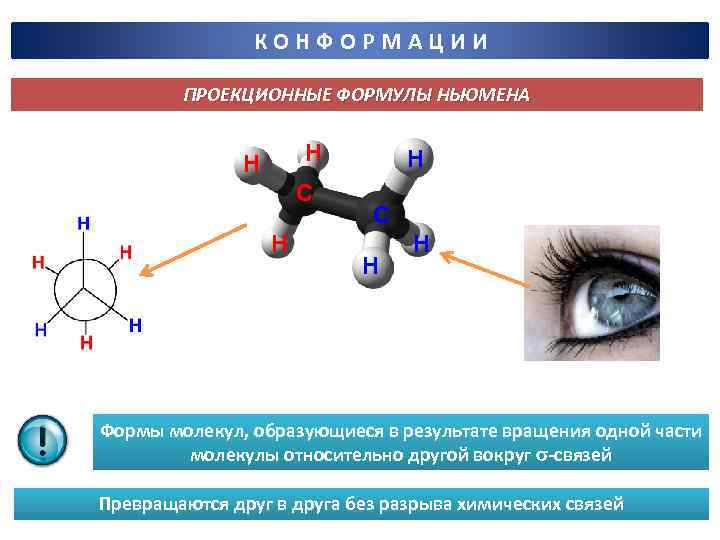
КОНФОРМАЦИИ ПРОЕКЦИОННЫЕ ФОРМУЛЫ НЬЮМЕНА Н Н С Н Н Формы молекул, образующиеся в результате вращения одной части молекулы относительно другой вокруг -связей Превращаются друг в друга без разрыва химических связей
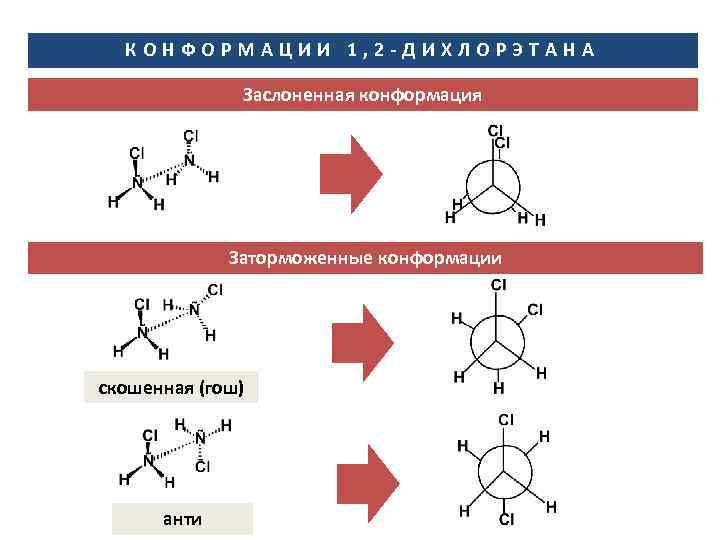
КОНФОРМАЦИИ 1, 2 -ДИХЛОРЭТАНА Заслоненная конформация Заторможенные конформации скошенная (гош) анти

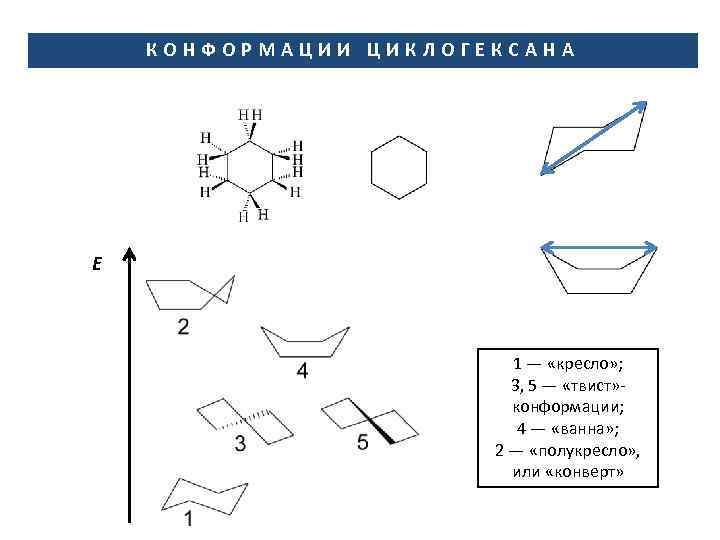
КОНФОРМАЦИИ ЦИКЛОГЕКСАНА Е 1 — «кресло» ; 3, 5 — «твист» конформации; 4 — «ванна» ; 2 — «полукресло» , или «конверт»
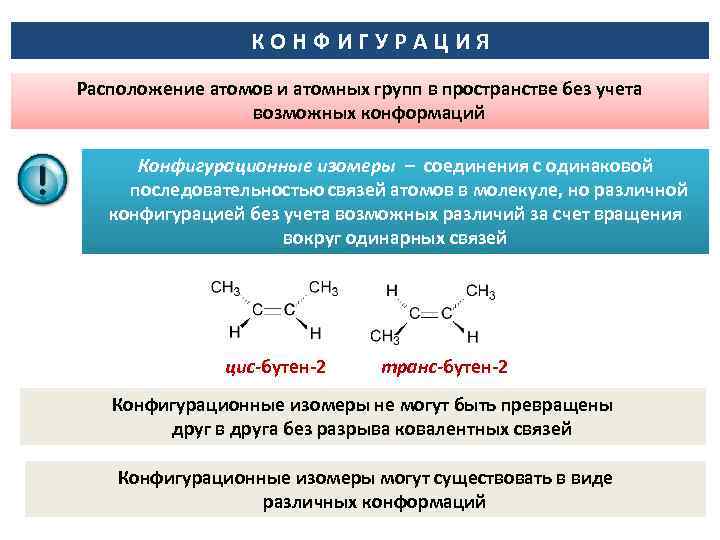
КОНФИГУРАЦИЯ Расположение атомов и атомных групп в пространстве без учета возможных конформаций Конфигурационные изомеры – соединения с одинаковой последовательностью связей атомов в молекуле, но различной конфигурацией без учета возможных различий за счет вращения вокруг одинарных связей цис-бутен-2 транс-бутен-2 Конфигурационные изомеры не могут быть превращены друг в друга без разрыва ковалентных связей Конфигурационные изомеры могут существовать в виде различных конформаций

ОПТИЧЕСКАЯ ИЗОМЕРИЯ. ХИРАЛЬНОСТЬ Хиральность – свойство предмета быть неидентичным своему зеркальному отображению (от греч. cheir рука)

Молекулы могут быть хиральными и ахиральными Глицериновый альдегид Вследствие хиральности, некоторые молекулы существуют в виде пары пространственных изомеров – энантиомеров, представляющих собой несовместимые в пространстве зеркальные изображения (зеркальные изомеры) Простейший случай хиральности – наличие в молекуле центра хиральности (хирального центра), которым может служить атом С, содержащий четыре различных заместителя (асимметрический атом)
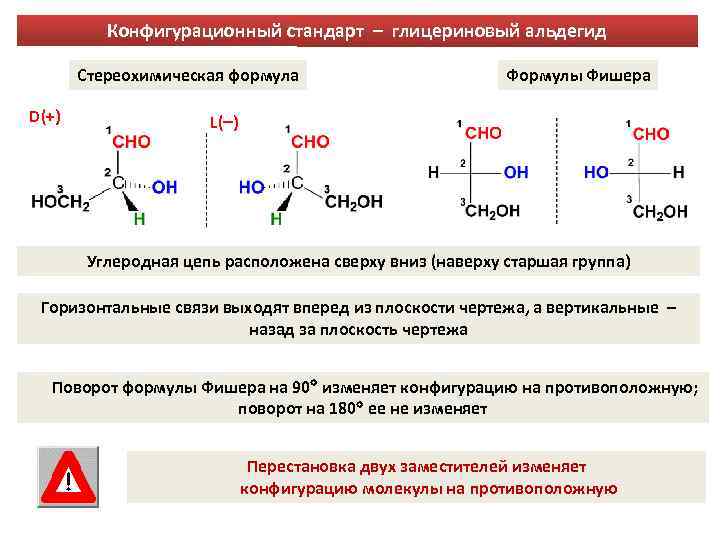
Конфигурационный стандарт – глицериновый альдегид Стереохимическая формула D(+) Формулы Фишера L( ) Углеродная цепь расположена сверху вниз (наверху старшая группа) Горизонтальные связи выходят вперед из плоскости чертежа, а вертикальные – назад за плоскость чертежа Поворот формулы Фишера на 90 изменяет конфигурацию на противоположную; поворот на 180 ее не изменяет Перестановка двух заместителей изменяет конфигурацию молекулы на противоположную


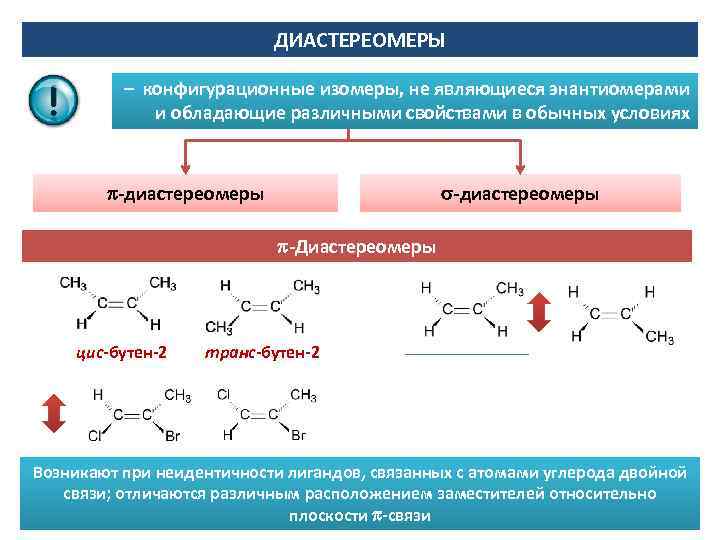
ДИАСТЕРЕОМЕРЫ – конфигурационные изомеры, не являющиеся энантиомерами и обладающие различными свойствами в обычных условиях -диастереомеры -Диастереомеры цис-бутен-2 транс-бутен-2 Возникают при неидентичности лигандов, связанных с атомами углерода двойной связи; отличаются различным расположением заместителей относительно плоскости -связи
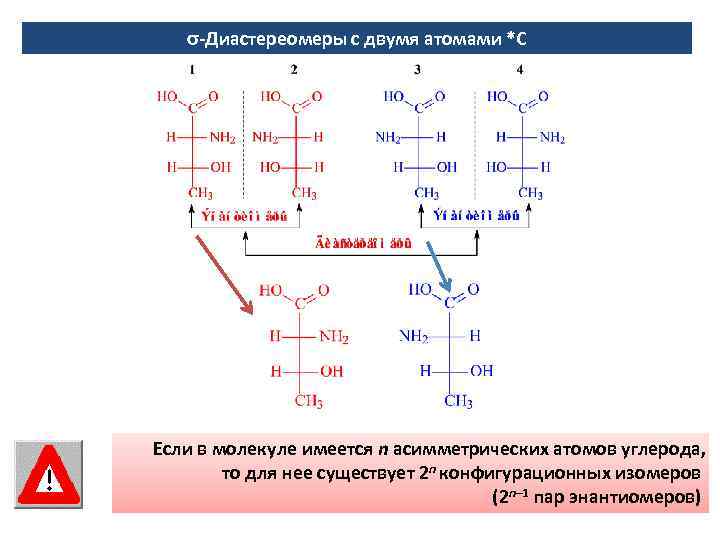
-Диастереомеры с двумя атомами *С Если в молекуле имеется n асимметрических атомов углерода, то для нее существует 2 n конфигурационных изомеров (2 n– 1 пар энантиомеров)
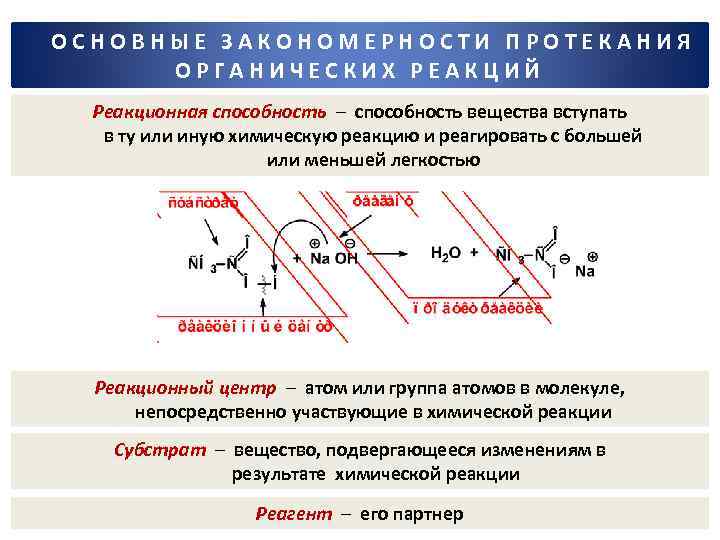
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ Реакционная способность – способность вещества вступать в ту или иную химическую реакцию и реагировать с большей или меньшей легкостью Реакционный центр – атом или группа атомов в молекуле, непосредственно участвующие в химической реакции Субстрат – вещество, подвергающееся изменениям в результате химической реакции Реагент – его партнер
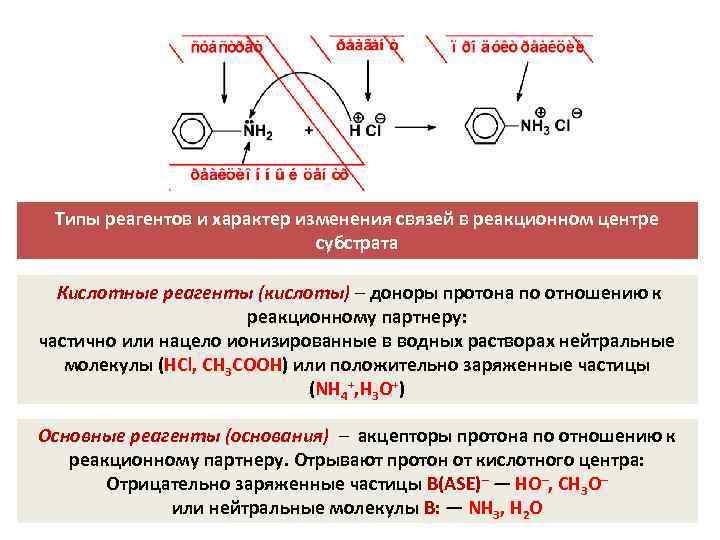
Типы реагентов и характер изменения связей в реакционном центре субстрата Кислотные реагенты (кислоты) – доноры протона по отношению к реакционному партнеру: частично или нацело ионизированные в водных растворах нейтральные молекулы (HCl, CH 3 COOH) или положительно заряженные частицы (NH 4+, H 3 O+) Основные реагенты (основания) – акцепторы протона по отношению к реакционному партнеру. Отрывают протон от кислотного центра: Отрицательно заряженные частицы B(ASE)– — HO–, CH 3 O– или нейтральные молекулы B: — NH 3, H 2 O

Нуклеофильные реагенты (нуклеофилы) – частицы, образующие новую ковалентную связь за счет своей электронной пары; СВОЙСТВА: – обладают повышенной электронной плотностью, взаимодействуют с любым атомом (кроме водорода), несущим частичный или полный положительный заряд; – нуклеофил заряжен отрицательно (Nu–, Cl–, HO–, CH 3 O–, R 3 C– карбоанион) или имеет неподеленную пару электронов (Nu: , NH 3, H 2 O) или -связь CH 2=CH 2, C 6 H 6 Электрофильные реагенты (электрофилы) – частицы, образующие новую ковалентную связь за счет пары электронов партнера; СВОЙСТВА: – имеют недостаток электронов; – взаимодействуют с реакционным центром партнера с повышенной электронной плотностью; – имеют атом, несущий частичный или полный положительный заряд или обладают вакантной орбиталью. E или E+ – H+, Cl+, Al. Cl 3, SO 3, R 3 C+ (карбокатион), RC(O)+,
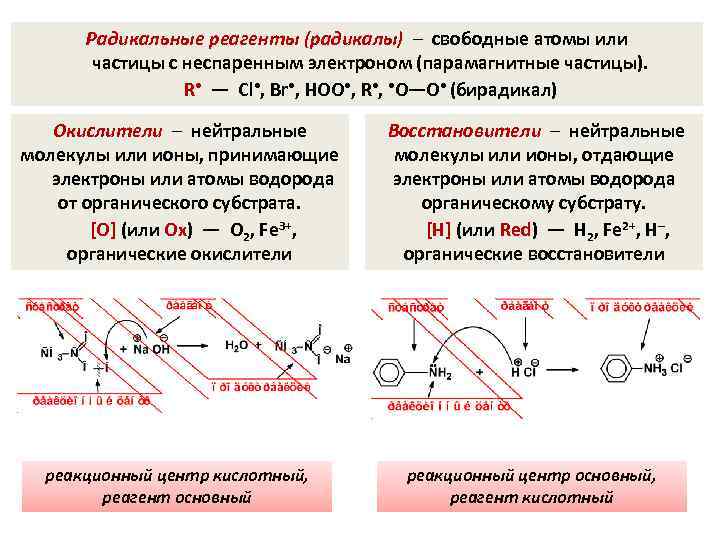
Радикальные реагенты (радикалы) – свободные атомы или частицы с неспаренным электроном (парамагнитные частицы). R • — Cl • , Br • , HOO • , R • , • O—O • (бирадикал) Окислители – нейтральные молекулы или ионы, принимающие электроны или атомы водорода от органического субстрата. [O] (или Ox) — O 2, Fe 3+, органические окислители Восстановители – нейтральные молекулы или ионы, отдающие электроны или атомы водорода органическому субстрату. [H] (или Red) — H 2, Fe 2+, H–, органические восстановители реакционный центр кислотный, реагент основный реакционный центр основный, реагент кислотный
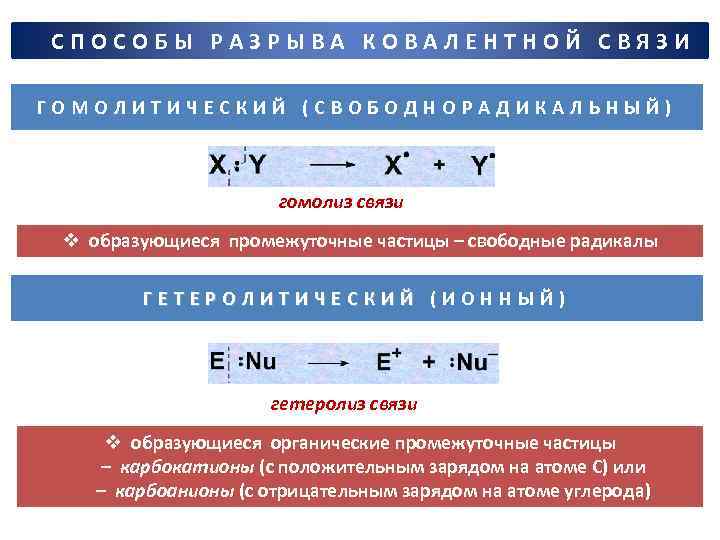
СПОСОБЫ РАЗРЫВА КОВАЛЕНТНОЙ СВЯЗИ ГОМОЛИТИЧЕСКИЙ (СВОБОДНОРАДИКАЛЬНЫЙ) гомолиз связи v образующиеся промежуточные частицы – свободные радикалы ГЕТЕРОЛИТИЧЕСКИЙ (ИОННЫЙ) гетеролиз связи v образующиеся органические промежуточные частицы – карбокатионы (с положительным зарядом на атоме С) или – карбоанионы (с отрицательным зарядом на атоме углерода)
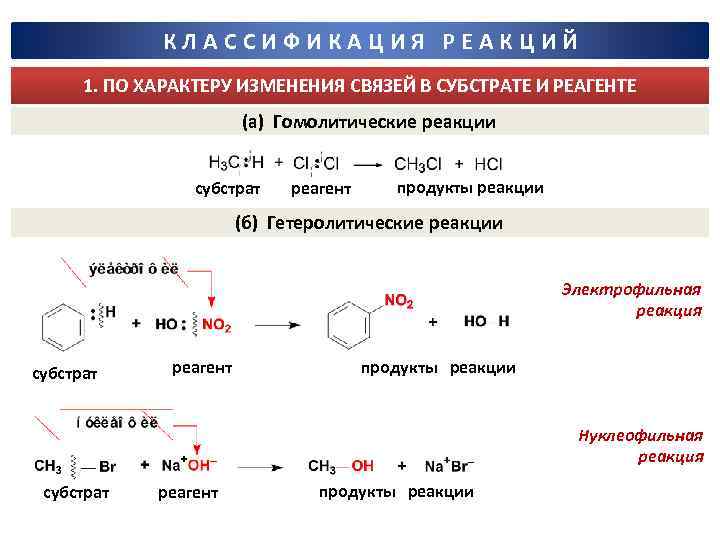
КЛАССИФИКАЦИЯ РЕАКЦИЙ 1. ПО ХАРАКТЕРУ ИЗМЕНЕНИЯ СВЯЗЕЙ В СУБСТРАТЕ И РЕАГЕНТЕ (а) Гомолитические реакции субстрат реагент продукты реакции (б) Гетеролитические реакции Электрофильная реакция субстрат реагент продукты реакции Нуклеофильная реакция субстрат реагент продукты реакции
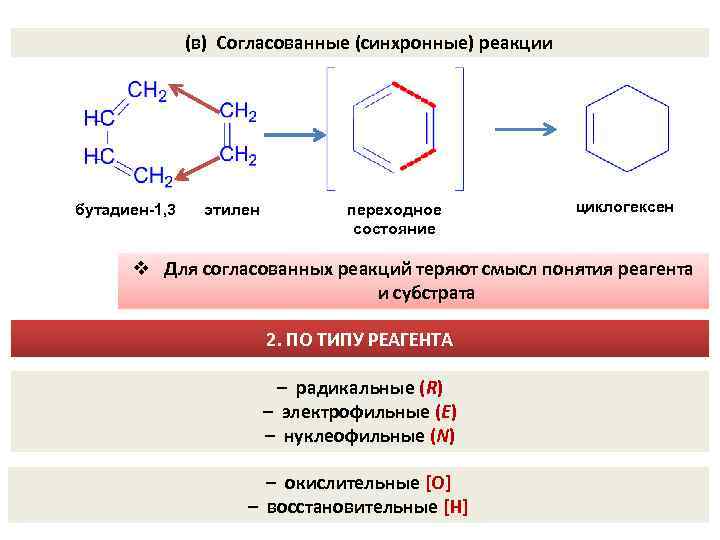
(в) Согласованные (синхронные) реакции бутадиен-1, 3 этилен переходное состояние циклогексен v Для согласованных реакций теряют смысл понятия реагента и субстрата 2. ПО ТИПУ РЕАГЕНТА – радикальные (R) – электрофильные (E) – нуклеофильные (N) – окислительные [O] – восстановительные [H]
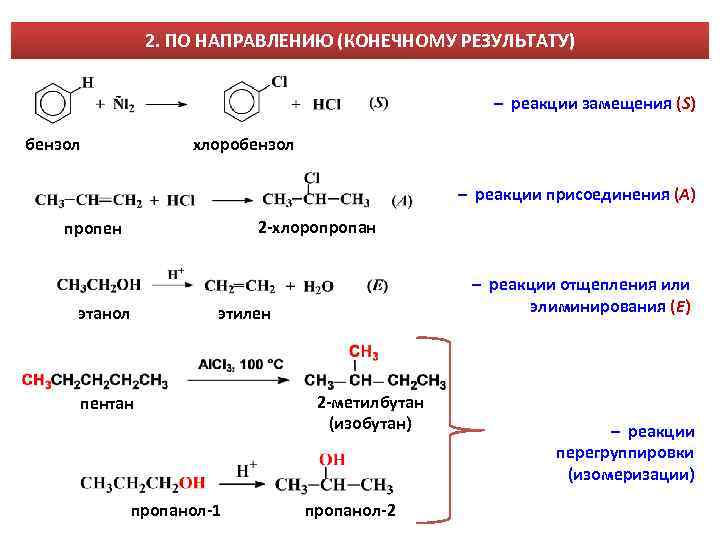
2. ПО НАПРАВЛЕНИЮ (КОНЕЧНОМУ РЕЗУЛЬТАТУ) – реакции замещения (S) бензол хлоробензол – реакции присоединения (A) 2 -хлоропропан пропен этанол – реакции отщепления или элиминирования (E) этилен пентан пропанол-1 2 -метилбутан (изобутан) пропанол-2 – реакции перегруппировки (изомеризации)
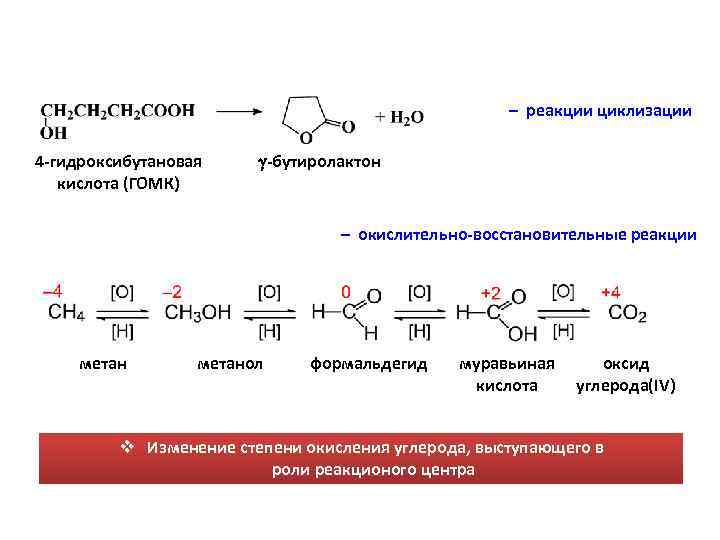
– реакции циклизации 4 -гидроксибутановая кислота (ГОМК) -бутиролактон – окислительно-восстановительные реакции метанол формальдегид муравьиная кислота оксид углерода(IV) v Изменение степени окисления углерода, выступающего в роли реакционого центра
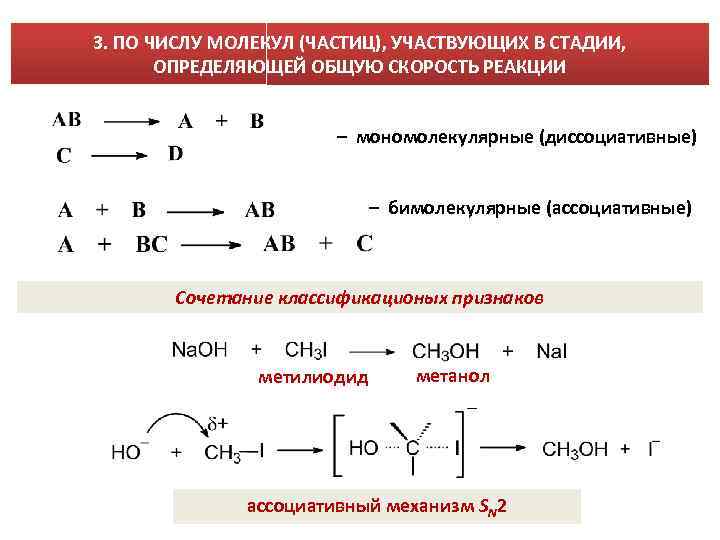
3. ПО ЧИСЛУ МОЛЕКУЛ (ЧАСТИЦ), УЧАСТВУЮЩИХ В СТАДИИ, ОПРЕДЕЛЯЮЩЕЙ ОБЩУЮ СКОРОСТЬ РЕАКЦИИ – мономолекулярные (диссоциативные) – бимолекулярные (ассоциативные) Сочетание классификационых признаков метилиодид метанол ассоциативный механизм SN 2

ПОНЯТИЕ О МЕХАНИЗМЕ РЕАКЦИИ Механизм реакции – детальное описание процесса, в результате которого исходные вещества превращаются в конечные продукты – детальное описание всех стадий реакции Включает: (1) элементарные стадии реакции; (2) способ разрыва и образования связей на каждой стадии Согласуется с: (3) стереохимией процесса – пространственным строением исходных продуктов, переходных состояний, промежуточно образующихся частиц и продуктов реакции; (4) кинетическими закономерностями процесса; (5) термодинамикой процесса
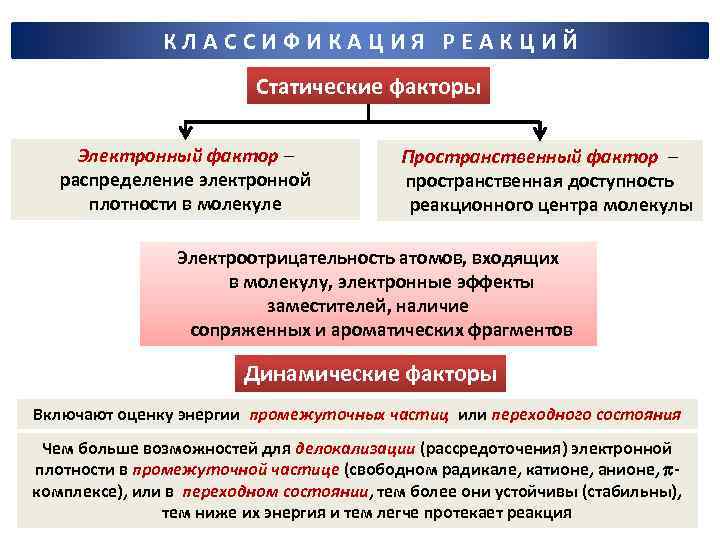
КЛАССИФИКАЦИЯ РЕАКЦИЙ Статические факторы Электронный фактор – распределение электронной плотности в молекуле Пространственный фактор – пространственная доступность реакционного центра молекулы Электроотрицательность атомов, входящих в молекулу, электронные эффекты заместителей, наличие сопряженных и ароматических фрагментов Динамические факторы Включают оценку энергии промежуточных частиц или переходного состояния Чем больше возможностей для делокализации (рассредоточения) электронной плотности в промежуточной частице (свободном радикале, катионе, анионе, комплексе), или в переходном состоянии, тем более они устойчивы (стабильны), тем ниже их энергия и тем легче протекает реакция
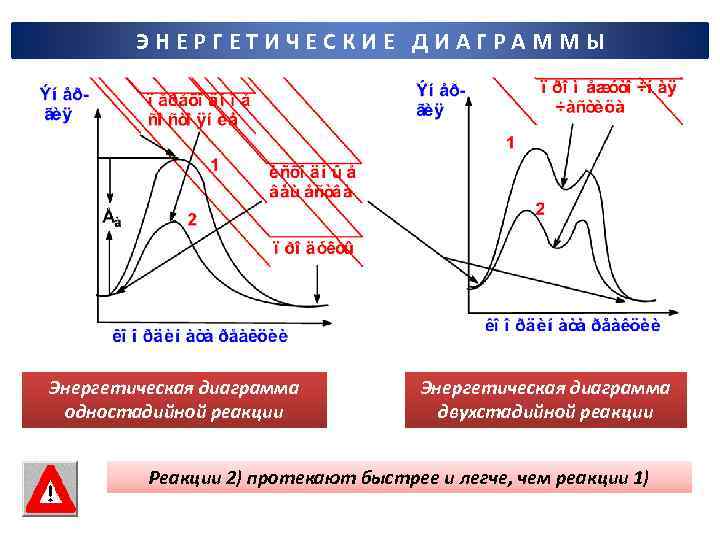
ЭНЕРГЕТИЧЕСКИЕ ДИАГРАММЫ Энергетическая диаграмма одностадийной реакции Энергетическая диаграмма двухстадийной реакции Реакции 2) протекают быстрее и легче, чем реакции 1)
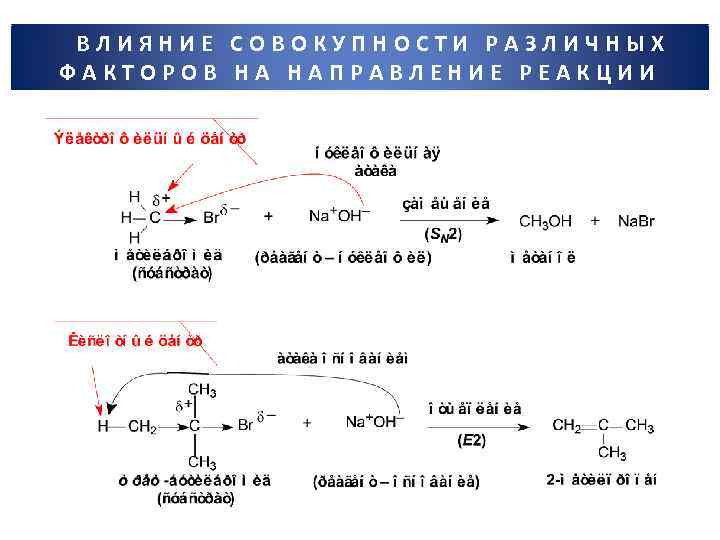
ВЛИЯНИЕ СОВОКУПНОСТИ РАЗЛИЧНЫХ ФАКТОРОВ НА НАПРАВЛЕНИЕ РЕАКЦИИ
