30 Алкены.pptx
- Количество слайдов: 26

Назаров Б. К. предоставляет АЛКЕНЫ

Тема урока: «Алкены» Цели и задачи урока: Методическая цель: показать один из методов инновационного обучения. Данный метод позволяет учить на уроке, широко используя в комплексе аудивизуальные возможности преподавания нового материала, развивать опорные знания, активизируя мыслительную деятельность студентов. Тип урока: комбинированный. Цели урока: Дидактические: на примере этилена сформировать у студентов понятие о влиянии электронного строения алкенов на их химические и физические свойства. Воспитательная: научить самостоятельности, аккуратности и настойчивости в достижении намеченной цели. Развивающая: развивать познавательные способности студентов, их логическое мышление. Оборудование: Проектор данных VPL - CS 5, реактивы для демонстрации опытов.

План урока: Фронтальный письменный опрос по теме «Алканы» . 2. Изложение нового материала 1. 2. 3. 4. 5. 6. 7. Электронное строение этена. Номенклатура. Изомерия. Способы получения алкенов. Физические свойства алкенов. Химические свойства алкенов. Область применения. 3. Закрепление пройденного материала. 4. Выдача домашнего задания.
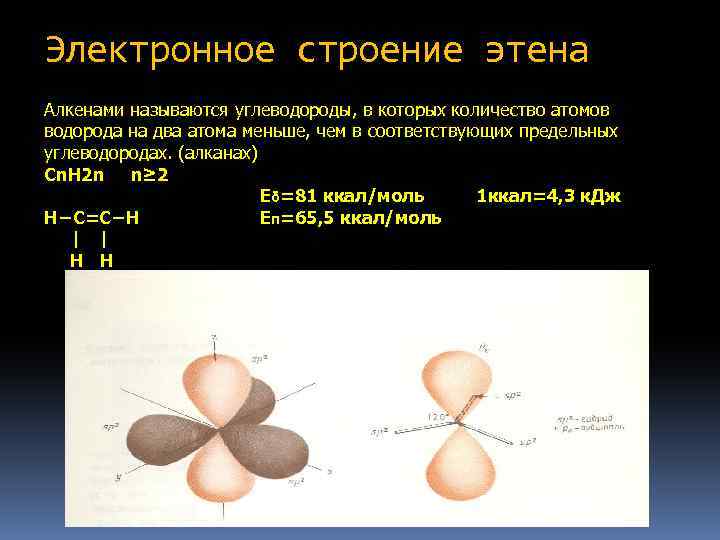
Электронное строение этена Алкенами называются углеводороды, в которых количество атомов водорода на два атома меньше, чем в соответствующих предельных углеводородах. (алканах) Cn. H 2 n n≥ 2 Eδ=81 ккал/моль 1 ккал=4, 3 к. Дж H−C=C−H Eπ=65, 5 ккал/моль | | H H
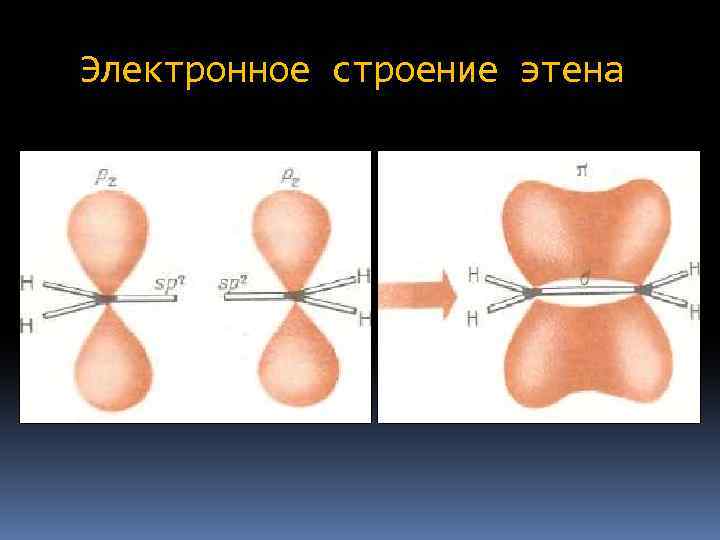
Электронное строение этена

Номенклатура С 2 Н 4 Этен С 3 Н 6 Пропен С 4 Н 8 Бутен С 5 Н 10 Пентен С 6 Н 12 Гексен С 7 Н 14 Гептен С 8 Н 16 Октен С 9 Н 18 Нонен С 10 Н 20 Декен Общая формула алкенов Сn. H 2 n где n≥ 2

Номенклатура Выбирается самая длинная цепь с двойной связью и нумеруется с той стороны ближе к которой располагается 2 -ая связь. Если есть радикалы, то указывается место и их количество, а также место 2 -ой связи. СH 3−CН−CH=CH 2 | CH 3 3 -метилбутен-1

Изомерия зависит от положение двойной связи и от положения R (радикалов). СН 3 -СН 2 -СН=СН 2 СН 3 -СН=СН-СН 3 бутен-1 бутен-2 СН 3 -СН=СН 2 | СН 3 2 -метилпропен-1

Изомерия Пространственная (геометрическая) изомерия существует из-за невозможности вращения атомов углерода относительно друга. cis и tr – изомерия CH 3 | | | C=C | CH 3 H | | C=C | | H H cis H CH 3 tr t кип +4 t кип +1

Способы получения лабораторный способ к H 2 SO 4 1. CH 3−CH 2−OH→CH 2=CH 2 + H 2 O этанол этен промышленный способ Cr 2 O 3 2. CH 3−CH 3 → CH 2=CH 2 + H 2 этан Al 2 O 3 t 350 -500˚C 3. CH 3 − CH−CH 3 → CH 3−CH=CH−CH 3 | | -H 2 O бутен-2 OH H бутанол-2 правило А. М. Зайцева

Способы получения 4. CH 2−CH 2+Zn→CH 2=CH 2+Zn. Cl 2 | | этен Cl Cl 1, 2 дихлорэтан KOH (спирт р-р) 5. CH 3−CH−CH−CH 3→CH 3−CH=CH−CH 3 + HCl | | Cl H 2 -хлорбутан бутен-2

Физические свойства Те же закономерности что и у алканов: увеличение молярной массы влечет за собой увеличение плотности, tпл. , tкип вещества. Первые 3 – газы, с C 5 -C 18 – жидкости, с C 19 – твердые вещества. Плохо растворимые в воде. Все непредельные обладают наркотическими свойствами.
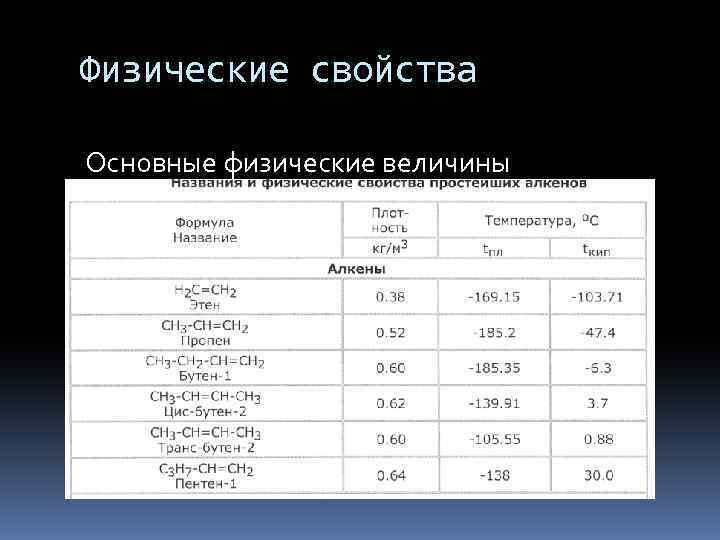
Физические свойства Основные физические величины

Химические свойства 1. CH 2=CH 2+3 O 2→ 2 CO 2+2 H 2 O-∆H Ni, Pt 2. CH 2=CH 2+H 2→CH 3 -CH 3 (Фокин, Собатье) этан 3. Cl 2, Br 2, J 2 убывает → H 2 C=CH 2+Cl 2 → H 2 Cl. C−CH 2 Cl 1, 2 -дихлорэтан 4. HJ, HBr, HCl убывает → CH 2=CH 2+HJ → CH 3−CH 2 J иодэтан

Химические свойства 5. Правило В. В. Марковникова + +CH 3→CH=CH 2+HCl → CH 3−CH−CH 3 | Cl 2 хлорпропан Атом водорода из галогеноводорода присоединяется к наиболее гидрированному углеродному атому.

Химические свойства Если в состав непредельного УВ входит заместитель с отрицательным индукционным эффектом, например, -F, -CN, -NO 2, -COOH, то реакция идет против правила В. В. Марковникова + +СН 2=СН→COOH + HCl → CH 2 -CH-COOH пропеновая кислота | | Cl H 3 -хлорпропановая кислота

Химические свойства Hg 2+ 6. CH 2=CH 2+H 2 O → CH 3−CH 2−OH 7. CH 2=CH 2+Cl 2+H 2 O→CH 2−CH 2+HCl | | OH Cl хлоргидрид 8. 3 CH 2=CH 2 +2 KMn. O 4+4 H 2 O → 3 CH 2−CH 2 +2 KOH+2 Mn. O 2 | | OH OH этандиол

Химические свойства P H 2 SO 4 9. CH 2=CH−CH 3+H 2 O → CH 3−CH−CH 3 пропен | OH пропанол-2 10. Изомеризация Al 2 O 3 CH 3−CH−CH=CH 2 → CH 3−C=CH−CH 3 | 500˚ | CH 3 2 -метилбутен-2 3 -метилбутен -1

Химические свойства Ag 11. 2 CH 2=CH 2+O 2→ 2 CH 2−CH 2 / O оксид этилена 12. Окисление в мягких условиях H 2 O 2 CH 3−CH=CH 2 + [o] +H 2 O→CH 3−CH−CH 2 пропен | | OH OH пропандиол-1, 2

Химические свойства 13. в жестких условиях K 2 Cr 2 O 7 CH 3−CH=CH 2 + 4[О] → CH 3−C=O+H−C=O пропен H+ | | OH OH этановая метановая кислота K 2 Cr 2 O 7 CH 3−C=CH−CH 3 + 3[O] →CH 3−C=O+CH 3−C=O | H+ | | CH 3 OH 2 - метилбутен-2 ацетон уксусная кислота

Химические свойства 14. Полимеризация к C 6 H 5−O−O−C 6 H 5 Перекись бензола n CH 2=CH 2→(-CH 2 -)n полиэтилен R* CH 2=CH 2 n CH 2=CH 2 → CH 2−CH 2*→R−CH 2−CH 2−сн 2* | R радиационный способ

Применение Этен используется в качестве исходного вещества для получения: стирола; полистирола; этиленгликоля; хлорэтана; дихлорэтана; полиэтилена; диэтилового эфира; этанола; дивинила; каучука; и др. веществ.

Ответьте на вопросы: 1. Какие углеводороды называются непредельными? 2. Какие непредельные УВ называются алкенами? Напишите общую формулу гомологического ряда алкенов. 3. Напишите молекулярные формулы и названия первых четырех членов гомологического ряда алкенов.

Ответьте на вопросы: 4. Укажите валентное состояние и тип гибридизации орбиталей атомов углерода, связанных двойной связью в молекулах алкенов. 5. Какие типы изомерии характерны для алкенов? Напишите структурные формулы изомеров пентена и назовите их по международной номенклатуре. 6. Объясните, почему для алкенов возможна геометрическая изомерия.

Ответьте на вопросы: 7. Какой тип реакций характерен для алкенов? Почему? 8. Какие виды реакций присоединения характерны для алкенов? 9. Сформулируйте правило В. В. Марковникова. 10. В каких случаях реакции присоединения идут против правила В. В. Марковникова?

Ответьте на вопросы: 11. Какие реакции являются качественными реакциями на алкены? Напишите уравнения этих реакций. 12. Что называется полимеризацией? 13. Какими способами получают алкены: а) в промышленности; б) в лабораторных условиях?
30 Алкены.pptx