Азот, фосфор и их соединения.ppt
- Количество слайдов: 25
 Нахождение в природе и получение Из минералов промышленное значение имеют чилийская селитра Na. NO 3, индийская (калийная) селитра KNO 3, норвежская селитра Ca(NO 3)2.
Нахождение в природе и получение Из минералов промышленное значение имеют чилийская селитра Na. NO 3, индийская (калийная) селитра KNO 3, норвежская селитра Ca(NO 3)2.

 Получение азота В промышленности азот получают фракционированием (ректификацией) жидкого воздуха. В лабораторных условиях азот получают: 1. термическим разложением азида лития или натрия: 2. нагреванием смеси растворов нитрата натрия и хлорида аммония: 3. разложением азотсодержащих соединений. Например, твердый нитрит аммония разлагается при нагревании:
Получение азота В промышленности азот получают фракционированием (ректификацией) жидкого воздуха. В лабораторных условиях азот получают: 1. термическим разложением азида лития или натрия: 2. нагреванием смеси растворов нитрата натрия и хлорида аммония: 3. разложением азотсодержащих соединений. Например, твердый нитрит аммония разлагается при нагревании:
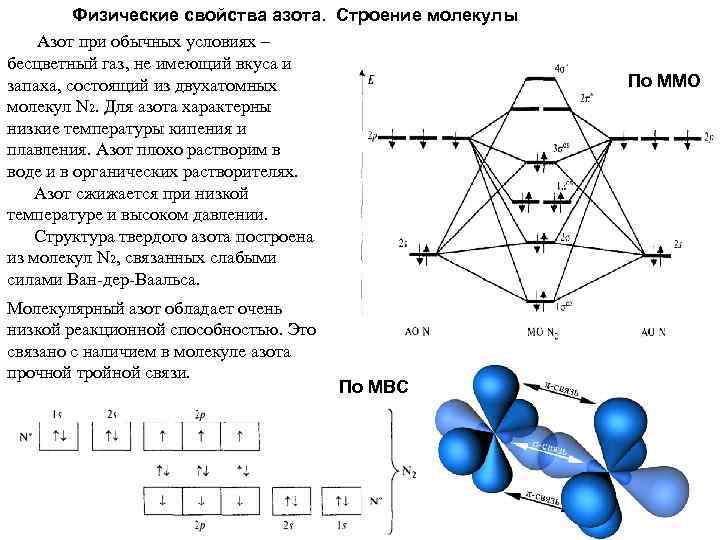 Физические свойства азота. Строение молекулы Азот при обычных условиях – бесцветный газ, не имеющий вкуса и запаха, состоящий из двухатомных молекул N 2. Для азота характерны низкие температуры кипения и плавления. Азот плохо растворим в воде и в органических растворителях. Азот сжижается при низкой температуре и высоком давлении. Структура твердого азота построена из молекул N 2, связанных слабыми силами Ван-дер-Ваальса. Молекулярный азот обладает очень низкой реакционной способностью. Это связано с наличием в молекуле азота прочной тройной связи. По МВС По ММО
Физические свойства азота. Строение молекулы Азот при обычных условиях – бесцветный газ, не имеющий вкуса и запаха, состоящий из двухатомных молекул N 2. Для азота характерны низкие температуры кипения и плавления. Азот плохо растворим в воде и в органических растворителях. Азот сжижается при низкой температуре и высоком давлении. Структура твердого азота построена из молекул N 2, связанных слабыми силами Ван-дер-Ваальса. Молекулярный азот обладает очень низкой реакционной способностью. Это связано с наличием в молекуле азота прочной тройной связи. По МВС По ММО
 Модификации фосфора, их свойства и получение Белый фосфор химически очень активен, что объясняется неустойчивостью тетраэдрической структуры, в которой углы Р-Р-Р составляют 60°, т. е. они существенно меньше, чем углы между р-орбиталями (90°), за счет перекрывания которых образованы связи. Белый фосфор загорается на воздухе, светится в темноте (выделяется энергия при медленном окислении), реагирует с галогенами, серой, металлами:
Модификации фосфора, их свойства и получение Белый фосфор химически очень активен, что объясняется неустойчивостью тетраэдрической структуры, в которой углы Р-Р-Р составляют 60°, т. е. они существенно меньше, чем углы между р-орбиталями (90°), за счет перекрывания которых образованы связи. Белый фосфор загорается на воздухе, светится в темноте (выделяется энергия при медленном окислении), реагирует с галогенами, серой, металлами:
 Красный фосфор имеет вид пластинчатых кристаллов красно-фиолетового цвета.
Красный фосфор имеет вид пластинчатых кристаллов красно-фиолетового цвета.

 Химические свойства азота Азот – инертное вещество при обычных условиях. Только при высоких температурах азот вступает в химические реакции. 1. При комнатной температуре азот реагирует с литием, с образованием нитрида лития: 2. С металлами азот реагирует при нагревании. При этом он проявляет свойства окислителя: 3. Азот как восстановитель реагирует с кислородом (в электрическом разряде) и фтором (при высоких температурах): 4. Азот реагирует с водородом. Данная реакция протекает при повышенных значениях температуры (400 ºС) и давления 200 атм, а также в присутствии катализатора (Fe): С серой и галогенами азот не взаимодействует.
Химические свойства азота Азот – инертное вещество при обычных условиях. Только при высоких температурах азот вступает в химические реакции. 1. При комнатной температуре азот реагирует с литием, с образованием нитрида лития: 2. С металлами азот реагирует при нагревании. При этом он проявляет свойства окислителя: 3. Азот как восстановитель реагирует с кислородом (в электрическом разряде) и фтором (при высоких температурах): 4. Азот реагирует с водородом. Данная реакция протекает при повышенных значениях температуры (400 ºС) и давления 200 атм, а также в присутствии катализатора (Fe): С серой и галогенами азот не взаимодействует.
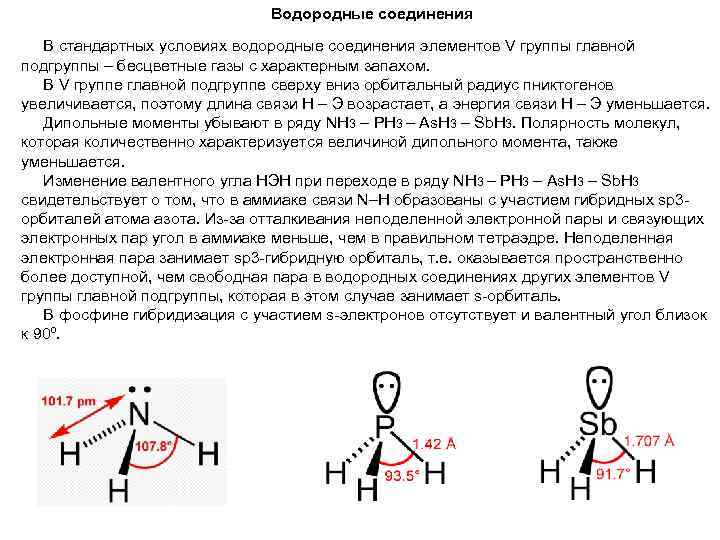 Водородные соединения В стандартных условиях водородные соединения элементов V группы главной подгруппы – бесцветные газы с характерным запахом. В V группе главной подгруппе сверху вниз орбитальный радиус пниктогенов увеличивается, поэтому длина связи Н – Э возрастает, а энергия связи Н – Э уменьшается. Дипольные моменты убывают в ряду NH 3 – PH 3 – As. H 3 – Sb. H 3. Полярность молекул, которая количественно характеризуется величиной дипольного момента, также уменьшается. Изменение валентного угла НЭН при переходе в ряду NH 3 – PH 3 – As. H 3 – Sb. H 3 свидетельствует о том, что в аммиаке связи N–H образованы с участием гибридных sp 3 орбиталей атома азота. Из-за отталкивания неподеленной электронной пары и связующих электронных пар угол в аммиаке меньше, чем в правильном тетраэдре. Неподеленная электронная пара занимает sp 3 -гибридную орбиталь, т. е. оказывается пространственно более доступной, чем свободная пара в водородных соединениях других элементов V группы главной подгруппы, которая в этом случае занимает s-орбиталь. В фосфине гибридизация с участием s-электронов отсутствует и валентный угол близок к 90º.
Водородные соединения В стандартных условиях водородные соединения элементов V группы главной подгруппы – бесцветные газы с характерным запахом. В V группе главной подгруппе сверху вниз орбитальный радиус пниктогенов увеличивается, поэтому длина связи Н – Э возрастает, а энергия связи Н – Э уменьшается. Дипольные моменты убывают в ряду NH 3 – PH 3 – As. H 3 – Sb. H 3. Полярность молекул, которая количественно характеризуется величиной дипольного момента, также уменьшается. Изменение валентного угла НЭН при переходе в ряду NH 3 – PH 3 – As. H 3 – Sb. H 3 свидетельствует о том, что в аммиаке связи N–H образованы с участием гибридных sp 3 орбиталей атома азота. Из-за отталкивания неподеленной электронной пары и связующих электронных пар угол в аммиаке меньше, чем в правильном тетраэдре. Неподеленная электронная пара занимает sp 3 -гибридную орбиталь, т. е. оказывается пространственно более доступной, чем свободная пара в водородных соединениях других элементов V группы главной подгруппы, которая в этом случае занимает s-орбиталь. В фосфине гибридизация с участием s-электронов отсутствует и валентный угол близок к 90º.
 Водородные соединения элементов V группы главной подгруппы проявляют свойства восстановителей. В ряду NH 3 – PH 3 – As. H 3 – Sb. H 3 энергия ионизации атома пниктогена уменьшается, восстановительная способность увеличивается. Аммиак – бесцветный газ с резким запахом. Токсичен. Аммиак хорошо растворим в воде (при 0 ºС один объем воды растворяет до 1200 объемов аммиака). Хорошая растворимость аммиака объясняется образованием водородной связи между молекулами аммиака и воды и гидратов NH 3 × n. H 2 O различного состава. В промышленности аммиак получают синтезом из простых веществ: Равновесие данной реакции при повышении давления и понижении температуры смещается вправо. Несмотря на то, что реакция экзотермическая, для увеличения скорости реакции ее проводят при температуре 400 – 500 ºС. Давление в колонне синтеза до 300 атм (для увеличения выхода). Катализатором является губчатое железо с добавками оксидов калия, кальция, магния, алюминия и кремния, которые улучшают его механические свойства и увеличивают срок действия. В лаборатории небольшое количество аммиака получают при нагревании смеси твердых хлорида аммония и гашеной извести или при гидролизе нитридов металлов:
Водородные соединения элементов V группы главной подгруппы проявляют свойства восстановителей. В ряду NH 3 – PH 3 – As. H 3 – Sb. H 3 энергия ионизации атома пниктогена уменьшается, восстановительная способность увеличивается. Аммиак – бесцветный газ с резким запахом. Токсичен. Аммиак хорошо растворим в воде (при 0 ºС один объем воды растворяет до 1200 объемов аммиака). Хорошая растворимость аммиака объясняется образованием водородной связи между молекулами аммиака и воды и гидратов NH 3 × n. H 2 O различного состава. В промышленности аммиак получают синтезом из простых веществ: Равновесие данной реакции при повышении давления и понижении температуры смещается вправо. Несмотря на то, что реакция экзотермическая, для увеличения скорости реакции ее проводят при температуре 400 – 500 ºС. Давление в колонне синтеза до 300 атм (для увеличения выхода). Катализатором является губчатое железо с добавками оксидов калия, кальция, магния, алюминия и кремния, которые улучшают его механические свойства и увеличивают срок действия. В лаборатории небольшое количество аммиака получают при нагревании смеси твердых хлорида аммония и гашеной извести или при гидролизе нитридов металлов:
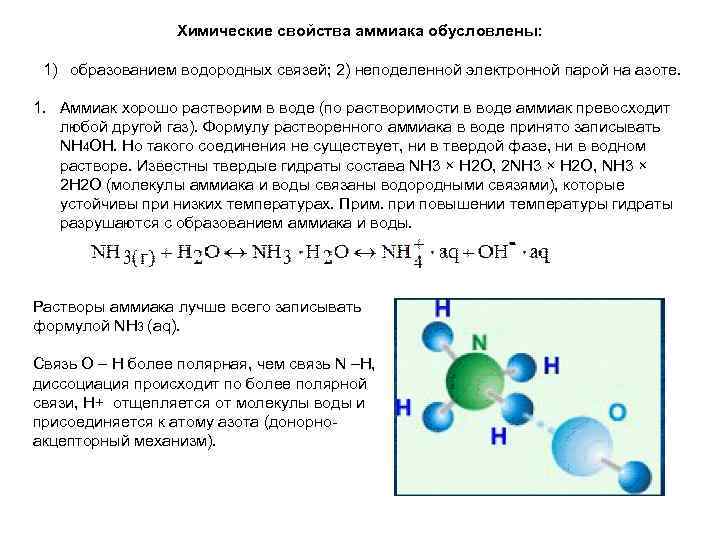 Химические свойства аммиака обусловлены: 1) образованием водородных связей; 2) неподеленной электронной парой на азоте. 1. Аммиак хорошо растворим в воде (по растворимости в воде аммиак превосходит любой другой газ). Формулу растворенного аммиака в воде принято записывать NH 4 OH. Но такого соединения не существует, ни в твердой фазе, ни в водном растворе. Известны твердые гидраты состава NH 3 × Н 2 О, 2 NH 3 × Н 2 О, NH 3 × 2 Н 2 О (молекулы аммиака и воды связаны водородными связями), которые устойчивы при низких температурах. Прим. при повышении температуры гидраты разрушаются с образованием аммиака и воды. Растворы аммиака лучше всего записывать формулой NH 3 (aq). Связь О – Н более полярная, чем связь N –Н, диссоциация происходит по более полярной связи, Н+ отщепляется от молекулы воды и присоединяется к атому азота (донорноакцепторный механизм).
Химические свойства аммиака обусловлены: 1) образованием водородных связей; 2) неподеленной электронной парой на азоте. 1. Аммиак хорошо растворим в воде (по растворимости в воде аммиак превосходит любой другой газ). Формулу растворенного аммиака в воде принято записывать NH 4 OH. Но такого соединения не существует, ни в твердой фазе, ни в водном растворе. Известны твердые гидраты состава NH 3 × Н 2 О, 2 NH 3 × Н 2 О, NH 3 × 2 Н 2 О (молекулы аммиака и воды связаны водородными связями), которые устойчивы при низких температурах. Прим. при повышении температуры гидраты разрушаются с образованием аммиака и воды. Растворы аммиака лучше всего записывать формулой NH 3 (aq). Связь О – Н более полярная, чем связь N –Н, диссоциация происходит по более полярной связи, Н+ отщепляется от молекулы воды и присоединяется к атому азота (донорноакцепторный механизм).
 Вследствие полярности молекул и высокой диэлектрической проницаемости жидкий аммиак является хорошим неводным растворителем. В неводном растворе аммиак может подвергаться автопротолизу: Но собственная диссоциация жидкого аммиака очень мала и ионное произведение аммиака составляет 2, 2 × 10 - 33 при – 50 ºС. Водные растворы аммиака проявляют свойства слабого основания вследствие донорной активности атома азота в NH 3. Аммиак реагирует с кислотами, с образованием солей аммония: Аммиак может образовывать комплексные соединения – аммиакаты: В жидком аммиаке растворяются активные металлы – щелочные и щелочноземельные, магний, алюминий. Щелочные металлы реагируют с жидким аммиаком с образованием амида (в присутствии катализатора – платины): В данной реакции аммиак проявляет свойства окислителя за счет атома водорода.
Вследствие полярности молекул и высокой диэлектрической проницаемости жидкий аммиак является хорошим неводным растворителем. В неводном растворе аммиак может подвергаться автопротолизу: Но собственная диссоциация жидкого аммиака очень мала и ионное произведение аммиака составляет 2, 2 × 10 - 33 при – 50 ºС. Водные растворы аммиака проявляют свойства слабого основания вследствие донорной активности атома азота в NH 3. Аммиак реагирует с кислотами, с образованием солей аммония: Аммиак может образовывать комплексные соединения – аммиакаты: В жидком аммиаке растворяются активные металлы – щелочные и щелочноземельные, магний, алюминий. Щелочные металлы реагируют с жидким аммиаком с образованием амида (в присутствии катализатора – платины): В данной реакции аммиак проявляет свойства окислителя за счет атома водорода.
 Другие металлы при взаимодействии с газообразным аммиаком образуют нитриды: Аммиак проявляет восстановительные свойства (за счет атома азота в минимальной степени окисления). На воздухе аммиак не горит, но в атмосфере кислорода сгорает с образованием азота и водяных паров: Может происходить каталитическое окисление аммиака: Применение аммиака Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений – жидкого аммиака и его водных растворов, нитрата аммония, сульфата аммония и др. Водный раствор аммиака – важный реактив для проведения различных реакций. Жидкий аммиак как растворитель широко применяется для проведения различных синтезов.
Другие металлы при взаимодействии с газообразным аммиаком образуют нитриды: Аммиак проявляет восстановительные свойства (за счет атома азота в минимальной степени окисления). На воздухе аммиак не горит, но в атмосфере кислорода сгорает с образованием азота и водяных паров: Может происходить каталитическое окисление аммиака: Применение аммиака Основная масса производимого аммиака используется для получения азотной кислоты и азотистых удобрений – жидкого аммиака и его водных растворов, нитрата аммония, сульфата аммония и др. Водный раствор аммиака – важный реактив для проведения различных реакций. Жидкий аммиак как растворитель широко применяется для проведения различных синтезов.
 Соли аммония – это кристаллические вещества белого цвета. Образуют ионную кристаллическую решетку. Соли аммония в водных растворах подвергаются гидролизу по катиону: Соли аммония термически неустойчивы. Природа продуктов термического разложения солей аммония определяется природой аниона: 1. Соли летучих кислот при нагревании разлагаются с выделением газообразных продуктов, одним из которых является аммиак: 2. Соли нелетучих кислот (сульфаты, фосфаты, силикаты и др. ) при нагревании разлагаются с выделением аммиака и образованием кислоты: 3. Соли, в которых анион является сильным окислителем. При нагревании происходит окислительно-восстановительная реакция (реакция внутримолекулярного окисления и восстановления):
Соли аммония – это кристаллические вещества белого цвета. Образуют ионную кристаллическую решетку. Соли аммония в водных растворах подвергаются гидролизу по катиону: Соли аммония термически неустойчивы. Природа продуктов термического разложения солей аммония определяется природой аниона: 1. Соли летучих кислот при нагревании разлагаются с выделением газообразных продуктов, одним из которых является аммиак: 2. Соли нелетучих кислот (сульфаты, фосфаты, силикаты и др. ) при нагревании разлагаются с выделением аммиака и образованием кислоты: 3. Соли, в которых анион является сильным окислителем. При нагревании происходит окислительно-восстановительная реакция (реакция внутримолекулярного окисления и восстановления):
 Другие соединения азота со степенью окисления – 3 (нитриды) При высоких температурах азот окисляет многие металлы и неметаллы. При этом образуются нитриды. Например: Нитриды подразделяют на следующие группы: 1. Нитриды активных металлов. Преимущественно данную группу составляют нитриды sэлементов I и II групп. Например: Li 3 N, Mg 3 N 2. Это твердые, кристаллические вещества белого цвета. Это вещества с химической связью близкой к ионной. Химически активные вещества. Например, разлагаются водой, образуя при этом щелочь и аммиак: 2. Нитриды неметаллов. Например, Si 3 N 4, S 4 N 4, P 3 N 5 – это вещества с ковалентной малополярной связью. Атомная кристаллическая решетка. Это твердые вещества с высокими температурами плавления и кипения (2000 – 3000 ºС). Устойчивы к действию кислот и воды при комнатной температуре. 3. Нитриды d-элементов. Это кристаллические вещества переменного состава (нестехиометрические соединения), чаще всего встречаются нитриды типа Me. N (Ti. N, VN, Cr. N) и Me 2 N (Nb 2 N, Cr 2 N, Fe 2 N). Азот с металлами образует соединения внедрения, проникает в кристаллическую решетку между атомами металла и образует ковалентные связи Me – N. При малом числе таких связей сохраняется металлическая связь и физические свойства металла. Нитриды данной группы обладают высокой твердостью и тугоплавкостью, которая иногда превышает тугоплавкость исходного металла. Большинство нитридов d-элементов химически очень инертны, поэтому они не разрушаются растворами кислот, расплавленными металлами, устойчивы против окисления на воздухе.
Другие соединения азота со степенью окисления – 3 (нитриды) При высоких температурах азот окисляет многие металлы и неметаллы. При этом образуются нитриды. Например: Нитриды подразделяют на следующие группы: 1. Нитриды активных металлов. Преимущественно данную группу составляют нитриды sэлементов I и II групп. Например: Li 3 N, Mg 3 N 2. Это твердые, кристаллические вещества белого цвета. Это вещества с химической связью близкой к ионной. Химически активные вещества. Например, разлагаются водой, образуя при этом щелочь и аммиак: 2. Нитриды неметаллов. Например, Si 3 N 4, S 4 N 4, P 3 N 5 – это вещества с ковалентной малополярной связью. Атомная кристаллическая решетка. Это твердые вещества с высокими температурами плавления и кипения (2000 – 3000 ºС). Устойчивы к действию кислот и воды при комнатной температуре. 3. Нитриды d-элементов. Это кристаллические вещества переменного состава (нестехиометрические соединения), чаще всего встречаются нитриды типа Me. N (Ti. N, VN, Cr. N) и Me 2 N (Nb 2 N, Cr 2 N, Fe 2 N). Азот с металлами образует соединения внедрения, проникает в кристаллическую решетку между атомами металла и образует ковалентные связи Me – N. При малом числе таких связей сохраняется металлическая связь и физические свойства металла. Нитриды данной группы обладают высокой твердостью и тугоплавкостью, которая иногда превышает тугоплавкость исходного металла. Большинство нитридов d-элементов химически очень инертны, поэтому они не разрушаются растворами кислот, расплавленными металлами, устойчивы против окисления на воздухе.
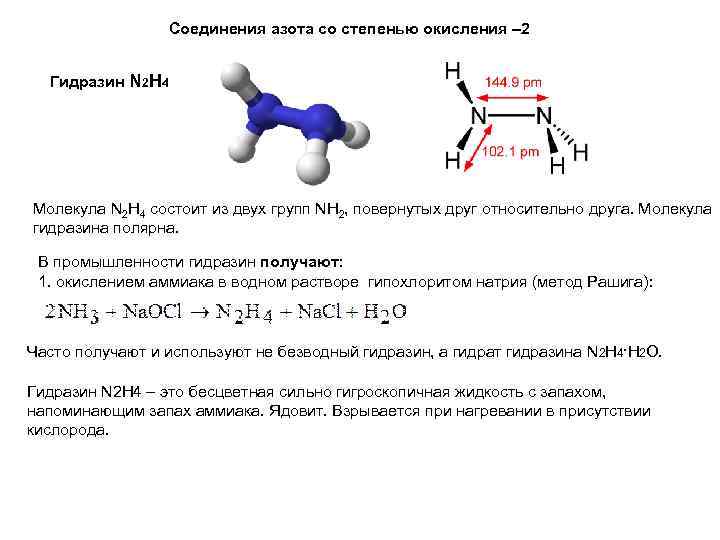 Соединения азота со степенью окисления – 2 Гидразин N 2 H 4 Молекула N 2 H 4 состоит из двух групп NH 2, повернутых друг относительно друга. Молекула гидразина полярна. В промышленности гидразин получают: 1. окислением аммиака в водном растворе гипохлоритом натрия (метод Рашига): Часто получают и используют не безводный гидразин, а гидрат гидразина N 2 H 4·H 2 O. Гидразин N 2 H 4 – это бесцветная сильно гигроскопичная жидкость с запахом, напоминающим запах аммиака. Ядовит. Взрывается при нагревании в присутствии кислорода.
Соединения азота со степенью окисления – 2 Гидразин N 2 H 4 Молекула N 2 H 4 состоит из двух групп NH 2, повернутых друг относительно друга. Молекула гидразина полярна. В промышленности гидразин получают: 1. окислением аммиака в водном растворе гипохлоритом натрия (метод Рашига): Часто получают и используют не безводный гидразин, а гидрат гидразина N 2 H 4·H 2 O. Гидразин N 2 H 4 – это бесцветная сильно гигроскопичная жидкость с запахом, напоминающим запах аммиака. Ядовит. Взрывается при нагревании в присутствии кислорода.
 1. Гидразин проявляет основные свойства, как и аммиак, но является более слабым основанием (т. к. только 2 атома Н смещают эл. плотность к азоту, а не 3 как в аммиаке): Гидразин образует два ряда солей гидразония, например 2. Гидразин и соли гидразония – сильные восстановители. В растворах гидразин, как правило, окисляется до N 2. Например: 3. На воздухе гидразин горит с выделением большого количества теплоты: 4. Гидразин в реакциях с сильными восстановителями может проявлять окислительные свойства: Применение: большая теплота, выделяющаяся при сгорании гидразина, позволяет использовать его в качестве ракетного топлива. В микроконцентрациях гидразин ингибирует коррозию железа, поэтому его добавляют в систему водоохлаждения. Производные гидразина используют при производстве гербицидов и лекарственных препаратов.
1. Гидразин проявляет основные свойства, как и аммиак, но является более слабым основанием (т. к. только 2 атома Н смещают эл. плотность к азоту, а не 3 как в аммиаке): Гидразин образует два ряда солей гидразония, например 2. Гидразин и соли гидразония – сильные восстановители. В растворах гидразин, как правило, окисляется до N 2. Например: 3. На воздухе гидразин горит с выделением большого количества теплоты: 4. Гидразин в реакциях с сильными восстановителями может проявлять окислительные свойства: Применение: большая теплота, выделяющаяся при сгорании гидразина, позволяет использовать его в качестве ракетного топлива. В микроконцентрациях гидразин ингибирует коррозию железа, поэтому его добавляют в систему водоохлаждения. Производные гидразина используют при производстве гербицидов и лекарственных препаратов.
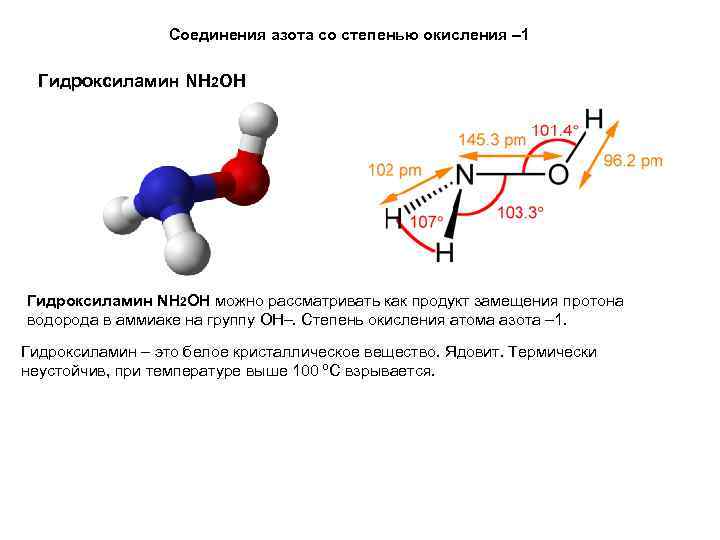 Соединения азота со степенью окисления – 1 Гидроксиламин NH 2 OH можно рассматривать как продукт замещения протона водорода в аммиаке на группу ОН–. Степень окисления атома азота – 1. Гидроксиламин – это белое кристаллическое вещество. Ядовит. Термически неустойчив, при температуре выше 100 ºС взрывается.
Соединения азота со степенью окисления – 1 Гидроксиламин NH 2 OH можно рассматривать как продукт замещения протона водорода в аммиаке на группу ОН–. Степень окисления атома азота – 1. Гидроксиламин – это белое кристаллическое вещество. Ядовит. Термически неустойчив, при температуре выше 100 ºС взрывается.


 Азотистоводородная кислота и азиды
Азотистоводородная кислота и азиды

 Водородные соединения фосфора. Фосфин и соли фосфония Фосфин PH 3 – бесцветный газ с неприятным запахом, сильный яд.
Водородные соединения фосфора. Фосфин и соли фосфония Фосфин PH 3 – бесцветный газ с неприятным запахом, сильный яд.




