Презентация.ppt
- Количество слайдов: 42

Научно-образовательный семинар Основы науки о коррозии и современные способы защиты материалов

Тема 1. Коррозионная болезнь металлов, приводящая к колоссальным экономическим затратам и катастрофическим последствиям
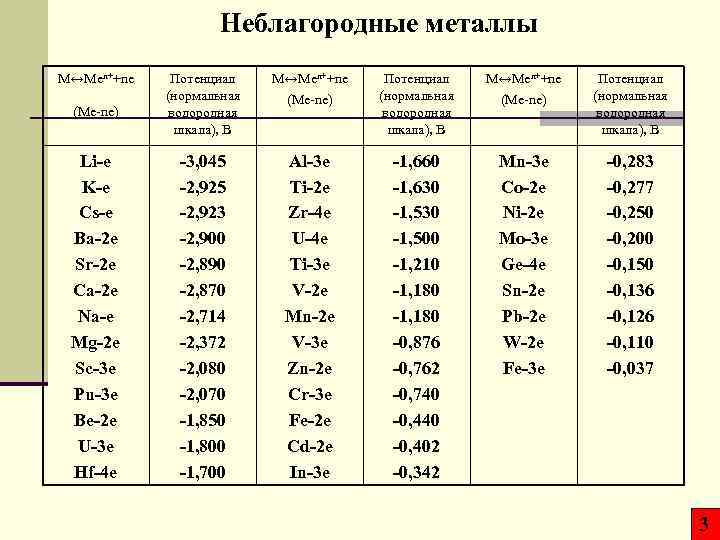
Неблагородные металлы M↔Men++ne (Me-ne) Li-e K-e Cs-e Ba-2 e Sr-2 e Ca-2 e Na-e Mg-2 e Sc-3 e Pu-3 e Be-2 e U-3 e Hf-4 e Потенциал (нормальная водородная шкала), В M↔Men++ne (Me-ne) Потенциал (нормальная водородная шкала), В -3, 045 -2, 923 -2, 900 -2, 890 -2, 870 -2, 714 -2, 372 -2, 080 -2, 070 -1, 850 -1, 800 -1, 700 Al-3 e Ti-2 e Zr-4 e U-4 e Ti-3 e V-2 e Mn-2 e V-3 e Zn-2 e Cr-3 e Fe-2 e Cd-2 e In-3 e -1, 660 -1, 630 -1, 500 -1, 210 -1, 180 -0, 876 -0, 762 -0, 740 -0, 402 -0, 342 Mn-3 e Co-2 e Ni-2 e Mo-3 e Ge-4 e Sn-2 e Pb-2 e W-2 e Fe-3 e -0, 283 -0, 277 -0, 250 -0, 200 -0, 150 -0, 136 -0, 126 -0, 110 -0, 037 3
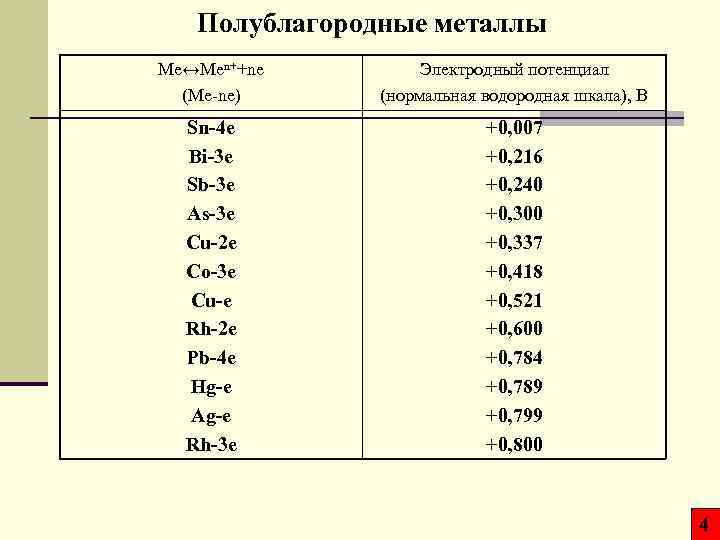
Полублагородные металлы Mе↔Men++ne (Me-ne) Электродный потенциал (нормальная водородная шкала), В Sn-4 e Bi-3 e Sb-3 e As-3 e Cu-2 e Co-3 e Cu-e Rh-2 e Pb-4 e Hg-e Ag-e Rh-3 e +0, 007 +0, 216 +0, 240 +0, 300 +0, 337 +0, 418 +0, 521 +0, 600 +0, 784 +0, 789 +0, 799 +0, 800 4
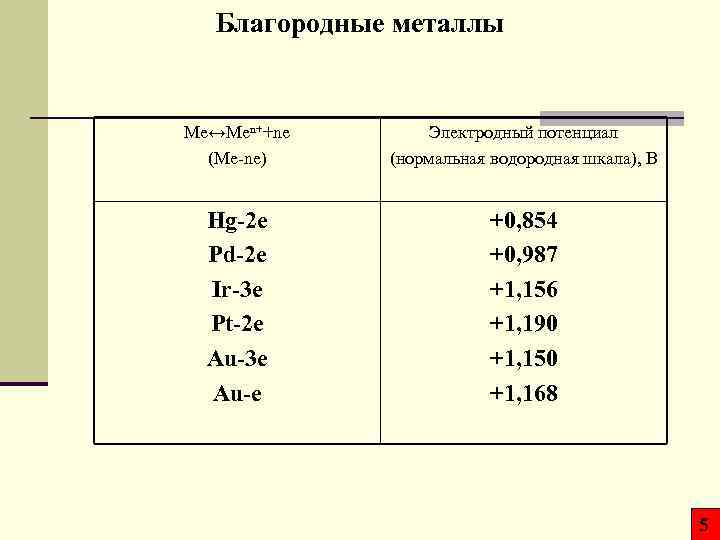
Благородные металлы Mе↔Men++ne (Me-ne) Электродный потенциал (нормальная водородная шкала), В Hg-2 e Pd-2 e Ir-3 e Pt-2 e Au-3 e Au-e +0, 854 +0, 987 +1, 156 +1, 190 +1, 150 +1, 168 5
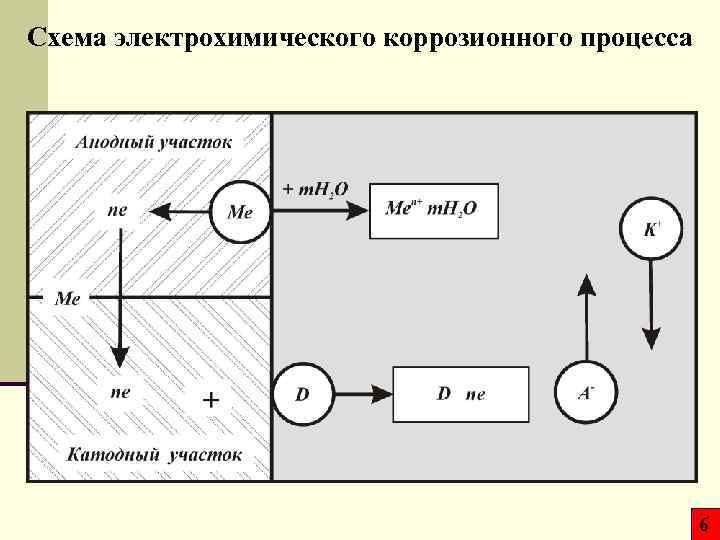
Схема электрохимического коррозионного процесса 6
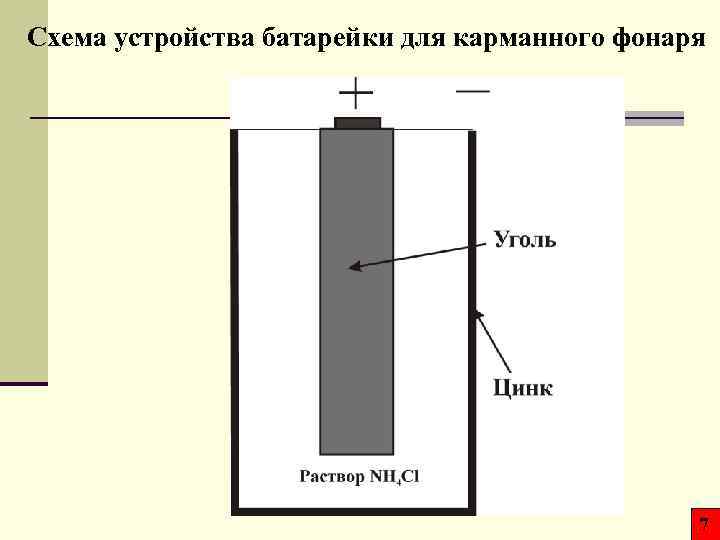
Схема устройства батарейки для карманного фонаря 7
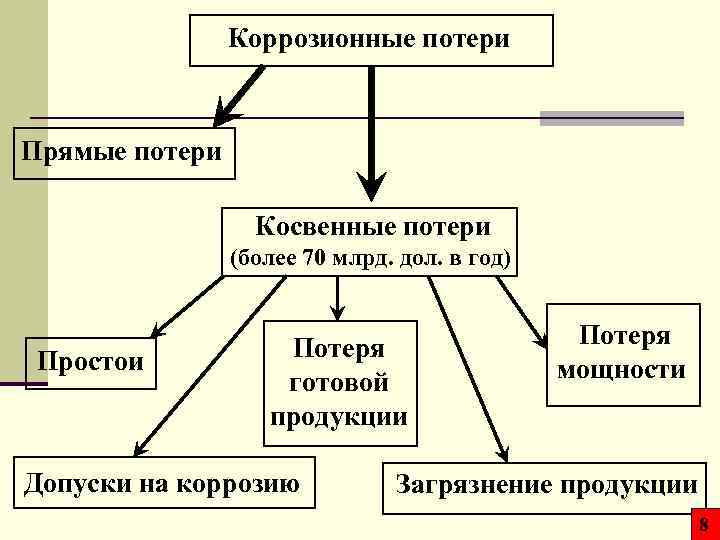
Коррозионные потери Прямые потери Косвенные потери (более 70 млрд. дол. в год) Простои Потеря готовой продукции Допуски на коррозию Потеря мощности Загрязнение продукции 8
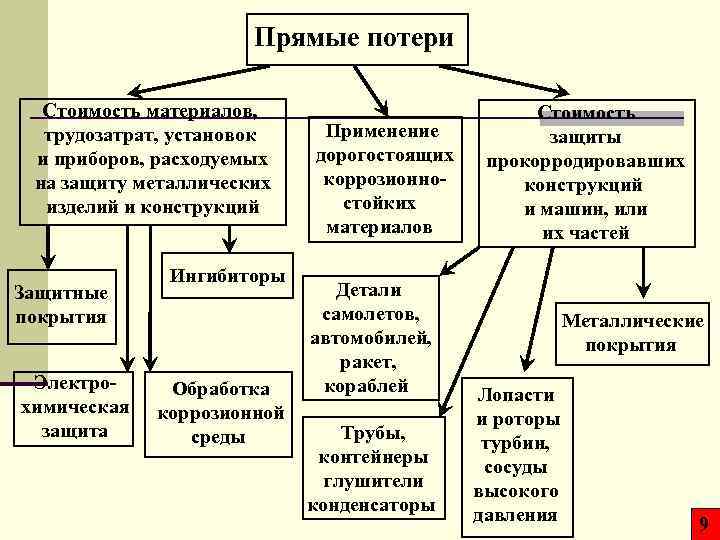
Прямые потери Стоимость материалов, трудозатрат, установок и приборов, расходуемых на защиту металлических изделий и конструкций Защитные покрытия Электрохимическая защита Ингибиторы Обработка коррозионной среды Применение дорогостоящих коррозионностойких материалов Детали самолетов, автомобилей, ракет, кораблей Трубы, контейнеры глушители конденсаторы Стоимость защиты прокорродировавших конструкций и машин, или их частей Металлические покрытия Лопасти и роторы турбин, сосуды высокого давления 9

Тема 2. «Чудеса!» Железные конструкции не ржавеют, а пористые металлические покрытия приводят к их ускоренному разрушению 10

Индийская железная колонна (г. Дели) 11

Эйфелева башня (г. Париж) 12
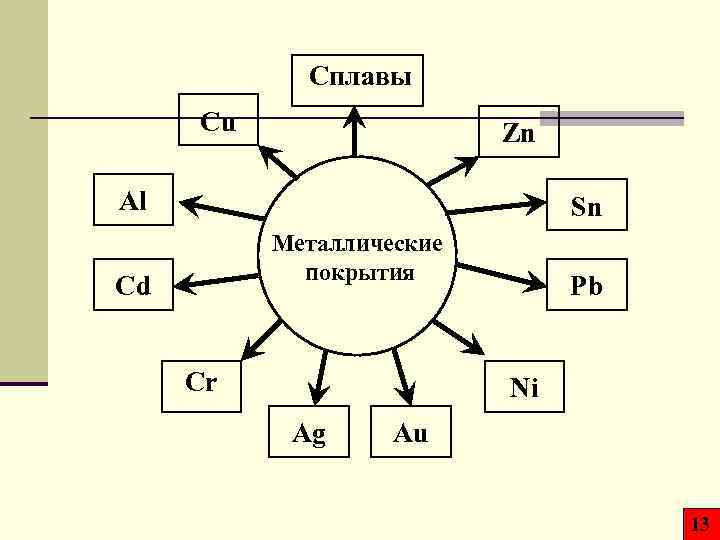
Сплавы Cu Zn Al Sn Металлические покрытия Cd Cr Pb Ni Ag Au 13
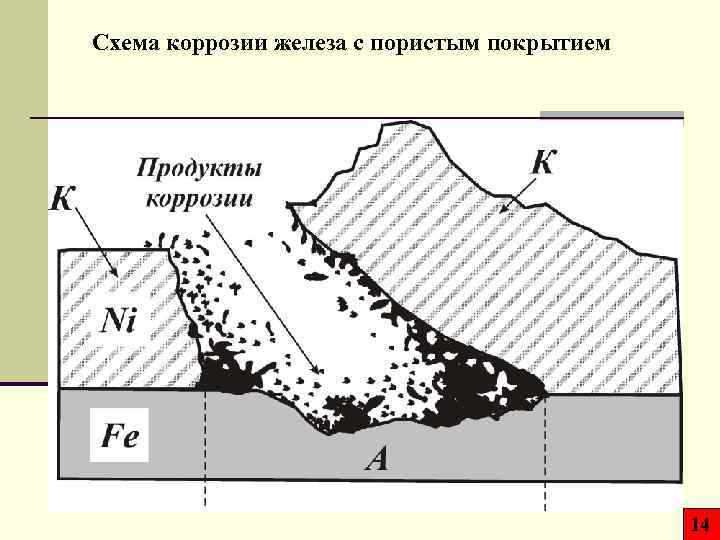
Схема коррозии железа с пористым покрытием 14

Металлические покрытия Цинкование Хромирование Серебрение и золочение 15

Тема 3. Панцири толщиной в несколько нанометров или пассивность металлов 16
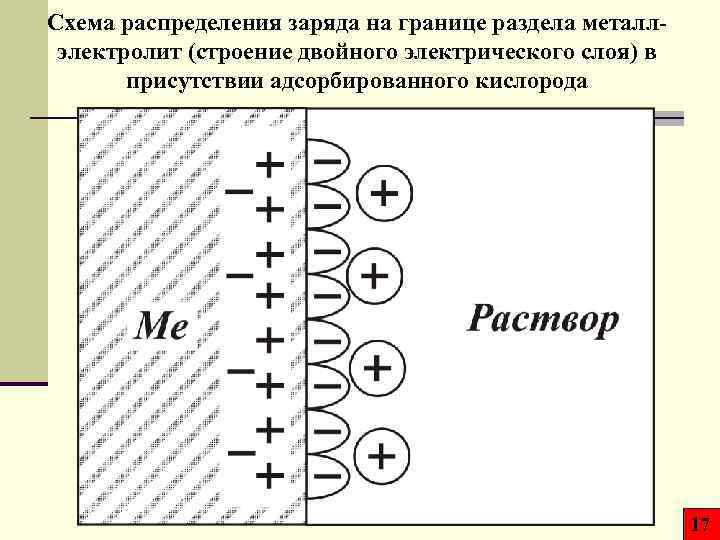
Схема распределения заряда на границе раздела металлэлектролит (строение двойного электрического слоя) в присутствии адсорбированного кислорода 17
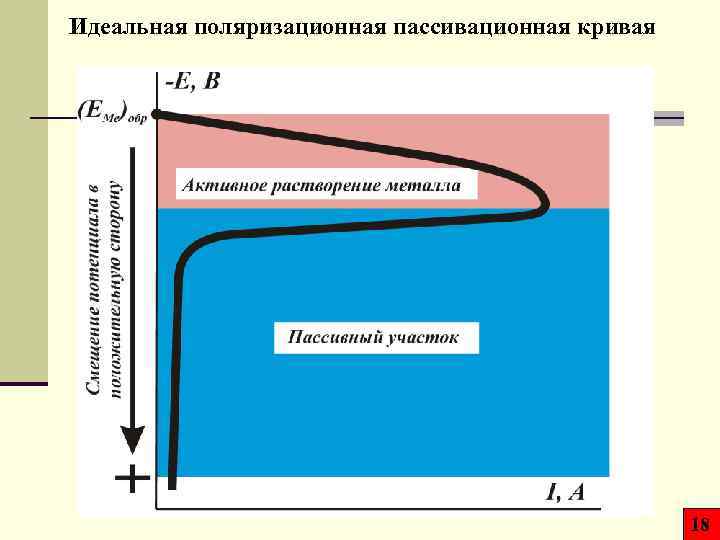
Идеальная поляризационная пассивационная кривая 18
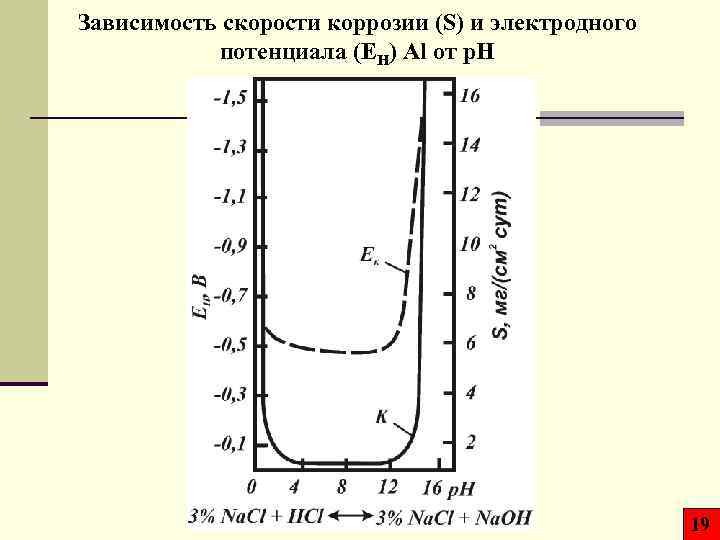
Зависимость скорости коррозии (S) и электродного потенциала (EH) Al от p. H 19
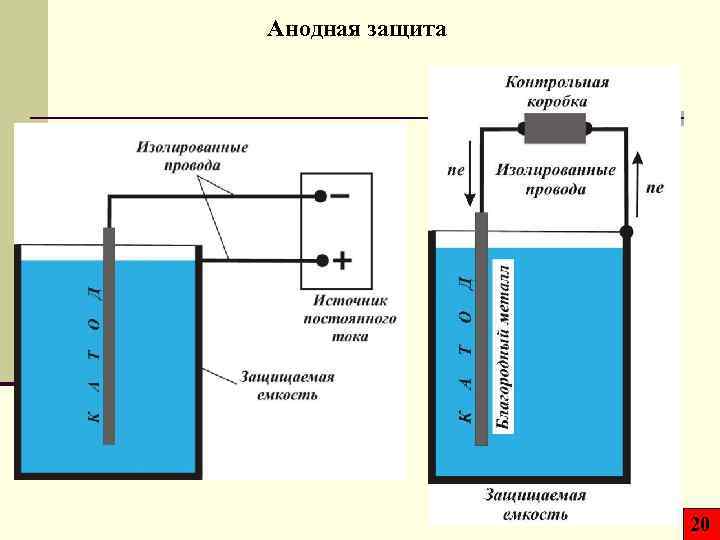
Анодная защита 20
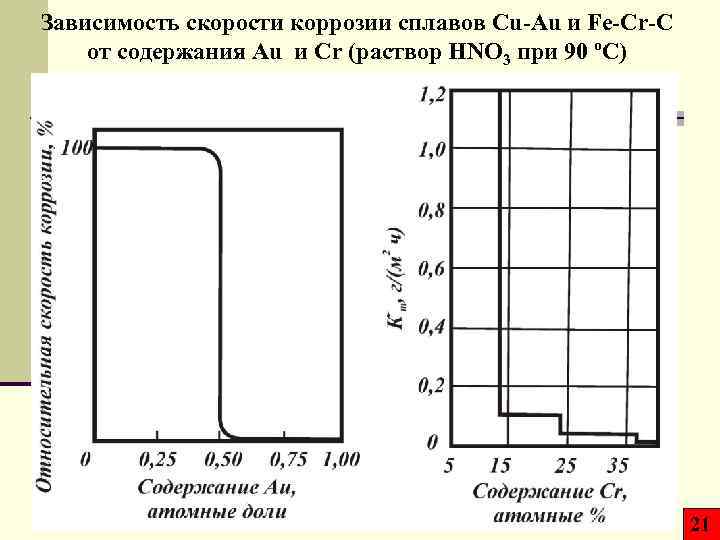
Зависимость скорости коррозии сплавов Cu-Au и Fe-Cr-C от содержания Au и Cr (раствор HNO 3 при 90 ºС) 21
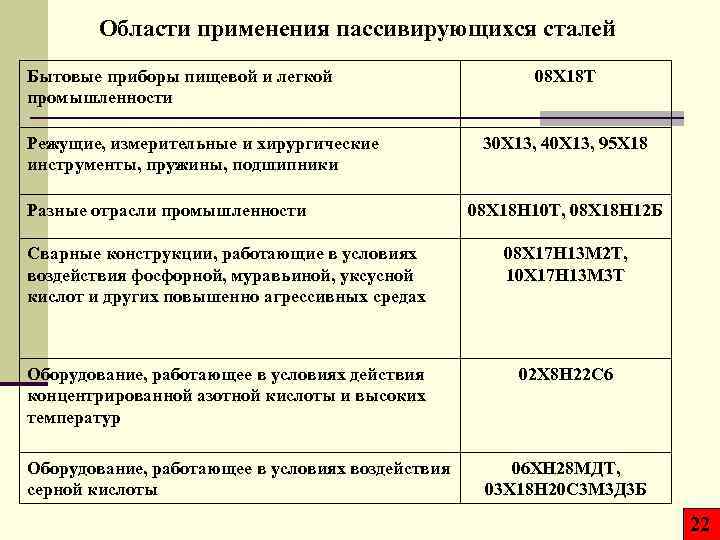
Области применения пассивирующихся сталей Бытовые приборы пищевой и легкой промышленности Режущие, измерительные и хирургические инструменты, пружины, подшипники Разные отрасли промышленности 08 Х 18 Т 30 Х 13, 40 Х 13, 95 Х 18 08 Х 18 Н 10 Т, 08 Х 18 Н 12 Б Сварные конструкции, работающие в условиях воздействия фосфорной, муравьиной, уксусной кислот и других повышенно агрессивных средах 08 Х 17 Н 13 М 2 Т, 10 Х 17 Н 13 М 3 Т Оборудование, работающее в условиях действия концентрированной азотной кислоты и высоких температур 02 Х 8 Н 22 С 6 Оборудование, работающее в условиях воздействия серной кислоты 06 ХН 28 МДТ, 03 Х 18 Н 20 С 3 М 3 Д 3 Б 22

Рабочий и колхозница 23

Тема 4. Большая четверка – сверхтугоплавкие металлы и их защита от газовой коррозии 24
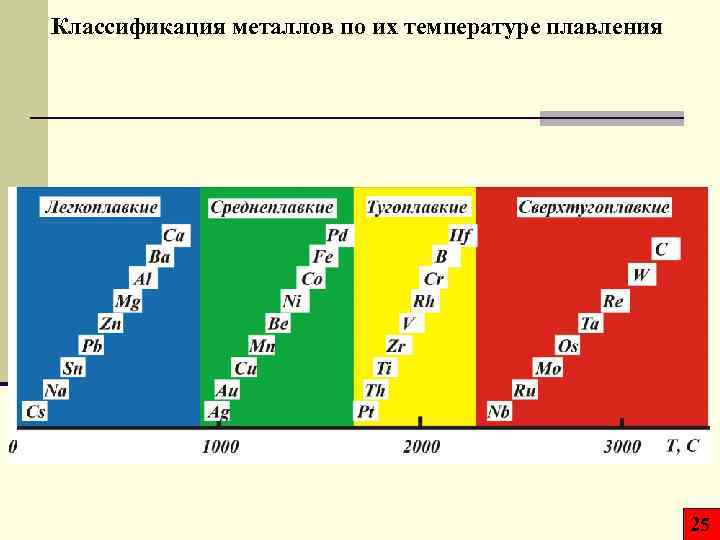
Классификация металлов по их температуре плавления 25
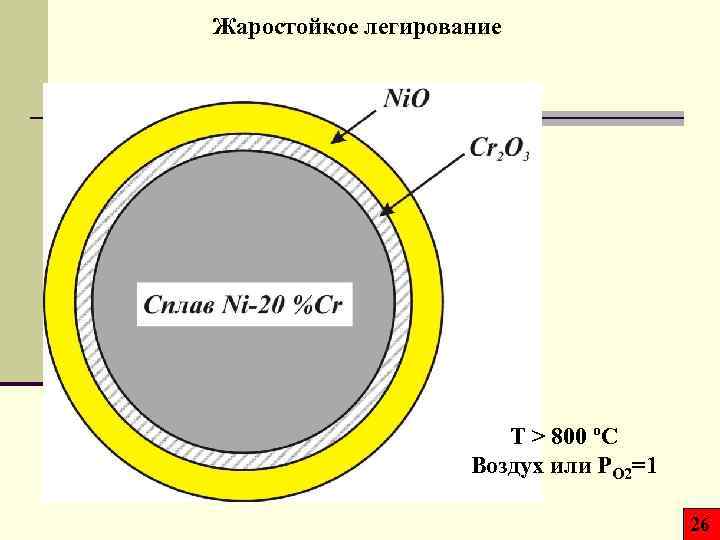
Жаростойкое легирование T > 800 ºC Воздух или PO 2=1 26

Реакции высокотемпературного окисления Mo. Si 2, WSi 2 2 Mo. Si 2(т) + 7 O 2(г) → 2 Mo. O 3(г) + 4 Si. O 2(т) 2 WSi 2(т) + 7 O 2(г) → 2 WO 3(г) + 4 Si. O 2(т) Когда пленка из Si. O 2 полностью закроет всю поверхность изделия (Mo. O 3, WO 3 – летучие оксиды при высоких температурах), то благодаря низкой ее проницаемости реакция окисления дисилицидов идет по уравнениям: 5 Mo. Si 2 + 7 O 2 → Mo 5 Si 3 + 7 Si. O 2 5 WSi 2 + 7 O 2 → W 5 Si 3 + 7 Si. O 2 что приводит к утолщению «брони» из Si. O. 27
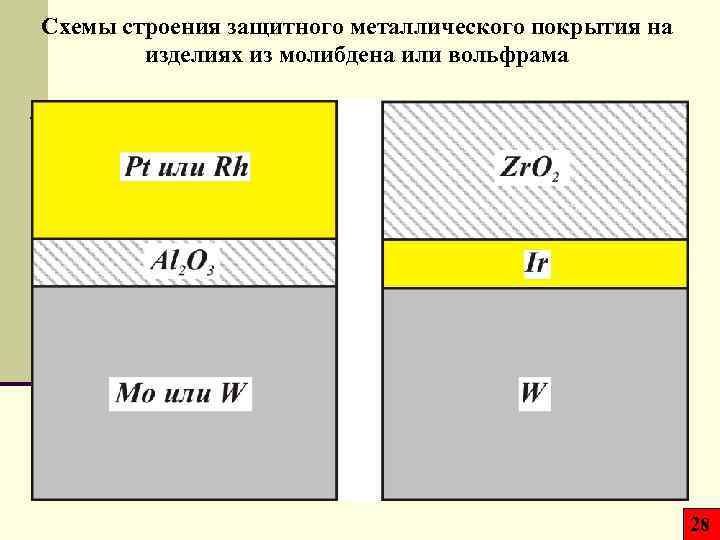
Схемы строения защитного металлического покрытия на изделиях из молибдена или вольфрама 28
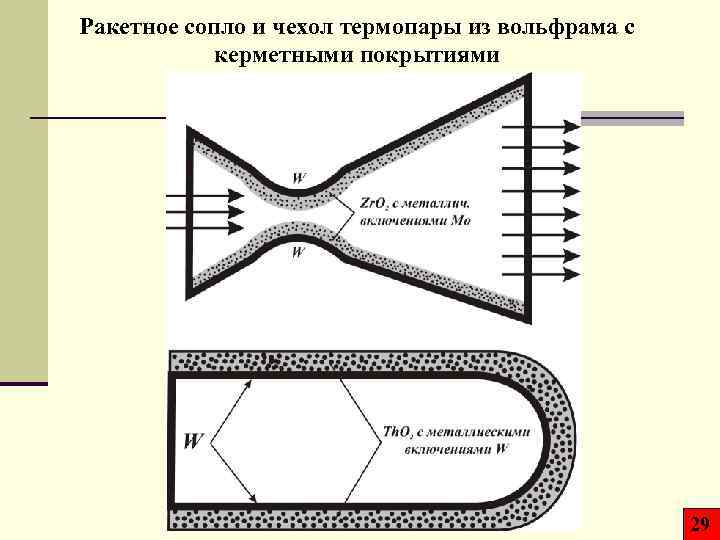
Ракетное сопло и чехол термопары из вольфрама с керметными покрытиями 29
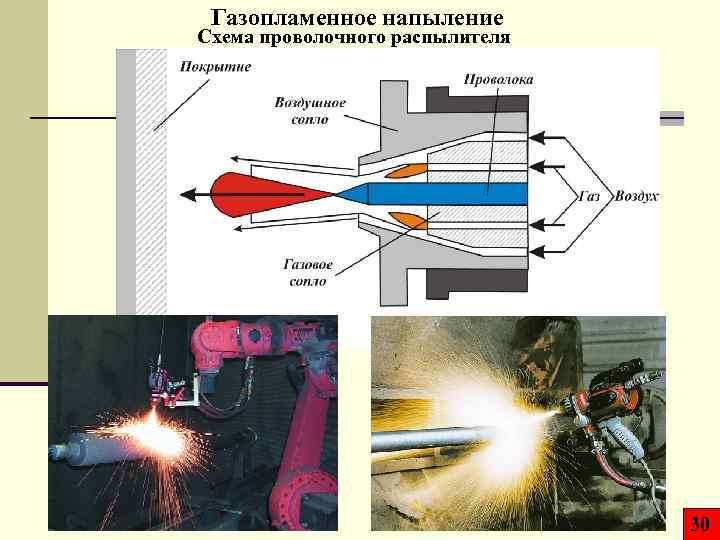
Газопламенное напыление Схема проволочного распылителя 30
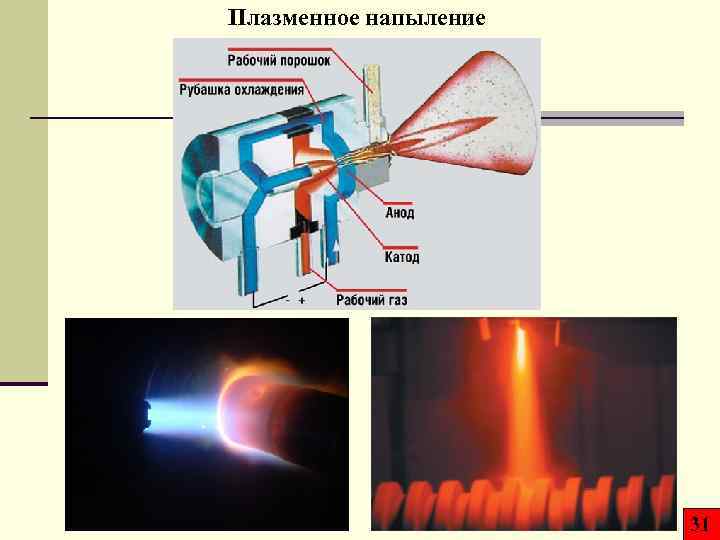
Плазменное напыление 31

Тема 5. Старинный и перспективный электрохимические методы получения брони, предохраняющей от разрушения изделия из алюминиевых сплавов 32
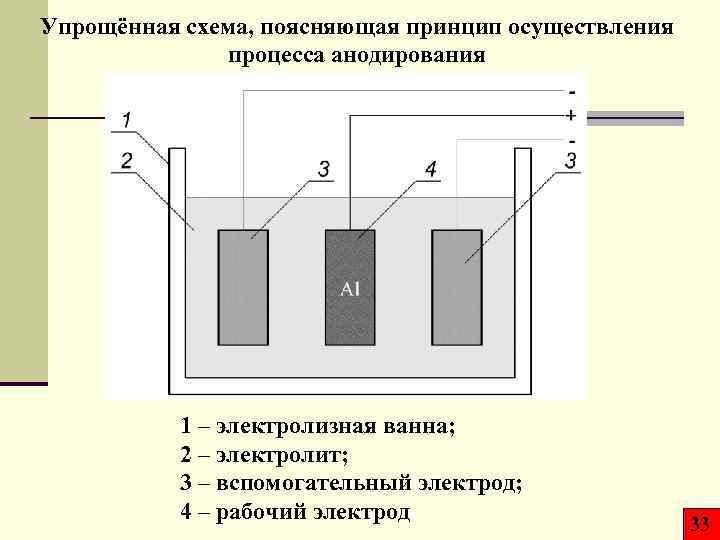
Упрощённая схема, поясняющая принцип осуществления процесса анодирования 1 – электролизная ванна; 2 – электролит; 3 – вспомогательный электрод; 4 – рабочий электрод 33

Электродные и суммарная реакции, протекающие при анодировании Al На аноде протекают реакции: Al → Al 3+ + 3ē 2 Al 3+ + 6 OH– → 2 Al(OH)3 → Al 2 O 3 + 3 H 2 O На катоде: 2 H+ + 2ē → H 2↑ Суммарная реакция: 2 Al + 3 H 2 O → Al 2 O 3 + 3 H 2↑ 34
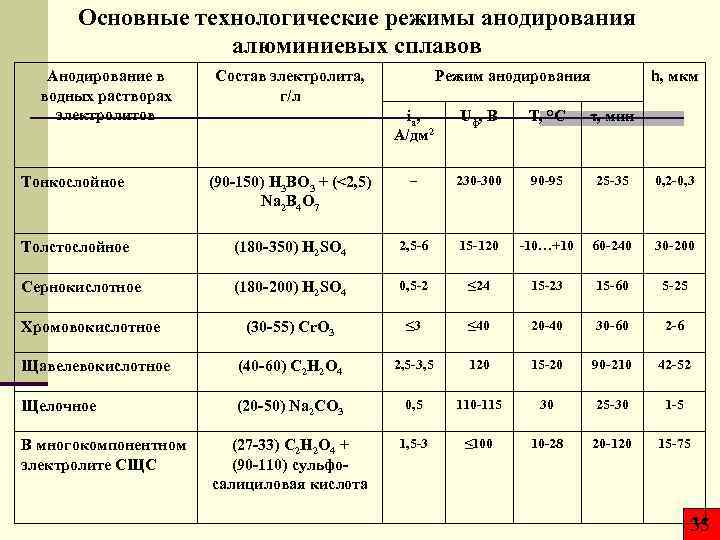
Основные технологические режимы анодирования алюминиевых сплавов Анодирование в водных растворах электролитов Состав электролита, г/л Режим анодирования h, мкм iа, А/дм 2 Uф, В T, °C τ, мин Тонкослойное (90‑ 150) H 3 BO 3 + (<2, 5) Na 2 B 4 O 7 – 230‑ 300 90‑ 95 25‑ 35 0, 2‑ 0, 3 Толстослойное (180‑ 350) H 2 SO 4 2, 5‑ 6 15‑ 120 ‑ 10…+10 60‑ 240 30‑ 200 Сернокислотное (180‑ 200) H 2 SO 4 0, 5‑ 2 ≤ 24 15‑ 23 15‑ 60 5‑ 25 (30‑ 55) Cr. O 3 ≤ 40 20‑ 40 30‑ 60 2‑ 6 Щавелевокислотное (40‑ 60) C 2 H 2 O 4 2, 5‑ 3, 5 120 15‑ 20 90‑ 210 42‑ 52 Щелочное (20‑ 50) Na 2 CO 3 0, 5 110‑ 115 30 25‑ 30 1‑ 5 (27‑ 33) C 2 H 2 O 4 + (90‑ 110) сульфосалициловая кислота 1, 5‑ 3 ≤ 100 10‑ 28 20‑ 120 15‑ 75 Хромовокислотное В многокомпонентном электролите СЩС 35

Электродные реакции, протекающие при микродуговом оксидировании Al Анодные реакции: Al + m. H 2 O → Al 3+·m. H 2 O + 3ē 4 OH– → O 2↑ + 2 H 2 O + 4ē Катодные реакции: 2 H+·H 2 O + 2ē → H 2↑ + 2 H 2 O + 2ē → 2 OH– + H 2↑ Men+·m. H 2 O + nē → Me + m. H 2 O m – количество молекул воды; n – степень окисления металла. 36
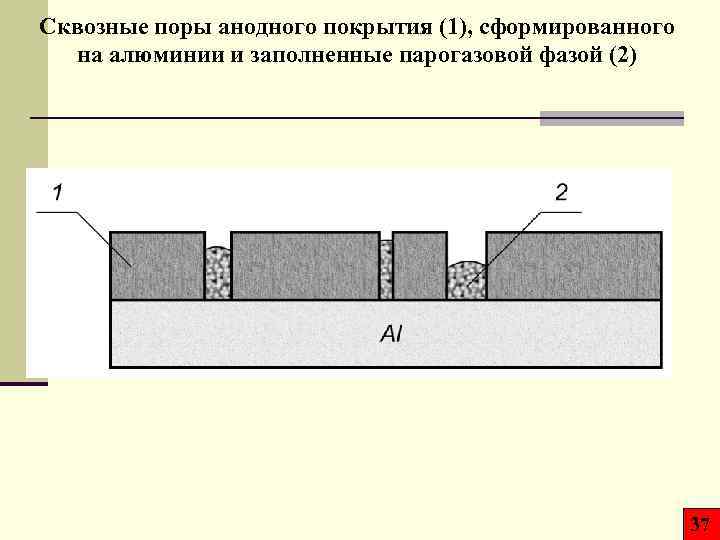
Сквозные поры анодного покрытия (1), сформированного на алюминии и заполненные парогазовой фазой (2) 37

Стадии процесса микродугового оксидирования и фотографии поверхности рабочего электрода, соответствующие им 38
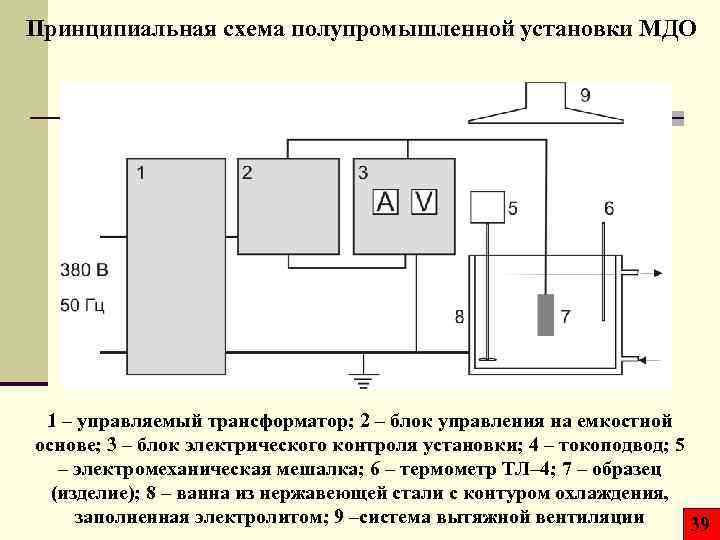
Принципиальная схема полупромышленной установки МДО 1 – управляемый трансформатор; 2 – блок управления на емкостной основе; 3 – блок электрического контроля установки; 4 – токоподвод; 5 – электромеханическая мешалка; 6 – термометр ТЛ– 4; 7 – образец (изделие); 8 – ванна из нержавеющей стали с контуром охлаждения, заполненная электролитом; 9 –система вытяжной вентиляции 39
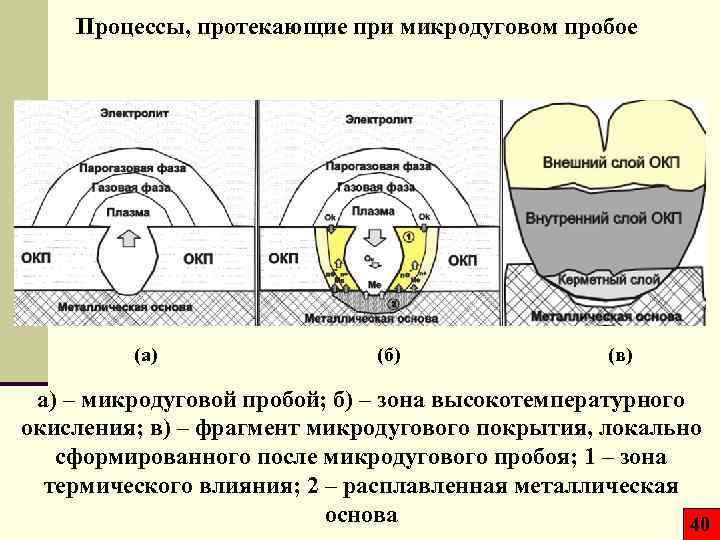
Процессы, протекающие при микродуговом пробое (а) (б) (в) а) – микродуговой пробой; б) – зона высокотемпературного окисления; в) – фрагмент микродугового покрытия, локально сформированного после микродугового пробоя; 1 – зона термического влияния; 2 – расплавленная металлическая основа 40
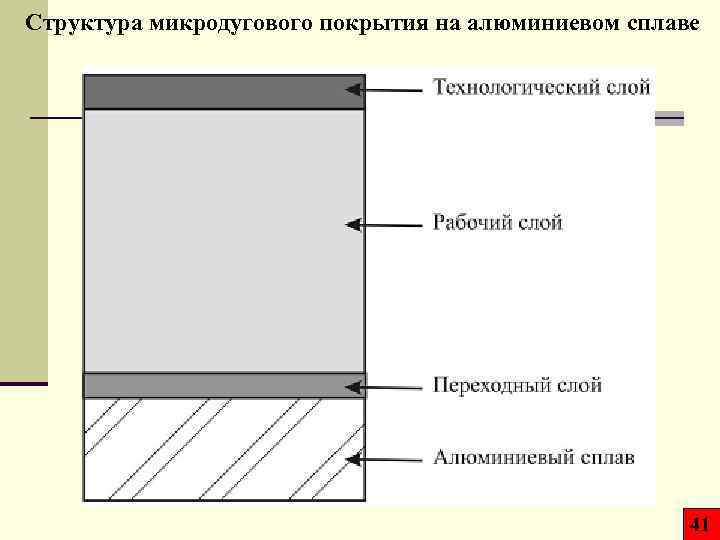
Структура микродугового покрытия на алюминиевом сплаве 41

Пластина из сплава Д 16 с микродуговым покрытием – элемент для отделки фюзеляжа самолёта Деталь фюзеляжа самолёта (опора) Деталь самолёта 42
Презентация.ppt