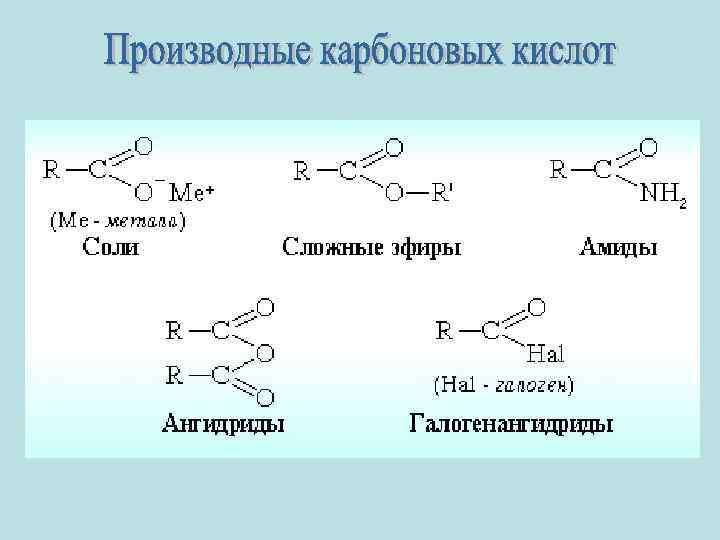
Карбоновые кислоты для Б.ppt
- Количество слайдов: 19


насыщенных монокарбоновых кислот: Сn. Н 2 n+1 СООН

Классификация 1) по количеству карбоксильных групп одноосновные двухосновные 2) по строению углеводородного радикала алифатические алициклические ароматические 3) по насыщению насыщенные ненасыщенные

Номенклатура НСООН – метановая, муравьиная кислота СН 3 СООН – этановая, уксусная кислота НООС–СООН – этандиовая, щавелевая кислота НООС–СН 2–СООН – пропандиовая, малоновая кислота
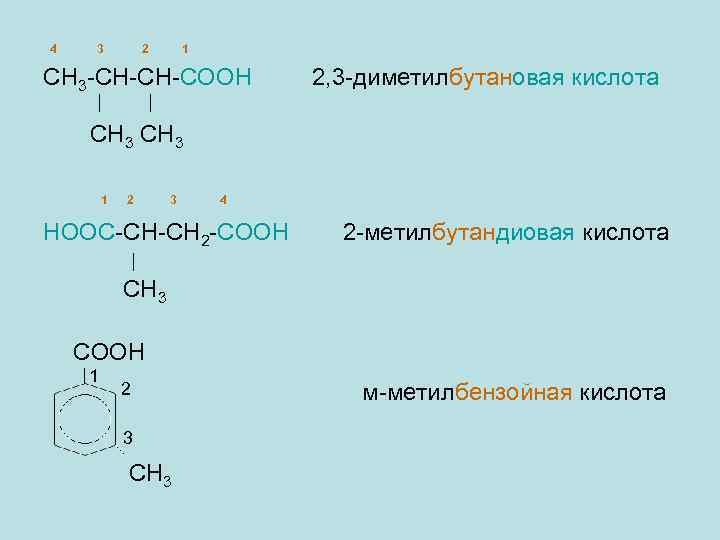
4 3 2 1 СН 3 -СН-СН-СООН 2, 3 -диметилбутановая кислота СН 3 1 2 3 4 НООС-СН-СН 2 -СООН 2 -метилбутандиовая кислота СН 3 СООН 1 2 3 СН 3 м-метилбензойная кислота

Cтруктурная изомерия • изомерия углеводородного радикала, начиная с C 4 • межклассовая изомерия, начиная с C 2. (со сложными эфирами) • Например, формуле C 2 H 4 O 2 соответствуют 2 изомера, относящиеся к различным классам органических соединений.

Между молекулами карбоновых кислот образуются водородные связи
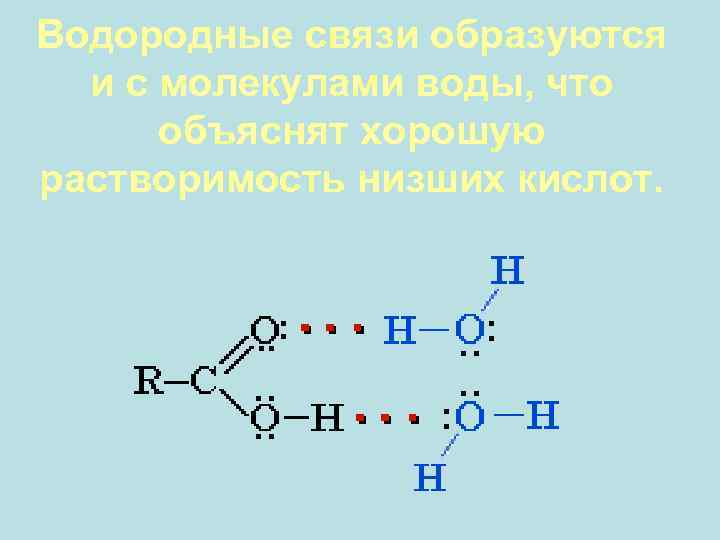
Водородные связи образуются и с молекулами воды, что объяснят хорошую растворимость низших кислот.
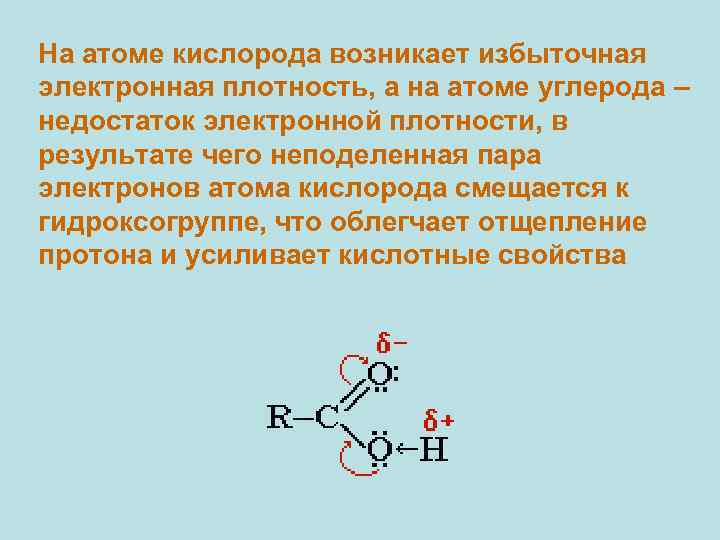
На атоме кислорода возникает избыточная электронная плотность, а на атоме углерода – недостаток электронной плотности, в результате чего неподеленная пара электронов атома кислорода смещается к гидроксогруппе, что облегчает отщепление протона и усиливает кислотные свойства
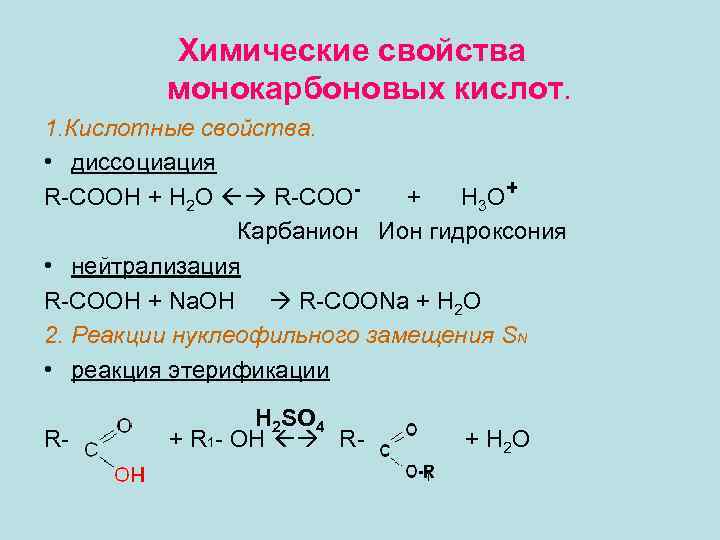
Химические свойства монокарбоновых кислот. 1. Кислотные свойства. • диссоциация R-COOH + H 2 O R-COO+ H 3 O + Карбанион Ион гидроксония • нейтрализация R-COOH + Na. OH R-COONa + H 2 O 2. Реакции нуклеофильного замещения SN • реакция этерификации R- H 2 SO 4 + R 1 - OH R- + H 2 O 1

Качественные реакции 1. на уксусную кислоту (ацетат ион) (образование жёлто-красного окрашивания раствора ). 1. 1 CH 3 COOH + Na. OH CH 3 COONa + H 2 O 3 CH 3 COONa + Fe. Cl 3 (CH 3 COO)3 Fe + 3 Na. Cl 1. 2 СH 3 COOH + C 2 H 5 OH CH 3 COOC 2 H 5 +H 2 O (при нагревании в присутствии H 2 SO 4 ) 2. на бензойную кислоту (бензоат ион) 2. 1 C 6 H 5 COOH + Na. OH C 6 H 5 COONa + H 2 O 2. 2 C 6 H 5 COONa + Fe. Cl 3 осадок телесного цвета

3. на щавелевую кислоту (оксалат ион) ( образования осадка белого цвета) 2 HOOC-COOH + Ca. Cl 2 Ca. C 2 O 4 ↓ + 2 HCl 4. на муравьиную кислоту HCOOН + 2[Ag(NH 3)2]OH CO 2↑ + 2 H 2 O + 2 Ag ↓ + 4 NH 3
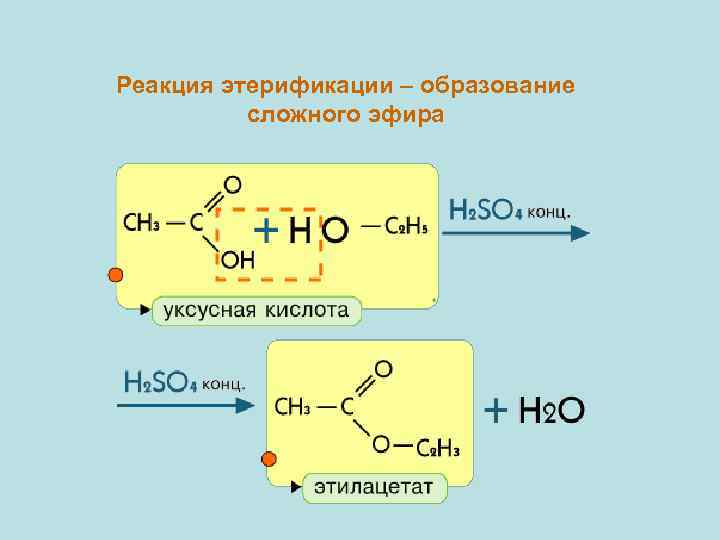
Реакция этерификации – образование сложного эфира
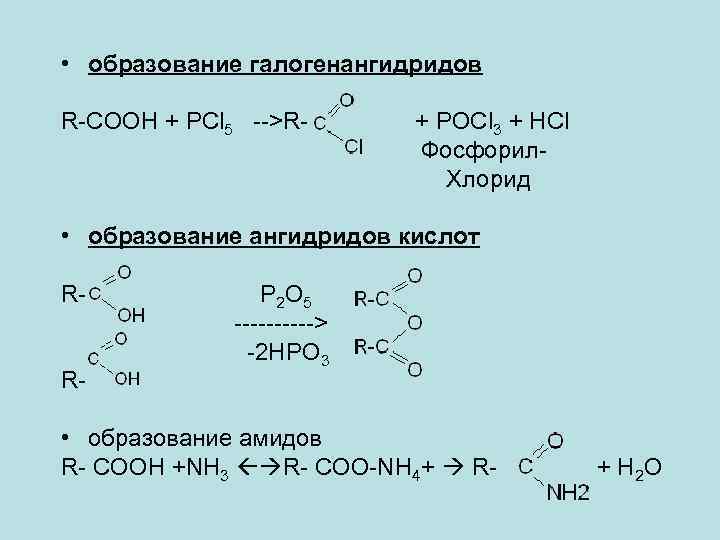
• образование галогенангидридов R-COOH + PCl 5 -->R- + POCl 3 + HCl Фосфорил. Хлорид • образование ангидридов кислот RR- P 2 O 5 -----> -2 HPO 3 • образование амидов R- COOH +NH 3 R- COO-NH 4+ R- + H 2 O
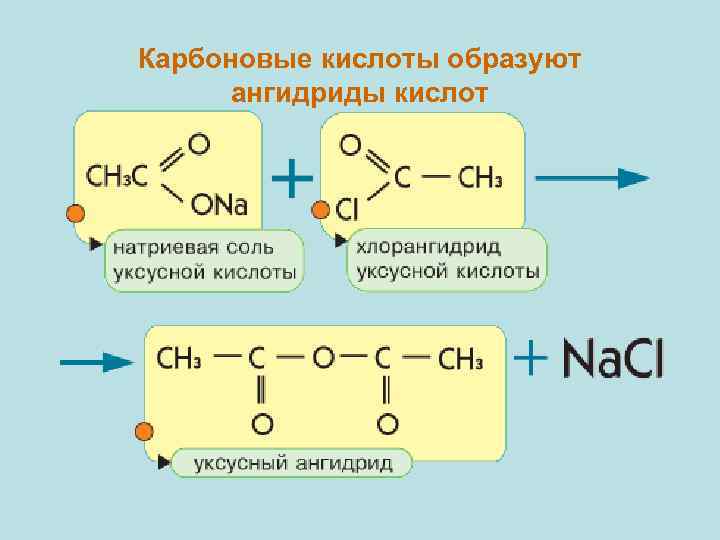
Карбоновые кислоты образуют ангидриды кислот

Химические свойства дикарбоновых кислот. 1. Кислотные свойства HOOC-R-COOH HOOC-R-COO- + H+ HOOC-COOH + Na. OH HOOC-COONa +H 2 O HOOC-COOH + 2 Na. OH Na. OOC-COONa + 2 H 2 O 2. Реакции нуклеофильного замещения (SN) HOOC-R-COOH + R 1 OH HOOC-R-OOR 1 + H 2 O Моноэтиловый эфир HOOC-R-COOH + 2 R 1 OH R 1 OOC-COOR 1 + 2 H 2 O Диэтиловый эфир
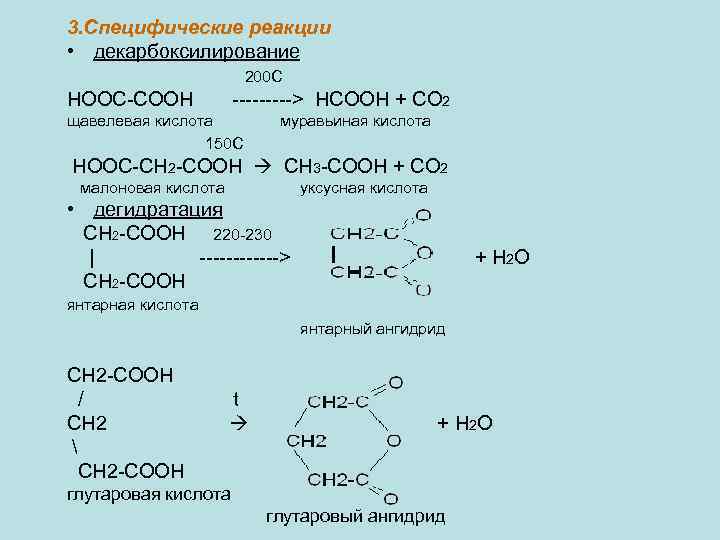
3. Специфические реакции • декарбоксилирование 200 C НООС-СООН -----> HCOOH + CO 2 щавелевая кислота 150 С муравьиная кислота HOOC-CH 2 -COOH CH 3 -COOH + CO 2 малоновая кислота уксусная кислота • дегидратация CH 2 -COOH 220 -230 | ------> CH 2 -COOH + H 2 O янтарная кислота янтарный ангидрид CH 2 -COOH / CH 2 CH 2 -COOH t + H 2 O глутаровая кислота глутаровый ангидрид

Последовательные стадии окисления первичных спиртов
Карбоновые кислоты для Б.ppt