Тажмухан Б.pptx
- Количество слайдов: 41
Нарушение обменных процессов, недостаточность компенсаторных возможностей, изменение функции органов и систем. Гемотологические данные и состояние гемокоагуляционной системы у онкобольных

Обмен веществ в организме человека • Обмен веществ - это набор химических реакций, обеспечивающий жизнедеятельность и рост клетки. Обмен веществ – это то, что является основой живого организма, это обмен между химическим составом человека и окружающей среды. • В обменных процессах нашего организма участвуют все химические и природные элементы – белки, жиры и углеводы. Выполняя каждый свою роль - белки, создавая строительный материал, а жиры с углеводами, регулируя баланс энергетических затрат – четко и слаженно взаимодействуют друг с другом. К ним в помощь приходят минеральные вещества и витамины, которые улучшают клеточную среду.


• Обмен веществ состоит из двух сторон: • 1. диссимиляция – разложение, распад питательных веществ. • 2. ассимиляция – синтез, создание и усвоение организмом новых веществ. • Различают следующие этапы: • 1. Поступление питательных веществ в организм • 2. Всасывание их из пищеварительного тракта • 3. Перераспределение и усвоение питательных веществ (тканевый этап) • 4. Выделение остатков продуктов распада, которые не могут усвоиться в организме • Процессы обмена веществ идут в организме быстро и интенсивно, хотя в организме нет высокого давления и температуры. Эта быстрота обеспечивается участием ферментов и других веществ


• Родовые (различные врожденные отклонения, которые передаются из поколения в поколение); • Сбой в работе эндокринной системы (нарушение работы щитовидной железы, дисфункция гипофиза или надпочечников и т. д. ); • Отклонения в функционировании центральной нервной системы (нарушение работы гипоталамуса); • Авитаминоз (нехватка витаминов или минералов, участвующих в обменных процессах); • Нарушение режима питания, либо резкое изменение образа питания (проще говоря, голодание либо переедание); • Дефицит белков, жиров и углеводов (недостаток этих веществ приводит к атрофированию мышц, заболеваниям сердечно-сосудистой системы и т. д. ); • Избыток белков, жиров и углеводов ( перенасыщение организма этими веществами непременно приводит к ожирению, а так же тяжелым застойным процессам в организме человека); • Нервное перенапряжение или стрессы, недостаток сна; • Малоподвижный образ жизни, полное отсутствие физических нагрузок (развивает кислородный голод).

• Радиационное и радиоволновое воздействие; • Генетическая предрасположенность к онкологическим патологиям наследственного характера; • Влияние канцерогенных веществ, попадающих с некачественной пищей в организм; • В процессе курения в организм проникают опасные химические вещества и никотин, которые могут спровоцировать некоторые формы рака; • Некоторые инфекционные заболевания могут осложниться развитием онкологического процесса; • Возраст играет немаловажную роль в развитии раковых опухолей, чем старше человек, тем выше вероятность онкологии; • Неправильный образ жизни вроде гиподинамии, ожирения, неправильного питания тоже способствуют развитию онкологических процессов; • УФ-излучение, исходящее от солнца, тоже может спровоцировать некоторые онкологические формы вроде рака кожи и пр.
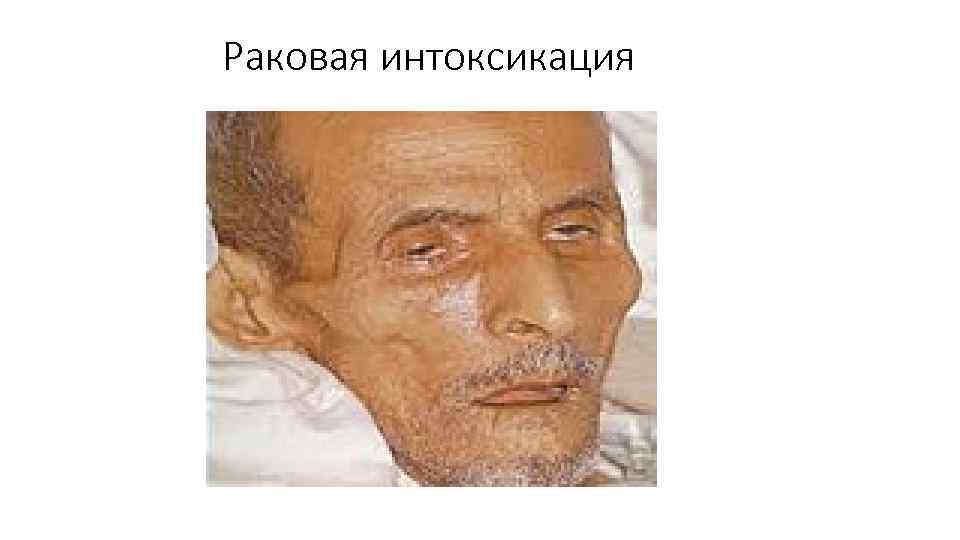
Раковая интоксикация

• Раковая интоксикация – патологическое состояние, обусловленное распространенным онкологическим процессом и распадом злокачественной опухоли. • Возникает на поздних стадиях онкологического заболевания. Может провоцироваться активной противораковой терапией. Проявляется слабостью, утомляемостью, бледностью кожи, сухостью слизистых, тошнотой, рвотой, потерей веса и аппетита, потливостью, гипертермией, костно-суставными болями, нарушениями сна, психическими расстройствами, анемией и снижением иммунитета. • Диагноз выставляется на основании анамнеза, клинической симптоматики, результатов анализов и инструментальных исследований.

• Раковая интоксикация – комплекс расстройств, возникающих у онкологических больных при отравлении организма продуктами распада злокачественной опухоли. Выявляется преимущественно на терминальных стадиях заболевания, рассматривается как одна из основных причин гибели пациентов. Кроме того, раковая интоксикация часто наблюдается при проведении химиотерапии, является закономерным следствием активного противоракового лечения, вызывающего разрушение опухоли. • Раковая интоксикация может провоцировать нарушения деятельности различных органов и систем, в том числе – почечную и печеночную недостаточность, сепсис и другие тяжелые инфекционные осложнения, что обуславливает важность продуманного подбора дозировок и видов лекарственных препаратов с учетом общего состояния больного, а также наличия тех или иных хронических заболеваний.

Причины раковой интоксикации • Одной из отличительных особенностей злокачественной опухоли является ее способность к быстрому неконтролируемому росту. Как правило, темпы роста сосудов, обеспечивающих кровоснабжение новообразования, отстают от скорости роста опухолевой ткани. Злокачественные клетки достаточно устойчивы к гипоксии и могут некоторое время существовать в условиях недостаточного кровоснабжения, однако рано или поздно умирают. Обычно этот процесс наблюдается при опухолях достаточно большого размера. Массовая гибель клеток становится причиной распада новообразования и вызывает раковую интоксикацию.

• В организм попадает большое количество продуктов распада, которые провоцируют расстройства всех видов обмена веществ и нарушения деятельности различных органов и систем. Раковая интоксикация становится причиной повышения уровня мочевины. Кристаллы мочевины оседают в почечных канальцах, вызывая развитие почечной недостаточности, которая еще больше усугубляет обменные нарушения. Из-за увеличения количества фосфатов возникает дефицит ионов кальция, следствием которого становятся нарушения работы нервной системы. Повышение уровня кальция негативно влияет на работу сердца. У пациентов с раковой интоксикацией возникают аритмии, в тяжелых случаях возможно прекращение сердечной деятельности. Увеличение количества свободных радикалов стимулирует распад эритроцитов и развитие анемии.

Симптомы раковой интоксикации • Наиболее постоянными признаками раковой интоксикации являются прогрессирующая слабость и беспричинная утомляемость. Наблюдаются характерные изменения внешнего вида: дефицит массы тела (в тяжелых случаях – вплоть до кахексии), бледный, землистый или желтоватый оттенок кожи, сухость кожи и слизистых оболочек. Возможен цианоз дистальных отделов конечностей. У больных с нарушениями функции печени выявляется иктеричность склер. Пациенты с раковой интоксикацией предъявляют жалобы на усиленное потоотделение. Как правило, потливость более выражена в ночное время.


Компенсаторные процессы • Компенсаторные процессы (лат. compensare уравновешивать, возмещать) — приспособительные реакции организма на повреждение тканей, выражающиеся в том, что функцию тканей, утраченную в результате их повреждения, осуществляют неповрежденные ткани пострадавшего органа либо другие органы или системы, обеспечивая полное или частичное возмещение функционального дефекта.

• В ряде случаев К. п. развиваются почти исключительно в самом поврежденном органе. Так, при гибели части мышечной ткани сердца вследствие инфаркта миокарда компенсация сократительной функции органа обеспечивается за счет сохранившихся отделов миокарда. Подобным образом компенсируются дефекты функций при повреждениях головного мозга, инкреторного аппарата поджелудочной железы, печени и других органов, основная функция которых в организме не дублируется. В других случаях компенсация повреждения происходит как за счет усиления функции сохранившихся отделов больного органа, так и вследствие выполнения этой функции неповрежденным парным органом или другими органами и системами. Например, нарушение выделительной функции почек компенсируется не только их неповрежденными структурами, но и легкими, кожей, кишечником; убыль экзокринной паренхимы поджелудочной железы возмещается как интенсификацией функции сохранившихся ее отделов, так и путем соответствующих изменений функции желудка и других отделов желудочно-кишечного тракта. В редких случаях при гибели всего органа или при его оперативном удалении в связи с обширным поражением (желудок, селезенка) компенсация его функции обеспечивается различными отделами родственной структурно-функциональной системы


• В органах и тканях (например, костном мозге, коже) компенсация нарушенной функции происходит главным образом за счет гиперплазии клеток, в других (например, в печени, поджелудочной железе) — вследствие увеличения числа клеток и гипертрофии каждой из них. В ц. н. с. и миокарде новообразования клеток не происходит, в основе компенсации нарушенной функции лежит гиперплазиявнутриклеточных органелл.

• При внезапном и сильном воздействии патогенного фактора К. п. не успевают развернуться в полной мере с достижением гиперплазии компенсирующих структур, и организм для ликвидации повреждения может использовать только наличный их запас, что не всегда бывает достаточно для сохранения жизни. В этих случаях резкую интенсификацию адаптивных процессов расценивают как срочную компенсацию. Характер срочной компенсации нередко носит остро развивающаяся компенсаторная гиперфункция непарного органа. Если организму с помощью этих срочных мероприятий удается «продержаться» , то спустя примерно сутки после повреждения ткани начинают развиваться внутриклеточные гиперпластические процессы, а в последующем происходит также новообразование клеток, что принято называть долговременной компенсацией.


• Для онкологических больных характерны низкие компенсаторноприспособительные реакции организма, в частности сниженная иммунореактивность. Специфика онкологических операций во многом состоит в обширности и высокой травматичности. Нередки рассширенные и комбинированные вмешательства с резекцией и удалением нескольких органов(до 5 -6 и даже более). Широкое иссечение региональных лимфатических коллекторов современная онкохирургия считает необходимым атрибутом всех непаллиативных хирургических вмешательств. В результате удлиняется время операций, они становятся высокотравматичными, сопровождаются значительной кровопотерей, нарушениями регионального лимфотока и др. Что в свою очередь создает условие для развития и недостаточности компенсаторных возможностей организма. Массивная травма и анестезия усугубляет иммуносупрессию. На последнюю роль играет поступление в кровоток продуктов массивного цитолиза, неизбежно сопровождающего операции подобной травматичности.
Гематологические паранеопластические онкологические синдромы • К паранеопластическим проявлениям со стороны крови относят • анемию • лейкемоидную реакцию • тромбоцитопению • эритремию • коагулопатии

Анемия • При первичных новообразованиях анемия регистрируется в 20 -60% наблюдений. Независимо от причины, уменьшение содержания гемоглобина существенно снижает качество жизни больных, а при некоторых опухолях (злокачественные лимфомы) является неблагоприятным прогностическим признаком и оказывает негативное влияние на результаты терапии. Клинические провлявления анемии варьируют от утомляемости, общей слабости, головокружения, сонливости до снижения умственных способностей, респираторных расстройств и сердечной недостаточности. Возможны лихорадка: лимфаденопатия, умеренная-желтушность кожных покровов и склер, сплено- и гепатомегалия: В крови находят эритроцитопению, повышенное содержание непрямого билирубина. В пунктате костного мозга отмечается увеличение числа ретикулоцитов и нормоэритробластов. Симптомы анемии подчас настолько резко выражены, что основной диагноз на протяжении какого-то времени ускользает от врача. • Анемия у больных злокачественными опухолями может иметь различный генез, но предполагают, что основной механизм сходен с так называемой анемией хронического заболевания, для которой характерно умеренное снижение продолжительности жизни эритроцитов и неспособность организма повысить эритропоэз и утилизировать железо из гибнущих эритроцитов.

Эритропоэз • Эритропоэз — фундаментальный гемопоэтический процесс, в результате которого в ответ на анемию или гипоксию стимулируется продукция эритроидного ростка костного мозга и образование такого количества зрелых эритроцитов, которое обеспечивало бы необходимое количество гемоглобина для снабжения тканей кислородом. Регулирует эритропоэз гормон эритропоэтин, уровень которого при анемии или гипоксии может увеличиваться в 100 -1000 раз, обеспечивая баланс между производством эритропоэтина и уровнем гемоглобина • У взрослых эритропоэтин синтезируется в основном в перитубулярных фибробластах коркового и мозгового слоя, почек, а затем переносится с током крови в орган-мишень — костный мозг. Около 10% гормона производится печенью В основе физиологического механизма образования и действия эритропоэтина лежит механизм обратной связи. В норме кислородонасыщение тканей обеспечивается числом циркулирующих в крови эритроцитов.

• После кислородного насыщения происходит инактивация гена эритропоэтина, продукция гормона прекращается, пока вновь не поступит сигнал о гипоксии, указывающий на снижение массы эритроцитов ниже нормы.

• Для анемии на Фоне онкологического заболевания характерны резистентность клеток-предшественниц эритроидного ряда к эритропоэтину, неадекватно сниженная почечная секреция эритропоэтина для данного уровня гемоглобина, а также нарушение метаболизма, железа, которое ведет к его функциональному дефициту. Важную роль в развитии анемии играют цитокины (интерликин (ИЛ)-1 - и фактор некроза опухоли, интерферон (ИФ)-), которые подавляют пролиферацию клеток-предшественников эритроидного ряда, блокируют продукцию эритропоэтина в перитубулярных фибробластах почек и угнетают метаболизм железа вследствие ретикулоэндотелиального блока, при котором снижается фагоцитоз гибнущих эритроцитов ретикулоэндотелиальными клетками различных органов и повторная утилизация фрагментов молекулы гемоглобина
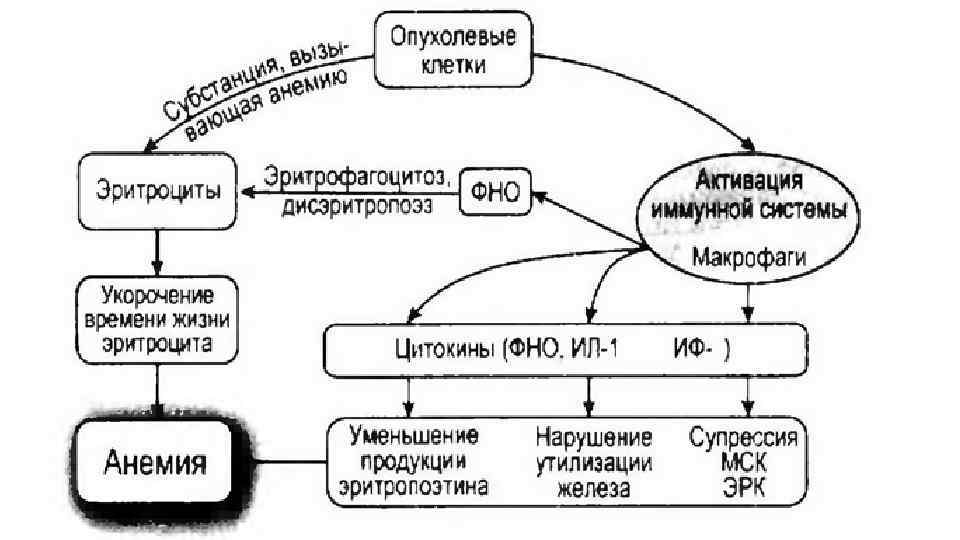

• В норме железо поступает в кровяное русло, захватывается трансферрином плазмы и переносится в костный мозг, где осуществляется синтез гемоглобина. При высокой концентрации цитокинов происходит задержка железа в ретикулоэндотелиальных клетках и, как следствие, снижение количества железа, доступного для связывания с трансферрином. • Помимо угнетения гемоглобинового звена, высокие концентрации цитокинов в сыворотке крови стимулируют дифференцировку мегакариоцитов, являющихся предшественниками тромбоцитов. Клинически это проявляется в повышении уровня лейкоцитов и тромбоцитов на фоне анемии и низкой концентрации железа в крови.

• Другими наиболее частыми причинами анемии являются дефицит железа, фолиевой кислоты, витамина В 12, гемолиз; инфекции; поражение костного мозга (инфильтрация опухолевыми клетками при злокачественных лимфомах или метастазы солидных опухолей); почечная недостаточность.

• Развитие анемии часто является поздним симптомом и происходит на фоне распространенного опухолевого процесса, поэтому прогноз при развившейся анемии нередко неблагоприятен. Тем не менее, в случаях, когда нет четких данных о метастазах, больному не следует отказывать в оперативном лечении.

Тромбоцитопения • Клиническая картина характеризуется геморрагическими высыпаниями изменениями нервной системы, лихорадкой, тромбоцитопенией и анемией. Заболевание может протекать в острой и подострой формах. Появлению геморрагических высыпаний предшествует продромальный период от нескольких дней до нескольких месяцев. В этот период у больных разбиваются общая слабость, быстрая утомляемость, отсутствие аппетита, явления вяло текущего бронхита, боли в суставах и мышцах, уртикарные высыпания на коже. • Нередко у больных отмечается значительное похудение. Во втором периоде, как правило, остро развиваются кровоизлияния в слизистую оболочку носа, десен, желудочно-кишечного тракта, кожу и т. д. В крови обнаруживают тромбоцитопению, нормохромную и нормоцитную анемию, анизоцитоз, пойкилоцитоз, ретикулоцитоз, лейкоцитоз со сдвигом влево. Может развиться незначительная гемолитическая желтуха. Время свертывания крови остается в пределах нормы. Течение синдрома тяжелое, и нередко в разгар основных клинических проявлений наступает смерть. Паранеопластическая тромбоцитопения может предшествовать или возникать на фоне хронического лимфолейкоза, злокачественной лимфомы.

Коагулопатии • Высокий риск образования венозных и артериальных тромбов у онкологических больных обусловлен наличием двух патогенетических факторов: высокие тромбогенные свойства опухолевой ткани и развивающееся претромботическое состояние системы гемостаза (тромбофилия).

Тромбогенные свойства опухолевой ткани • Установлено, что неоппастические клетки выделяют прокоагулянты. Поэтому опухоль обладает высокой коагуляционной способностью и по своим тромбогенным свойствам превосходит аналогичные нормальные ткани. Так, для ряда опухолей характерно резкое увеличение продукции тканевого тромбоппастина. • Последний активирует коагуляционный каскад процесса свертывания крови и индуцирует локальное (в опухоли) и диссеминированное (в организме) внутрисосудистое свертывание крови. Опухолевые клетки способны взаимодействовать с тромбоцитами, с коагуляционным и фибринолитическим звеньями системы гемостаза и вызывать повреждение эндотелия сосудов.

Претромботическое состояние системы гемостаза • Претромботическое состояние системы гемостаза у онкологических больных характеризуется повышенной наклонностью крови к внутрисосудистому свертыванию и тромбообразованию. • Важнейшую роль в этом процессе, помимо активаторов системы гемостаза, принадлежит опухолевым цитокинам в частности фактор некроза опухоли (ФНО), интерлейкин (ИЛ-1), гемопоэтическим колониестимулирующим фактором и др. , которые выступают в качестве триггеров гиперкоагуляции. • Воздействие вышеперечисленных патогенетических факторов при злокачественном росте индуцирует развитие претромботического состояния, основу которого составляют два компонента — снижение антитромбогенного потенциала стенки сосудов и внутрисосудистая активация системы гемостаза, которые потенцируются замедленным током крови.

• Изменения гемостаза в стенке сосудов проявляются в снижении их антитромбогенной (антиагрегационной, антикоагулянтной, фибриполитической) активности, механизм которой у онкологических больных не совсем ясен. Но в результате создаются благоприятные условия для внутрисосудистой агрегации тромбоцитов и образования тромбов, снижения фибрине- и тромболизиса. Активацию системы гемостаза вызывают и повреждения стенки сосудов образуемыми иммунными комплексами. • Внутрисосудистая активация системы гемостаза, ведущая к повышению свертывания и тромбообразованию, у больных раком может быть связана с различными звеньями процесса свертывания

• 1) повышение функциональной активности тромбоцитов с последующим внутрисосудистым образованием тромбоцитарных тромбов. Кроме того, тромбоциты и активно образующийся фибрин взаимодействуют с циркулирующими в сосудистом русле опухолевыми клетками и формируют тромбоонкогенные эмболы, которые могут, задерживаясь в сосудах микроциркуляции, вызывать ишемию и некроз стенки сосудов;

• 2) повышение концентрации в крови фактора VII и VIII, антитромбина III, протеина С, протеина S и фибриногена, что ведет к нарушению реологических свойств крови, снижению антикоагулянтной активности;

• 3) снижение фибринолитической активности крови, в результате уменьшается фибрино-тромболизис и повышается риск возникновения тромбозов. Таким образом, по мере прогрессирования опухолевого процесса собственно тромбогенные факторы опухоли, нарастающее претромботическое состояние системы гемостаза и замедление кровотока формируют состояние хронической внутрисосудистой активации системы гемостаза, ведущие в конечном итоге к хроническому диссеминированному свертыванию крови.

Тажмухан Б.pptx