Родина lecture 5.ppt
- Количество слайдов: 59

НАНОМАТЕРИАЛЫ НА ОСНОВЕ БЕЛКОВ И ПЕПТИДОВ Механические свойства белковых материалов Белковые волокна Природные и синтетические нанокомпозиты Эластомерные белки и возможности их использования. Механосенсорные системы. Белки межклеточной адгезии, механозависимые ионные каналы.
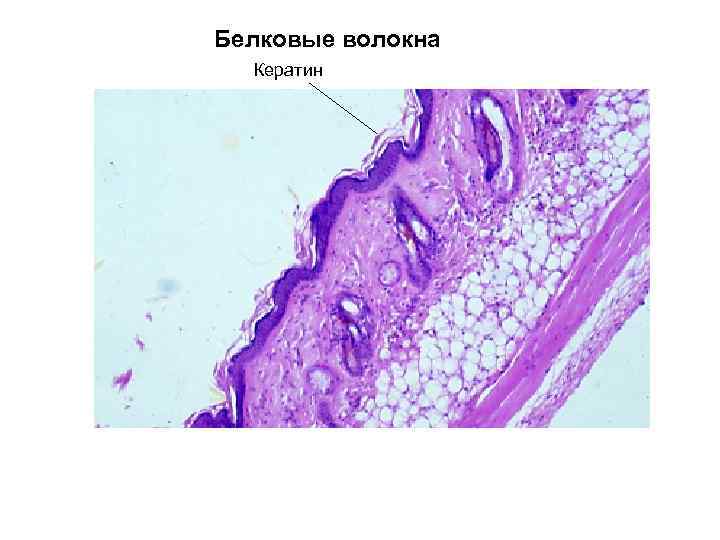
Белковые волокна Кератин
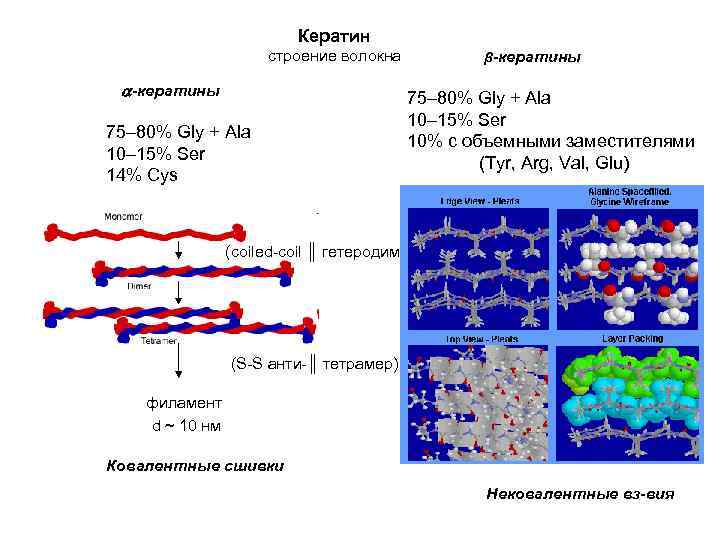
Кератин строение волокна -кератины 75– 80% Gly + Ala 10– 15% Ser 14% Cys β-кератины 75– 80% Gly + Ala 10– 15% Ser 10% с объемными заместителями (Tyr, Arg, Val, Glu) (coiled-coil ║ гетеродимер) (S-S анти-║ тетрамер) филамент d ~ 10 нм Ковалентные сшивки Нековалентные вз-вия
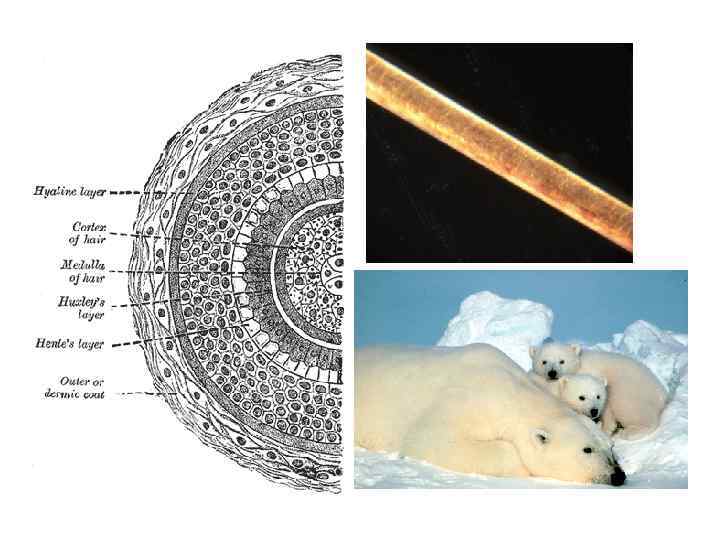

Кератин шерсти морфология продуктов щелочного гидролиза необработанное волокно 0, 5 н. Na. OH/H 2 O 2 8 М мочевина, 1 н. Na. OH лиофилизованный гидролизат кератина Research Letters in Materials Science Volume 2009 (2009), Article ID 147175, 5 pages doi: 10. 1155/2009/147175
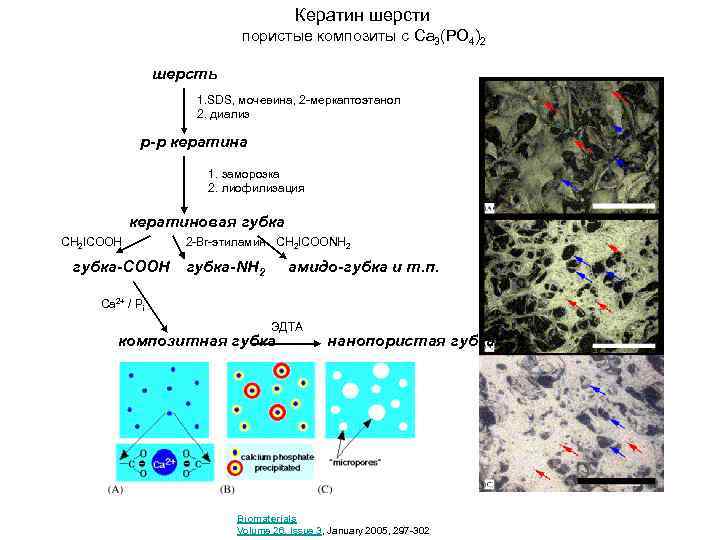
Кератин шерсти пористые композиты с Ca 3(PO 4)2 шерсть 1. SDS, мочевина, 2 -меркаптоэтанол 2. диализ р-р кератина 1. заморозка 2. лиофилизация кератиновая губка CH 2 ICOOH 2 -Br-этиламин CH 2 ICOONH 2 губка-COOH губка-NH 2 амидо-губка и т. п. Ca 2+ / Pi ЭДТА композитная губка нанопористая губка Biomaterials Volume 26, Issue 3, January 2005, 297 -302
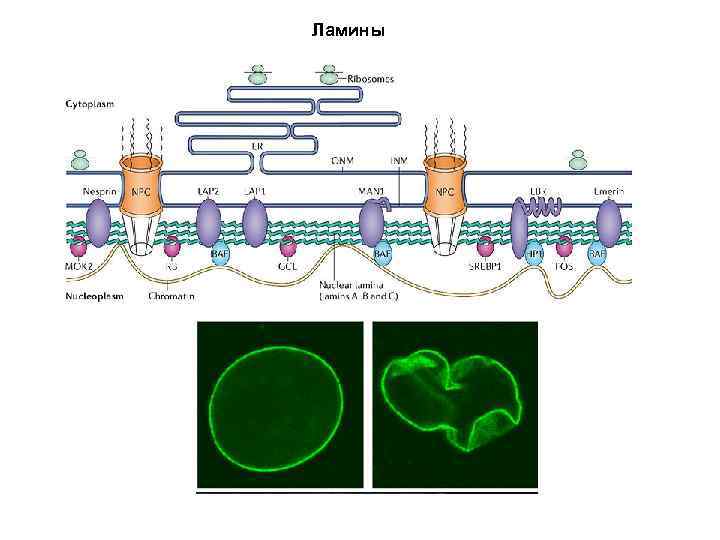
Ламины

Шелк

Byssus
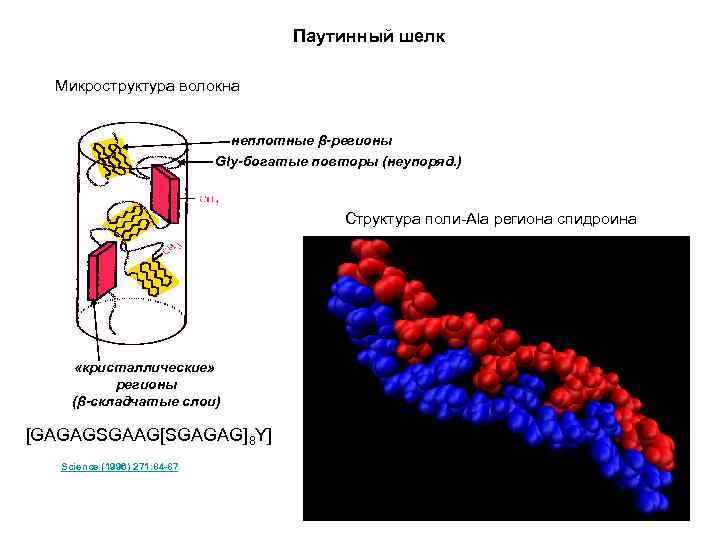
Паутинный шелк Микроструктура волокна неплотные β-регионы Gly-богатые повторы (неупоряд. ) Структура поли-Ala региона спидроина «кристаллические» регионы (β-складчатые слои) [GAGAGSGAAG[SGAGAG]8 Y] Science (1996) 271: 84 -87
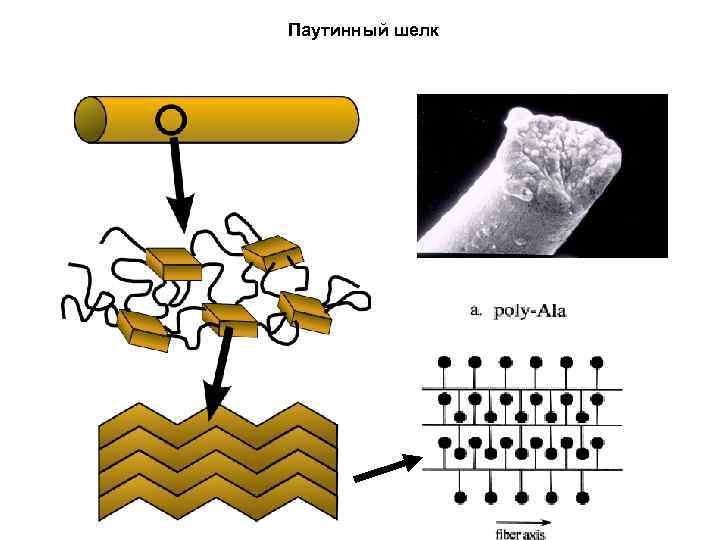
Паутинный шелк

Паутинный шелк vs шелк обычный Паутинный шелк как материал Возможные области применения: - добавка в композитах - сверхпрочные волокна, пленки и т. п. - синтетические материалы на основе SLP Плюсы: - Прочность - Стабильность при повышенных и пониженных температурах - Легкость - биосовместимость и биодеградируемость Трудности: - невозможность получения природного шелка в макроколичествах - непонятен механизм затвердевания in vivo
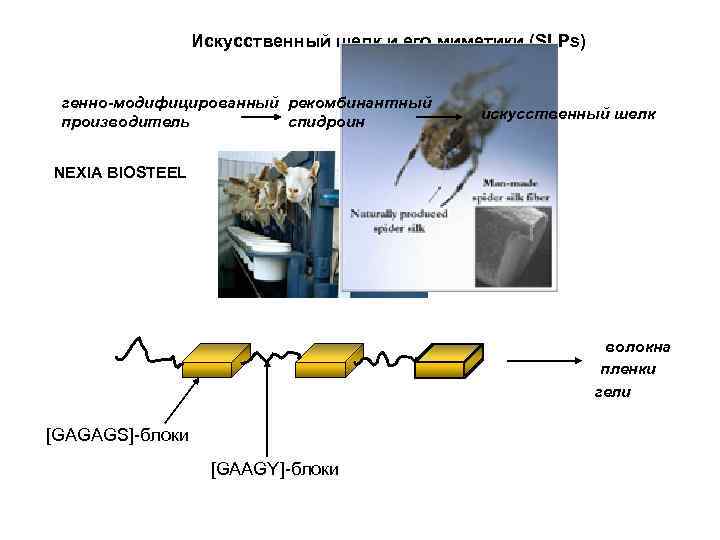
Искусственный шелк и его миметики (SLPs) генно-модифицированный рекомбинантный производитель спидроин искусственный шелк NEXIA BIOSTEEL волокна пленки гели [GAGAGS]-блоки [GAAGY]-блоки
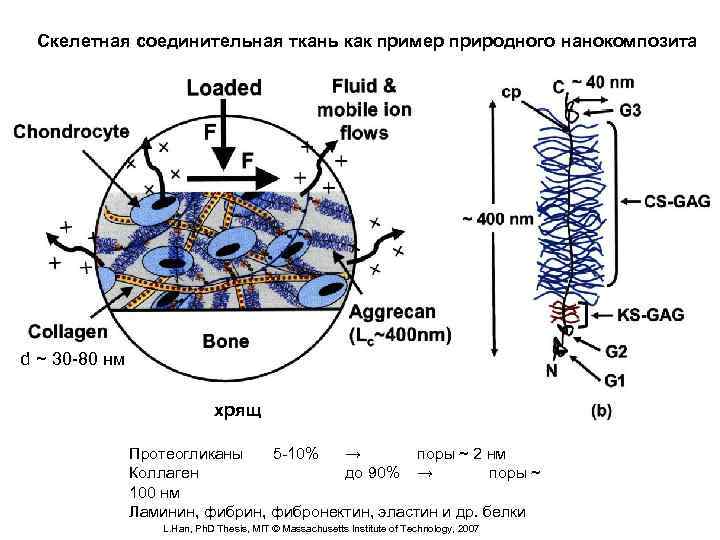
Скелетная соединительная ткань как пример природного нанокомпозита Структура хряща d ~ 30 -80 нм хрящ Протеогликаны 5 -10% → поры ~ 2 нм Коллаген до 90% → поры ~ 100 нм Ламинин, фибронектин, эластин и др. белки L. Han, Ph. D Thesis, MIT © Massachusetts Institute of Technology, 2007
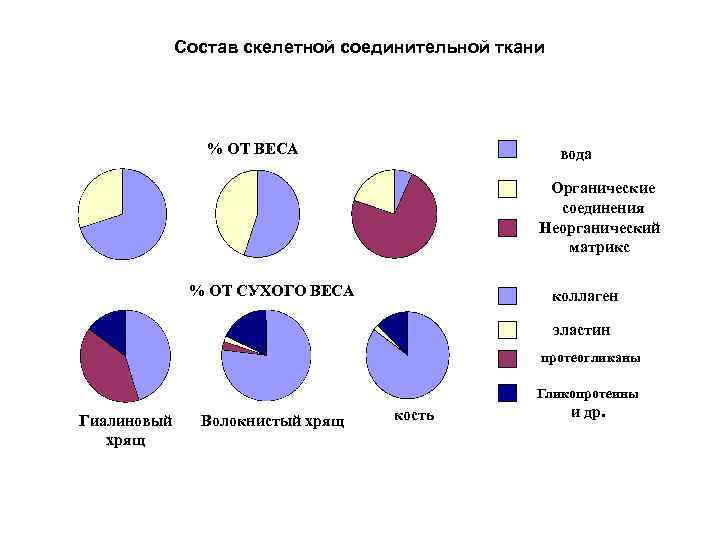
Состав скелетной соединительной ткани % ОТ ВЕСА вода Органические соединения Неорганический матрикс % ОТ СУХОГО ВЕСА коллаген эластин протеогликаны Гликопротеины Гиалиновый хрящ Волокнистый хрящ кость и др.

Структурные и эластичные белковые волокна Белки межклеточного матрикса эластин (микрофибр. ) эластин (аморф. ) Содержание белковых волокон в тканях, % от массы сух. в-ва коллаген Ткань 0. 6 -2. 1 71. 9 легкие 3 -7 10 аорта 28 -32 12 -24 Ligamentum nuchae 74. 8 17 Ахиллово сух-е 4. 4 86. 0 печень структурные волокна эластичные волокна Коллаген кожа Copyright © 2009 American Academy of Dermatology Эластин 0. 16 -0. 30 3. 9

Механические свойства волокон мягких тканей Коллаген
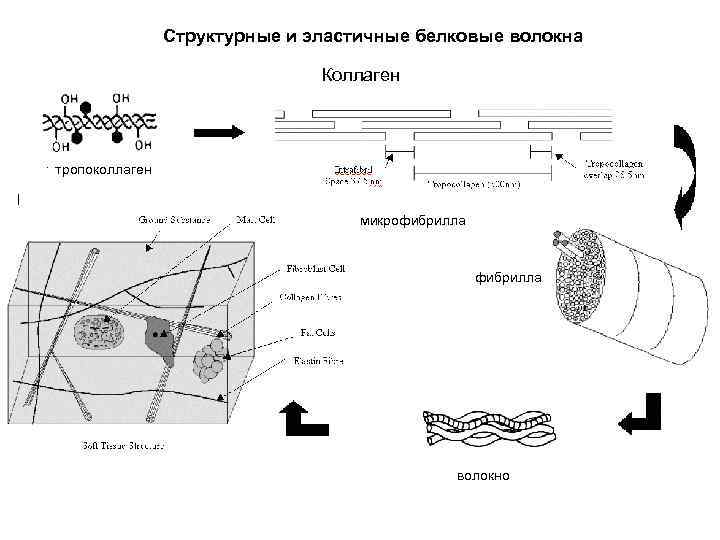
Структурные и эластичные белковые волокна Коллаген тропоколлаген микрофибрилла волокно
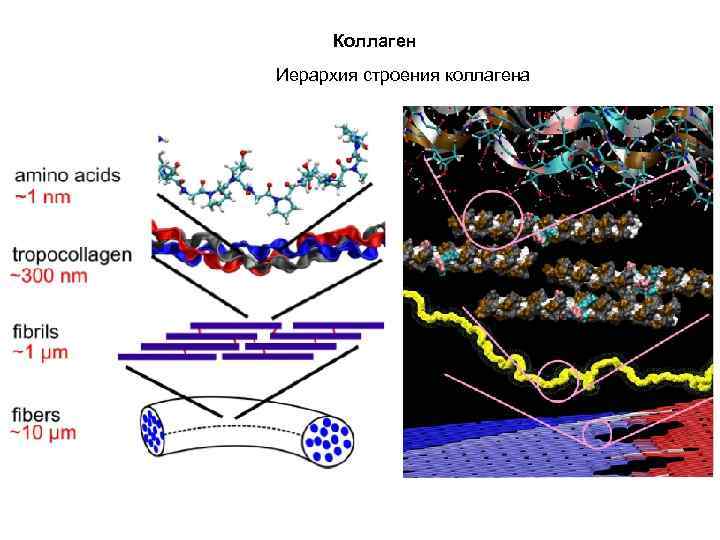
Коллаген Иерархия строения коллагена
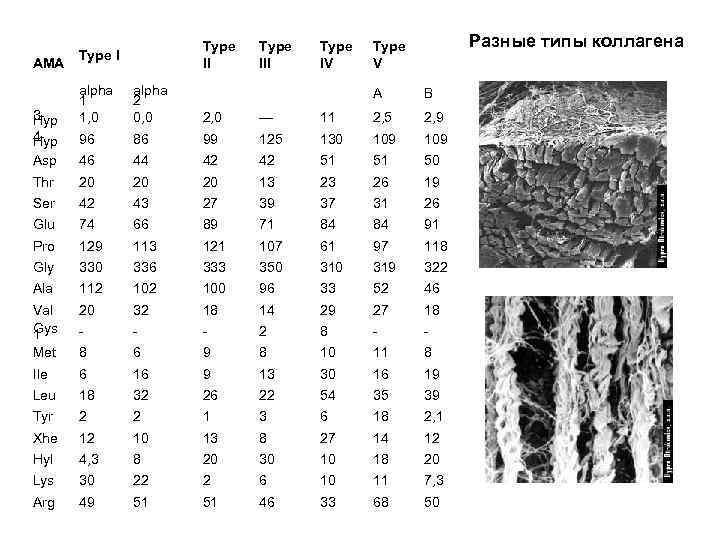
AMA Type III alpha 1 1, 0 alpha 2 0, 0 2, 0 — 96 86 99 Asp 46 44 Thr 20 Ser Type IV Разные типы коллагена Type V A B 11 2, 5 2, 9 125 130 109 42 42 51 51 50 20 20 13 23 26 19 42 43 27 39 37 31 26 Glu 74 66 89 71 84 84 91 Pro 129 113 121 107 61 97 118 Gly 330 336 333 350 319 322 Ala 112 100 96 33 52 46 Val Gys 1 20 32 18 14 29 27 18 - - - 2 8 - - Met 8 6 9 8 10 11 8 Ile 6 16 9 13 30 16 19 Leu 18 32 26 22 54 35 39 Tyr 2 2 1 3 6 18 2, 1 Xhe 12 10 13 8 27 14 12 Hyl 4, 3 8 20 30 10 18 20 Lys 30 22 2 6 10 11 7, 3 Arg 49 51 51 46 33 68 50 3 Hyp 4 Hyp
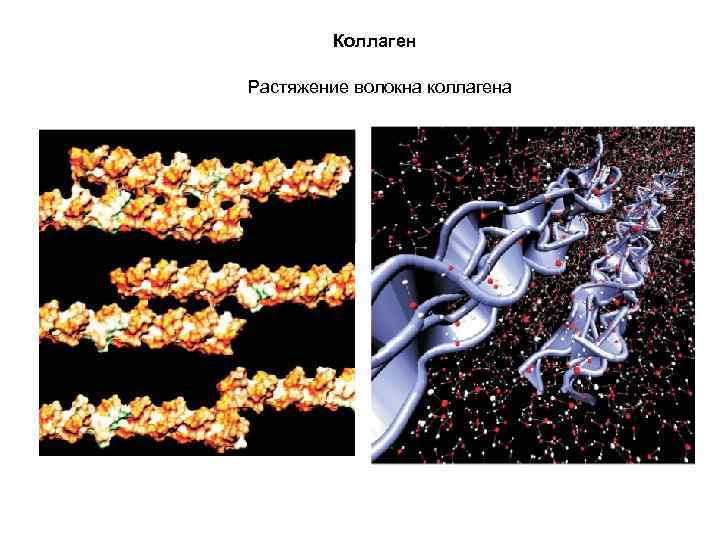
Коллаген Растяжение волокна коллагена

Эластин Волокна эластина в стенке артерии
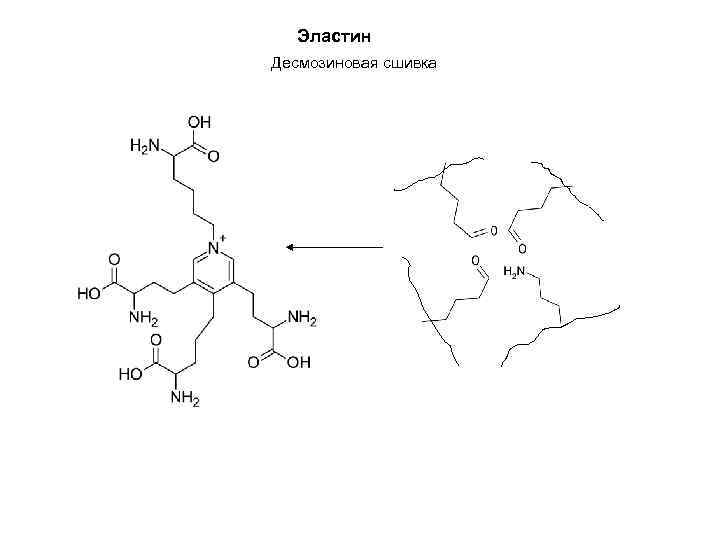
Эластин Десмозиновая сшивка

Природные белково-минеральные нанокомпозиты - Содержат компоненты разной функциональности: белковые филаменты – эластичные и структурные (сопротивление сж минеральные – твердость (сопротивление ударной нагрузке); различные орг. присадки (в т. ч. белковые) – адгезия, вязкость - Многоуровневая структурная иерархия (от молекулярных компонентов к макроструктурам) - Контролируемые размер, форма и расположение минеральных единиц - Контролируемая ориентация белковых фибрилл - Нековалентное взаимодействие между компонентами → компромисс между механической стабильностью и возможностью перестроек на разных уровнях перераспределение механической нагрузки за счет различных механизмов деформации
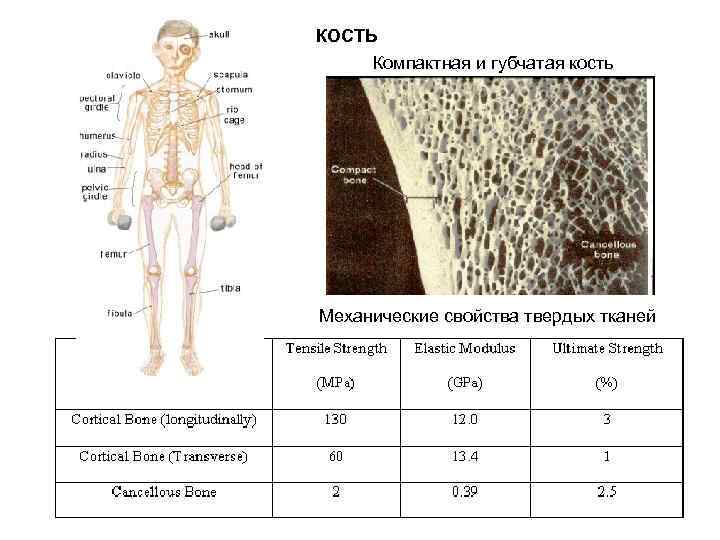
КОСТЬ Компактная и губчатая кость Механические свойства твердых тканей
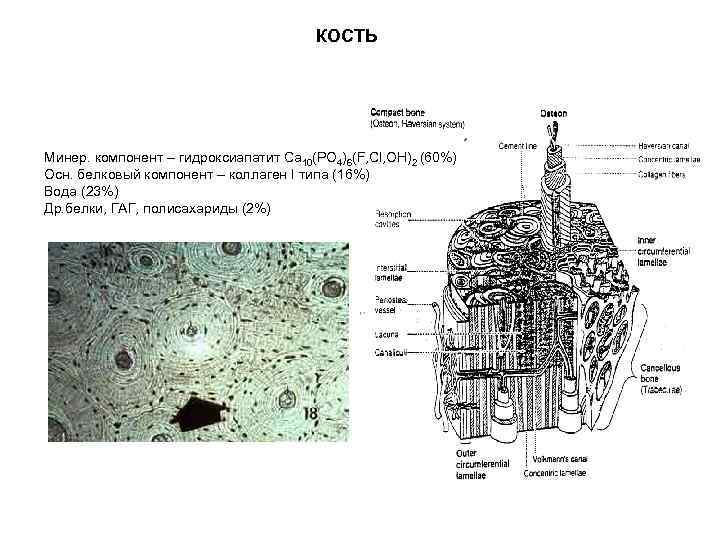
КОСТЬ Минер. компонент – гидроксиапатит Ca 10(PO 4)6(F, Cl, OH)2 (60%) Осн. белковый компонент – коллаген I типа (16%) Вода (23%) Др. белки, ГАГ, полисахариды (2%)
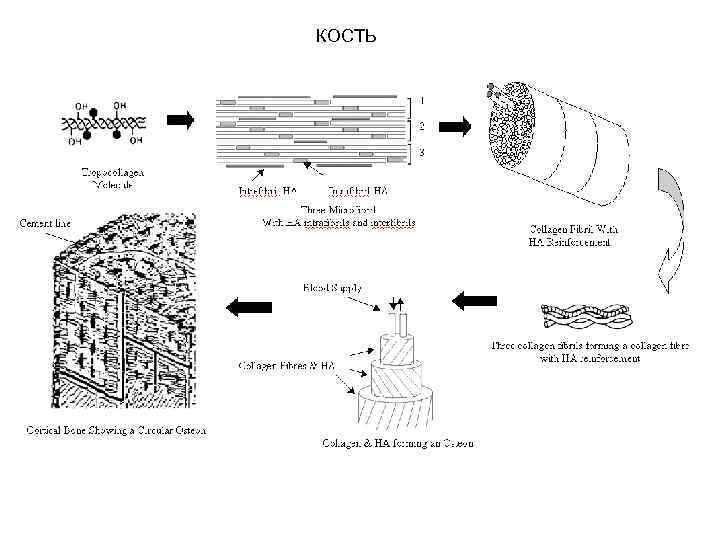
КОСТЬ
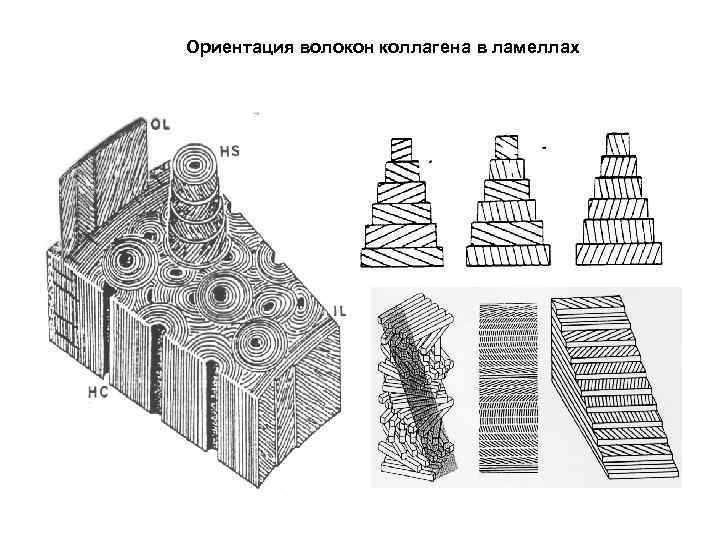
Ориентация волокон коллагена в ламеллах
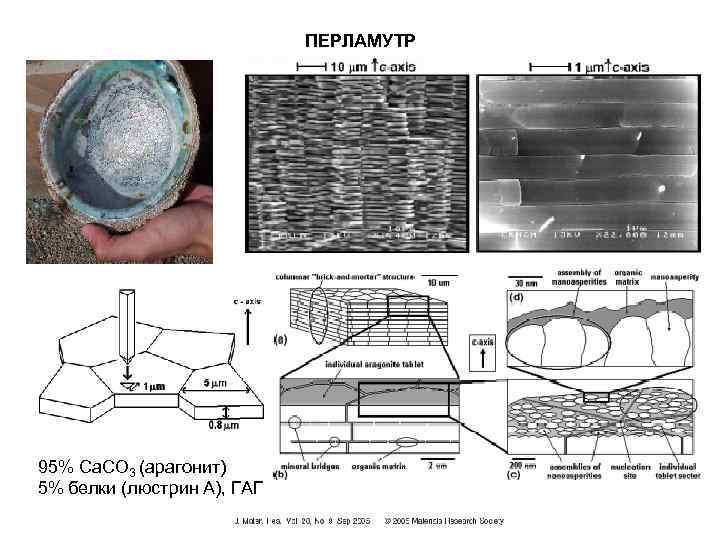
ПЕРЛАМУТР 95% Ca. CO 3 (арагонит) 5% белки (люстрин А), ГАГ
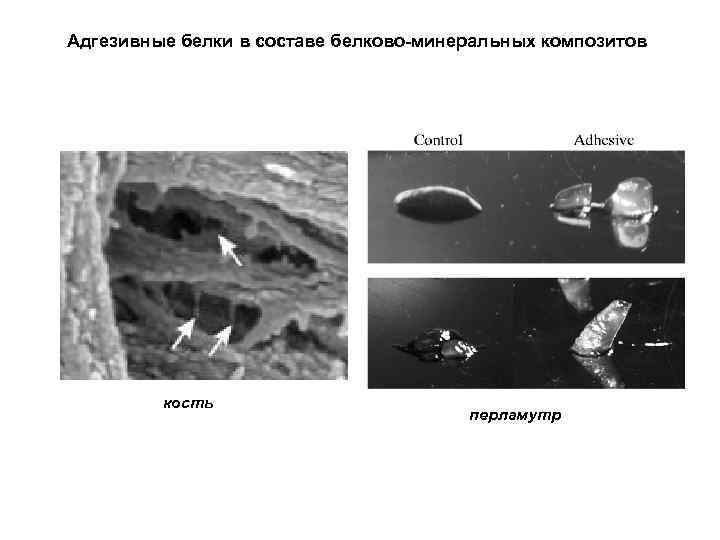
Адгезивные белки в составе белково-минеральных композитов кость перламутр
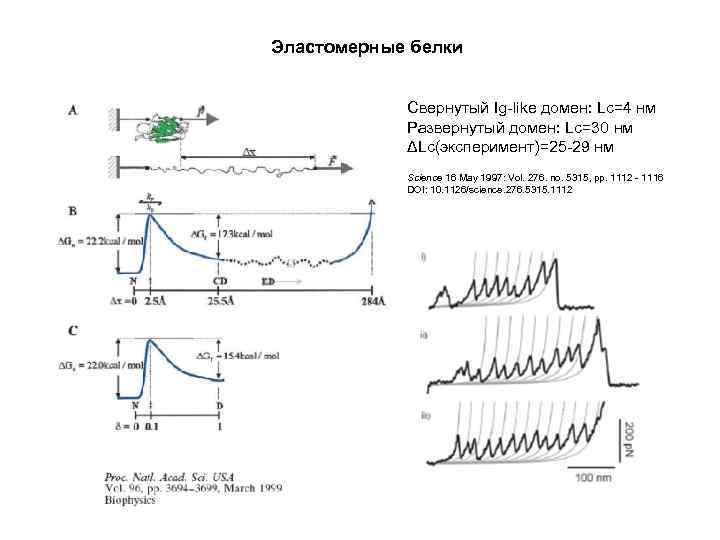
Эластомерные белки Свернутый Ig-like домен: Lc=4 нм Развернутый домен: Lc=30 нм ΔLc(эксперимент)=25 -29 нм Science 16 May 1997: Vol. 276. no. 5315, pp. 1112 - 1116 DOI: 10. 1126/science. 276. 5315. 1112
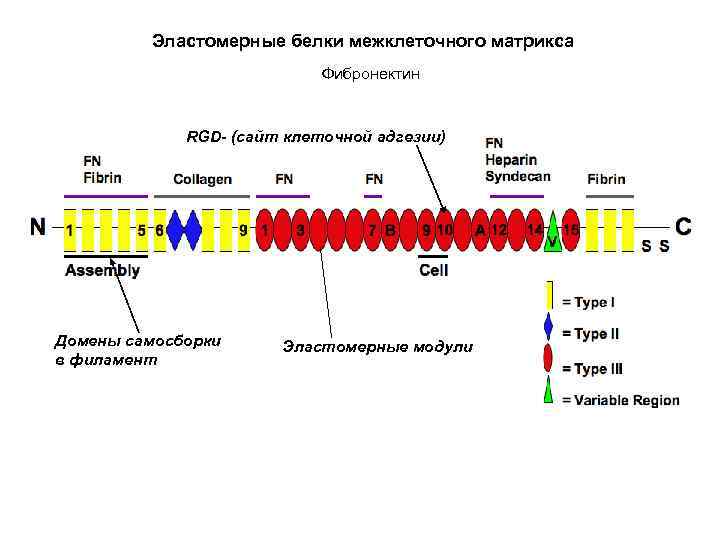
Эластомерные белки межклеточного матрикса Фибронектин RGD- (сайт клеточной адгезии) Домены самосборки в филамент Эластомерные модули
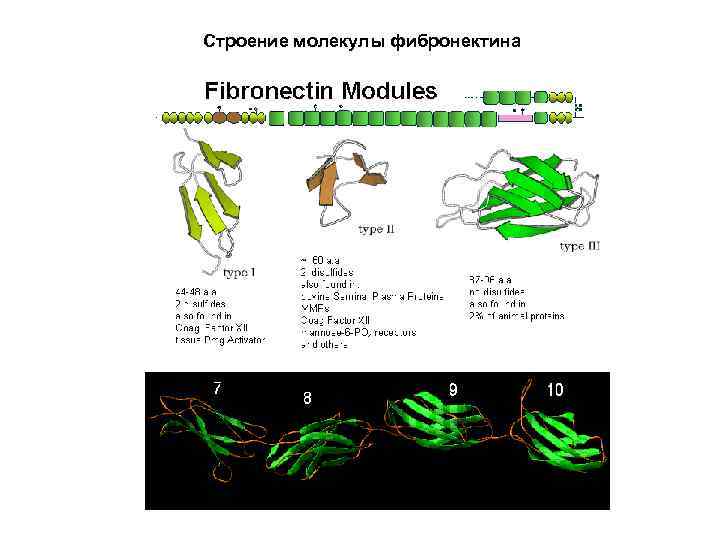
Строение молекулы фибронектина
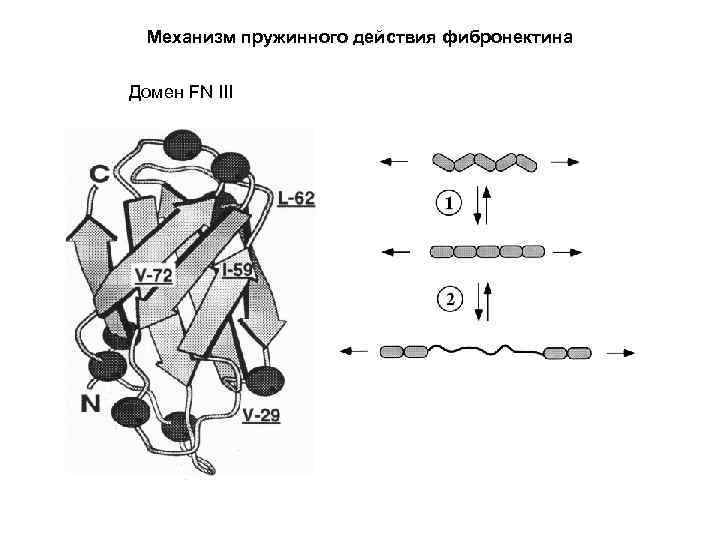
Механизм пружинного действия фибронектина Домен FN III
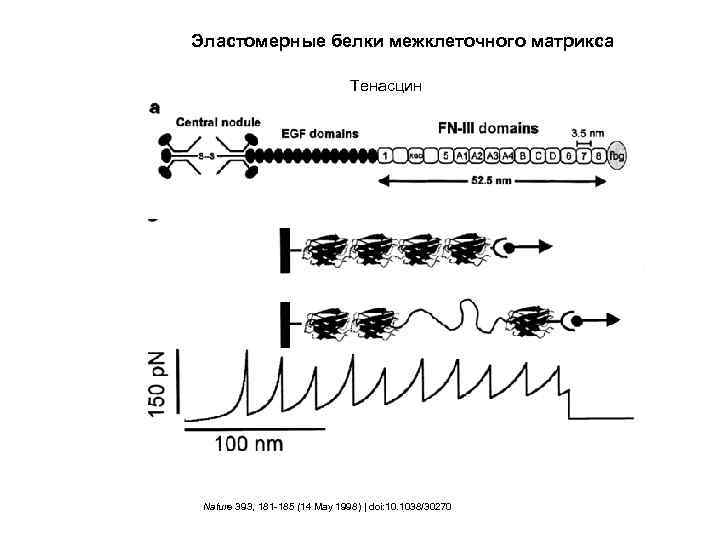
Эластомерные белки межклеточного матрикса Тенасцин Nature 393, 181 -185 (14 May 1998) | doi: 10. 1038/30270
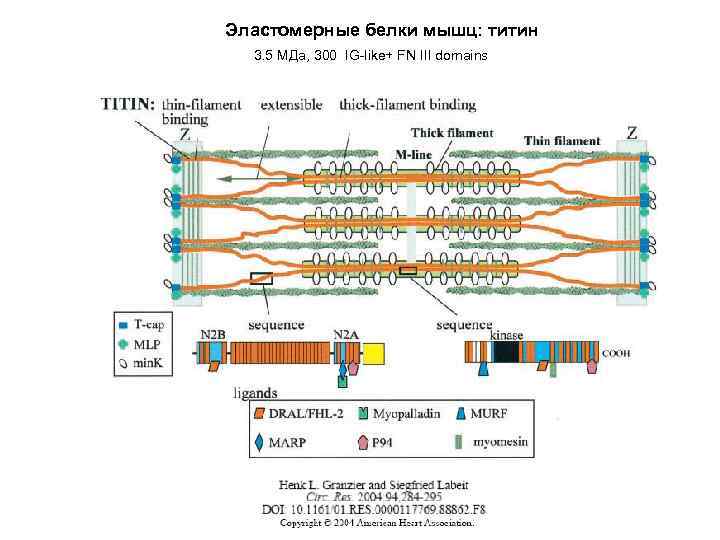
Эластомерные белки мышц: титин 3. 5 МДа, 300 IG-like+ FN III domains
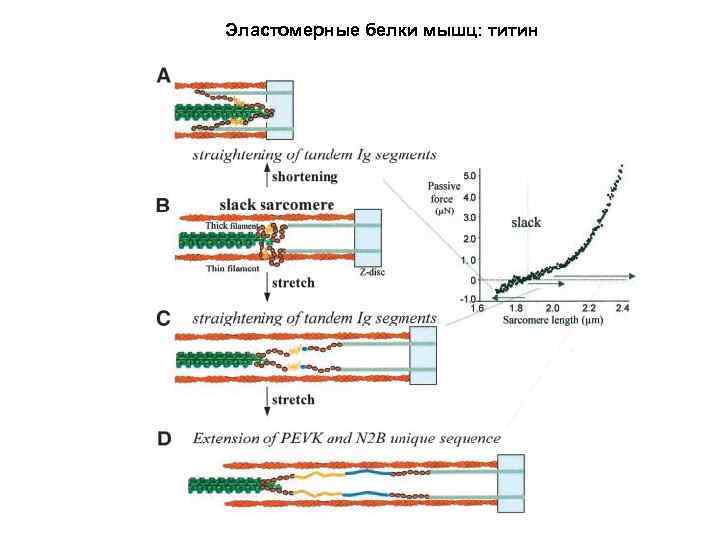
Эластомерные белки мышц: титин
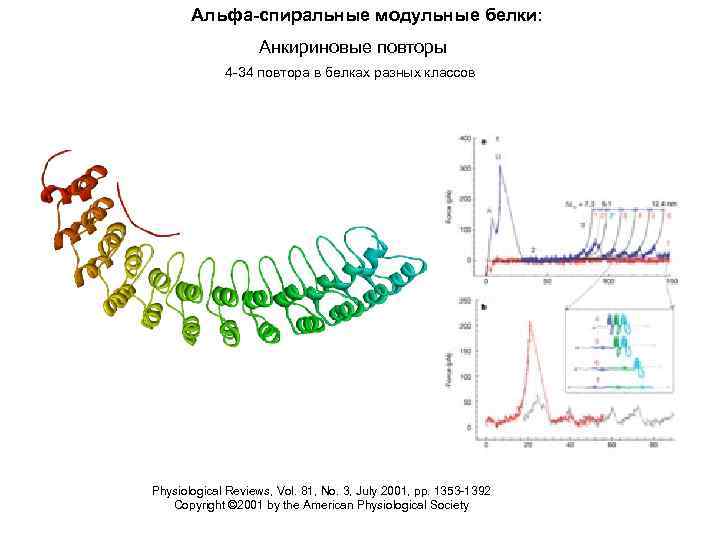
Альфа-спиральные модульные белки: Анкириновые повторы 4 -34 повтора в белках разных классов Physiological Reviews, Vol. 81, No. 3, July 2001, pp. 1353 -1392 Copyright © 2001 by the American Physiological Society
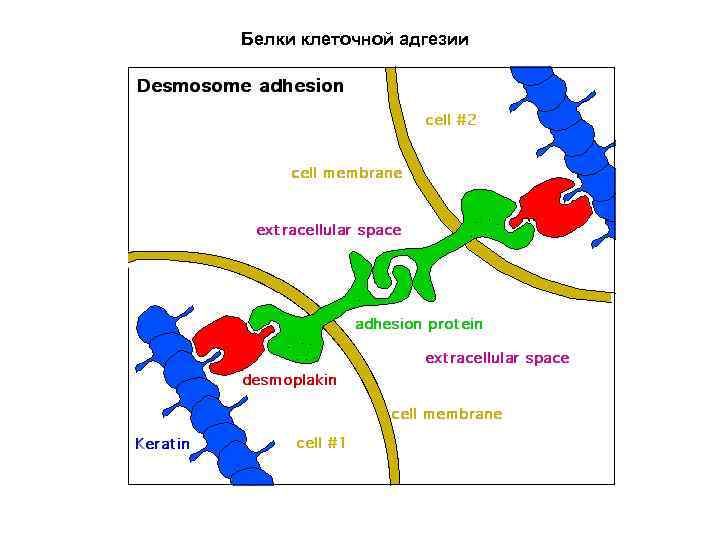
Белки клеточной адгезии
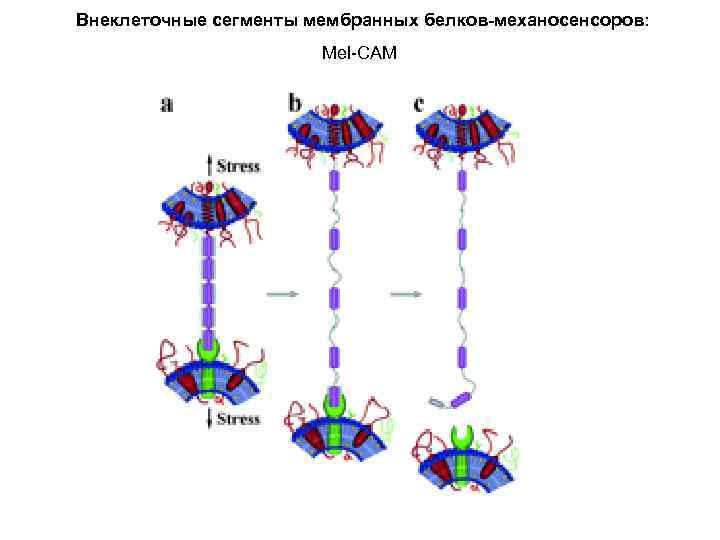
Внеклеточные сегменты мембранных белков-механосенсоров: Mel-САМ
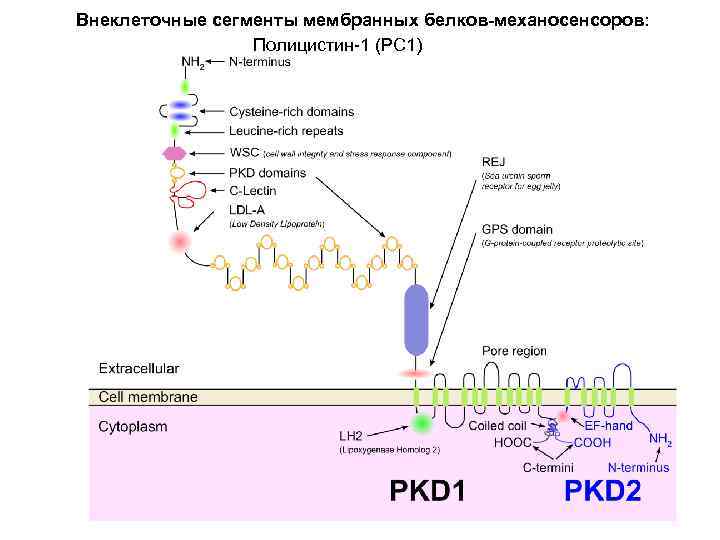
Внеклеточные сегменты мембранных белков-механосенсоров: Полицистин-1 (PC 1)
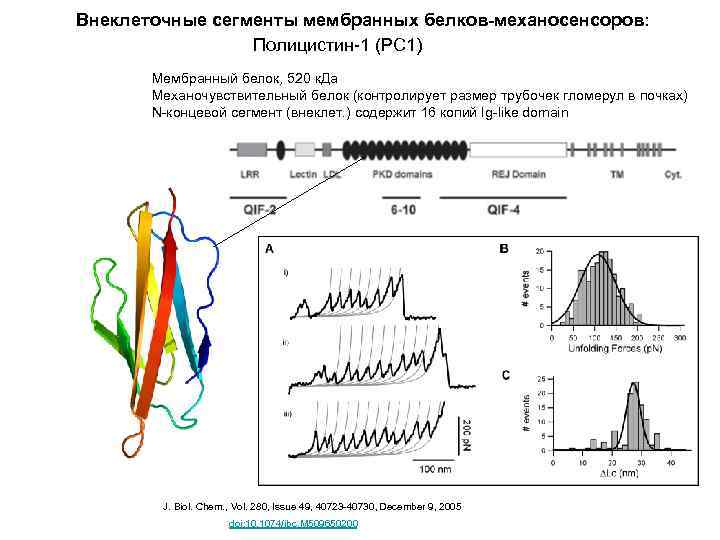
Внеклеточные сегменты мембранных белков-механосенсоров: Полицистин-1 (PC 1) Мембранный белок, 520 к. Да Механочувствительный белок (контролирует размер трубочек гломерул в почках) N-концевой сегмент (внеклет. ) содержит 16 копий Ig-like domain J. Biol. Chem. , Vol. 280, Issue 49, 40723 -40730, December 9, 2005 doi: 10. 1074/jbc. M 509650200
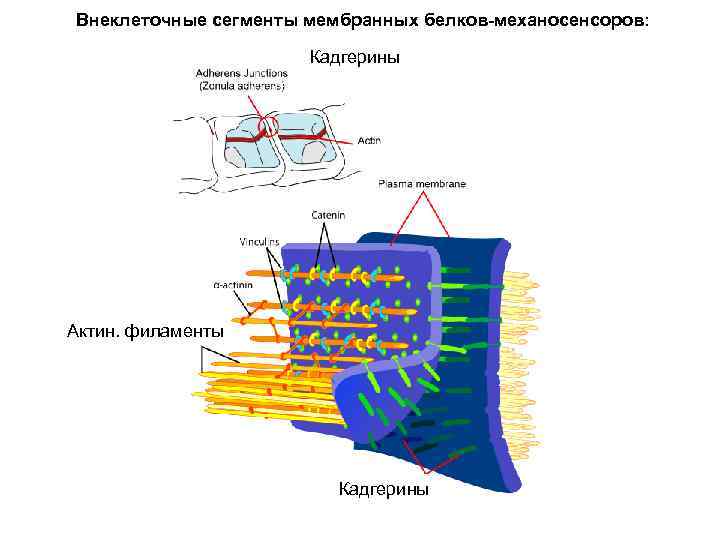
Внеклеточные сегменты мембранных белков-механосенсоров: Кадгерины Актин. филаменты Кадгерины
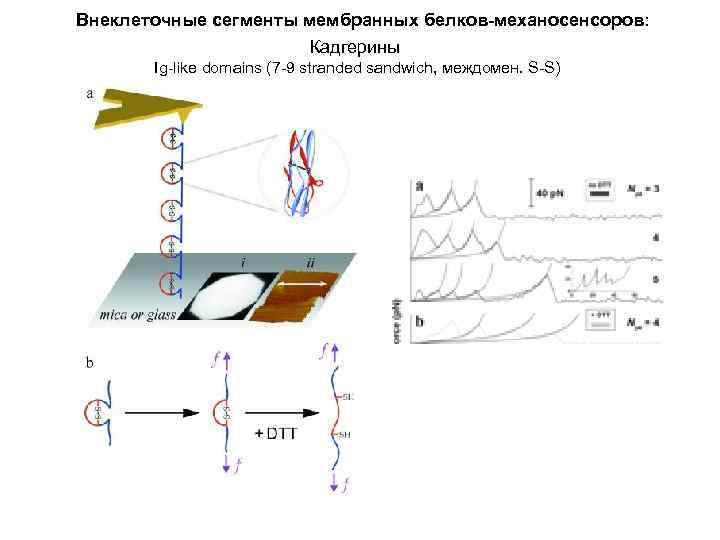
Внеклеточные сегменты мембранных белков-механосенсоров: Кадгерины Ig-like domains (7 -9 stranded sandwich, междомен. S-S)
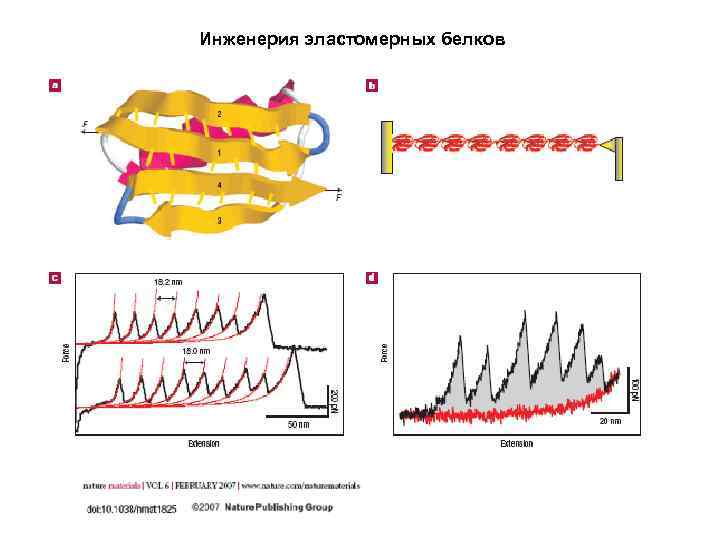
Инженерия эластомерных белков
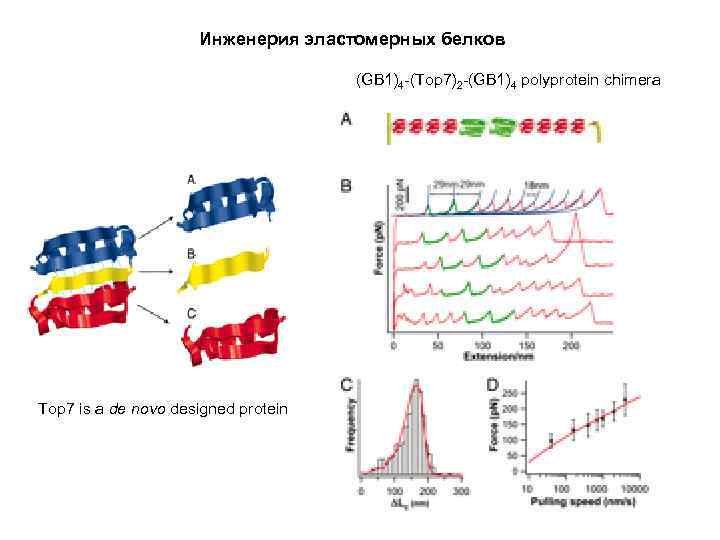
Инженерия эластомерных белков (GB 1)4 -(Top 7)2 -(GB 1)4 polyprotein chimera Top 7 is a de novo designed protein
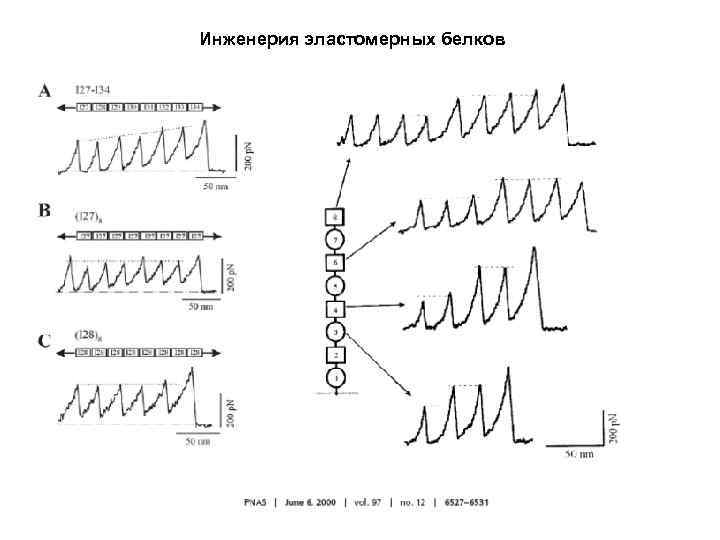
Инженерия эластомерных белков
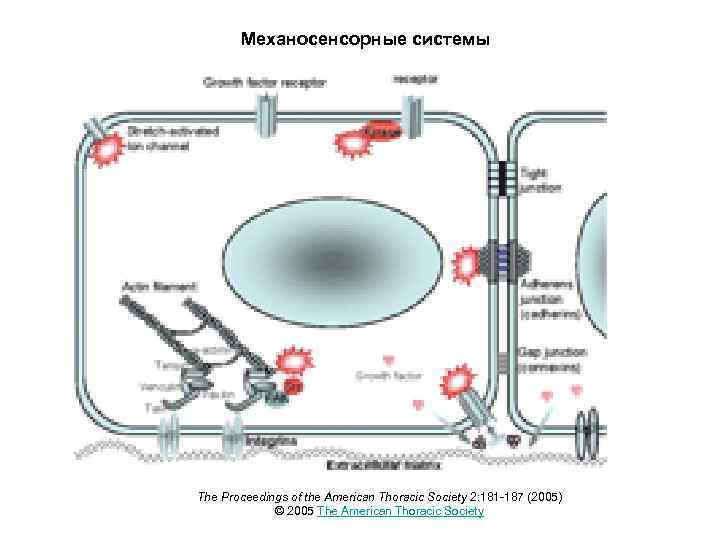
Механосенсорные системы The Proceedings of the American Thoracic Society 2: 181 -187 (2005) © 2005 The American Thoracic Society
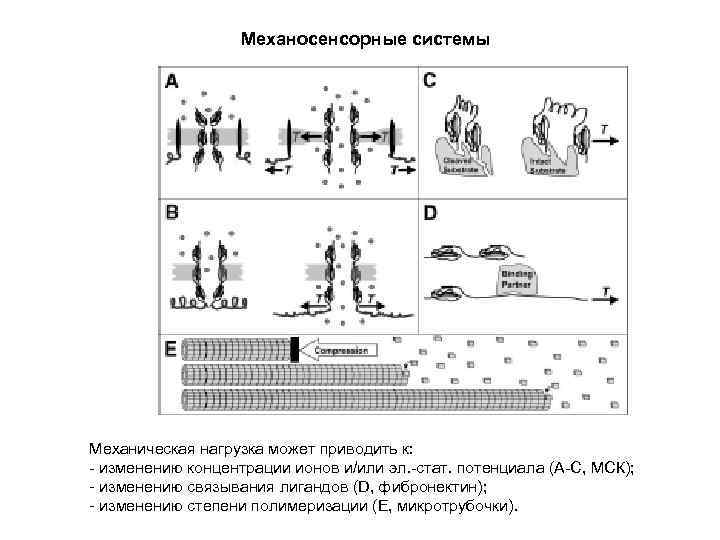
Механосенсорные системы Механическая нагрузка может приводить к: - изменению концентрации ионов и/или эл. -стат. потенциала (А-С, МСК); - изменению связывания лигандов (D, фибронектин); - изменению степени полимеризации (Е, микротрубочки).
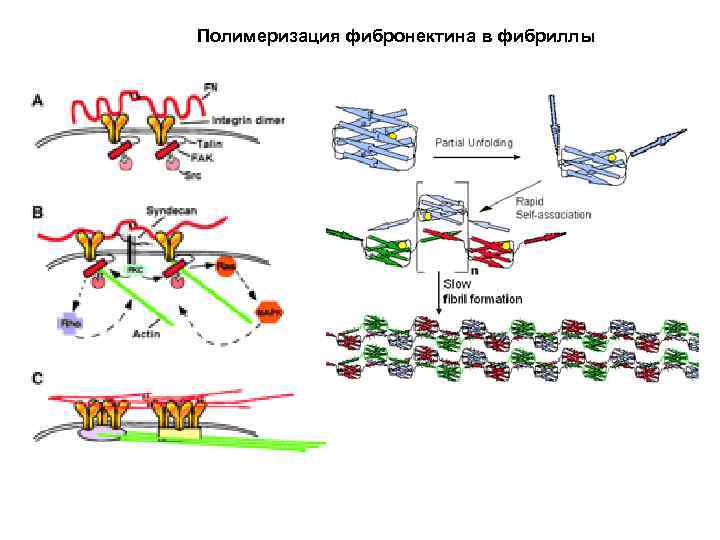
Полимеризация фибронектина в фибриллы
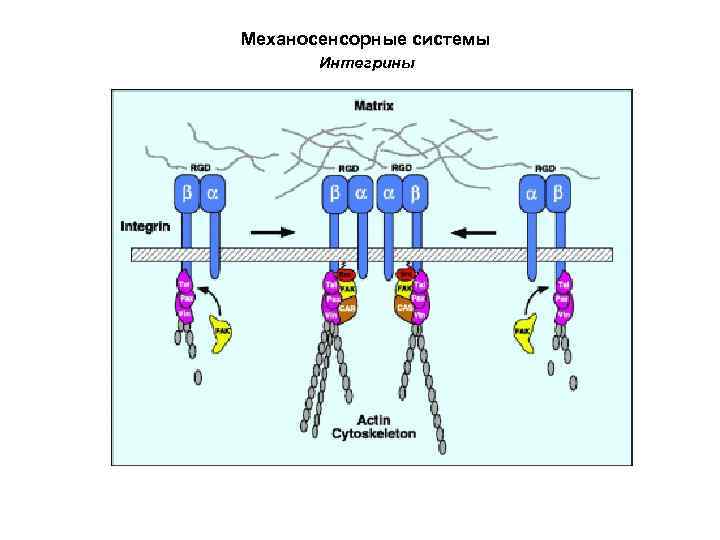
Механосенсорные системы Интегрины
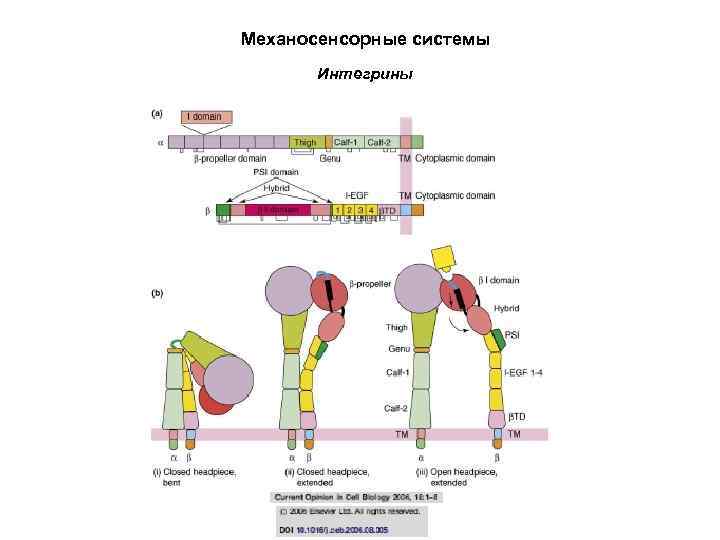
Механосенсорные системы Интегрины
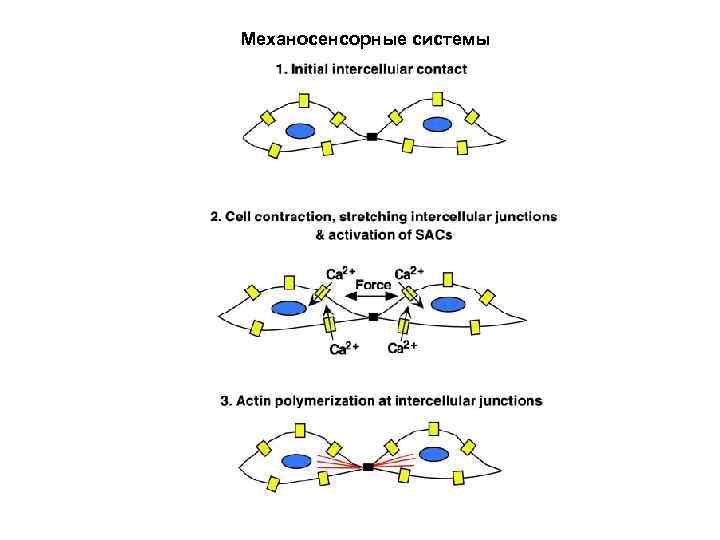
Механосенсорные системы
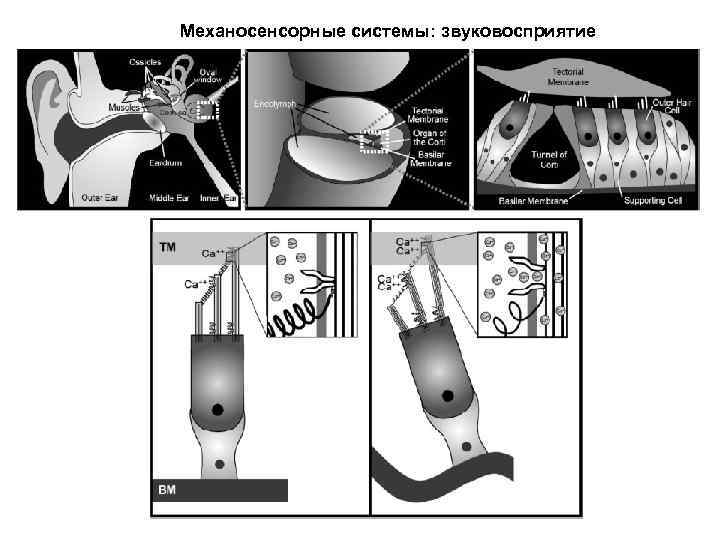
Механосенсорные системы: звуковосприятие
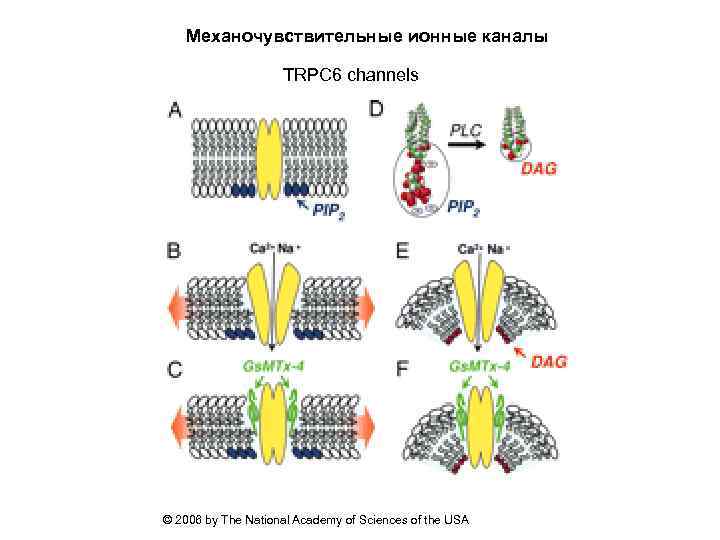
Механочувствительные ионные каналы TRPC 6 channels © 2006 by The National Academy of Sciences of the USA
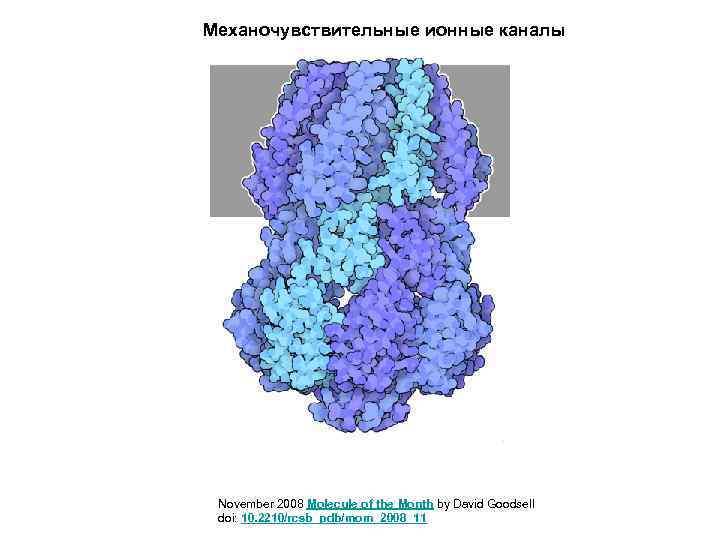
Механочувствительные ионные каналы November 2008 Molecule of the Month by David Goodsell doi: 10. 2210/rcsb_pdb/mom_2008_11
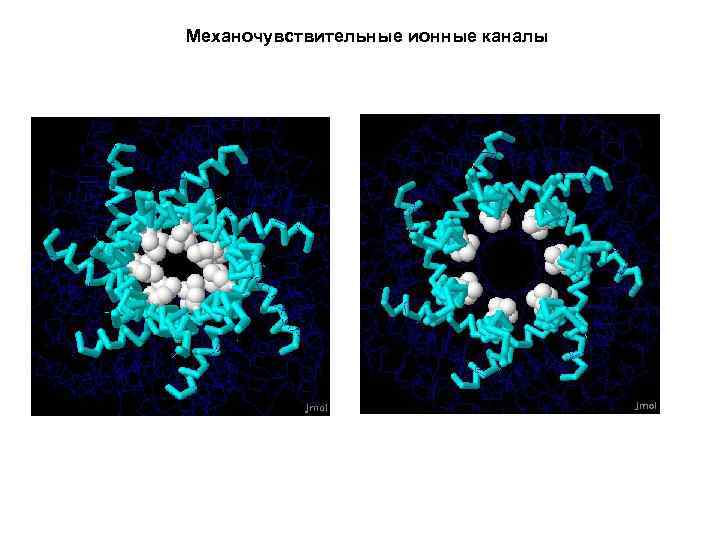
Механочувствительные ионные каналы
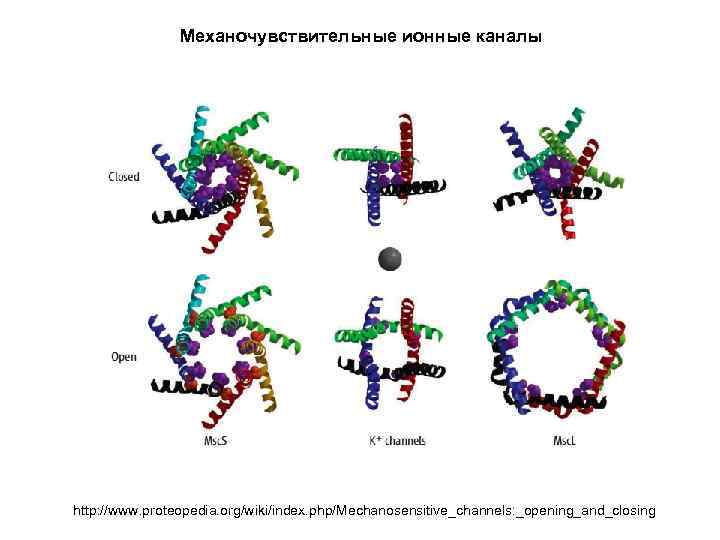
Механочувствительные ионные каналы http: //www. proteopedia. org/wiki/index. php/Mechanosensitive_channels: _opening_and_closing

Родина lecture 5.ppt