9f91ec22e53af694e0c461b17145ff27.ppt
- Количество слайдов: 34

Нанобиотехнологии МОЛЕКУЛЯРНОБИОЛОГИЧЕСКИЕ ОСНОВЫ НАНОБИОТЕХНОЛОГИИ к. х. н. , доцент кафедры микробиологии Герловский Денис Олегович Минск, 2015 1

Самосборка природных биологических наноструктур Процесс самосборки имеет ключевое значение для любых биологических систем. Все живые клетки состоят из сложных сетей, молекулярных машин и клеточных структур, которые спонтанно, путем самосборки образуются из простых строительных блоков. Это верно для любого организма, от самой примитивной бактерии, которая строит свои наномашины всего лишь из нескольких сотен белковых «блоков» , до млекопитающих, в «молекулярном арсенале» которых - десятки тысяч разнообразных белков. Сложные молекулярные машины, такие как рибосомы, состоят из десятков молекул белков и РНК, образующих высокоупорядоченные структуры с четким планом строения. Это один из важнейших примеров иерархической самосборки наномашин из простых строительных блоков. Сегодня мы рассмотрим основы процессов самосборки и самоорганизации биологических систем на примерах надмолекулярных структур, участвующих в функционировании 2 организма как в норме, так и при патологии.

Самоорганизация надмолекулярных сборок один из важнейших признаков биологических систем. В отличие от механизмов. созданных человеком, сложные трехмерные системы в живых организмах образуются путем спонтанной сборки простых строительных блоков. Таким образом, принцип «oт малого к большому» , который назван основным принципом нанотехнологии будущего, стал естественным выбором всех живых организмов. Альтернативный же подход «от большого к малому» удобен для традиционных микротехнологий. В большинстве случаев сборка сложных биосистем идет не по готовым «чертежам» , как в технике, а направляется процессами молекулярного узнавания и самосборки. В ходе этих процессов «плавающие» в растворе относительно простые строительные блоки узнают друга, связываются между собой и с другими молекулами, образуя высокоупорядочснную трехмерную структуру, способную выполнять определенные функции. 3
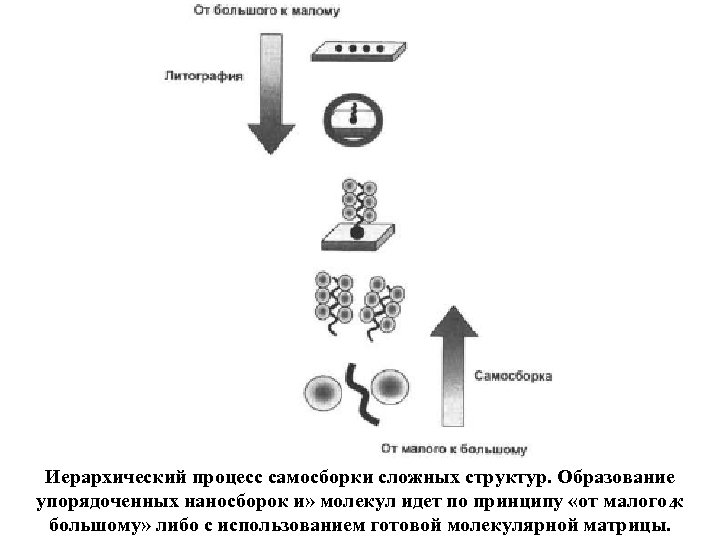
Иерархический процесс самосборки сложных структур. Образование упорядоченных наносборок и» молекул идет по принципу «от малого 4 к большому» либо с использованием готовой молекулярной матрицы.

Организации бактериальных S-слоев Одно из фундаментальных свойств неорганических наноматерналов самоорганизация в высокоупорядоченную кристаллическую или близкую к ней одно-, двух- или трехмерную структуру. Подобные свойства можно наблюдать и у биоматериалов из живых систем. Как будет показано, биологические сборки из таких материалов уже применяются в технике. Ярким примером могут служить двухмерные бактериальные S-слои, об использовании которых в нанотехнологии говорится уже много лет. Первым структуру, организацию и технологическое применение таких сборок исследовал Уве Слейтр (Uwe В. Slеytr) с коллегами (Sleytr et al. 2005). S-слои поверхностные структуры бактериальной клетки, обнаруженные у сотен видов бактерий, обладающих клеточной стенкой, и у всех архебактернй. Возможно, вам известно, что архебактерии это уникальная группа прокариот, включающая экстремальных термофилов и галлофилов (De. Long and Расе, 2001). Эта весьма интересная группа филогенетически обособлена oт бактерий и обладает некоторыми чертами сходства с эукариотами, особенно в отношении механизмов транскрипции и трансляции. Многие архебактерии экстремофилы (т. е. организмы, существующие только в экстремальных условиях среды). В этой группе есть галофилы - солелюбивые организмы, способные жить в солевых растворах с молярностью больше единицы (например, в водах Мертвого моря), и термофилы организмы, обитающие при высокой температуре (например, способные жить при температуре 5 свыше 100 °С).

Механизмы адаптации архебактерий и некоторых бактерий к таким экстремальным условиям можно было бы использовать для создания стабильных наноустройств, способных работать долгое время (низкая стабильность биомолекул - один из факторов, ограничивающих их использование). Структура S-слоя. Микрофотография получена путем замораживаниятравления с контрастированием металлом бактериальных клеток, 6 обладающих S-слоями с шестигранным ячейками. Длина масштабного отрезка - 100 им.

За миллиарды лет эволюции сборка S-слоев стала столь совершенной, что не имеет себе равных по упорядоченности и эффективности самосборки среди биологических систем. Эти плоские слои образуются из одного вида белков или гликобелков, молекулы которых собираются в единый слой, покрывающий поверхность клетки. Слой имеет симметричную ячеистую структуру с расстоянием между узлами от 3 до 30 нм. Толщина S-слоев варьирует от 5 до 15 нм, слои пропитаны порами диаметром 2 -6 нм. Об использовании этих наноструктур в нанотехнологии мы рассмотрим позже. Самоорганизации вирусов Другим примером хорошо изученного процесса самосборки биологических структур, обладающих потенциалом для использования в нанотехнологии, может служить спонтанная сборка вирусных капсидов на матрицах. Вирусы и бактериофаги весьма распространены в природе и представляют собой простейшие автономные биосистемы. Хотя вирусы не могут размножаться вне клетки хозяина, они все же являются независимыми системами, поскольку обладают собственным генетическим материалом, заключенным в оболочку. Наличие изолированного от внешнего мира компартмента с генетическим материалом критически важно для самовоспроизведения биологических систем. Это фундаментальный признак, отличающий сборку из молекул от живой системы. Как будет показано ниже, эту функцию в живых 7 организмах обычно выполняют липидные мембраны.

Интенсивнее других изучался вирус мозаики табака. Именно он стал первой молекулярной структурой, самосборка которой была продемонстрирована in vitro в 1957 г. В свой классической работе Френкель-Конрат и Вильяме показали спонтанное образование вирусных частиц при инкубации очищенных белков оболочки и РНК вируса. В этом случае, как и при самосборке рибосом, благодаря специфическому взаимодействию РНК и белков, происходит образование высокоупорядочснных трехмерных структур. Из этого наблюдения следует, что вся информация о молекулах, необходимая для сборки вируса, содержится в его строительных блоках. Далее эта структура образуется спонтанно, без подвода энергии извне, например в виде богатых энергией нуклеотидов (таких как АТФ). Это обстоятельство недвусмысленно свидетельствует о том, что образующаяся в результате самосборки структура является надмолекулярной структурой с минимальной свободной энергией. Первые исследования структуры ВТМ были выполнены в 1950 -х годах с использованием электронной микроскопии - тогда это был новый метод, вызвавший переворот во многих областях биологии. Оказалось, что вирусные частицы похожи на ровные полые стержни длиной около 300 нм, с внутренним диаметром - 4, а внешним 18 нм. Каждая вирусная частица включает более 2000 белковых субъединиц, расположенных по правозакрученной спирали, внутри которой находится молекула вирусной РНК. Процесс самосборки ВТМ начинается со связывания белковых субъединиц - двухслойных дисков, с определенным 8 местом или сайтом каркаса, роль которого играет вирусная РНК.
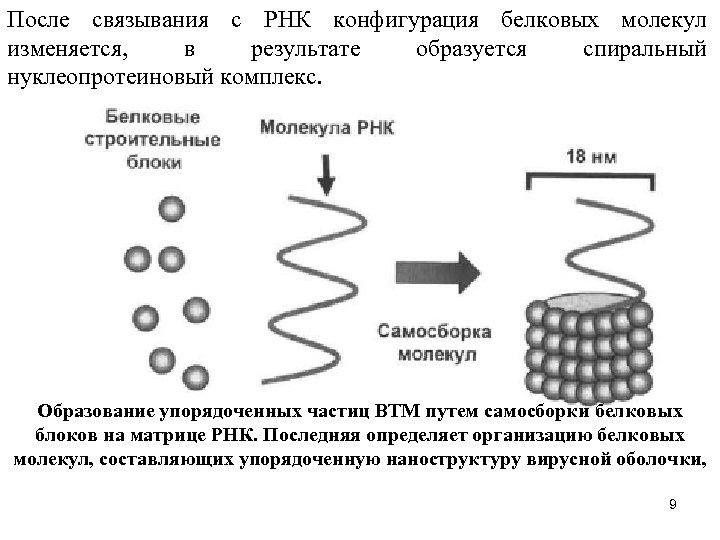
После связывания с РНК конфигурация белковых молекул изменяется, в результате образуется спиральный нуклеопротеиновый комплекс. Образование упорядоченных частиц ВТМ путем самосборки белковых блоков на матрице РНК. Последняя определяет организацию белковых молекул, составляющих упорядоченную наноструктуру вирусной оболочки, 9

Как и S-слои, наночаспшы ВТМ очень интересный для бионанотехнологии пример, поскольку по своей пространственной организации он очень похож на наноструктуры, образующиеся из неорганических соединений и углерода. Однако, в отличие от большинства наноструктур из чистого углерода и неорганических материалов, вирусные наночастицы образуются спонтанно, путем самосборки в мягких условиях. Некоторым исследователям удалось металлизировать частицы ВТМ путем химического восстановления, и использование в будущем генномодифицированных форм ВТМ, содержащих измененные белки, для решения различных задач нанотехнологии кажется вполне реальным. Другая распространенная форма упорядоченных вирусных сборок многогранник, сложенный из плоских субъединиц. Один из вариантов такой структуры - капсид в форме икосаэдра, Платонова тела, собранного из идентичных блоков. Подобные капсиды (пример - капсидов бактериофага φХ 174) сложены из треугольных блоков, каждый из которых образован тремя идентичными белковыми субъединицами. Таким образом, для сборки целого капсида требуется 60 белковых субъединиц. Обратите внимание на сходство икосаэдрального капсида с треугольными гранями и «квазиикосаэдра» фуллерена С 60, грани которого имеют пяти- и шестиугольную форму. 10
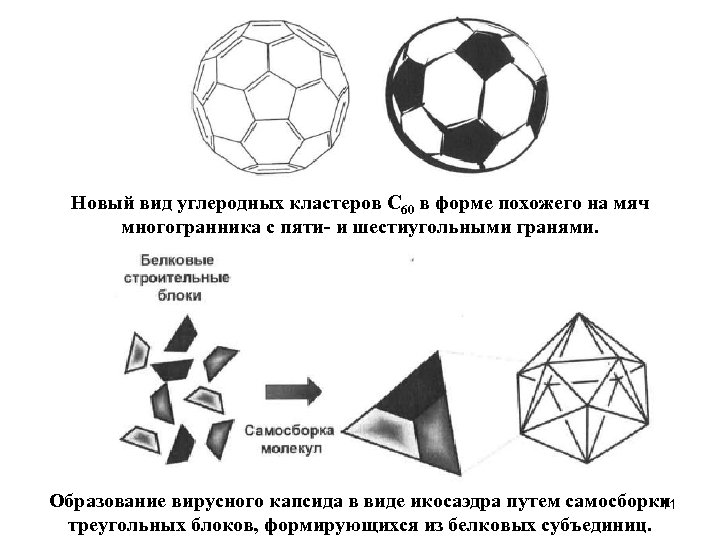
Новый вид углеродных кластеров С 60 в форме похожего на мяч многогранника с пяти- и шестиугольными гранями. Образование вирусного капсида в виде икосаэдра путем самосборки 11 треугольных блоков, формирующихся из белковых субъединиц.

Самоорганизация фосфолипидных мембран Важнейшим для любого живого организма процессом является спонтанное образование липидных бислоев из строительных блоков - молекул фосфолипидов. Подобно образованию фуллеренов из углерода и неорганических соединений, двуслойные биологические мембраны могут образовывать замкнутые объемные структуры сферической формы. Основной движущей силой образования липидных мембран являются гидрофобные взаимодействия. Фосфолипидные строительные блоки представляют сбой амфифильные молекулы, состоящие из гидрофильной головки, в роли которой выступает фосфатная группа, и гидрофобного хвоста алифатической цепи. При переносе в водный раствор молекулы фосфолипидов подвергаются быстрой спонтанной ассоциации, поскольку контакт алифатических хвостов с водой очень дорого обходится в энергетическом смысле. В результате образуются фосфолипидные бислои, в которых алифатические хвосты молекул направлены внутрь слоя и контактируют друг с другом, а гидрофильные головки оказываются на поверхности слоев и снаружи контактируют с водой, окружающей замкнутую фосфолипидную структуру, а внутри - с водой, расположенной в этой структуре. 12
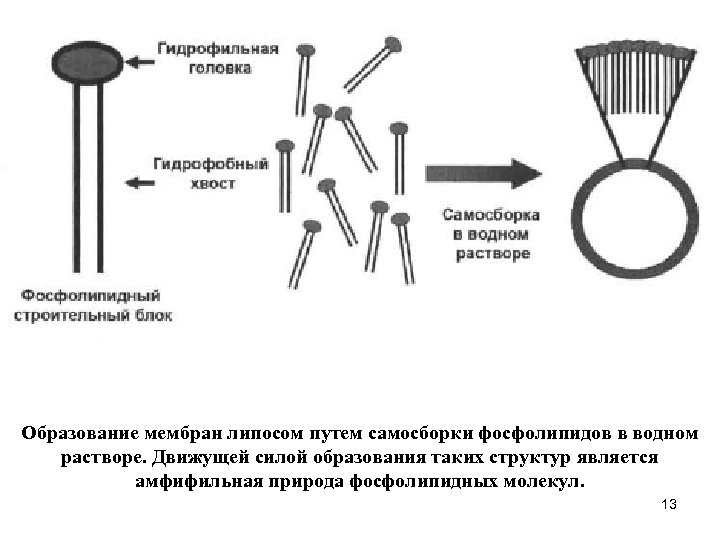
Образование мембран липосом путем самосборки фосфолипидов в водном растворе. Движущей силой образования таких структур является амфифильная природа фосфолипидных молекул. 13

Высушивание раствора фосфолипидов в неполярном органическом растворителе с последующим растворением в воде приводит к образованию структур, похожих на луковицы, крупных многослойных везикул (larger multilammelar vesicle, LMV) размером несколько микрон. Однако такие многослойные биологические структуры путем обработки ультразвуком или экструзии легко превратить в малые однослойные везикулы (small unilammelar vesicles, SUV), образованные единственным бислоем. Размер таких структур колеблется от 50 до нескольких сотен нм. Подобно другим материалам, существующим в виде слоев, фосфолипиды способны к образованию наноструктур иного вида, среди которых чаще всего встречается гак называемая гексагональная фаза. В определенных условиях фосфолипиды могут образовывать и трубчатые структуры, похожие на нанотрубки. Ультраструкгурный анализ липидных нанотрубок (Yager et al. , 1984; Yamada et al. , 1984; Nakashima et al. , 1995) подтверждает их сходство с углеродными и прочими нанотрбками. Это полые структуры диаметром меньше микрона, сборка которых происходит по тем же принципам, что и образование бислоев: спонтанное образование объемной упорядоченной структуры с меньшей свободной энергией из плоского бислоя. 14

Самосборка липидных нанотрубок из глюкопиранозиламидных липидов. Процесс идет с участием сил, но форма образующихся структур зависит от свойств гидрофильной головки липидных молекул. Тип объемной структуры (сфера или трубка) определяется геометрией молекулярных блоков и условиями, в которых происходит сборка. Заметим, что такие свойства (способность к образованию сферических либо трубчатых наноструктур) характерны для углерода и неорганических наноматриалов, описанных выше липидов и пептидов из ароматических аминокислот. Модель образования углеродных нанотрубок из плоского слоя, похожего на графит. На рисунке показана однослойная трубка, 15 бывают также двух- и многослойные.

Мелкие липидные везикулы или липосомы еще один тип хорошо изученных наночастиц. Еще до того, как нанотехнология вошла в моду, липосомы часто использовались в исследованиях как средство доставки лекарств. Один из самых ярких примеров использования липосом для этой цели препарат DOXIL, представляющий собой противораковое соединение доксорубицин. «упакованный» в липосомы. Инъекции этого препарата позволяют успешно бороться с рядом форм рака, и при введении в форме липосом он действует эффективнее и дает меньше побочных эффектов, чем при использовании обычного раствора. Отдельный интерес вызывают исследования SUV-липосом, несущих на поверхности особые молекулы в качестве средств адресной доставки лекарств. Для этого в поверхность везикулы с лекарствами для химиотерапии встраивают «систему наведения» , например рецептор, имеющий сродство к раковым клетками. Такое лечение должно быть более эффективным и вызывать намного меньше побочных эффектов. Интересно, что липосомы уже используются в косметической индустрии. Как утверждают производители, они обеспечивают проникновение витамина Е и других антиоксидантов во внутренние 16 слои кожи.

Нитчатые элементы цитоскелета Еще одни тип упорядоченных биологических наносборок строительные блоки цитоскелета, сложной сети белковых филаментов, пронизывающих цитоплазму и обеспечивающих механическую опору для клетки, внутриклеточную связь и транспорт. Основные нитчатые элементы цитоскелета актиновые филаменты, микротрубочки и промежуточные филаменты представляют собой нитевидные наноэлементы. Благодаря цитоскелету, клетки могут принимать самые разные формы, а также совершать координированные и направленные движения. Изменения сил деформации показали, что жесткость липидных нанотрубок велика по сравнению с другими упорядоченными наноструктурами. Актиновые филаменты (микрофиламенты) встречаются во всех эукариотных клетках. Структура строительных блоков этих филаментов молекул белка актина почти не изменилась в ходе эволюции. Обнаруженные в бактериях более древние аналоги актина, белки Fts. Z, также выполняют структурную функцию. По структуре эти белки представляют собой двухцепочечный полимер, закрученный в спираль диаметром около 7 нм. Эти структуры, обладающие значительной гибкостью, собраны в пучки различной толщины. Актиновые филаменты - основной компонент тонких нитей скелетных мышц, они также играют ключевую роль в обеспечении подвижности клетки. 17

Микротрубочки имеют вид полых цилиндров (внешний диаметр около 25 нм), образуются путем полимеризации строительных блоков, которыми являются молекулы белка тубулина. Микротрубочки намного жестче актиновых филаментов. Сеть микротрубочек прикреплена к расположенной в центре клетки структуре под названием центросома. Двигательные белки, такие как кинезин и динеины, транспортируют по клетке самые разные «грузы» , перемещаются вдоль микротрубочек. Кинезин перемешается только oт центросомы, а динеины напротив, только в направлении центросомы. Промежуточные филаменты напоминают растянутые по клетке «тросы» диаметром примерно 10 нм. Они получили свое название за размер, который больше, чем у актиновых филаментов, но меньше, чем у микротрубочек. В отличие от актиновых филаментов и микротрубочек, собранных из строительных блоков одного вида (соответственно актина и тубулина), промежуточные филаменты образованы разными белками из довольно «обширного и неоднородного» семейства. Филаменты этого типа выполняют разные функции: обеспечивают опору для клетки и образуют сеть вокруг ядерной мембраны. 18
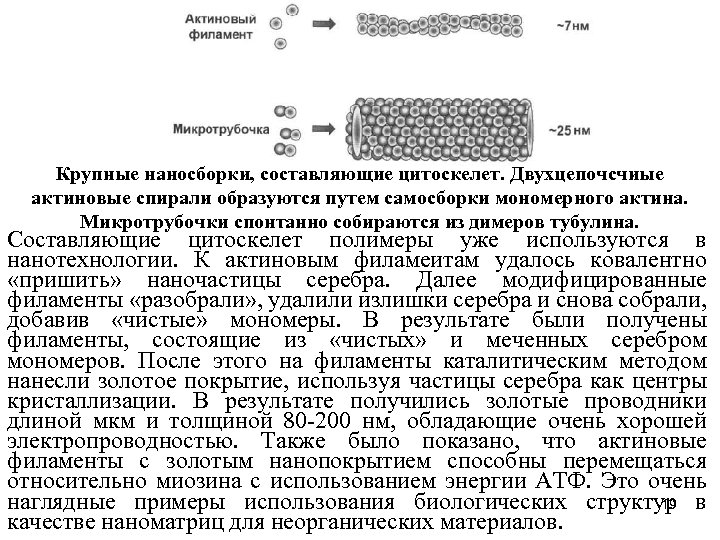
Крупные наносборки, составляющие цитоскелет. Двухцепочсчиые актиновые спирали образуются путем самосборки мономерного актина. Микротрубочки спонтанно собираются из димеров тубулина. Составляющие цитоскелет полимеры уже используются в нанотехнологии. К актиновым филамеитам удалось ковалентно «пришить» наночастицы серебра. Далее модифицированные филаменты «разобрали» , удалили излишки серебра и снова собрали, добавив «чистые» мономеры. В результате были получены филаменты, состоящие из «чистых» и меченных серебром мономеров. После этого на филаменты каталитическим методом нанесли золотое покрытие, используя частицы серебра как центры кристаллизации. В результате получились золотые проводники длиной мкм и толщиной 80 -200 нм, обладающие очень хорошей электропроводностью. Также было показано, что актиновые филаменты с золотым нанопокрытием способны перемещаться относительно миозина с использованием энергии АТФ. Это очень наглядные примеры использования биологических структур в 19 качестве наноматриц для неорганических материалов.

Нуклеиновые кислоты как матрицы для нанотехнологий Большинству студентов знакома двойная спираль ДНК (дезоксирнбонуклеиновая кислота). Открывшие ее в 1953 г. Уотсон и Крик получили в 1962 г. Нобелевскую премию. Долгое время это соединение не считали типичным наноматериалом, но спиральная молекула ДНК представляет собой характерную упорядоченную наноструктуру. Ее диаметр составляет около 2 нм, длинна варьирует от нескольких нм до многих микрон (длина каждой пары основании 0, 34 нм). Двойная спираль ДНК формируется спонтанно путем самосборки комплементарных цепей, в которых цитозин (Ц) из одной цепи взаимодействует с гуанином (Г) из другой цепи, а тимин (Т) «находит» и противоположной цепи аденин (А). Общая структура стабилизируется взаимодействием ароматических колец азотистых оснований, подобное наблюдается и в других наноструктурах, речь о которых пойдет позже. Молекулы РНК (рибонуклеиновой кислоты) также образуют сложные наноструктуры. В отличие от ДНК, эти структуры одноцепочечные, а их образование направляется внутримолекулярными (а не межмолекулярными) взаимодействиями. В результате образуются сложные трехмерные структуры, такие как транспортная РНК (т. РНК и компоненты наномашин рибосом). 20

Большинство первых работ по применению ДНК в качестве строительного материала для наноструктур выполнил Нэдриен Зееман из Нью-Йоркского университета (Seeman, 2005). Он получил комплементарные спирали ДНК, способные формировать сложные двухмерные структуры и даже нанокубы. Похоже, что ДНК очень привлекательный материал для нанотехнологий, поскольку ее молекулы достаточно термостабильны по сравнению с белками. Кроме того, благодаря революционному прорыву в генетической инженерии стал возможен грандиозный прогресс и в области химии ДНК. Теперь можно сравнительно дешево синтезировать большие количества очень крупных олигомеров ДНК и подвергать их химической модификации. 21

Другая важная работа, в которой использовалась ДНК как наноматериал - создание металлических нанопроводников на матрице ДНК (Braun et al. , 1998). Подробно об этом рассказывается позже, но суть работы в покрытии молекул ДНК серебром для получения нанопроводников. Следующий шаг в работе той же группы исследователей разработка белковой литографии на ДНК-матрицах (Keren et al. , 2002). Здесь ДНКсвязывающий белок, Rec. A, используется для защиты определенных участков молекулы ДНК от нанесения металлического покрытия. Таким образом, можно кодировать участки ДНК, подлежащие химической модификации, определенной последовательностью нуклеотидов. В принципе, используя сайты, которые точно опознаются белковыми молекулами, можно очень точно «разметить» участки ДНК для нанесения металлического покрытия. Короткие олигонуклеотиды могут выполнять в организме структурную и ряд других функций. Так, показано, что небольшие молекулы РНК, известные как рибозимы, могут обладать разнообразной ферментативной активностью, которая наблюдается, например, у некоторых РНК-компонентов рибосом. Позже это свойство было открыто у множества малых молекул РНК и ДНК. Также было показано, что некоторые олигомеры нуклеиновых кислот (аптамеры) специфически связывают различные лиганды. 22

Олигосахариды и полисахариды. Олиго- и полисахариды это полимеры, состоящие из молекул сахаров, соединенных гликозидными связями. Эти связи образуются при реакции альдегидной или кетогруппы одной молекулы с гидроксильной группой другой молекулы сахара. Небольшие полимерные молекулы сахаров с линейной либо разветвленной структурой называются олихосахаридами. Так, гликоген - этот длинный олигомер, образованный из глюкозных мономеров, собранных в крупную разветвленную молекулу. Большинство полисахаридов, построенных из одинаковых мономеров, выполняют функции запасания энергии. Сложные полисахариды, такие как пептидогликан - комплекс сахаридов, связанных с белковой матрицей, - служат механическим нанокаркасом для бактериальных клеток. Различные олигосахариды также играют роль в молекулярном узнавании компонентами иммунной системы различных бактерий и выработке антител, специфичных к этим полисахаридным структурам. Возможности применения олигосахаридов в нанотехнологиях еще не исследованы, но в будущем это направление может оказаться очень важным. 23

Амилоидные фибриллы - биологические наноструктуры, образующиеся путем самосборки. Как уже говорилось, большинство молекулярных структур, функционирующих в живых организмах в норме, образуется путем самосборки. Другой класс структур, образующихся тем же путем, приводит к развитию патологий. Амилоидные сборки - это нанофибрилы, обычно возникающие при ряде заболеваний различной этиологии. В качестве примера можно привести болезнь Альцгеймера, диабет 2 типа, вторичный амилоидоз, а также прионные заболевания, такие как губчатая энцефалопатия, или «коровье бешенство» . В зависимости от заболевания, амилоидные сборки обнаруживаются в различных органах и тканях (например, в мозгу при болезни Альцгеймера и в поджелудочной железе при диабете II типа). Ультраструктурный анализ амилоидных сборок с помощью электронной микроскопии (ЭМ) и атомной силовой микроскопии (АСМ) показал, что эти образования достигают 7 -10 нм в диаметре и длины несколько микрон. Эти фибриллы, обладающие высокоупорядоченной структурой, имеют вид волокон с четко выраженной меридиональной картиной дифракции рентгеновских лучей (размер 4, 6 -4, 8 А). Их каноническая вторичная структура вытянутый β-слой, диаметр 7 -10 нм, после окрашивания Конго красным наблюдается сильное двойное лучепреломление. Регулярная структура фибрилл, выявляемая вдоль длинной оси, в сочетании с классическими механизмами кристаллизации и роста позволило назвать процесс образования амилоидных фибрилл 24 «одномерной кристаллизацией» .
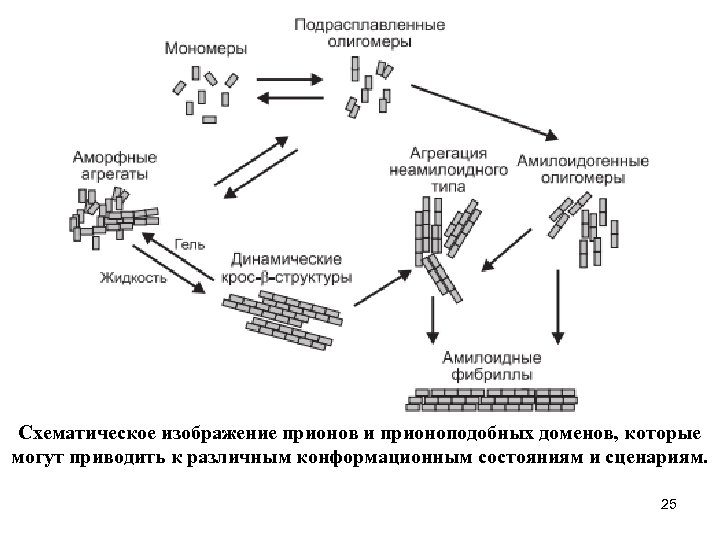
Схематическое изображение прионов и прионоподобных доменов, которые могут приводить к различным конформационным состояниям и сценариям. 25

Раньше амилоидным наносборкам приписывали исключительно патологическую роль, но последние исследования четко показали, что эти структуры могут выполнять важные физиологические функции. Первые указания на возможную физиологическую роль амилоидных фибрилл были получены при исследовании образования биопленок бактерией Escherichia coli. Оказалось, что этому процессу способствует самосборка мажорного белка Csg. A в типичные амилоидные фибриллы. Это открытие стало важной вехой в развитии представлений об амилоидных фибриллах как участницах нормальных физиологических, а не только патологических процессов. Дальнейшие исследования выявили роль амилоидных структур в образовании воздушных гиф бактерии Streptomyces coelicolor. Также показано, что возникающие путем самосборки амилоидные структуры участвуют в образовании дрожжевого приона, возможно, сыгравшего важную роль в эволюции дрожжевых грибов. Уже доказано, что амилоидные фибриллы могут служить строительными блоками для наноэлектроники на примере модифицированного белка дрожжевого приона, использованного в качестве матрицы для выращивания нанопроводников. При этом наночастицы золота, связанные с белковой молекулой посредством цистеиновых остатков, добавленных методами генной инженерии, доращивались до непрерывных нанопроводников. Принципы узнавания в самосборке амилоидных фибрилл, а именно взаимодействие типа «ключ замок» на основе ароматических группировок, позже были использованы для проектирования и 26 изготовления нанотрубок и наносфер.

Паутина и шелк - природные надмолекулярные сборки из фибриллярных белков Паутина и шелк - природные надмолекулярные структуры нитчатой формы, близкие к амилоидным фибриллам. Эти фибриллы сложены главным образом из двух видов белковых молекул, связывающихся в микроскопические нити за счет точного молекулярного узнавания и самосборки. Замечательное свойство шелковых нитей выдающаяся прочность и гибкость. Хотя такие нити являются нековалентно связанными надмолекулярными структурами, паутина намного прочнее и более гибкая, чем равная по толщине стальная нить. Столь необычные механические свойства обеспечивают функциональность и прочность паутины и шелковых коконов. Это яркий пример уникальных свойств надмолекулярных биоматериалов, демонстрирующий их превосходство над традиционными неорганическими и органическими материалами. 27

Самосборка может давать и настоящие молекулярные машины. Самой сложной биологической наномашиной, структура которой описана с разрешением на уровне отдельных атомов, является рибосома - гибридный механизм из РНК и белков, производящий новые белки. Рибосома, следуя программе, записанной в матричной РНК (м. РНК), собирает различные белки в ходе процесса под названием трансляция. Рибосома - очень сложный формирующийся путем самосборки комплекс диаметром примерно 200 нм. Рибосома состоит из двух субъединиц, каждая из них содержит одну или две очень крупные молекулы РНК (называемые рибосомальными РНК, или р. РНК). Типичная бактериальная рибосома состоит из 55 различных белков и трех молекул РНК. Этот сложный комплекс образуется путем спонтанной самосборки. На самом деле, смешав очищенные компоненты рибосом в пробирке, можно получить работоспособную рибосому. Самосборка рибосомы происходит поэтапно и координированно. Первые белки специфическим образом связываются с крупной молекулой РНК, что делает возможным связывание следующих белков, и т. д. , пока не получится работоспособная рибосома с типичной структурой. Некоторые аспекты этого процесса напоминают самосборку намного более простого ВТМ. Как и в случае ВТМ, некоторые молекулы, а именно РНК, служат матрицей для координированной спонтанной самосборки, также приводящей к образованию структуры с наименьшей свободной энергией, но значительно 28 превышающей ВТМ по сложности.

Довольно много известно и о процессах передачи и копирования генетической информации, которые также выполняются весьма сложными комплексами. Разные молекулярные машины отвечают за копирование биологических носителей информации - молекул ДНК - и переписывание их в м. РНК - форму, пригодную для ввода информации в рибосомы. Клеточные белки, называемые факторами транскрипции, включают и выключают реализацию этой информации в зависимости oт внешних условий либо (в случае многоклеточного организма) стадии дифференциации клетки. Другие машины клетки поддерживают целостность ДНК, выявляя и исправляя ошибки. Они, например, отвечают за репарацию повреждений ДНК, вызванных радиацией. При неполадках в работе этих механизмов резко возрастает вероятность онкологических заболеваний. Белки, синтезированные на рибосомах в процессе реализации генетической информации, находятся в динамическом биохимическом равновесии. В клетке имеются машины для разборки белков на составляющие их аминокислотные блоки. Время полураспада типичного белка варьирует от нескольких минут до нескольких суток. Деградация белков координированный процесс, который выполняют в клетке сложные молекулярные машины. Белки, предназначенные для разборки, помечаются особой меткой, в роли которой выступает белок убиквитин. Помеченные или, как говорят, убиквитинированные, белки подвергаются разборке с участием сложных молекулярных комплексов - протеосом. Протеосома - это наномашина в форме вытянутого цилиндра диаметром около 10 и длиной несколько десятков нм. Протеосомы разбирают комплексы белковых молекул с убиквитином с 29 использованием энергии АТФ на отдельные аминокислоты.

Биологические нанодвигатели: кинезин и динеин Живые организмы могут создавать нанодвигатели, которые на несколько порядков меньше самых маленьких моторов, созданных человеком. Два типа биологических двигателя кинезин и динеин, называемые также белками, связанными с микротрубочками (Microtubule Associated Proteins, MAP). Эти биодвигатели транспортируют грузы - органеллы, везикулы и другие компоненты цитоскелета (Marx et al. , 2005), двигаясь вдоль микротрубочек, как поезда по рельсам. Кинезины влекут грузы от центросомы (это так называемый антероградный транспорт), а динеины - к центросоме (ретроградный транспорт). Энергию, необходимую для перемещения белковых двигателей вдоль микротрубочек, предоставляют молекулы АТФ. Кинезиновый мотор намного меньше и проще динеинового: молекулярный вес кинезина и динеина 380 000 и больше 1 000 соответственно, поэтому кинезиновый комплекс интенсивно изучался. Молекула кинезина содержит три домена: два крупных головных домена глобулярной формы, связывающих АТФ и обеспечивающих движение, и длинный биспиральный хвостовой домен, соединяющий головные домены и связывающий груз. Эксперименты с очищенным кинезином и микротрубочками позволили расшифровать, молекулярные механизмы движения. Оказалось, что этот мотор перемещается шагами по 8 нм и обладает тягой около 6 пиконьютон. 30

Другие нанодвигатели: жгутики и реснички Другая форма механического движения живых систем основана на движении ресничек и жгутиков. Подобные «водные двигатели» характерны для бактерий, простейших и сперматозоидов. Движение эукариотических организмов с помощью ресничек обеспечивают те же молекулярные механизмы, что приводят в движение динеиновый двигатель. Это наноустройсгво, преобразующее химическую энергию в механическую, необходимую для движения разных элементов. Еще один тип биологического наномотора – F 0 -АТФаза. Он встречается у бактерий и в митохондриях-энергетических станциях эукариотной клетки, ведущих свое начало от прокариот. В митохондриях этот белковый комплекс используется для синтеза АТФ. Движение мотора за счет протондвижущей силы приводит к синтезу АТФ. У бактерий точно такой же двигатель «крутится» в обратную сторону, сообщая бактериальной клетке движение за счет энергии гидролиза АТФ. 31

Ионные каналы: селективные нанопоры Другой тип наносборок с особыми функциями - трансмембранные ионные каналы, уже упоминавшиеся в этой главе. Белки этого класса в результате самосборки образуют внедренные в мембрану селективные фильтры, пропускающие одни ноны и задерживающие другие. Наиболее распространены натриевые, калиевые и кальциевые каналы. Эти каналы играют ключевую роль в электрофизиологических процессах, обеспечивающих управление мышцами со стороны центральной нервной системы. Современные представления о структурных основах высокой селективности ионных наноканалов сформировались под влиянием работ Родерика Маккинона (Roderick Mac. Kinnon). Он первый кристаллизовал белок ионного канала и определил его структуру с высоким разрешением, за что получил в 2003 г. Нобелевскую премию по медицине. Позже была определена структура ряда других ионных каналов. Данные о структуре, биохимии и биофизике каналов будут использованы при проектировании селективных нанофильтров в будущем. 32

Молекулярные сборки, выполняющие функции каналов, очень широко распространены в природе и встречаются во всех организмах. У высших организмов имеется несколько форм каналов каждого типа, управляемых разными сигналами - физическими (каналы, управляемые напряжением) и химическими (каналы, управляемые лигандами). Это реальные примеры прецизионных наноклапанов, открывающихся и закрывающихся под действием внешнего управляющего сигнала. Замечательные свойства этих каналов стимулировали попытки использования в нанодетекторах и наносенсорах природных каналов, а также разработку искусственных наноканалов. Образование пор в клеточной мембране происходит в результате действия токсинов, вырабатываемых некоторыми организмами. Такие токсины внедряются в липидную мембрану и образуют в ней сквозные поры. В результате возникает неконтролируемый ток ионов через мембрану, который приводит к расстройству функций и часто к гибели клетки. Такие токсины, вызывающие образование нанопор, уже используются в нанотехнологии. Например, αгемолизин, образующий поры диаметром 2 нм, используется для транспорта через мембраны нуклеиновых кислот. Создав трансмембранный потенциал, удается перемещать через мембрану даже крупные молекулы ДНК и РНК. Предполагается, что мониторинг изменений трансмембранного тока, сопровождающих перемещение олигонуклеотидов через поры, ляжет в основу метода для быстрого секвенирования ДНК, который найдет широкое 33 применение в геномике и диагностике.

СПАСИБО ЗА ВНИМАНИЕ 34
9f91ec22e53af694e0c461b17145ff27.ppt