лекарственные вещества_2_общая.PPT
- Количество слайдов: 156
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНІВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ МЕТОДОЛОГИЯ И ОСОБЕННОСТИ ХИМИКОТОКСИКОЛОГИЧЕСКОГО АНАЛИЗА ЛЕКАРСТВЕННЫХ И НАРКОТИЧЕСКИХ ВЕЩЕСТВ План лекции: 1. Основные причины отравлений и характеристика основных токсикологически важных лекарственных средств. 2. Методология и особенности химико-токсикологического анализа лекарственных и наркотических веществ. доктор фармацевтических наук, профессор Бондарь Владимир Степанович
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНІВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ МЕТОДОЛОГИЯ И ОСОБЕННОСТИ ХИМИКОТОКСИКОЛОГИЧЕСКОГО АНАЛИЗА ЛЕКАРСТВЕННЫХ И НАРКОТИЧЕСКИХ ВЕЩЕСТВ План лекции: 1. Основные причины отравлений и характеристика основных токсикологически важных лекарственных средств. 2. Методология и особенности химико-токсикологического анализа лекарственных и наркотических веществ. доктор фармацевтических наук, профессор Бондарь Владимир Степанович
 Лекарственные средства как токсиканты По статистике лекарственные средства являются причиной приблизительно 50 % всех случаев острых отравлений химическими веществами. 2
Лекарственные средства как токсиканты По статистике лекарственные средства являются причиной приблизительно 50 % всех случаев острых отравлений химическими веществами. 2
 Основные причины отравлений лекарственными средствами Передозировка: – неумышленная (случайная); – умышленная (суицидальная и др. криминальные). Комбинированная фармакотерапия (ежегодно в США госпитализируют около 9 млн пациентов – 1 % с летальными последствиями). Причины отравлений Доступность в аптечной сети (безрецептурный отпуск). Побочные действия при использовании в терапевтических дозах. Наркомания, токсикомания, алкоголизм. 3
Основные причины отравлений лекарственными средствами Передозировка: – неумышленная (случайная); – умышленная (суицидальная и др. криминальные). Комбинированная фармакотерапия (ежегодно в США госпитализируют около 9 млн пациентов – 1 % с летальными последствиями). Причины отравлений Доступность в аптечной сети (безрецептурный отпуск). Побочные действия при использовании в терапевтических дозах. Наркомания, токсикомания, алкоголизм. 3
 Задачи, которые решает химико-токсикологический анализ лекарственных и психоактивных веществ Установление причины отравления – судебно-медицинская экспертиза Определение концентрации лекарств и/или их метаболитов в различных органах и тканях – терапевтический лекарственный мониторинг Определение концентрации лекарств и их метаболитов в различных органах и тканях – определение биоэквивалентности лекарств при их регистрации Освидетельствование живых лиц Установление факта употребления психоактивных веществ 4
Задачи, которые решает химико-токсикологический анализ лекарственных и психоактивных веществ Установление причины отравления – судебно-медицинская экспертиза Определение концентрации лекарств и/или их метаболитов в различных органах и тканях – терапевтический лекарственный мониторинг Определение концентрации лекарств и их метаболитов в различных органах и тканях – определение биоэквивалентности лекарств при их регистрации Освидетельствование живых лиц Установление факта употребления психоактивных веществ 4
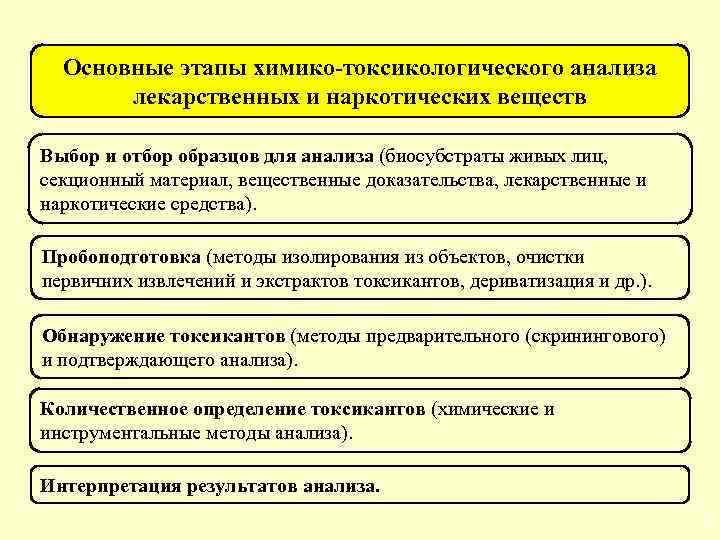 Основные этапы химико-токсикологического анализа лекарственных и наркотических веществ Выбор и отбор образцов для анализа (биосубстраты живых лиц, секционный материал, вещественные доказательства, лекарственные и наркотические средства). Пробоподготовка (методы изолирования из объектов, очистки первичних извлечений и экстрактов токсикантов, дериватизация и др. ). Обнаружение токсикантов (методы предварительного (скринингового) и подтверждающего анализа). Количественное определение токсикантов (химические и инструментальные методы анализа). Интерпретация результатов анализа. 5
Основные этапы химико-токсикологического анализа лекарственных и наркотических веществ Выбор и отбор образцов для анализа (биосубстраты живых лиц, секционный материал, вещественные доказательства, лекарственные и наркотические средства). Пробоподготовка (методы изолирования из объектов, очистки первичних извлечений и экстрактов токсикантов, дериватизация и др. ). Обнаружение токсикантов (методы предварительного (скринингового) и подтверждающего анализа). Количественное определение токсикантов (химические и инструментальные методы анализа). Интерпретация результатов анализа. 5
 Особенности отбора образцов для анализа у живых лиц Фальсификация образца (подмена, разбавление, загрязнение и др. ). Факторы снижения эффективности определения содержания токсиканта в образце Интерференция в тестировании с целью получения ложноотрицательного результата (маскировка тестов для определения наркотиков). Производство наркосиндикатами готовых форм, которые содержат химические вещества для маскировки применения наркотиков. 6
Особенности отбора образцов для анализа у живых лиц Фальсификация образца (подмена, разбавление, загрязнение и др. ). Факторы снижения эффективности определения содержания токсиканта в образце Интерференция в тестировании с целью получения ложноотрицательного результата (маскировка тестов для определения наркотиков). Производство наркосиндикатами готовых форм, которые содержат химические вещества для маскировки применения наркотиков. 6
 Особенности пробоподготовки Пробоподготовка – это процесс перевода пробы в форму, приемлимую и удобную для выполнения анализа. Предварительная оброботка образца (крови, мочи и секционного материала). Дериватизация – процесс превращения токсиканта в удобную для анализа форму, без изменения его основной структуры. Основные этапы пробоподготовк и Выделение (изолирование) токсикантов из объектов исследования общими и специальными (частными) методами. Очистка первичных извлечений и екстрактов токсикантов. 7
Особенности пробоподготовки Пробоподготовка – это процесс перевода пробы в форму, приемлимую и удобную для выполнения анализа. Предварительная оброботка образца (крови, мочи и секционного материала). Дериватизация – процесс превращения токсиканта в удобную для анализа форму, без изменения его основной структуры. Основные этапы пробоподготовк и Выделение (изолирование) токсикантов из объектов исследования общими и специальными (частными) методами. Очистка первичных извлечений и екстрактов токсикантов. 7
 Особенности предварительной пробоподготовки образца Кровь (разрушение связи токсиканта с белками): • действие амфифильными растворителями; • действие химическими факторами (трихлоруксусная кислота, соли тяжёлых металлов); • термообработка (для стойких веществ). Методы предварительной обработки образца Секционный материал (печень, почки, мышечная ткань и др. ): • гомогенизация; • замораживание; • лиофилизация. Моча (разрушение конъюгатов): • кислотный гидролиз; • ферментативный гидролиз (смесь β-сульфатазы и β-глюкуронидазы). 8
Особенности предварительной пробоподготовки образца Кровь (разрушение связи токсиканта с белками): • действие амфифильными растворителями; • действие химическими факторами (трихлоруксусная кислота, соли тяжёлых металлов); • термообработка (для стойких веществ). Методы предварительной обработки образца Секционный материал (печень, почки, мышечная ткань и др. ): • гомогенизация; • замораживание; • лиофилизация. Моча (разрушение конъюгатов): • кислотный гидролиз; • ферментативный гидролиз (смесь β-сульфатазы и β-глюкуронидазы). 8
 Особенности изолирования токсикантов Изолирование (выделение) – это процесс экстракции токсиканта из объекта. Жидкость-жидкостная экстракция – основана на распределении токсиканта между двумя несмешивающимися фазами (вода и органический растворитель). Микроволновая экстракция – основана на применении микроволнового излучения. Методы экстракции токсикантов Екстракция на жидкостных мембранах – основана на применении полупроницаемых жидких фаз. Твердофазная экстракция – основана на применении специальных картриджей, содержащих сорбент (силикагель и др. ). 9
Особенности изолирования токсикантов Изолирование (выделение) – это процесс экстракции токсиканта из объекта. Жидкость-жидкостная экстракция – основана на распределении токсиканта между двумя несмешивающимися фазами (вода и органический растворитель). Микроволновая экстракция – основана на применении микроволнового излучения. Методы экстракции токсикантов Екстракция на жидкостных мембранах – основана на применении полупроницаемых жидких фаз. Твердофазная экстракция – основана на применении специальных картриджей, содержащих сорбент (силикагель и др. ). 9
 Метод жидкость-жидкостной экстракции Характерной особенностью выделения токсикантов методом жидкость-жидкостной экстракции является их способность к образованию ионизированных и неионизированных (молекулярных) форм в водных растворах в зависимости от р. Н среды и константы ионизации. Константа ионизации для кислот p. Ka = p. H + lg [HA] – lg [A-] Макс. экстракция при р. Н=р. Ка + 2 Константа ионизации для оснований p. Ka = p. H + lg [В] – lg [ВН+] Макс. экстракция при р. Н=р. Ка - 2 В условиях метода жидкость-жидкостной экстракции при р. Н=2 -3 в органическую фазу экстрагируют свободные кислоты и вещества кислотного характера в молекулярной форме. При р. Н=9 -10 в органическую фазу экстрагируют вещества основного характера в молекулярной форме. 10
Метод жидкость-жидкостной экстракции Характерной особенностью выделения токсикантов методом жидкость-жидкостной экстракции является их способность к образованию ионизированных и неионизированных (молекулярных) форм в водных растворах в зависимости от р. Н среды и константы ионизации. Константа ионизации для кислот p. Ka = p. H + lg [HA] – lg [A-] Макс. экстракция при р. Н=р. Ка + 2 Константа ионизации для оснований p. Ka = p. H + lg [В] – lg [ВН+] Макс. экстракция при р. Н=р. Ка - 2 В условиях метода жидкость-жидкостной экстракции при р. Н=2 -3 в органическую фазу экстрагируют свободные кислоты и вещества кислотного характера в молекулярной форме. При р. Н=9 -10 в органическую фазу экстрагируют вещества основного характера в молекулярной форме. 10
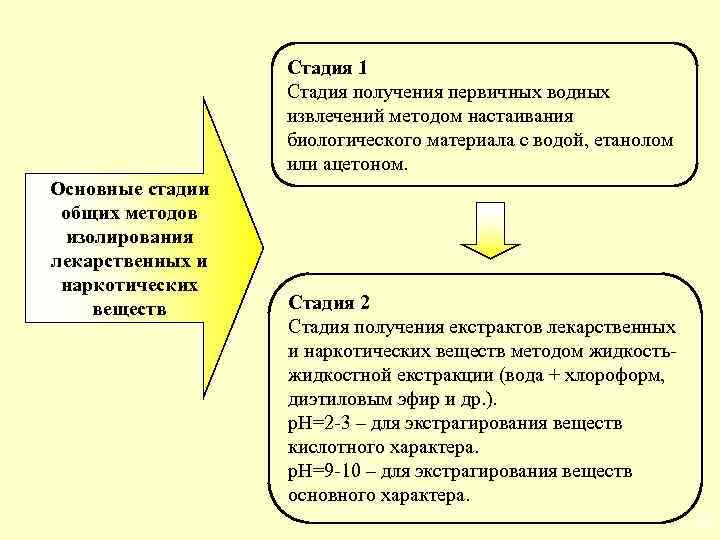 Стадия 1 Стадия получения первичных водных извлечений методом настаивания биологического материала с водой, етанолом или ацетоном. Основные стадии общих методов изолирования лекарственных и наркотических веществ Стадия 2 Стадия получения екстрактов лекарственных и наркотических веществ методом жидкостьжидкостной екстракции (вода + хлороформ, диэтиловым эфир и др. ). р. Н=2 -3 – для экстрагирования веществ кислотного характера. р. Н=9 -10 – для экстрагирования веществ основного характера. 11
Стадия 1 Стадия получения первичных водных извлечений методом настаивания биологического материала с водой, етанолом или ацетоном. Основные стадии общих методов изолирования лекарственных и наркотических веществ Стадия 2 Стадия получения екстрактов лекарственных и наркотических веществ методом жидкостьжидкостной екстракции (вода + хлороформ, диэтиловым эфир и др. ). р. Н=2 -3 – для экстрагирования веществ кислотного характера. р. Н=9 -10 – для экстрагирования веществ основного характера. 11
 Физико-химические свойства токсиканта, температура среды, присутствие электролитов. Природа кислоты, которую используют для подкисления биологического материала (минеральные кислоты гидролизуют эфиры токсикантов – атропин, кокаин). Факторы, влияющие на степень екстракции токсикантов Значение р. Н среды (при изменении р. Н водной фазы изменяется соотношение между ионизированной и молекулярной формой токсиканта). Природа екстрагента (вещества в ионизированной форме екстрагируют гидрофильными и амфифильными растворителями, а в молекулярной – липофильными и амфифильными). 12
Физико-химические свойства токсиканта, температура среды, присутствие электролитов. Природа кислоты, которую используют для подкисления биологического материала (минеральные кислоты гидролизуют эфиры токсикантов – атропин, кокаин). Факторы, влияющие на степень екстракции токсикантов Значение р. Н среды (при изменении р. Н водной фазы изменяется соотношение между ионизированной и молекулярной формой токсиканта). Природа екстрагента (вещества в ионизированной форме екстрагируют гидрофильными и амфифильными растворителями, а в молекулярной – липофильными и амфифильными). 12
 Методы изолирования лекарственных и наркотических веществ Общие методы используют для изолирования всех групп лекарственных и наркотических веществ, при ненаправленном ХТА. Частные (специальные) методы – для определенной группы лекарственных и наркотических веществ, при направленном ХТА. Водой, подкисленной щавелевой кислотой (метод А. А. Васильевой) Общие методы выделения токсикантов Ацетоном (метод В. А. Карташова) Етанолом, подкисленным щавелевой кислотой (метод Стаса-Отто) 13
Методы изолирования лекарственных и наркотических веществ Общие методы используют для изолирования всех групп лекарственных и наркотических веществ, при ненаправленном ХТА. Частные (специальные) методы – для определенной группы лекарственных и наркотических веществ, при направленном ХТА. Водой, подкисленной щавелевой кислотой (метод А. А. Васильевой) Общие методы выделения токсикантов Ацетоном (метод В. А. Карташова) Етанолом, подкисленным щавелевой кислотой (метод Стаса-Отто) 13
 МЕТОД А. А. ВАСИЛЬЕВОЙ 1 -й этап: Навеску 100 г заливают водой (1: 2), подкисленной щавелевой кислотой до р. Н 2 -2, 5 и настаивают 2 раза (2 часа и 1 час). Вытяжки процеживают через марлю (2 слоя) и центрифугируют 2 -й этап: Вытяжку экстрагируют хлороформом при р. Н 2, затем при р. Н 10 Метод быстрый, экономный, не используют при анализе загнивших объектов
МЕТОД А. А. ВАСИЛЬЕВОЙ 1 -й этап: Навеску 100 г заливают водой (1: 2), подкисленной щавелевой кислотой до р. Н 2 -2, 5 и настаивают 2 раза (2 часа и 1 час). Вытяжки процеживают через марлю (2 слоя) и центрифугируют 2 -й этап: Вытяжку экстрагируют хлороформом при р. Н 2, затем при р. Н 10 Метод быстрый, экономный, не используют при анализе загнивших объектов
 МЕТОД СТАСА-ОТТО (1851, 1856 гг) 1 -й этап: Навеску 100 г настаивают с 96% этанолом, подкисленным щавелевой кислотой до р. Н 2, 5 -3, 3 раза по 24 часа. Вытяжки упаривают при 40 С, осаждают белки 96% этанолом. Остаток растворяют в 25 мл воды. 2 -й этап: Раствор экстрагируют хлороформом при р. Н 2, затем при р. Н 8 -10 Метод длительный, возможны потери вещества, используют при работе с трупным материалом
МЕТОД СТАСА-ОТТО (1851, 1856 гг) 1 -й этап: Навеску 100 г настаивают с 96% этанолом, подкисленным щавелевой кислотой до р. Н 2, 5 -3, 3 раза по 24 часа. Вытяжки упаривают при 40 С, осаждают белки 96% этанолом. Остаток растворяют в 25 мл воды. 2 -й этап: Раствор экстрагируют хлороформом при р. Н 2, затем при р. Н 8 -10 Метод длительный, возможны потери вещества, используют при работе с трупным материалом
 МЕТОД В. А. КАРТАШОВА 1 -й этап: Навеску 5 г извлекают ацетоном 4 раза по 10, 5, 5, 5 мл по 5 минут. Пробы центрифугируют 5 минут. Добавляют карбонат калия. Ацетоновый слой отделяют, добавляют 20 мл 0, 5 М НСl и 10 мл гексана. Встряхивают, органическую фазу отбрасывают 2 -й этап: Водную фазу экстрагируют эфиром, эфир испаряют Водную фазу подщелачивают аммиаком до р. Н 9 -10, добавляют Na. Cl и снова экстрагируют эфиром Минимум потерь, получают чистые экстракты
МЕТОД В. А. КАРТАШОВА 1 -й этап: Навеску 5 г извлекают ацетоном 4 раза по 10, 5, 5, 5 мл по 5 минут. Пробы центрифугируют 5 минут. Добавляют карбонат калия. Ацетоновый слой отделяют, добавляют 20 мл 0, 5 М НСl и 10 мл гексана. Встряхивают, органическую фазу отбрасывают 2 -й этап: Водную фазу экстрагируют эфиром, эфир испаряют Водную фазу подщелачивают аммиаком до р. Н 9 -10, добавляют Na. Cl и снова экстрагируют эфиром Минимум потерь, получают чистые экстракты
 Локализация групп лекарственных и наркотических веществ в экстрактах после изолирования общими методами «Кислый» хлороформный экстракт: • Вещества кислотного характера – производные барбитуровой и салициловой кислот. • Вещества нейтрального и слабоосновного характера – алкалоиды производные пурина (кофеин, теофиллин и др. ) и индола (стрихнин, бруцин и др. ), а также производные 1, 4 -бензодиазепина и пиразолона-5. «Щелочной» хлороформный экстракт: • Вещества основного характера – алкалоиды (производные пиридина, пиперидина, тропана, хинолина, изохинолина, фенилалкиламина и др. ), производные фенотиазина и п-аминобензойной кислоты. • Вещества нейтрального характера – производные 1, 4 -бензодиазепина и пиразолона-5. 17
Локализация групп лекарственных и наркотических веществ в экстрактах после изолирования общими методами «Кислый» хлороформный экстракт: • Вещества кислотного характера – производные барбитуровой и салициловой кислот. • Вещества нейтрального и слабоосновного характера – алкалоиды производные пурина (кофеин, теофиллин и др. ) и индола (стрихнин, бруцин и др. ), а также производные 1, 4 -бензодиазепина и пиразолона-5. «Щелочной» хлороформный экстракт: • Вещества основного характера – алкалоиды (производные пиридина, пиперидина, тропана, хинолина, изохинолина, фенилалкиламина и др. ), производные фенотиазина и п-аминобензойной кислоты. • Вещества нейтрального характера – производные 1, 4 -бензодиазепина и пиразолона-5. 17
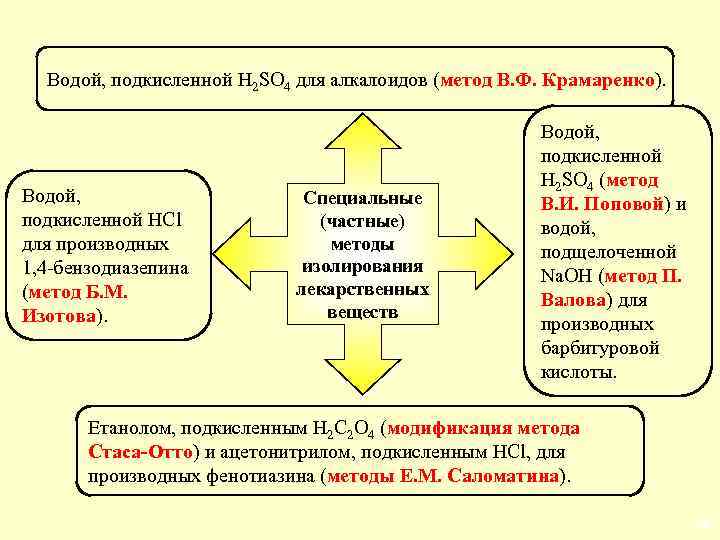 Водой, подкисленной H 2 SO 4 для алкалоидов (метод В. Ф. Крамаренко). Водой, подкисленной HCl для производных 1, 4 -бензодиазепина (метод Б. М. Изотова). Специальные (частные) методы изолирования лекарственных веществ Водой, подкисленной H 2 SO 4 (метод В. И. Поповой) и водой, подщелоченной Na. OH (метод П. Валова) для производных барбитуровой кислоты. Етанолом, подкисленным Н 2 C 2 O 4 (модификация метода Стаса-Отто) и ацетонитрилом, подкисленным HCl, для производных фенотиазина (методы Е. М. Саломатина). 18
Водой, подкисленной H 2 SO 4 для алкалоидов (метод В. Ф. Крамаренко). Водой, подкисленной HCl для производных 1, 4 -бензодиазепина (метод Б. М. Изотова). Специальные (частные) методы изолирования лекарственных веществ Водой, подкисленной H 2 SO 4 (метод В. И. Поповой) и водой, подщелоченной Na. OH (метод П. Валова) для производных барбитуровой кислоты. Етанолом, подкисленным Н 2 C 2 O 4 (модификация метода Стаса-Отто) и ацетонитрилом, подкисленным HCl, для производных фенотиазина (методы Е. М. Саломатина). 18
 МЕТОД В. Ф. КРАМАРЕНКО 1 -й этап: Навеску 100 г заливают 0, 02 М раствором серной кислоты (р. Н 2, 5) и настаивают 2 раза (2 часа и 1 час). Вытяжки центрифугируют, насыщают сульфатом аммония, снова центрифугируют, экстрагируют диэтиловым эфиром (для очистки) 2 -й этап: Водную фазу подщелачивают Na. OH до р. Н 8, 5 -9 и экстрагируют хлороформом 4 раза Метод для выделения алкалоидов
МЕТОД В. Ф. КРАМАРЕНКО 1 -й этап: Навеску 100 г заливают 0, 02 М раствором серной кислоты (р. Н 2, 5) и настаивают 2 раза (2 часа и 1 час). Вытяжки центрифугируют, насыщают сульфатом аммония, снова центрифугируют, экстрагируют диэтиловым эфиром (для очистки) 2 -й этап: Водную фазу подщелачивают Na. OH до р. Н 8, 5 -9 и экстрагируют хлороформом 4 раза Метод для выделения алкалоидов
 МЕТОД В. И. ПОПОВОЙ 1 -й этап: Навеску 100 г заливают 80 мл 0, 02 М раствора серной кислоты (р. Н 2 -3) и настаивают 3 раза (2 часа, 1 час). Вытяжки процеживают через марлю (3 слоя), центрифугируют 30 мин. Очищают гель-хроматографией (элюент 0, 02 М раствор серной кислоты ) 2 -й этап: Водную фазу экстрагируют хлороформом или эфиром Метод удобен для работы с гнилостным материалом Используется в анализе барбитуратов
МЕТОД В. И. ПОПОВОЙ 1 -й этап: Навеску 100 г заливают 80 мл 0, 02 М раствора серной кислоты (р. Н 2 -3) и настаивают 3 раза (2 часа, 1 час). Вытяжки процеживают через марлю (3 слоя), центрифугируют 30 мин. Очищают гель-хроматографией (элюент 0, 02 М раствор серной кислоты ) 2 -й этап: Водную фазу экстрагируют хлороформом или эфиром Метод удобен для работы с гнилостным материалом Используется в анализе барбитуратов
 МЕТОД П. ВАЛОВА (1946 г) 1 -й этап: Навеску 100 г заливают 180 мл подщелоченной воды (р. Н 10) и настаивают 30 минут. Вытяжку центрифугируют, подкисляют серной кислотой до р. Н 2 и добавляют вольфрамат натрия (для осаждения белков), центрифугируют 2 -й этап: Водную фазу при р. Н 2 экстрагируют эфиром. Эфирный слой реэкстрагируют водным раствором Na. OH. Экстракт подкисляют до р. Н 2, экстрагируют эфиром Метод для выделения барбитуратов
МЕТОД П. ВАЛОВА (1946 г) 1 -й этап: Навеску 100 г заливают 180 мл подщелоченной воды (р. Н 10) и настаивают 30 минут. Вытяжку центрифугируют, подкисляют серной кислотой до р. Н 2 и добавляют вольфрамат натрия (для осаждения белков), центрифугируют 2 -й этап: Водную фазу при р. Н 2 экстрагируют эфиром. Эфирный слой реэкстрагируют водным раствором Na. OH. Экстракт подкисляют до р. Н 2, экстрагируют эфиром Метод для выделения барбитуратов
 Методы очистки извлечений токсикантов Методы очистки первичных вытяжек из биологического материала на 1 -й стадии выделения токсикантов • Очистка от механических примесей (процеживание, фильтрование, центрифугирование). • Очистка от белков (осаждение реактивами, коагуляция, денатурация, высаливание, достижение изоелектрической точки белка, гельхроматография и др. ). Методы очистки екстрактов токсикантов на 2 -й стадии выделения Сублимация (возгонка), електрофорез, реэкстракция, диализ, дистилляция, различные виды хроматографии и др. 22
Методы очистки извлечений токсикантов Методы очистки первичных вытяжек из биологического материала на 1 -й стадии выделения токсикантов • Очистка от механических примесей (процеживание, фильтрование, центрифугирование). • Очистка от белков (осаждение реактивами, коагуляция, денатурация, высаливание, достижение изоелектрической точки белка, гельхроматография и др. ). Методы очистки екстрактов токсикантов на 2 -й стадии выделения Сублимация (возгонка), електрофорез, реэкстракция, диализ, дистилляция, различные виды хроматографии и др. 22
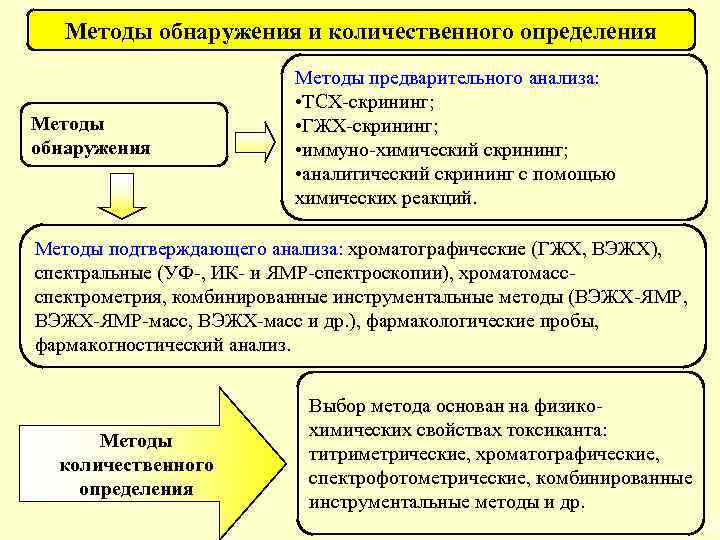 Методы обнаружения и количественного определения Методы обнаружения Методы предварительного анализа: • ТСХ-скрининг; • ГЖХ-скрининг; • иммуно-химический скрининг; • аналитический скрининг с помощью химических реакций. Методы подтверждающего анализа: хроматографические (ГЖХ, ВЭЖХ), спектральные (УФ-, ИК- и ЯМР-спектроскопии), хроматомассспектрометрия, комбинированные инструментальные методы (ВЭЖХ-ЯМР, ВЭЖХ-ЯМР-масс, ВЭЖХ-масс и др. ), фармакологические пробы, фармакогностический анализ. Методы количественного определения Выбор метода основан на физикохимических свойствах токсиканта: титриметрические, хроматографические, спектрофотометрические, комбинированные инструментальные методы и др. 23
Методы обнаружения и количественного определения Методы обнаружения Методы предварительного анализа: • ТСХ-скрининг; • ГЖХ-скрининг; • иммуно-химический скрининг; • аналитический скрининг с помощью химических реакций. Методы подтверждающего анализа: хроматографические (ГЖХ, ВЭЖХ), спектральные (УФ-, ИК- и ЯМР-спектроскопии), хроматомассспектрометрия, комбинированные инструментальные методы (ВЭЖХ-ЯМР, ВЭЖХ-ЯМР-масс, ВЭЖХ-масс и др. ), фармакологические пробы, фармакогностический анализ. Методы количественного определения Выбор метода основан на физикохимических свойствах токсиканта: титриметрические, хроматографические, спектрофотометрические, комбинированные инструментальные методы и др. 23
 Токсикологически важные лекарственные средства Группа веществ Общая формула Препараты Производные кислоты барбитуровой (снотворные средства). Барбитал, фенобарбитал, барбамил (амобарбитал), циклобарбитал, этаминал (пентобарбитал), бутобарбитал и др. Производные 1, 4 -бензодиазепина (транквилизаторы). Сибазон (диазепам), нозепам (оксазепам), элениум (хлордиазепоксид), феназепам, нитразепам, оксазепам, медазепам и др. 24
Токсикологически важные лекарственные средства Группа веществ Общая формула Препараты Производные кислоты барбитуровой (снотворные средства). Барбитал, фенобарбитал, барбамил (амобарбитал), циклобарбитал, этаминал (пентобарбитал), бутобарбитал и др. Производные 1, 4 -бензодиазепина (транквилизаторы). Сибазон (диазепам), нозепам (оксазепам), элениум (хлордиазепоксид), феназепам, нитразепам, оксазепам, медазепам и др. 24
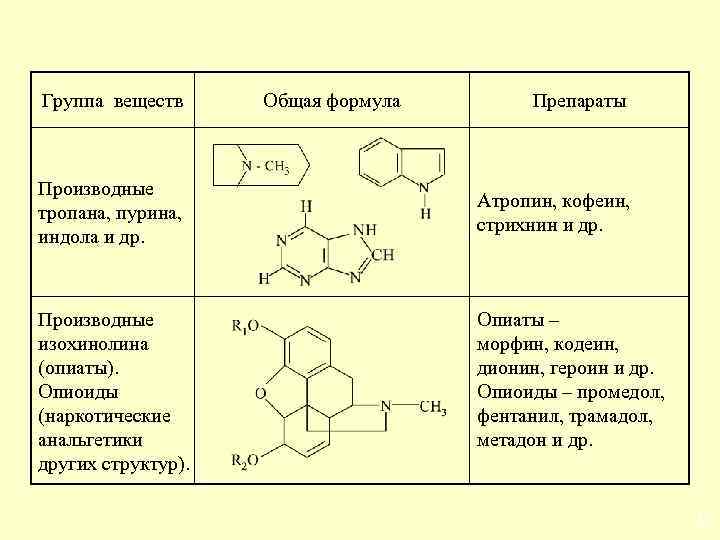 Группа веществ Производные тропана, пурина, индола и др. Производные изохинолина (опиаты). Опиоиды (наркотические анальгетики других структур). Общая формула Препараты Атропин, кофеин, стрихнин и др. Опиаты – морфин, кодеин, дионин, героин и др. Опиоиды – промедол, фентанил, трамадол, метадон и др. 25
Группа веществ Производные тропана, пурина, индола и др. Производные изохинолина (опиаты). Опиоиды (наркотические анальгетики других структур). Общая формула Препараты Атропин, кофеин, стрихнин и др. Опиаты – морфин, кодеин, дионин, героин и др. Опиоиды – промедол, фентанил, трамадол, метадон и др. 25
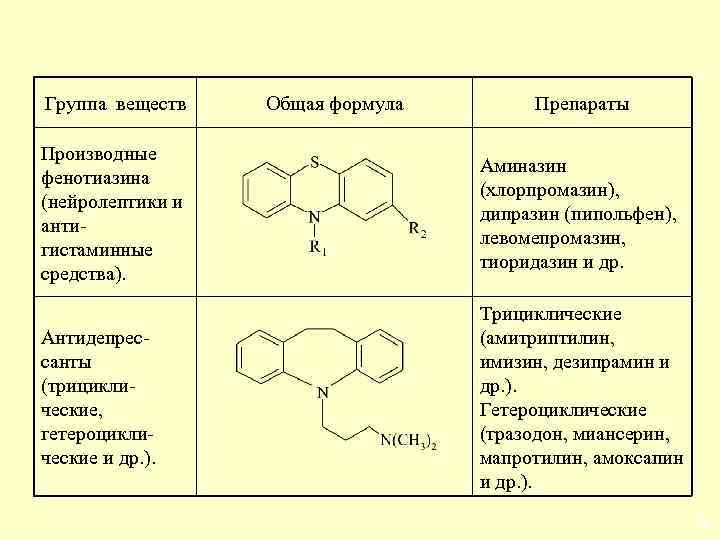 Группа веществ Общая формула Препараты Производные фенотиазина (нейролептики и антигистаминные средства). Аминазин (хлорпромазин), дипразин (пипольфен), левомепромазин, тиоридазин и др. Антидепрессанты (трициклические, гетероциклические и др. ). Трициклические (амитриптилин, имизин, дезипрамин и др. ). Гетероциклические (тразодон, миансерин, мапротилин, амоксапин и др. ). 26
Группа веществ Общая формула Препараты Производные фенотиазина (нейролептики и антигистаминные средства). Аминазин (хлорпромазин), дипразин (пипольфен), левомепромазин, тиоридазин и др. Антидепрессанты (трициклические, гетероциклические и др. ). Трициклические (амитриптилин, имизин, дезипрамин и др. ). Гетероциклические (тразодон, миансерин, мапротилин, амоксапин и др. ). 26
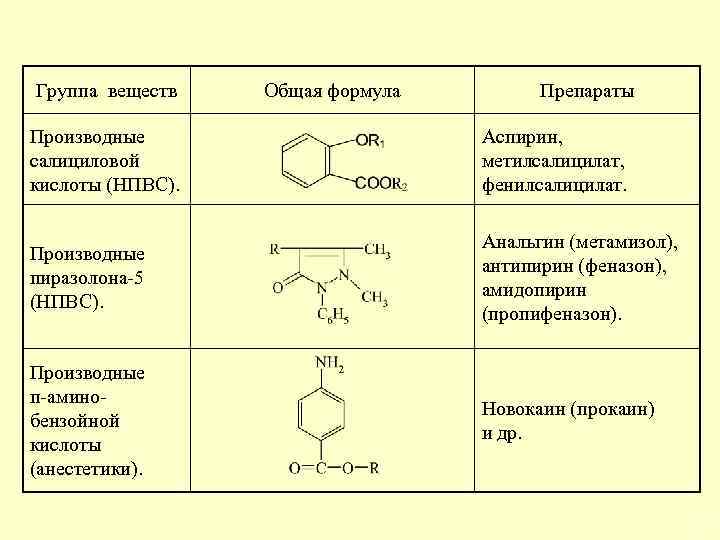 Группа веществ Общая формула Препараты Производные салициловой кислоты (НПВС). Аспирин, метилсалицилат, фенилсалицилат. Производные пиразолона-5 (НПВС). Анальгин (метамизол), антипирин (феназон), амидопирин (пропифеназон). Производные п-аминобензойной кислоты (анестетики). Новокаин (прокаин) и др. 27
Группа веществ Общая формула Препараты Производные салициловой кислоты (НПВС). Аспирин, метилсалицилат, фенилсалицилат. Производные пиразолона-5 (НПВС). Анальгин (метамизол), антипирин (феназон), амидопирин (пропифеназон). Производные п-аминобензойной кислоты (анестетики). Новокаин (прокаин) и др. 27
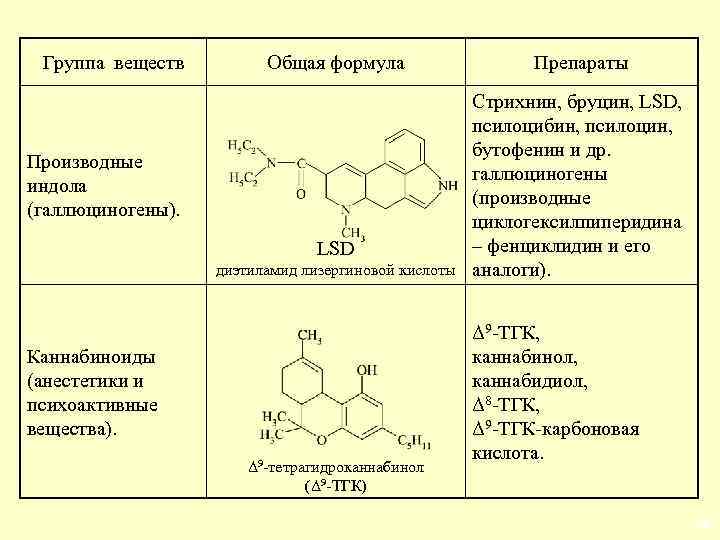 Группа веществ Общая формула Производные индола (галлюциногены). LSD диэтиламид лизергиновой кислоты Каннабиноиды (анестетики и психоактивные вещества). Δ 9 -тетрагидроканнабинол (Δ 9 -ТГК) Препараты Стрихнин, бруцин, LSD, псилоцибин, псилоцин, бутофенин и др. галлюциногены (производные циклогексилпиперидина – фенциклидин и его аналоги). Δ 9 -ТГК, каннабинол, каннабидиол, Δ 8 -ТГК, Δ 9 -ТГК-карбоновая кислота. 28
Группа веществ Общая формула Производные индола (галлюциногены). LSD диэтиламид лизергиновой кислоты Каннабиноиды (анестетики и психоактивные вещества). Δ 9 -тетрагидроканнабинол (Δ 9 -ТГК) Препараты Стрихнин, бруцин, LSD, псилоцибин, псилоцин, бутофенин и др. галлюциногены (производные циклогексилпиперидина – фенциклидин и его аналоги). Δ 9 -ТГК, каннабинол, каннабидиол, Δ 8 -ТГК, Δ 9 -ТГК-карбоновая кислота. 28
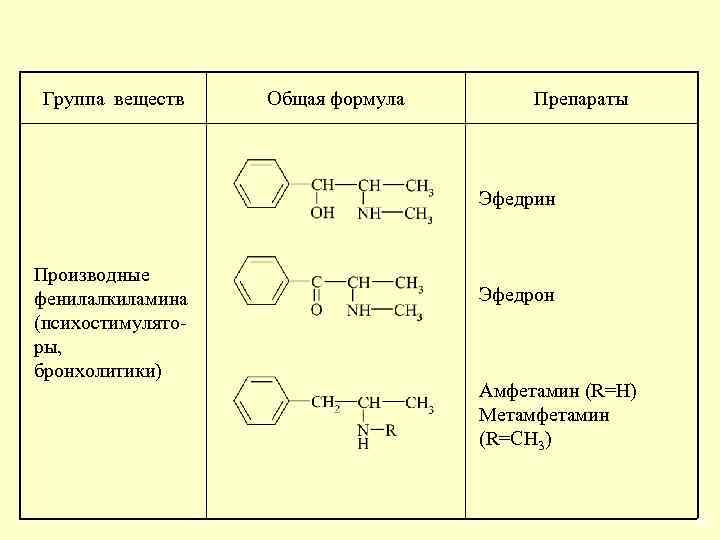 Группа веществ Общая формула Препараты Эфедрин Производные фенилалкиламина (психостимуляторы, бронхолитики) Эфедрон Амфетамин (R=H) Метамфетамин (R=CH 3) 29
Группа веществ Общая формула Препараты Эфедрин Производные фенилалкиламина (психостимуляторы, бронхолитики) Эфедрон Амфетамин (R=H) Метамфетамин (R=CH 3) 29
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ПРОИЗВОДНЫХ КИСЛОТЫ БАРБИТУРОВОЙ, САЛИЦИЛОВОЙ И ПИРАЗОЛОНА-5 План лекции: 1. Химико-токсикологический анализ производных барбитуровой кислоты. 2. Химико-токсикологический анализ производных салициловой кислоты. 3. Химико-токсикологический анализ производных пиразолона-5. доктор фармацевтических наук, профессор Бондарь Владимир Степанович
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ ВЕЩЕСТВ ПРОИЗВОДНЫХ КИСЛОТЫ БАРБИТУРОВОЙ, САЛИЦИЛОВОЙ И ПИРАЗОЛОНА-5 План лекции: 1. Химико-токсикологический анализ производных барбитуровой кислоты. 2. Химико-токсикологический анализ производных салициловой кислоты. 3. Химико-токсикологический анализ производных пиразолона-5. доктор фармацевтических наук, профессор Бондарь Владимир Степанович
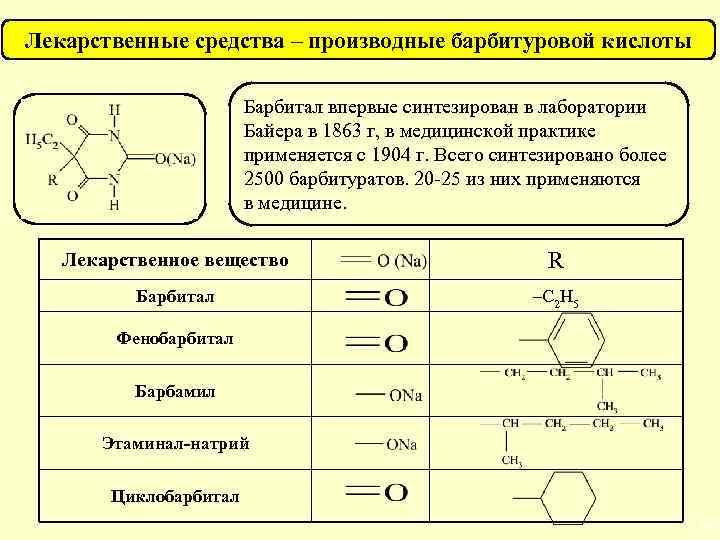 Лекарственные средства – производные барбитуровой кислоты Барбитал впервые синтезирован в лаборатории Байера в 1863 г, в медицинской практике применяется с 1904 г. Всего синтезировано более 2500 барбитуратов. 20 -25 из них применяются в медицине. Лекарственное вещество R Барбитал –С 2 Н 5 Фенобарбитал Барбамил Этаминал-натрий Циклобарбитал 31
Лекарственные средства – производные барбитуровой кислоты Барбитал впервые синтезирован в лаборатории Байера в 1863 г, в медицинской практике применяется с 1904 г. Всего синтезировано более 2500 барбитуратов. 20 -25 из них применяются в медицине. Лекарственное вещество R Барбитал –С 2 Н 5 Фенобарбитал Барбамил Этаминал-натрий Циклобарбитал 31
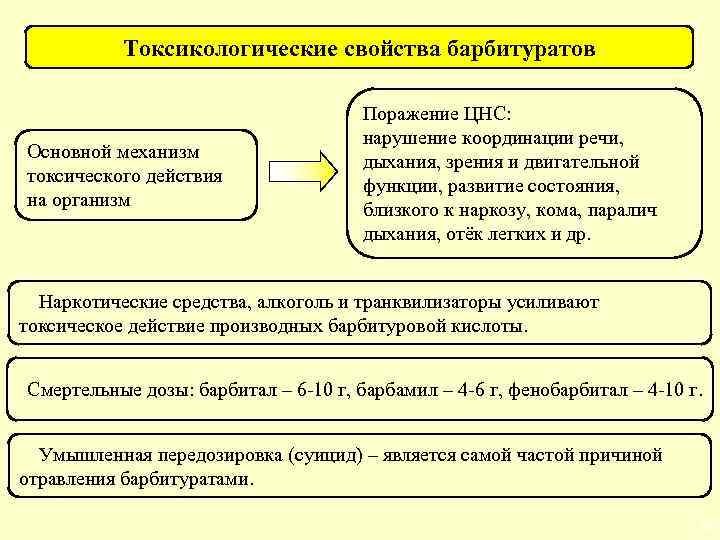 Токсикологические свойства барбитуратов Основной механизм токсического действия на организм Поражение ЦНС: нарушение координации речи, дыхания, зрения и двигательной функции, развитие состояния, близкого к наркозу, кома, паралич дыхания, отёк легких и др. Наркотические средства, алкоголь и транквилизаторы усиливают токсическое действие производных барбитуровой кислоты. Смертельные дозы: барбитал – 6 -10 г, барбамил – 4 -6 г, фенобарбитал – 4 -10 г. Умышленная передозировка (суицид) – является самой частой причиной отравления барбитуратами. 32
Токсикологические свойства барбитуратов Основной механизм токсического действия на организм Поражение ЦНС: нарушение координации речи, дыхания, зрения и двигательной функции, развитие состояния, близкого к наркозу, кома, паралич дыхания, отёк легких и др. Наркотические средства, алкоголь и транквилизаторы усиливают токсическое действие производных барбитуровой кислоты. Смертельные дозы: барбитал – 6 -10 г, барбамил – 4 -6 г, фенобарбитал – 4 -10 г. Умышленная передозировка (суицид) – является самой частой причиной отравления барбитуратами. 32
 33
33
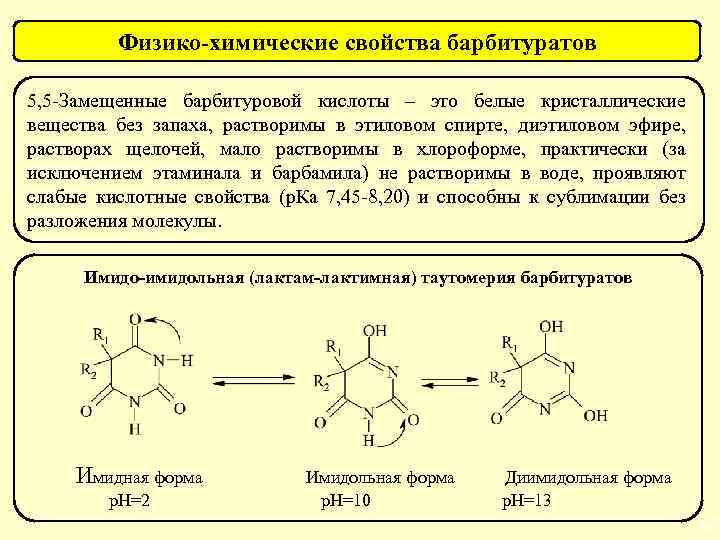 Физико-химические свойства барбитуратов 5, 5 -Замещенные барбитуровой кислоты – это белые кристаллические вещества без запаха, растворимы в этиловом спирте, диэтиловом эфире, растворах щелочей, мало растворимы в хлороформе, практически (за исключением этаминала и барбамила) не растворимы в воде, проявляют слабые кислотные свойства (р. Ка 7, 45 -8, 20) и способны к сублимации без разложения молекулы. Имидо-имидольная (лактам-лактимная) таутомерия барбитуратов Имидная форма Имидольная форма Диимидольная форма р. Н=2 р. Н=10 р. Н=13 34
Физико-химические свойства барбитуратов 5, 5 -Замещенные барбитуровой кислоты – это белые кристаллические вещества без запаха, растворимы в этиловом спирте, диэтиловом эфире, растворах щелочей, мало растворимы в хлороформе, практически (за исключением этаминала и барбамила) не растворимы в воде, проявляют слабые кислотные свойства (р. Ка 7, 45 -8, 20) и способны к сублимации без разложения молекулы. Имидо-имидольная (лактам-лактимная) таутомерия барбитуратов Имидная форма Имидольная форма Диимидольная форма р. Н=2 р. Н=10 р. Н=13 34
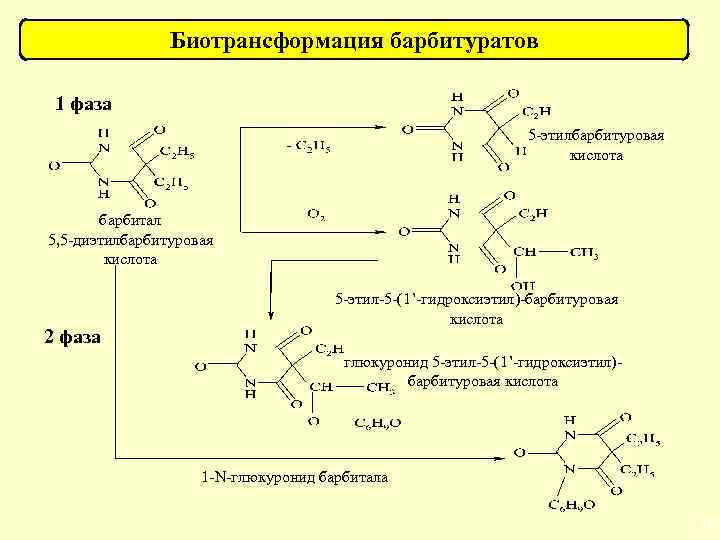 Биотрансформация барбитуратов 1 фаза 5 -этилбарбитуровая кислота барбитал 5, 5 -диэтилбарбитуровая кислота 2 фаза 5 -этил-5 -(1’-гидроксиэтил)-барбитуровая кислота глюкуронид 5 -этил-5 -(1’-гидроксиэтил)барбитуровая кислота 1 -N-глюкуронид барбитала 35
Биотрансформация барбитуратов 1 фаза 5 -этилбарбитуровая кислота барбитал 5, 5 -диэтилбарбитуровая кислота 2 фаза 5 -этил-5 -(1’-гидроксиэтил)-барбитуровая кислота глюкуронид 5 -этил-5 -(1’-гидроксиэтил)барбитуровая кислота 1 -N-глюкуронид барбитала 35
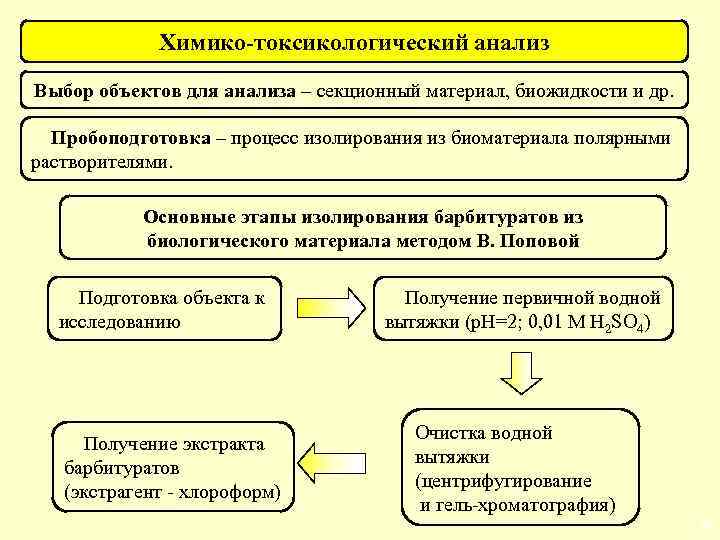 Химико-токсикологический анализ Выбор объектов для анализа – секционный материал, биожидкости и др. Пробоподготовка – процесс изолирования из биоматериала полярными растворителями. Основные этапы изолирования барбитуратов из биологического материала методом В. Поповой Подготовка объекта к исследованию Получение экстракта барбитуратов (экстрагент - хлороформ) Получение первичной водной вытяжки (р. Н=2; 0, 01 М H 2 SО 4) Очистка водной вытяжки (центрифугирование и гель-хроматография) 36
Химико-токсикологический анализ Выбор объектов для анализа – секционный материал, биожидкости и др. Пробоподготовка – процесс изолирования из биоматериала полярными растворителями. Основные этапы изолирования барбитуратов из биологического материала методом В. Поповой Подготовка объекта к исследованию Получение экстракта барбитуратов (экстрагент - хлороформ) Получение первичной водной вытяжки (р. Н=2; 0, 01 М H 2 SО 4) Очистка водной вытяжки (центрифугирование и гель-хроматография) 36
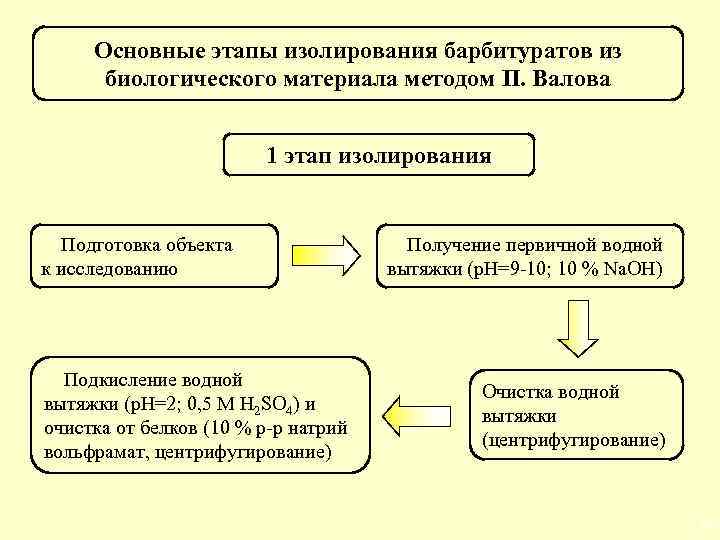 Основные этапы изолирования барбитуратов из биологического материала методом П. Валова 1 этап изолирования Подготовка объекта к исследованию Подкисление водной вытяжки (р. Н=2; 0, 5 М H 2 SО 4) и очистка от белков (10 % р-р натрий вольфрамат, центрифугирование) Получение первичной водной вытяжки (р. Н=9 -10; 10 % Na. OH) Очистка водной вытяжки (центрифугирование) 37
Основные этапы изолирования барбитуратов из биологического материала методом П. Валова 1 этап изолирования Подготовка объекта к исследованию Подкисление водной вытяжки (р. Н=2; 0, 5 М H 2 SО 4) и очистка от белков (10 % р-р натрий вольфрамат, центрифугирование) Получение первичной водной вытяжки (р. Н=9 -10; 10 % Na. OH) Очистка водной вытяжки (центрифугирование) 37
 2 этап изолирования Получение экстракта барбитуратов (экстрагент диэтиловый эфир) Реэкстракция барбитуратов (р. Н=10; 10 % Na. OH) Получение экстракта барбитуратов (экстрагент диэтиловый эфир) Подкисление водной вытяжки (р. Н=2; 0, 5 М H 2 SО 4) 38
2 этап изолирования Получение экстракта барбитуратов (экстрагент диэтиловый эфир) Реэкстракция барбитуратов (р. Н=10; 10 % Na. OH) Получение экстракта барбитуратов (экстрагент диэтиловый эфир) Подкисление водной вытяжки (р. Н=2; 0, 5 М H 2 SО 4) 38
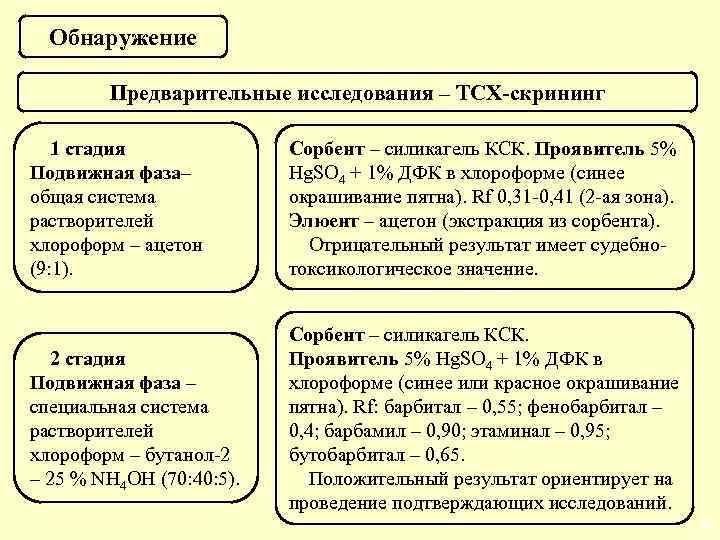 Обнаружение Предварительные исследования – ТСХ-скрининг 1 стадия Подвижная фаза– общая система растворителей хлороформ – ацетон (9: 1). Сорбент – силикагель КСК. Проявитель 5% Hg. SO 4 + 1% ДФК в хлороформе (синее окрашивание пятна). Rf 0, 31 -0, 41 (2 -ая зона). Элюент – ацетон (экстракция из сорбента). Отрицательный результат имеет судебнотоксикологическое значение. 2 стадия Подвижная фаза – специальная система растворителей хлороформ – бутанол-2 – 25 % NH 4 OH (70: 40: 5). Сорбент – силикагель КСК. Проявитель 5% Hg. SO 4 + 1% ДФК в хлороформе (синее или красное окрашивание пятна). Rf: барбитал – 0, 55; фенобарбитал – 0, 4; барбамил – 0, 90; этаминал – 0, 95; бутобарбитал – 0, 65. Положительный результат ориентирует на проведение подтверждающих исследований. 39
Обнаружение Предварительные исследования – ТСХ-скрининг 1 стадия Подвижная фаза– общая система растворителей хлороформ – ацетон (9: 1). Сорбент – силикагель КСК. Проявитель 5% Hg. SO 4 + 1% ДФК в хлороформе (синее окрашивание пятна). Rf 0, 31 -0, 41 (2 -ая зона). Элюент – ацетон (экстракция из сорбента). Отрицательный результат имеет судебнотоксикологическое значение. 2 стадия Подвижная фаза – специальная система растворителей хлороформ – бутанол-2 – 25 % NH 4 OH (70: 40: 5). Сорбент – силикагель КСК. Проявитель 5% Hg. SO 4 + 1% ДФК в хлороформе (синее или красное окрашивание пятна). Rf: барбитал – 0, 55; фенобарбитал – 0, 4; барбамил – 0, 90; этаминал – 0, 95; бутобарбитал – 0, 65. Положительный результат ориентирует на проведение подтверждающих исследований. 39
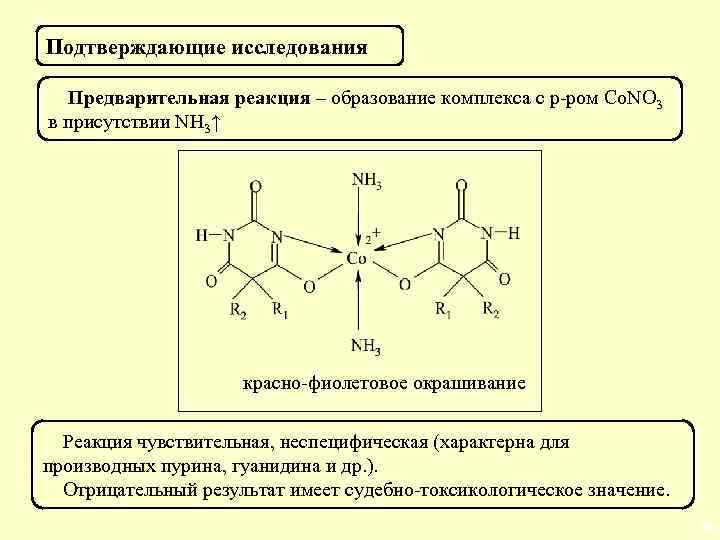 Подтверждающие исследования Предварительная реакция – образование комплекса с р-ром Co. NO 3 в присутствии NH 3↑ красно-фиолетовое окрашивание Реакция чувствительная, неспецифическая (характерна для производных пурина, гуанидина и др. ). Отрицательный результат имеет судебно-токсикологическое значение. 40
Подтверждающие исследования Предварительная реакция – образование комплекса с р-ром Co. NO 3 в присутствии NH 3↑ красно-фиолетовое окрашивание Реакция чувствительная, неспецифическая (характерна для производных пурина, гуанидина и др. ). Отрицательный результат имеет судебно-токсикологическое значение. 40
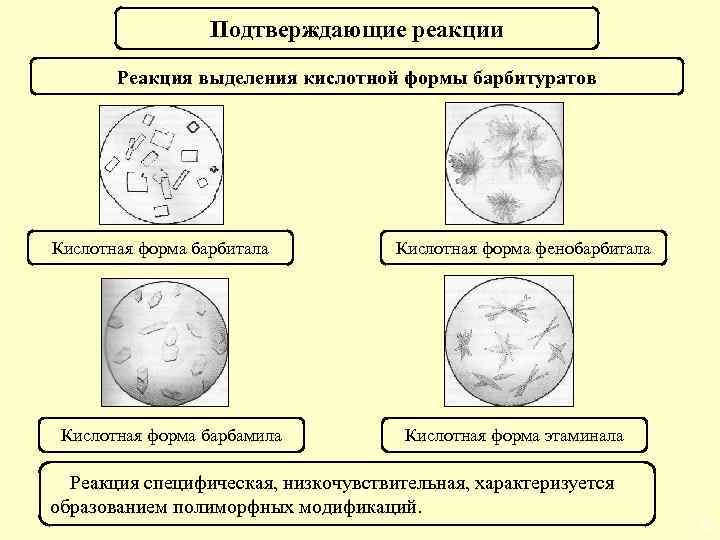 Подтверждающие реакции Реакция выделения кислотной формы барбитуратов Кислотная форма барбитала Кислотная форма барбамила Кислотная форма фенобарбитала Кислотная форма этаминала Реакция специфическая, низкочувствительная, характеризуется образованием полиморфных модификаций. 41
Подтверждающие реакции Реакция выделения кислотной формы барбитуратов Кислотная форма барбитала Кислотная форма барбамила Кислотная форма фенобарбитала Кислотная форма этаминала Реакция специфическая, низкочувствительная, характеризуется образованием полиморфных модификаций. 41
 Реакция с хлорцинкйодом Этаминал – кристаллы оранжево-коричневого цвета. Барбитал – кристаллы красного, зелёного, фиолетового цвета. Барбамил – кристаллы красного, оранжевого цвета. Реакция чувствительная, подтверждающая Фенобарбитал кристаллов не образует. 42
Реакция с хлорцинкйодом Этаминал – кристаллы оранжево-коричневого цвета. Барбитал – кристаллы красного, зелёного, фиолетового цвета. Барбамил – кристаллы красного, оранжевого цвета. Реакция чувствительная, подтверждающая Фенобарбитал кристаллов не образует. 42
 Реакция с подкисленным раствором KI (по Г. Ф. Лозовой) Барбитал – кристаллы зелёного, красного и серого цвета. Этаминал – кристаллы оранжевого цвета. Реакция чувствительная, подтверждающая (предел обнаружения 0, 5 мкг в пробе) Фенобарбитал и барбамил кристаллов не образуют. 43
Реакция с подкисленным раствором KI (по Г. Ф. Лозовой) Барбитал – кристаллы зелёного, красного и серого цвета. Этаминал – кристаллы оранжевого цвета. Реакция чувствительная, подтверждающая (предел обнаружения 0, 5 мкг в пробе) Фенобарбитал и барбамил кристаллов не образуют. 43
 Реакция со смесью Fe. Cl 3 и KI (железойодный комплекс) Кристаллы барбамила Кристаллы фенобарбитала Кристаллы этаминала Реакция чувствительная, подтверждающая Барбитал кристаллов не образует. 44
Реакция со смесью Fe. Cl 3 и KI (железойодный комплекс) Кристаллы барбамила Кристаллы фенобарбитала Кристаллы этаминала Реакция чувствительная, подтверждающая Барбитал кристаллов не образует. 44
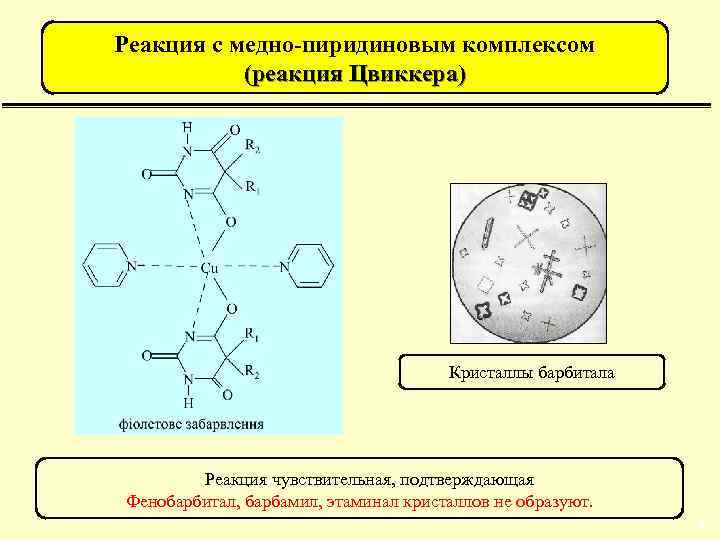 Реакция с медно-пиридиновым комплексом (реакция Цвиккера) Кристаллы барбитала Реакция чувствительная, подтверждающая Фенобарбитал, барбамил, этаминал кристаллов не образуют. 45
Реакция с медно-пиридиновым комплексом (реакция Цвиккера) Кристаллы барбитала Реакция чувствительная, подтверждающая Фенобарбитал, барбамил, этаминал кристаллов не образуют. 45
 Обнаружение барбитуратов иммуно-химическим методом Результаты применения ИХМ ориентируют эксперта на возможное содержание в объекте исследования веществ из группы барбитуратов без их дифференцирования. 46
Обнаружение барбитуратов иммуно-химическим методом Результаты применения ИХМ ориентируют эксперта на возможное содержание в объекте исследования веществ из группы барбитуратов без их дифференцирования. 46
 Инструментальные методы обнаружения барбитуратов УФ-спектроскопический метод В имидольной (лактимной) форме – максимум поглощения барбитуратов при длине волны 240 нм (р. Н=10). В диимидольной (дилактимной) форме – максимум поглощения барбитуратов при длине волны 255 -260 нм (р. Н=13). УФ-спектр барбитала р. Н 9, 2 – 239 нм; р. Н 13 – 254 нм УФ-спектр фенобарбитала р. Н 9, 2 – 239 нм; р. Н 13 – 254 нм 47
Инструментальные методы обнаружения барбитуратов УФ-спектроскопический метод В имидольной (лактимной) форме – максимум поглощения барбитуратов при длине волны 240 нм (р. Н=10). В диимидольной (дилактимной) форме – максимум поглощения барбитуратов при длине волны 255 -260 нм (р. Н=13). УФ-спектр барбитала р. Н 9, 2 – 239 нм; р. Н 13 – 254 нм УФ-спектр фенобарбитала р. Н 9, 2 – 239 нм; р. Н 13 – 254 нм 47
 ИК-спектры барбитуратов ИК-спектр фенобарбитала Основные пики 1712, 1684, 1670, 1770, 1310, 1300 см-1 ( KBr disk). ИК-спектр циклобарбиталау Основные пики 1693, 1725, 1745, 1300, 1210, 830 см-1 ( KBr disk). ИК-спектр барбитала Основные пики 1680, 1720, 1767, 1320, 1245, 875 см-1 ( KBr disk). 48
ИК-спектры барбитуратов ИК-спектр фенобарбитала Основные пики 1712, 1684, 1670, 1770, 1310, 1300 см-1 ( KBr disk). ИК-спектр циклобарбиталау Основные пики 1693, 1725, 1745, 1300, 1210, 830 см-1 ( KBr disk). ИК-спектр барбитала Основные пики 1680, 1720, 1767, 1320, 1245, 875 см-1 ( KBr disk). 48
 Масс-спектры барбитуратов Масс-спектр фенобарбитала Основные ионы m/z 204, 117, 146, 161, 77, 103, 115, 118 Масс-спектр циклобарбтала Основные ионы m/z 207, 141, 81, 79, 67, 80, 41, 77 Масс-спектр барбитала Основные ионы m/z 156, 141, 55, 155, 98, 39, 82, 43 49
Масс-спектры барбитуратов Масс-спектр фенобарбитала Основные ионы m/z 204, 117, 146, 161, 77, 103, 115, 118 Масс-спектр циклобарбтала Основные ионы m/z 207, 141, 81, 79, 67, 80, 41, 77 Масс-спектр барбитала Основные ионы m/z 156, 141, 55, 155, 98, 39, 82, 43 49
 Метод газо-жидкостной хроматографии Метод ГЖХ используют для определения нативных барбитуратов в вещественных доказательствах и биологических объектах без предварительной дериватизации. При проведении хромато-масс-спектрометрии и при исследовании метаболитов проводят дериватизацию молекул по NH-группам барбитуратов (метилирование или ацилирование). Метод ВЭЖХ используют для определения нативных барбитуратов в вещественных доказательствах и биологических объектах. Подвижная фаза – смесь ацетонитрила или метанола с водным буфером (ацетатным или фосфатным). Неподвижная фаза – колонки с сорбентом С 8 и С 18. Для детектирования зон адсорбции – УФ-детектор или диодная матрица. 50
Метод газо-жидкостной хроматографии Метод ГЖХ используют для определения нативных барбитуратов в вещественных доказательствах и биологических объектах без предварительной дериватизации. При проведении хромато-масс-спектрометрии и при исследовании метаболитов проводят дериватизацию молекул по NH-группам барбитуратов (метилирование или ацилирование). Метод ВЭЖХ используют для определения нативных барбитуратов в вещественных доказательствах и биологических объектах. Подвижная фаза – смесь ацетонитрила или метанола с водным буфером (ацетатным или фосфатным). Неподвижная фаза – колонки с сорбентом С 8 и С 18. Для детектирования зон адсорбции – УФ-детектор или диодная матрица. 50
 Методы количественного определения Спектральные методы: УФ-спектрофотометрия, УФспектрофотоколориметрия, экстракционная фотометрия, химическая дифференциальная спектрофотометрия (данный метод нивелирует влияние сопутствующих примесей). Хроматографические методы: ГЖХ, ВЭЖХ (определение концентрации по площади пика). Метод дифференциальной спектрофотометрии После измерения оптической плотности при разных значениях р. Н определение концентрации барбитуратов проводят по удельному показателю поглощения: где С – концентрация веществ, %. – разность оптических плотностей: • (р. Н=10) – (р. Н=2) – при исследовании органов; • (р. Н=13) – (р. Н=10) – при исследовании биожидкостей; – толщина поглощающего слоя, см. 51
Методы количественного определения Спектральные методы: УФ-спектрофотометрия, УФспектрофотоколориметрия, экстракционная фотометрия, химическая дифференциальная спектрофотометрия (данный метод нивелирует влияние сопутствующих примесей). Хроматографические методы: ГЖХ, ВЭЖХ (определение концентрации по площади пика). Метод дифференциальной спектрофотометрии После измерения оптической плотности при разных значениях р. Н определение концентрации барбитуратов проводят по удельному показателю поглощения: где С – концентрация веществ, %. – разность оптических плотностей: • (р. Н=10) – (р. Н=2) – при исследовании органов; • (р. Н=13) – (р. Н=10) – при исследовании биожидкостей; – толщина поглощающего слоя, см. 51
 нм 220 230 240 250 260 270 280 Спектры поглощения барбитуратов при различных значениях р. Н: 1 – спектр поглощения лактамной формы (р. Н=2); 2 -спектр поглощения лактимной формы (р. Н=10); 3 – спектр поглощения дилактимной формы (р. Н=13). 52
нм 220 230 240 250 260 270 280 Спектры поглощения барбитуратов при различных значениях р. Н: 1 – спектр поглощения лактамной формы (р. Н=2); 2 -спектр поглощения лактимной формы (р. Н=10); 3 – спектр поглощения дилактимной формы (р. Н=13). 52
 Интерпретация результатов ХТА Факторы, повыщающие концентрацию барбитуратов до токсической: индивидуальные особенности организма (генетические), степень толерантности, присутствие в объектах других психоактивных веществ (этанол, наркотические средства, бензодиазепины), заболевания сердечной и дыхательной систем. При условии быстро развивающейся толерантности терапевтические концентрации барбитуратов в плазме крови близки или превышают токсические. Вещество Макс. терапевт. конц. , мг/л Мин. токсич. конц. , мг/л Барбитал 30 20 Бутабарбитал 15 14 Циклобарбитал 10 8 Фенобарбитал 40 3 Метилфенобарбитал 15 40 Секобарбитал 10 10 53
Интерпретация результатов ХТА Факторы, повыщающие концентрацию барбитуратов до токсической: индивидуальные особенности организма (генетические), степень толерантности, присутствие в объектах других психоактивных веществ (этанол, наркотические средства, бензодиазепины), заболевания сердечной и дыхательной систем. При условии быстро развивающейся толерантности терапевтические концентрации барбитуратов в плазме крови близки или превышают токсические. Вещество Макс. терапевт. конц. , мг/л Мин. токсич. конц. , мг/л Барбитал 30 20 Бутабарбитал 15 14 Циклобарбитал 10 8 Фенобарбитал 40 3 Метилфенобарбитал 15 40 Секобарбитал 10 10 53
 Лекарственные средства, производные салициловой кислоты Салициловая кислота R 1=H, R 2=H Общая формула Ацетилсалициловая кислота R 1=COCH 3, R 2=H Метилсалицилат R 1=H, R 2=CH 3 Натрий салицилат R 1=H, R 2=Na Фенилсалицилат (салол) R 1=H, R 2=С 6 Н 5 54
Лекарственные средства, производные салициловой кислоты Салициловая кислота R 1=H, R 2=H Общая формула Ацетилсалициловая кислота R 1=COCH 3, R 2=H Метилсалицилат R 1=H, R 2=CH 3 Натрий салицилат R 1=H, R 2=Na Фенилсалицилат (салол) R 1=H, R 2=С 6 Н 5 54
 Токсикологическое значение салицилатов Токсикологические свойства. При передозировке – нервнопсихические нарушения (дыхания, дискоординация речи, судороги, беспокойство и др. ), которые сопровождаются образованием желудочных язв и нарушением свертывающей системы крови. Основная причина отравления – неумышленное (случайное) передозирование. Смертельная доза – 2 -4 г для детей и 20 г для взрослых. Физико-химические свойства. Салицилаты являются веществами кислотного характера, мало или практически (за исключением солей) не растворимы в воде, легко растворимы в растворах щелочей, спирте и других органических растворителях. 55
Токсикологическое значение салицилатов Токсикологические свойства. При передозировке – нервнопсихические нарушения (дыхания, дискоординация речи, судороги, беспокойство и др. ), которые сопровождаются образованием желудочных язв и нарушением свертывающей системы крови. Основная причина отравления – неумышленное (случайное) передозирование. Смертельная доза – 2 -4 г для детей и 20 г для взрослых. Физико-химические свойства. Салицилаты являются веществами кислотного характера, мало или практически (за исключением солей) не растворимы в воде, легко растворимы в растворах щелочей, спирте и других органических растворителях. 55
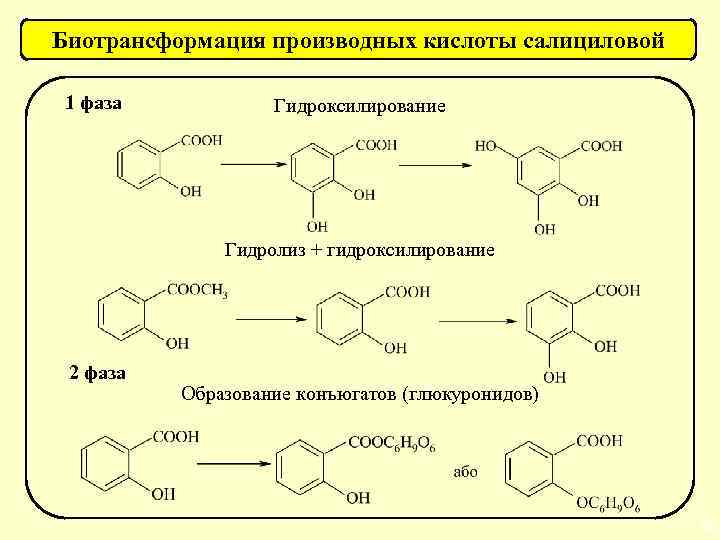 Биотрансформация производных кислоты салициловой 1 фаза Гидроксилирование Гидролиз + гидроксилирование 2 фаза Образование конъюгатов (глюкуронидов) 56
Биотрансформация производных кислоты салициловой 1 фаза Гидроксилирование Гидролиз + гидроксилирование 2 фаза Образование конъюгатов (глюкуронидов) 56
 Химико-токсикологический анализ Направленный ХТА на производные кислоты салициловой проводится при получении кристаллического остатка (в виде иголок) на предметном стекле (возгонка салициловой кислоты) из пробы, полученной на стадии выделения или по обстоятельствам дела. Выбор объектов для анализа – секционный материал, биожидкости, продукты питания и др. Изолирование из биологического материала Общими методами – А. А. Васильевой и Стаса-Отто (локализация в кислом хлороформном извлечении). Изолирование из продуктов питания (основные этапы) • Настаивание биологического материала в растворе Na 2 CO 3. • Фильтрование и подкисление первичной водной вытяжки 0, 1 М H 2 SO 4. • Экстракция салициловой кислоты хлороформом. 57
Химико-токсикологический анализ Направленный ХТА на производные кислоты салициловой проводится при получении кристаллического остатка (в виде иголок) на предметном стекле (возгонка салициловой кислоты) из пробы, полученной на стадии выделения или по обстоятельствам дела. Выбор объектов для анализа – секционный материал, биожидкости, продукты питания и др. Изолирование из биологического материала Общими методами – А. А. Васильевой и Стаса-Отто (локализация в кислом хлороформном извлечении). Изолирование из продуктов питания (основные этапы) • Настаивание биологического материала в растворе Na 2 CO 3. • Фильтрование и подкисление первичной водной вытяжки 0, 1 М H 2 SO 4. • Экстракция салициловой кислоты хлороформом. 57
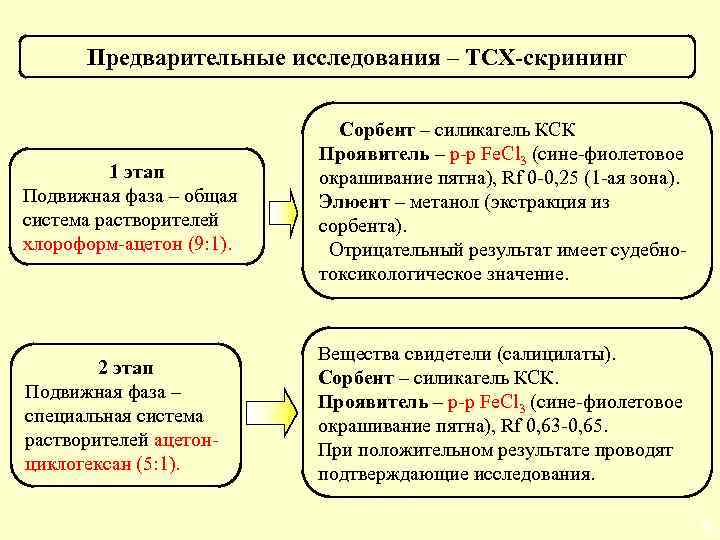 Предварительные исследования – ТСХ-скрининг 1 этап Подвижная фаза – общая система растворителей хлороформ-ацетон (9: 1). Сорбент – силикагель КСК Проявитель – р-р Fe. Cl 3 (сине-фиолетовое окрашивание пятна), Rf 0 -0, 25 (1 -ая зона). Элюент – метанол (экстракция из сорбента). Отрицательный результат имеет судебнотоксикологическое значение. 2 этап Подвижная фаза – специальная система растворителей ацетонциклогексан (5: 1). Вещества свидетели (салицилаты). Сорбент – силикагель КСК. Проявитель – р-р Fe. Cl 3 (сине-фиолетовое окрашивание пятна), Rf 0, 63 -0, 65. При положительном результате проводят подтверждающие исследования. 58
Предварительные исследования – ТСХ-скрининг 1 этап Подвижная фаза – общая система растворителей хлороформ-ацетон (9: 1). Сорбент – силикагель КСК Проявитель – р-р Fe. Cl 3 (сине-фиолетовое окрашивание пятна), Rf 0 -0, 25 (1 -ая зона). Элюент – метанол (экстракция из сорбента). Отрицательный результат имеет судебнотоксикологическое значение. 2 этап Подвижная фаза – специальная система растворителей ацетонциклогексан (5: 1). Вещества свидетели (салицилаты). Сорбент – силикагель КСК. Проявитель – р-р Fe. Cl 3 (сине-фиолетовое окрашивание пятна), Rf 0, 63 -0, 65. При положительном результате проводят подтверждающие исследования. 58
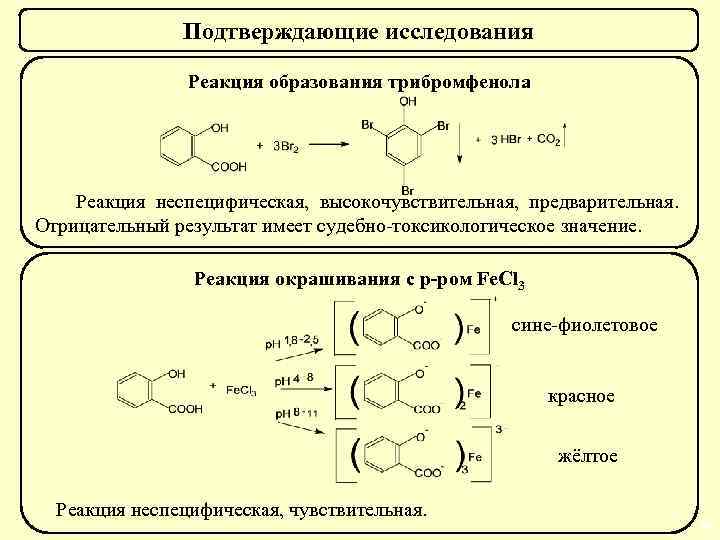 Подтверждающие исследования Реакция образования трибромфенола Реакция неспецифическая, высокочувствительная, предварительная. Отрицательный результат имеет судебно-токсикологическое значение. Реакция окрашивания с р-ром Fe. Cl 3 сине-фиолетовое красное жёлтое Реакция неспецифическая, чувствительная. 59
Подтверждающие исследования Реакция образования трибромфенола Реакция неспецифическая, высокочувствительная, предварительная. Отрицательный результат имеет судебно-токсикологическое значение. Реакция окрашивания с р-ром Fe. Cl 3 сине-фиолетовое красное жёлтое Реакция неспецифическая, чувствительная. 59
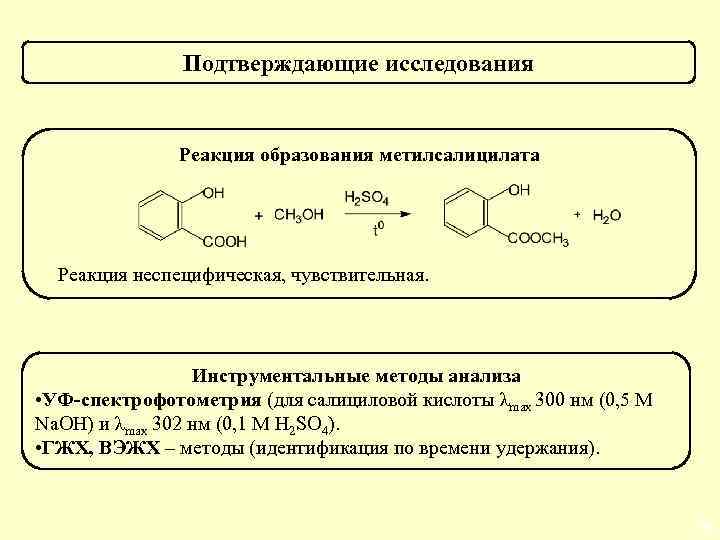 Подтверждающие исследования Реакция образования метилсалицилата Реакция неспецифическая, чувствительная. Инструментальные методы анализа • УФ-спектрофотометрия (для салициловой кислоты λmax 300 нм (0, 5 М Na. OH) и λmax 302 нм (0, 1 М H 2 SO 4). • ГЖХ, ВЭЖХ – методы (идентификация по времени удержания). 60
Подтверждающие исследования Реакция образования метилсалицилата Реакция неспецифическая, чувствительная. Инструментальные методы анализа • УФ-спектрофотометрия (для салициловой кислоты λmax 300 нм (0, 5 М Na. OH) и λmax 302 нм (0, 1 М H 2 SO 4). • ГЖХ, ВЭЖХ – методы (идентификация по времени удержания). 60
 Количественное определение Титриметрические методы • По реакции нейтрализации (титрант р-р Na. OH, индикатор фенолфталеин). • По реакции образования трибромфенола (броматометрический метод, титрант – р-р KI). Инструментальные методы • Спектральные методы (УФ-спектрофотометрия, фотоэлектроколориметрия). Измеряют оптическую плотность исследуемых растворов. Концентрацию токсиканта определяют по калибровочному графику или с использованием стандартного раствора вещества и его удельного показателя поглощения. • Хроматографические методы (ГЖХ, ВЭЖХ). Концентрацию токсиканта определяют методом внутреннего или внешнего стандарта. Расчёт концентрации – по площади пика и по формуле расчета. 61
Количественное определение Титриметрические методы • По реакции нейтрализации (титрант р-р Na. OH, индикатор фенолфталеин). • По реакции образования трибромфенола (броматометрический метод, титрант – р-р KI). Инструментальные методы • Спектральные методы (УФ-спектрофотометрия, фотоэлектроколориметрия). Измеряют оптическую плотность исследуемых растворов. Концентрацию токсиканта определяют по калибровочному графику или с использованием стандартного раствора вещества и его удельного показателя поглощения. • Хроматографические методы (ГЖХ, ВЭЖХ). Концентрацию токсиканта определяют методом внутреннего или внешнего стандарта. Расчёт концентрации – по площади пика и по формуле расчета. 61
 Лекарственные средства производные пиразолона-5 Антипирин (феназон) R=H Общая формула Амидопирин (пропифеназон) R=N(CH 3)2 Анальгин (метамизол-натрий) 62
Лекарственные средства производные пиразолона-5 Антипирин (феназон) R=H Общая формула Амидопирин (пропифеназон) R=N(CH 3)2 Анальгин (метамизол-натрий) 62
 Токсикологические свойства и метаболизм Токсикологические свойства Хронические отравления – характеризуются гематологическими нарушениями (лейкопения, агранулоцитоз), аллергическими реакциями, нарушениями ЦНС, судорогами (эпилепсия). Острые отравления – характеризуются поражениями ЦНС, судорогами, параличем, цианозом кожи и слизистых оболочек, остановкой дыхания. Наиболее частая причина отравления производными пиразолона-5 – неумышленная передозировка, в основном среди детей. Летальные дозы – от 5 до 15 г. Основные направления биотрансформации • Деметилирование (анальгин, амидопирин). • Окисление (антипирин и продукты деметилирования). • Конъюгация с глюкуроновой кислотой (4 -оксиантипирин) и уксусной кислотой (продукты деметилирования). 63
Токсикологические свойства и метаболизм Токсикологические свойства Хронические отравления – характеризуются гематологическими нарушениями (лейкопения, агранулоцитоз), аллергическими реакциями, нарушениями ЦНС, судорогами (эпилепсия). Острые отравления – характеризуются поражениями ЦНС, судорогами, параличем, цианозом кожи и слизистых оболочек, остановкой дыхания. Наиболее частая причина отравления производными пиразолона-5 – неумышленная передозировка, в основном среди детей. Летальные дозы – от 5 до 15 г. Основные направления биотрансформации • Деметилирование (анальгин, амидопирин). • Окисление (антипирин и продукты деметилирования). • Конъюгация с глюкуроновой кислотой (4 -оксиантипирин) и уксусной кислотой (продукты деметилирования). 63
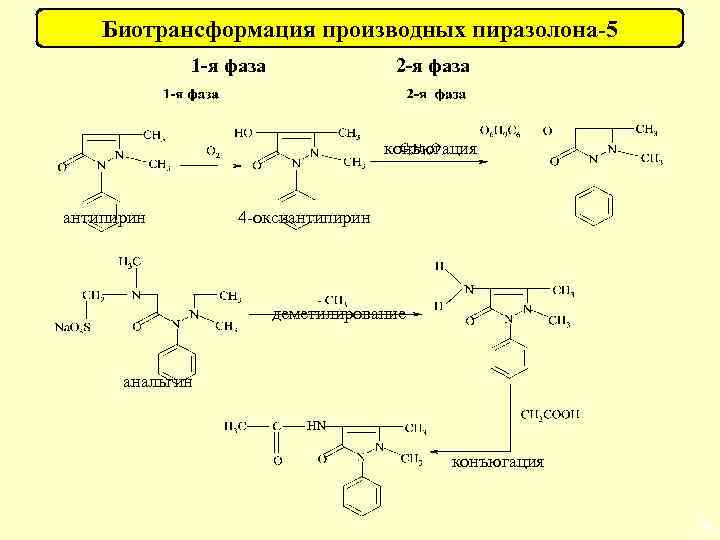 Биотрансформация производных пиразолона-5 1 -я фаза 2 -я фаза конъюгация антипирин 4 -оксиантипирин деметилирование анальгин конъюгация 64
Биотрансформация производных пиразолона-5 1 -я фаза 2 -я фаза конъюгация антипирин 4 -оксиантипирин деметилирование анальгин конъюгация 64
 Химико-токсикологический анализ Изолирование из биоматериала – общими методами (А. А. Васильевой и Стаса-Отто) Предварительне исследованя – ТСХ-скрининг 1 этап Подвижная фаза – общие системы растворителей для кислого и щелочного хлороформных экстрактов 2 этап Подвижная фаза – специальные системы растворителей: ацетонциклогексан (5: 1) и хлороформ-ацетон (5: 1) Проявители: 5 % Fe. Cl 3 (синее, красное и фиолетовое окрашивание), р-в Драгендорфа + 10 % H 2 SO 4 (оранжево-коричневое окрашивание), Rf 0 -0, 25. Элюент – метанол или метанол + 25 % NH 4 OH. Отрицательный результат имеет судебнотоксикологическое значение. Вещества свидетели (производные пиразолона). Проявитель: 5 % Fe. Cl 3 (синее, красное и фиолетовое окрашивание). Положительный результат ориентирует на проведение подтверждающих исследований. 65
Химико-токсикологический анализ Изолирование из биоматериала – общими методами (А. А. Васильевой и Стаса-Отто) Предварительне исследованя – ТСХ-скрининг 1 этап Подвижная фаза – общие системы растворителей для кислого и щелочного хлороформных экстрактов 2 этап Подвижная фаза – специальные системы растворителей: ацетонциклогексан (5: 1) и хлороформ-ацетон (5: 1) Проявители: 5 % Fe. Cl 3 (синее, красное и фиолетовое окрашивание), р-в Драгендорфа + 10 % H 2 SO 4 (оранжево-коричневое окрашивание), Rf 0 -0, 25. Элюент – метанол или метанол + 25 % NH 4 OH. Отрицательный результат имеет судебнотоксикологическое значение. Вещества свидетели (производные пиразолона). Проявитель: 5 % Fe. Cl 3 (синее, красное и фиолетовое окрашивание). Положительный результат ориентирует на проведение подтверждающих исследований. 65
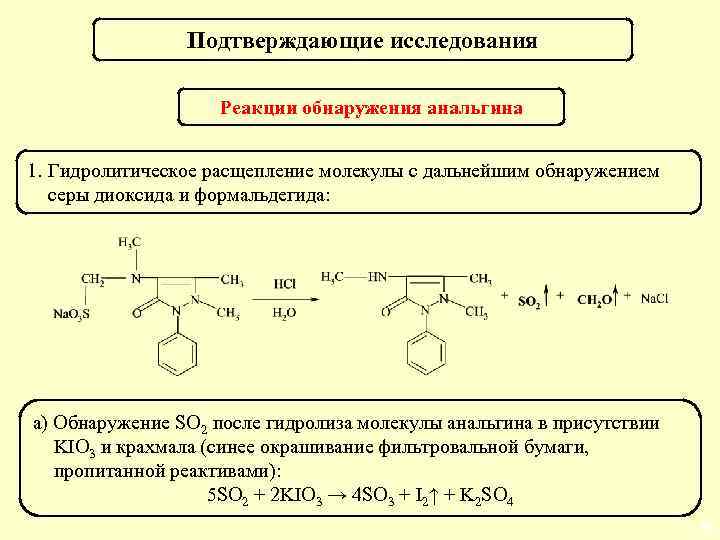 Подтверждающие исследования Реакции обнаружения анальгина 1. Гидролитическое расщепление молекулы с дальнейшим обнаружением серы диоксида и формальдегида: а) Обнаружение SO 2 после гидролиза молекулы анальгина в присутствии KIO 3 и крахмала (синее окрашивание фильтровальной бумаги, пропитанной реактивами): 5 SO 2 + 2 KIO 3 → 4 SO 3 + I 2↑ + K 2 SO 4 66
Подтверждающие исследования Реакции обнаружения анальгина 1. Гидролитическое расщепление молекулы с дальнейшим обнаружением серы диоксида и формальдегида: а) Обнаружение SO 2 после гидролиза молекулы анальгина в присутствии KIO 3 и крахмала (синее окрашивание фильтровальной бумаги, пропитанной реактивами): 5 SO 2 + 2 KIO 3 → 4 SO 3 + I 2↑ + K 2 SO 4 66
 б) Обнаружение формальдегида после гидролиза молекулы анальгина по реакции с хромотроповой или фуксинсернистой кислотами (синефиолетовое окрашивание). Реакция неспецифическая, чувствительная. в) Обнаружение формальдегида после гидролиза молекулы анальгина по реакции образования ауринового красителя: Салициловая кислота Ауриновый краситель красного цвета 67 67
б) Обнаружение формальдегида после гидролиза молекулы анальгина по реакции с хромотроповой или фуксинсернистой кислотами (синефиолетовое окрашивание). Реакция неспецифическая, чувствительная. в) Обнаружение формальдегида после гидролиза молекулы анальгина по реакции образования ауринового красителя: Салициловая кислота Ауриновый краситель красного цвета 67 67
 2. Лигниновая проба (жёлтое окрашивание газетной бумаги, пропитанной 10 % HCl). 3. Реакция с реактивом Несслера (оранжевый осадок). 4. Реакция с реактивом Миллона (р-р Hg. NO 3) – при нагревании образуется темно-синее окрашивание. Реакции обнаружения антипирина 1. Реакция комплексообразования с 5 % р-ром Fe. Cl 3 (3 C 11 H 12 NO 2*2 Fe. Cl 3 → красное окрашивание). Реакция неспецифическая, чувствительная. 2. Реакция образования нитрозоантипирина (зеленое окрашивание) Реакция неспецифическая, чувствительная. 68 68
2. Лигниновая проба (жёлтое окрашивание газетной бумаги, пропитанной 10 % HCl). 3. Реакция с реактивом Несслера (оранжевый осадок). 4. Реакция с реактивом Миллона (р-р Hg. NO 3) – при нагревании образуется темно-синее окрашивание. Реакции обнаружения антипирина 1. Реакция комплексообразования с 5 % р-ром Fe. Cl 3 (3 C 11 H 12 NO 2*2 Fe. Cl 3 → красное окрашивание). Реакция неспецифическая, чувствительная. 2. Реакция образования нитрозоантипирина (зеленое окрашивание) Реакция неспецифическая, чувствительная. 68 68
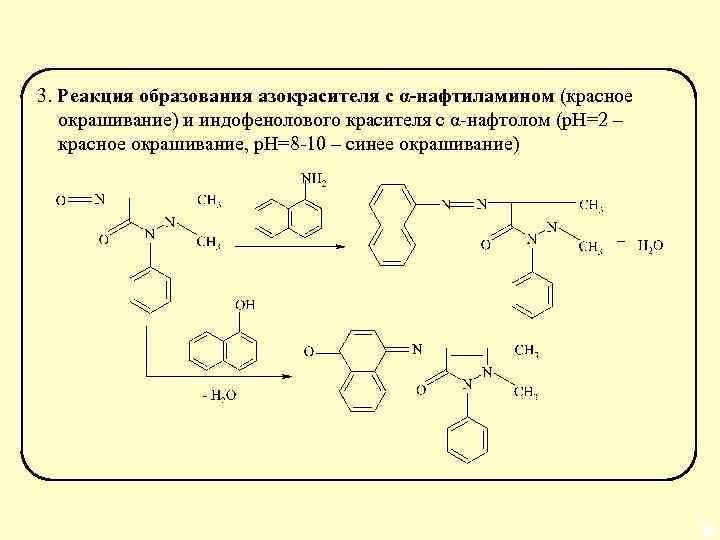 3. Реакция образования азокрасителя с α-нафтиламином (красное окрашивание) и индофенолового красителя с α-нафтолом (р. Н=2 – красное окрашивание, р. Н=8 -10 – синее окрашивание) 69 69
3. Реакция образования азокрасителя с α-нафтиламином (красное окрашивание) и индофенолового красителя с α-нафтолом (р. Н=2 – красное окрашивание, р. Н=8 -10 – синее окрашивание) 69 69
 Реакции обнаружения амидопирина • Реакция с 5 % р-ром Fe. Cl 3 (красное окрашивание; при добавлении HCl переходит в жёлтое окрашивание). • Реакция с 1 % р-ром Ag. NО 3 (при нагревании образуется фиолетовое окрашивание, со временем → серо-коричневый осадок Ag). Инструментальные методы обнаружения • УФ-спектрофотометрия (анальгин λmax 237 нм и 270 нм, водный раствор; антипирин λmax 230 нм, 0, 1 М H 2 SO 4; амидопирин λmax 238 нм, 0, 1 М HCl. • ИК-спектроскопия (1660, 770 та 1486 см-1). • ВЭЖХ (идентификация по времени удерживания). 70
Реакции обнаружения амидопирина • Реакция с 5 % р-ром Fe. Cl 3 (красное окрашивание; при добавлении HCl переходит в жёлтое окрашивание). • Реакция с 1 % р-ром Ag. NО 3 (при нагревании образуется фиолетовое окрашивание, со временем → серо-коричневый осадок Ag). Инструментальные методы обнаружения • УФ-спектрофотометрия (анальгин λmax 237 нм и 270 нм, водный раствор; антипирин λmax 230 нм, 0, 1 М H 2 SO 4; амидопирин λmax 238 нм, 0, 1 М HCl. • ИК-спектроскопия (1660, 770 та 1486 см-1). • ВЭЖХ (идентификация по времени удерживания). 70
 Количественное определение производных пиразолона-5 Метод фотоколориметрии • Антипирин. Определение концентрации по реакции образования азокрасителя. • Анальгин. Определение концентрации по реакции образования ауринового красителя (H 2 SO 4 конц. + натрий салицилат + Т °С→красное окрашивание). Метод УФ-спектрофотометрии Измеряют оптическую плотность соответствующих растворов. Концентрацию токсиканта определяют по калибровочному графику или с использованием стандартного раствора вещества и его удельного показателя поглощения. ВЭЖХ. Концентрацию токсиканта определяют по площади пика с использованием методов внутреннего или внешнего стандарта, а также соответствующей формулы расчёта. 71
Количественное определение производных пиразолона-5 Метод фотоколориметрии • Антипирин. Определение концентрации по реакции образования азокрасителя. • Анальгин. Определение концентрации по реакции образования ауринового красителя (H 2 SO 4 конц. + натрий салицилат + Т °С→красное окрашивание). Метод УФ-спектрофотометрии Измеряют оптическую плотность соответствующих растворов. Концентрацию токсиканта определяют по калибровочному графику или с использованием стандартного раствора вещества и его удельного показателя поглощения. ВЭЖХ. Концентрацию токсиканта определяют по площади пика с использованием методов внутреннего или внешнего стандарта, а также соответствующей формулы расчёта. 71
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ АЛКАЛОИДОВ ПРОИЗВОДНЫХ ПИРИДИНА, ПИПЕРИДИНА И ТРОПАНА План лекции: 1. Классификация, физико-химические и токсикологические свойства алкалоидов. 2. Особенности и общая схема направленного химико-токсикологического анализа на алкалоиды. 3. Химико-токсикологический анализ на алкалоиды производные пиридина, пиперидина и тропана.
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ АЛКАЛОИДОВ ПРОИЗВОДНЫХ ПИРИДИНА, ПИПЕРИДИНА И ТРОПАНА План лекции: 1. Классификация, физико-химические и токсикологические свойства алкалоидов. 2. Особенности и общая схема направленного химико-токсикологического анализа на алкалоиды. 3. Химико-токсикологический анализ на алкалоиды производные пиридина, пиперидина и тропана.
 Алкалоиды (alkali – щелочи) – азотсодержащие органические основания природного происхождения, которые в низких концентрациях проявляют сильное фармакологическое действие. Алкалоиды - психоактивные и наркотические вещества: – кокаин (производное тропана) – наркотическое вещество; – псилоцибин (производное индола) – галюциноген; – морфин и кодеин (производные изохинолина) – наркотические вещества; – эфедрин и псевдоэфедрин (производные фенилалкиламина) – прекурсоры, используют для синтеза полусинтетических психоактивных веществ эфедрона и метамфетамина. Токсикологическое значение алкалоидов обусловлено: – низкими концентрациями для достижения фармакологического эффекта; – доступностью исходного сырья в окружающей среде; – способностью к стимуляции ЦНС (психоактивные и наркотические в-ва); – отравлениями с летальным исходом. 73
Алкалоиды (alkali – щелочи) – азотсодержащие органические основания природного происхождения, которые в низких концентрациях проявляют сильное фармакологическое действие. Алкалоиды - психоактивные и наркотические вещества: – кокаин (производное тропана) – наркотическое вещество; – псилоцибин (производное индола) – галюциноген; – морфин и кодеин (производные изохинолина) – наркотические вещества; – эфедрин и псевдоэфедрин (производные фенилалкиламина) – прекурсоры, используют для синтеза полусинтетических психоактивных веществ эфедрона и метамфетамина. Токсикологическое значение алкалоидов обусловлено: – низкими концентрациями для достижения фармакологического эффекта; – доступностью исходного сырья в окружающей среде; – способностью к стимуляции ЦНС (психоактивные и наркотические в-ва); – отравлениями с летальным исходом. 73
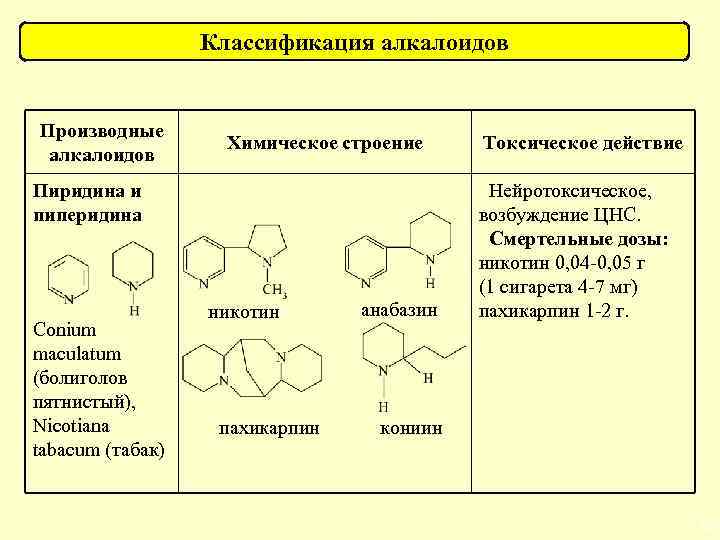 Классификация алкалоидов Производные алкалоидов Химическое строение Пиридина и пиперидина Conium maculatum (болиголов пятнистый), Nicotiana tabacum (табак) никотин анабазин Токсическое действие Нейротоксическое, возбуждение ЦНС. Смертельные дозы: никотин 0, 04 -0, 05 г (1 сигарета 4 -7 мг) пахикарпин 1 -2 г. пахикарпин кониин 74
Классификация алкалоидов Производные алкалоидов Химическое строение Пиридина и пиперидина Conium maculatum (болиголов пятнистый), Nicotiana tabacum (табак) никотин анабазин Токсическое действие Нейротоксическое, возбуждение ЦНС. Смертельные дозы: никотин 0, 04 -0, 05 г (1 сигарета 4 -7 мг) пахикарпин 1 -2 г. пахикарпин кониин 74
 Тропана Atropa Belladonna (красавка), Datura stramonium (дурман обыкновенный, Hyoscyamus niger (белена чёрная), Scopolia carniolica (скополия карниолийская Повышение глазного давления, тахикардия, гипотензия, расширение зрачков, привыкание (кокаин), возбуждение ЦНС. Смертельные дозы: атропин 0, 1 г скополамин 0, 1 г кокаин 0, 05 г атропин скополамин кокаин 75
Тропана Atropa Belladonna (красавка), Datura stramonium (дурман обыкновенный, Hyoscyamus niger (белена чёрная), Scopolia carniolica (скополия карниолийская Повышение глазного давления, тахикардия, гипотензия, расширение зрачков, привыкание (кокаин), возбуждение ЦНС. Смертельные дозы: атропин 0, 1 г скополамин 0, 1 г кокаин 0, 05 г атропин скополамин кокаин 75
 Хинолина Cinchona Remija (хинное дерево) Поражение ЦНС и сердечно-сосудистой системы хинин Изохинолина Papaver somniferum (мак снотворный) морфин R –ОH кодеин R –OCH 3 Поражение ЦНС, наркотическая кома, гипертонус скелетных мышц, угнетение дыхания, гиперемия кожи, паралич дыхания. Смертельные дозы: морфин 0, 3 -1, 4 г кодеин 0, 5 г 76
Хинолина Cinchona Remija (хинное дерево) Поражение ЦНС и сердечно-сосудистой системы хинин Изохинолина Papaver somniferum (мак снотворный) морфин R –ОH кодеин R –OCH 3 Поражение ЦНС, наркотическая кома, гипертонус скелетных мышц, угнетение дыхания, гиперемия кожи, паралич дыхания. Смертельные дозы: морфин 0, 3 -1, 4 г кодеин 0, 5 г 76
 Индола Strychnos nuxvomica (рвотный орех) стрихнин R –Н, бруцин R – ОСН 3 Пурина Плоды какао, листья чая кофеин R 1, 2 –СH 3 теобромин R 1 – H, R 2 – CH 3 теофилин R 1 –CH 3, R 2 –H Возбуждение ЦНС, «судорожный» яд, затрудненное дыхание, паралич дыхательного центра. Смертельные дозы: стрихнин 0, 1 -0, 3 г. Возбуждение ЦНС, истощение нервных клеток, ухудшение работы сердца, судороги. Смертельные дозы: кофеин 1, 0 -10, 0 г. 77
Индола Strychnos nuxvomica (рвотный орех) стрихнин R –Н, бруцин R – ОСН 3 Пурина Плоды какао, листья чая кофеин R 1, 2 –СH 3 теобромин R 1 – H, R 2 – CH 3 теофилин R 1 –CH 3, R 2 –H Возбуждение ЦНС, «судорожный» яд, затрудненное дыхание, паралич дыхательного центра. Смертельные дозы: стрихнин 0, 1 -0, 3 г. Возбуждение ЦНС, истощение нервных клеток, ухудшение работы сердца, судороги. Смертельные дозы: кофеин 1, 0 -10, 0 г. 77
 Особенности химико-токсикологического анализа Недостаточность судебно-медицинских результатов вскрытия для заключения об отравлении алкалоидами. Низкая летальная доза ориентирует на достижение максимальной экстракции алкалоидов при их выделении из биоматериала. Обязательная очистка первичной водной вытяжки и хлороформного экстракта от биогенных примесей с минимальными потерями алкалоидов. Подтверждение результатов обнаружения алкалоидов химическими методами с помощью фармакологических и фармакогностических исследований (по необходимости). Сложность проведения количественного определения алкалоидов в хлороформном экстракте из-за их низкой концентрации. 78
Особенности химико-токсикологического анализа Недостаточность судебно-медицинских результатов вскрытия для заключения об отравлении алкалоидами. Низкая летальная доза ориентирует на достижение максимальной экстракции алкалоидов при их выделении из биоматериала. Обязательная очистка первичной водной вытяжки и хлороформного экстракта от биогенных примесей с минимальными потерями алкалоидов. Подтверждение результатов обнаружения алкалоидов химическими методами с помощью фармакологических и фармакогностических исследований (по необходимости). Сложность проведения количественного определения алкалоидов в хлороформном экстракте из-за их низкой концентрации. 78
 Общая схема химико-токсикологического анализа Выбор объектов анализа – секционный материал, биожидкости, ЛРС и др. Пробоподготовка (изолирование из биоматериала) При ненаправленном ХТА – метод А. А. Васильевой или Стаса-Отто (локализация токсикантов в “щелочном” хлороформном экстракте). При направленном ХТА – метод В. Ф. Крамаренко. Обнаружение. Предварительные исследования – метод ТСХскрининга. Обнаружение. Подтверждающие исследования • Осадительные реакции (общеалкалоидные реактивы). • Цветные реакции (цветные реактивы). • Инструментальные методы анализа (ВЕЖХ, УФ, ИК, ЯМР и др. ). • Фармакологические пробы. • Фармакогностические исследования. Количественное определение – инструментальные методы анализа. 79
Общая схема химико-токсикологического анализа Выбор объектов анализа – секционный материал, биожидкости, ЛРС и др. Пробоподготовка (изолирование из биоматериала) При ненаправленном ХТА – метод А. А. Васильевой или Стаса-Отто (локализация токсикантов в “щелочном” хлороформном экстракте). При направленном ХТА – метод В. Ф. Крамаренко. Обнаружение. Предварительные исследования – метод ТСХскрининга. Обнаружение. Подтверждающие исследования • Осадительные реакции (общеалкалоидные реактивы). • Цветные реакции (цветные реактивы). • Инструментальные методы анализа (ВЕЖХ, УФ, ИК, ЯМР и др. ). • Фармакологические пробы. • Фармакогностические исследования. Количественное определение – инструментальные методы анализа. 79
 Предварительные исследования (метод ТСХ-скрининга) 1 этап Подвижная фаза – общая система растворителей для щелочного хлороформного экстракта: хлороформдиоксан-ацетон-25 % аммиак (45: 47, 5: 5: 2, 5) Сорбент – силикагель КСК. Проявитель – реактив Драгендорфа по Мунье (жёлто-коричневое окрашивание пятен), Rf 0, 12 -0, 36 (1 -ая зона) и 0, 67 -0, 98 (4 -ая зона). Элюент (1 -ая зона) – метанол-диэтиламин (9: 1). Элюент (4 -ая зона) – метанол-25 % аммиак (9: 1). 2 этап Подвижная фаза – специальная система растворителей для алкалоидов: хлороформдиэтиловый эфир (9: 1) Вещества свидетели – стандартные образцы алкалоидов. Сорбент – основной Al 2 O 3. Проявитель реактив Драгендорфа по Мунье (жёлто-коричневое окрашивание пятен). 80
Предварительные исследования (метод ТСХ-скрининга) 1 этап Подвижная фаза – общая система растворителей для щелочного хлороформного экстракта: хлороформдиоксан-ацетон-25 % аммиак (45: 47, 5: 5: 2, 5) Сорбент – силикагель КСК. Проявитель – реактив Драгендорфа по Мунье (жёлто-коричневое окрашивание пятен), Rf 0, 12 -0, 36 (1 -ая зона) и 0, 67 -0, 98 (4 -ая зона). Элюент (1 -ая зона) – метанол-диэтиламин (9: 1). Элюент (4 -ая зона) – метанол-25 % аммиак (9: 1). 2 этап Подвижная фаза – специальная система растворителей для алкалоидов: хлороформдиэтиловый эфир (9: 1) Вещества свидетели – стандартные образцы алкалоидов. Сорбент – основной Al 2 O 3. Проявитель реактив Драгендорфа по Мунье (жёлто-коричневое окрашивание пятен). 80
 Подтверждающие исследования Осадительные (общеалкалоидные) реакции Реактивы, которые образуют с алкалоидами простые соли: – дубильная кислота (танин); – пикриновая кислота; – пикролоновая кислота. Реактивы, которые образуют с алкалоидами комплексные соли: – I 2/KI (р-в Вагнера или Бушарда); – Bi. I 3/KI (р-в Драгендорфа); – Cd. I 2/KI или K 2 Cd. I 4 (р-в Марме); – Hg. I 2/KI или K 2 Hg. I 4 (р-в Майера); – фосфорно-молибденовая кислота (р-в Зонненшейна); – фосфорно-вольфрамовая кислота (р-в Шейблера). 81
Подтверждающие исследования Осадительные (общеалкалоидные) реакции Реактивы, которые образуют с алкалоидами простые соли: – дубильная кислота (танин); – пикриновая кислота; – пикролоновая кислота. Реактивы, которые образуют с алкалоидами комплексные соли: – I 2/KI (р-в Вагнера или Бушарда); – Bi. I 3/KI (р-в Драгендорфа); – Cd. I 2/KI или K 2 Cd. I 4 (р-в Марме); – Hg. I 2/KI или K 2 Hg. I 4 (р-в Майера); – фосфорно-молибденовая кислота (р-в Зонненшейна); – фосфорно-вольфрамовая кислота (р-в Шейблера). 81
 Цветные реакции Реактивы: – конц. H 2 SO 4; – конц. HNO 3; – конц. H 2 SO 4 + HNO 3 (р-в Эрдмана); – конц. H 2 SO 4 + молибденовая кислота (р-в Фреде); – конц. H 2 SO 4 + ванадиевая кислота (р-в Манделина); – конц. H 2 SO 4 + формальдегид (р-в Марки). Механизм цветных реакций: – дегидрирование H 2 SO 4; – окисление K 2 Cr 2 O 7; – окисление + дегидрирование; – конденсация с альдегидами. 82
Цветные реакции Реактивы: – конц. H 2 SO 4; – конц. HNO 3; – конц. H 2 SO 4 + HNO 3 (р-в Эрдмана); – конц. H 2 SO 4 + молибденовая кислота (р-в Фреде); – конц. H 2 SO 4 + ванадиевая кислота (р-в Манделина); – конц. H 2 SO 4 + формальдегид (р-в Марки). Механизм цветных реакций: – дегидрирование H 2 SO 4; – окисление K 2 Cr 2 O 7; – окисление + дегидрирование; – конденсация с альдегидами. 82
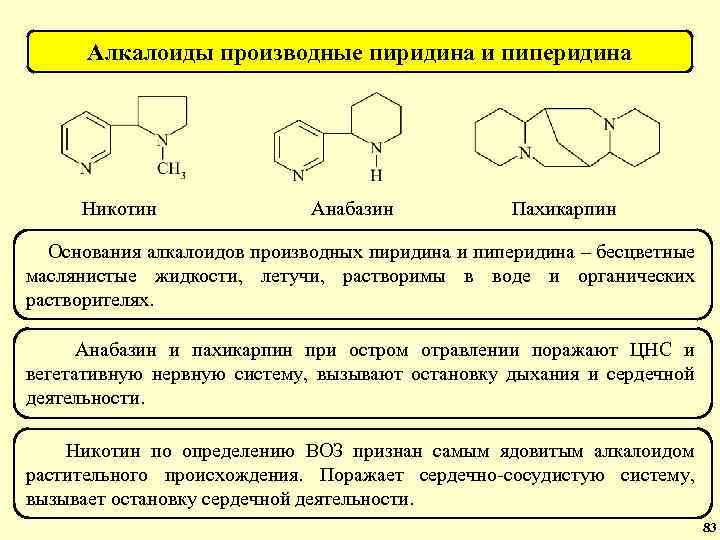 Алкалоиды производные пиридина и пиперидина Никотин Анабазин Пахикарпин Основания алкалоидов производных пиридина и пиперидина – бесцветные маслянистые жидкости, летучи, растворимы в воде и органических растворителях. Анабазин и пахикарпин при остром отравлении поражают ЦНС и вегетативную нервную систему, вызывают остановку дыхания и сердечной деятельности. Никотин по определению ВОЗ признан самым ядовитым алкалоидом растительного происхождения. Поражает сердечно-сосудистую систему, вызывает остановку сердечной деятельности. 83
Алкалоиды производные пиридина и пиперидина Никотин Анабазин Пахикарпин Основания алкалоидов производных пиридина и пиперидина – бесцветные маслянистые жидкости, летучи, растворимы в воде и органических растворителях. Анабазин и пахикарпин при остром отравлении поражают ЦНС и вегетативную нервную систему, вызывают остановку дыхания и сердечной деятельности. Никотин по определению ВОЗ признан самым ядовитым алкалоидом растительного происхождения. Поражает сердечно-сосудистую систему, вызывает остановку сердечной деятельности. 83
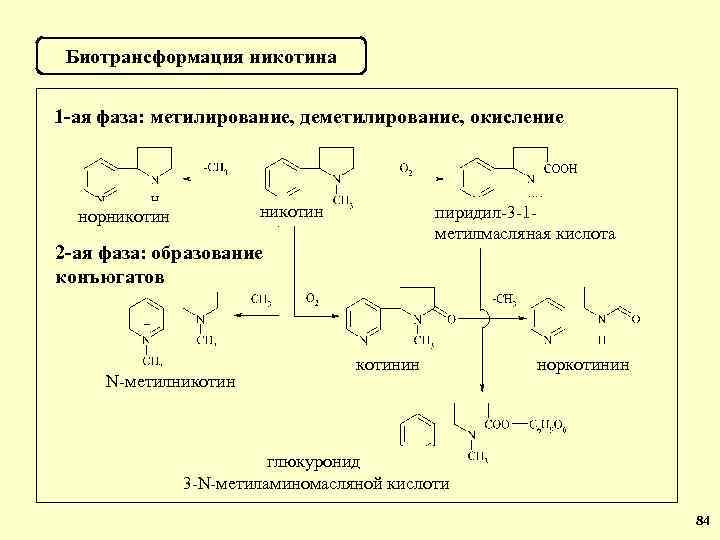 Биотрансформация никотина 1 -ая фаза: метилирование, деметилирование, окисление никотин норникотин пиридил-3 -1 метилмасляная кислота 2 -ая фаза: образование конъюгатов N-метилникотинин норкотинин глюкуронид 3 -N-метиламиномасляной кислоти 84
Биотрансформация никотина 1 -ая фаза: метилирование, деметилирование, окисление никотин норникотин пиридил-3 -1 метилмасляная кислота 2 -ая фаза: образование конъюгатов N-метилникотинин норкотинин глюкуронид 3 -N-метиламиномасляной кислоти 84
 Подтверждающие исследования Реакция с реактивом Драгендорфа Никотин и анабазин образуют кристаллы характерной формы. Реакция с солью Рейнеке Анабазин образует кристаллы в виде иголок (реакция неспецифическая). Реакция с реактивом Бушарда Пахикарпин образует характерные кристаллы зелёного цвета. Реакция с пикриновой кислотой Никотин образует характерные кристаллы, анабазин – жёлтый кристаллический осадок, пахикарпин – жёлто-зелёные кристаллы характерной формы. Реакция с медно-йодидным комплексом Пахикарпин образует жёлтые кристаллы характерной формы. УФ-спектрофотометрия Анабазин в 0, 1 М HCl – λmax 256 нм; никотин в 0, 1 М HCl – λmax 260 нм. 85
Подтверждающие исследования Реакция с реактивом Драгендорфа Никотин и анабазин образуют кристаллы характерной формы. Реакция с солью Рейнеке Анабазин образует кристаллы в виде иголок (реакция неспецифическая). Реакция с реактивом Бушарда Пахикарпин образует характерные кристаллы зелёного цвета. Реакция с пикриновой кислотой Никотин образует характерные кристаллы, анабазин – жёлтый кристаллический осадок, пахикарпин – жёлто-зелёные кристаллы характерной формы. Реакция с медно-йодидным комплексом Пахикарпин образует жёлтые кристаллы характерной формы. УФ-спектрофотометрия Анабазин в 0, 1 М HCl – λmax 256 нм; никотин в 0, 1 М HCl – λmax 260 нм. 85
 Химико-токсикологический анализ Изолирование: • Ненаправленный ХТА – общие методы А. А. Васильевой и Стаса. Отто (локализация токсиканта в щелочном хлороформном экстракте). • Направленный ХТА – метод В. Ф. Крамаренко (вода + H 2 SO 4) и дистилляция с водяным паром (р. Н=8 -10) для летучих веществ. Обнаружение Предварительные исследования ТСХ-скрининг. Проявитель р-в Драгендорфа по Мунье (жёлтокоричневое окрашивание пятен). Rf анабазина 0, 58; Rf никотина 0, 76; подвижная фаза – хлороформ-этанол (9: 1)). Аналитический скрининг – на анабазин и никотин: • Реакция с пероксидом водорода (хлороформный экстракт + H 2 O 2 + H 2 SO 4 конц. ) → красное или коричневое окрашивание. • Реакция с ванилином (хлороформный экстракт + ванилин + HCl конц. ) → красное окрашивание. 86
Химико-токсикологический анализ Изолирование: • Ненаправленный ХТА – общие методы А. А. Васильевой и Стаса. Отто (локализация токсиканта в щелочном хлороформном экстракте). • Направленный ХТА – метод В. Ф. Крамаренко (вода + H 2 SO 4) и дистилляция с водяным паром (р. Н=8 -10) для летучих веществ. Обнаружение Предварительные исследования ТСХ-скрининг. Проявитель р-в Драгендорфа по Мунье (жёлтокоричневое окрашивание пятен). Rf анабазина 0, 58; Rf никотина 0, 76; подвижная фаза – хлороформ-этанол (9: 1)). Аналитический скрининг – на анабазин и никотин: • Реакция с пероксидом водорода (хлороформный экстракт + H 2 O 2 + H 2 SO 4 конц. ) → красное или коричневое окрашивание. • Реакция с ванилином (хлороформный экстракт + ванилин + HCl конц. ) → красное окрашивание. 86
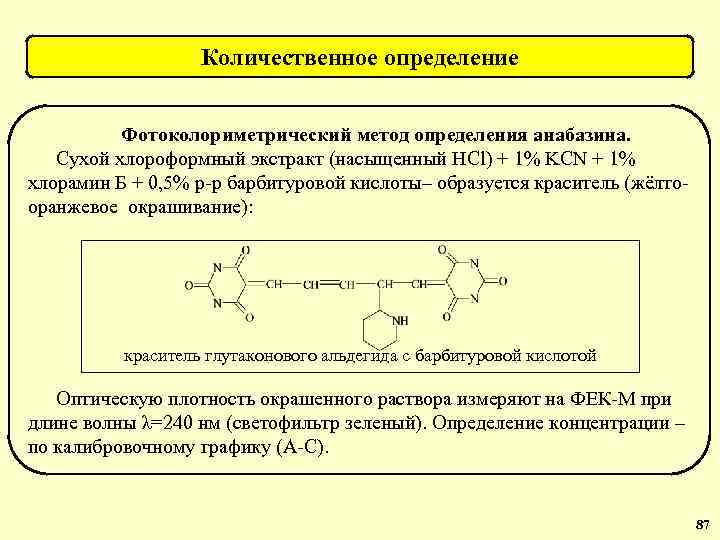 Количественное определение Фотоколориметрический метод определения анабазина. Сухой хлороформный экстракт (насыщенный HCl) + 1% KCN + 1% хлорамин Б + 0, 5% р-р барбитуровой кислоты– образуется краситель (жёлтооранжевое окрашивание): краситель глутаконового альдегида с барбитуровой кислотой Оптическую плотность окрашенного раствора измеряют на ФЕК-М при длине волны λ=240 нм (светофильтр зеленый). Определение концентрации – по калибровочному графику (А-С). 87
Количественное определение Фотоколориметрический метод определения анабазина. Сухой хлороформный экстракт (насыщенный HCl) + 1% KCN + 1% хлорамин Б + 0, 5% р-р барбитуровой кислоты– образуется краситель (жёлтооранжевое окрашивание): краситель глутаконового альдегида с барбитуровой кислотой Оптическую плотность окрашенного раствора измеряют на ФЕК-М при длине волны λ=240 нм (светофильтр зеленый). Определение концентрации – по калибровочному графику (А-С). 87
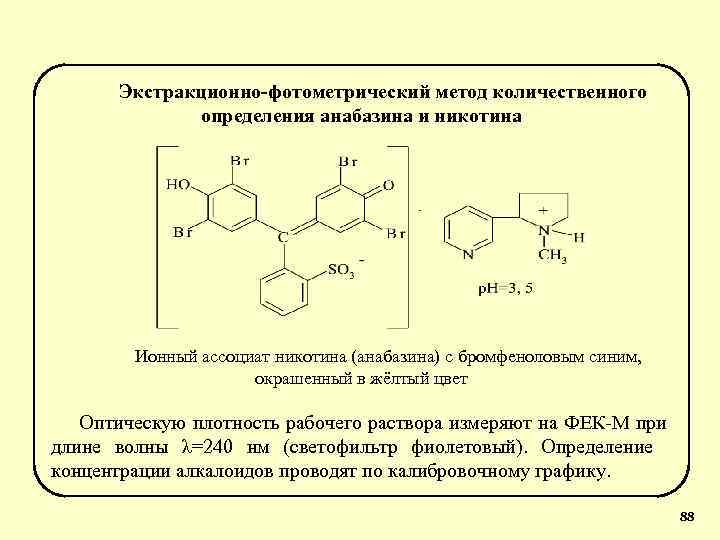 Экстракционно-фотометрический метод количественного определения анабазина и никотина Ионный ассоциат никотина (анабазина) с бромфеноловым синим, окрашенный в жёлтый цвет Оптическую плотность рабочего раствора измеряют на ФЕК-М при длине волны λ=240 нм (светофильтр фиолетовый). Определение концентрации алкалоидов проводят по калибровочному графику. 88
Экстракционно-фотометрический метод количественного определения анабазина и никотина Ионный ассоциат никотина (анабазина) с бромфеноловым синим, окрашенный в жёлтый цвет Оптическую плотность рабочего раствора измеряют на ФЕК-М при длине волны λ=240 нм (светофильтр фиолетовый). Определение концентрации алкалоидов проводят по калибровочному графику. 88
 Алкалоиды производные тропана атропин скополамин кокаин Основания алкалоидов производных тропана - кристаллические вещества, растворимы в этаноле и хлороформе, нерастворимы в воде. Соли алкалоидов растворимы в воде и нерастворимы в хлороформе. При остром отравлении атропин и скополамин поражают ЦНС, вызывают асфиксию и паралич дыхательного центра. 89
Алкалоиды производные тропана атропин скополамин кокаин Основания алкалоидов производных тропана - кристаллические вещества, растворимы в этаноле и хлороформе, нерастворимы в воде. Соли алкалоидов растворимы в воде и нерастворимы в хлороформе. При остром отравлении атропин и скополамин поражают ЦНС, вызывают асфиксию и паралич дыхательного центра. 89
 Биотрансформация алкалоидов производных тропана 1 фаза а) гидролиз атропин (скополамин) кокаин тропин (скопин) экгонин троповая кислота бензойная кислота 90
Биотрансформация алкалоидов производных тропана 1 фаза а) гидролиз атропин (скополамин) кокаин тропин (скопин) экгонин троповая кислота бензойная кислота 90
 б) деметилирование атропин (скополамин, кокаин) норатропин (норскополамин, норкокаин) 2 фаза Образование глюкуронидов (конъюгация) глюкуронид тропина (скопина, норскопина, экгонина) глюкуронид троповой кислоты 91
б) деметилирование атропин (скополамин, кокаин) норатропин (норскополамин, норкокаин) 2 фаза Образование глюкуронидов (конъюгация) глюкуронид тропина (скопина, норскопина, экгонина) глюкуронид троповой кислоты 91
 Химико-токсикологический анализ на алкалоиды производные тропана Изолирование Ненаправленный ХТА – общие методы Стаса-Отто и А. А. Васильевой (локализация токсикантов в щелочном хлороформном экстракте). Направленный ХТА – метод В. Ф. Крамаренко (вода + H 2 SO 4) Обнаружение Предварительные исследования При направленном ХТА – метод ТСХ-скрининга. Подвижная фаза – специальная система растворителей хлороформ-ацетон -диэтиламин (50: 30: 2), вещества свидетели – стандартные образцы алкалоидов производных тропана. Проявитель – реактив Драгендорфа по Мунье (розово-бурое окрашивание пятен на хроматограмме). Rf кокаина 0, 64; атропина 0, 26 и скополамина 0, 44. 92
Химико-токсикологический анализ на алкалоиды производные тропана Изолирование Ненаправленный ХТА – общие методы Стаса-Отто и А. А. Васильевой (локализация токсикантов в щелочном хлороформном экстракте). Направленный ХТА – метод В. Ф. Крамаренко (вода + H 2 SO 4) Обнаружение Предварительные исследования При направленном ХТА – метод ТСХ-скрининга. Подвижная фаза – специальная система растворителей хлороформ-ацетон -диэтиламин (50: 30: 2), вещества свидетели – стандартные образцы алкалоидов производных тропана. Проявитель – реактив Драгендорфа по Мунье (розово-бурое окрашивание пятен на хроматограмме). Rf кокаина 0, 64; атропина 0, 26 и скополамина 0, 44. 92
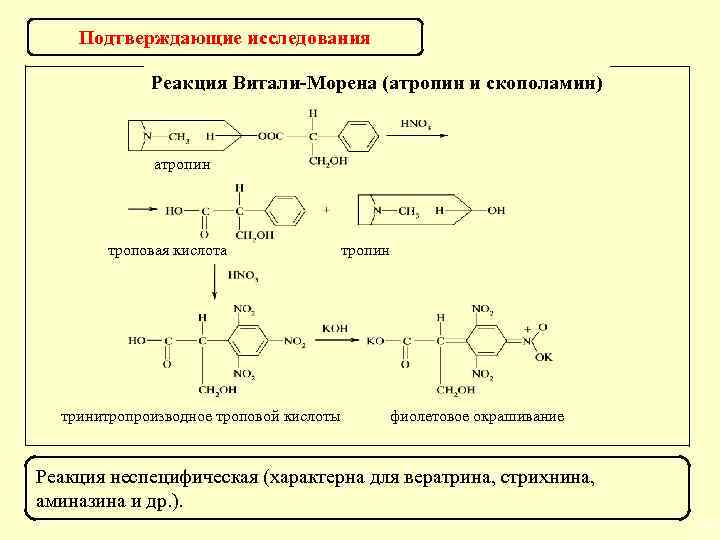 Подтверждающие исследования Реакция Витали-Морена (атропин и скополамин) атропин троповая кислота тринитропроизводное троповой кислоты тропин фиолетовое окрашивание Реакция неспецифическая (характерна для вератрина, стрихнина, аминазина и др. ). 93
Подтверждающие исследования Реакция Витали-Морена (атропин и скополамин) атропин троповая кислота тринитропроизводное троповой кислоты тропин фиолетовое окрашивание Реакция неспецифическая (характерна для вератрина, стрихнина, аминазина и др. ). 93
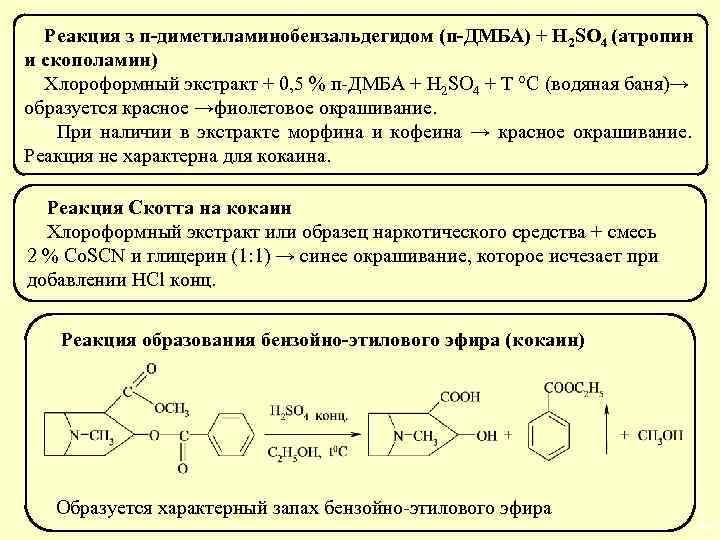 Реакция з п-диметиламинобензальдегидом (п-ДМБА) + H 2 SO 4 (атропин и скополамин) Хлороформный экстракт + 0, 5 % п-ДМБА + H 2 SO 4 + Т °C (водяная баня)→ образуется красное →фиолетовое окрашивание. При наличии в экстракте морфина и кофеина → красное окрашивание. Реакция не характерна для кокаина. Реакция Скотта на кокаин Хлороформный экстракт или образец наркотического средства + смесь 2 % Co. SCN и глицерин (1: 1) → синее окрашивание, которое исчезает при добавлении HCl конц. Реакция образования бензойно-этилового эфира (кокаин) Образуется характерный запах бензойно-этилового эфира 94
Реакция з п-диметиламинобензальдегидом (п-ДМБА) + H 2 SO 4 (атропин и скополамин) Хлороформный экстракт + 0, 5 % п-ДМБА + H 2 SO 4 + Т °C (водяная баня)→ образуется красное →фиолетовое окрашивание. При наличии в экстракте морфина и кофеина → красное окрашивание. Реакция не характерна для кокаина. Реакция Скотта на кокаин Хлороформный экстракт или образец наркотического средства + смесь 2 % Co. SCN и глицерин (1: 1) → синее окрашивание, которое исчезает при добавлении HCl конц. Реакция образования бензойно-этилового эфира (кокаин) Образуется характерный запах бензойно-этилового эфира 94
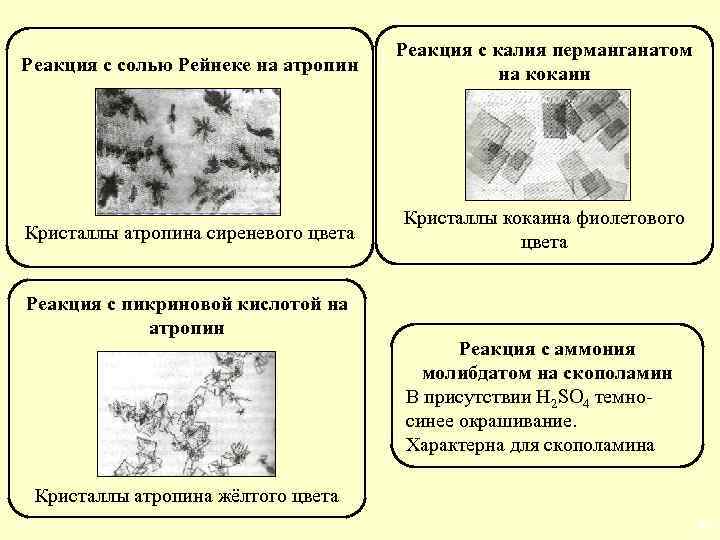 Реакция с солью Рейнеке на атропин Реакция с калия перманганатом на кокаин Кристаллы атропина сиреневого цвета Кристаллы кокаина фиолетового цвета Реакция с пикриновой кислотой на атропин Реакция с аммония молибдатом на скополамин В присутствии H 2 SO 4 темносинее окрашивание. Характерна для скополамина Кристаллы атропина жёлтого цвета 95
Реакция с солью Рейнеке на атропин Реакция с калия перманганатом на кокаин Кристаллы атропина сиреневого цвета Кристаллы кокаина фиолетового цвета Реакция с пикриновой кислотой на атропин Реакция с аммония молибдатом на скополамин В присутствии H 2 SO 4 темносинее окрашивание. Характерна для скополамина Кристаллы атропина жёлтого цвета 95
 ИК-спектроскопия Атропин – 1720, 1035, 1153 см-1; скополамин – 1725, 1041, 1165, 1060 см-1; кокаин – 1275, 1700, 1106, 1040, 1280 см-1. УФ-спектрофотометрия Атропин – λmax 252, 258 и 264 нм; скополамин – λmax 251, 257, 263 нм; кокаин – λmax 233 та 275 нм. Фармакологические пробы Атропин, скополамин и кокаин расширяют глазной зрачок кошки при закапывании в условиях яркого света. Фармакогностические исследования Под микроскопом обнаруживают характерные морфологические признаки для каждого вида растений тропанового ряда. 96
ИК-спектроскопия Атропин – 1720, 1035, 1153 см-1; скополамин – 1725, 1041, 1165, 1060 см-1; кокаин – 1275, 1700, 1106, 1040, 1280 см-1. УФ-спектрофотометрия Атропин – λmax 252, 258 и 264 нм; скополамин – λmax 251, 257, 263 нм; кокаин – λmax 233 та 275 нм. Фармакологические пробы Атропин, скополамин и кокаин расширяют глазной зрачок кошки при закапывании в условиях яркого света. Фармакогностические исследования Под микроскопом обнаруживают характерные морфологические признаки для каждого вида растений тропанового ряда. 96
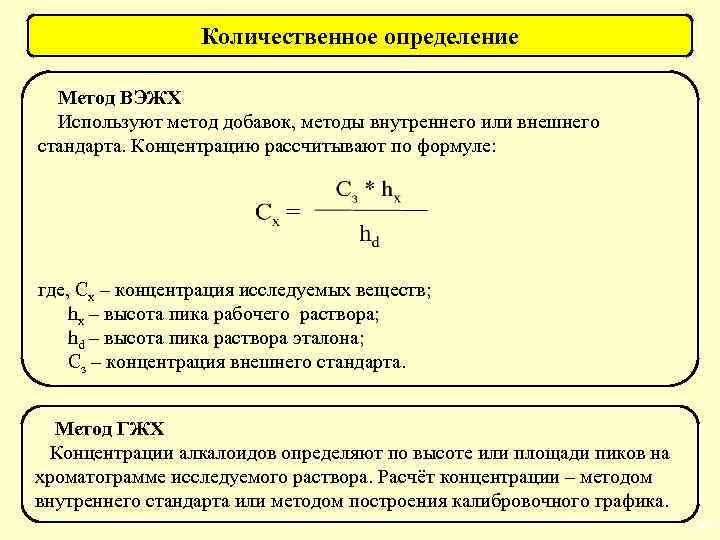 Количественное определение Метод ВЭЖХ Используют метод добавок, методы внутреннего или внешнего стандарта. Концентрацию рассчитывают по формуле: где, Сх – концентрация исследуемых веществ; hx – высота пика рабочего раствора; hd – высота пика раствора эталона; Сз – концентрация внешнего стандарта. Метод ГЖХ Концентрации алкалоидов определяют по высоте или площади пиков на хроматограмме исследуемого раствора. Расчёт концентрации – методом внутреннего стандарта или методом построения калибровочного графика. 97
Количественное определение Метод ВЭЖХ Используют метод добавок, методы внутреннего или внешнего стандарта. Концентрацию рассчитывают по формуле: где, Сх – концентрация исследуемых веществ; hx – высота пика рабочего раствора; hd – высота пика раствора эталона; Сз – концентрация внешнего стандарта. Метод ГЖХ Концентрации алкалоидов определяют по высоте или площади пиков на хроматограмме исследуемого раствора. Расчёт концентрации – методом внутреннего стандарта или методом построения калибровочного графика. 97
 НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ АЛКАЛОИДОВ ПРОИЗВОДНЫХ ХИНОЛИНА, ИЗОХИНОЛИНА И ИХ ФАРМАКОЛОГИЧЕСКИХ АНАЛОГОВ, ПУРИНА План лекции: 1. Физико-химические и токсикологические свойства, метаболизм и ХТА хинина. 2. Физико-химические и токсикологические свойства, метаболизм и ХТА опиатов и опиоидов. 3. Физико-химические и токсикологические свойства, метаболизм и ХТА алкалоидов производных пурина.
НАЦИОНАЛЬНЫЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ АЛКАЛОИДОВ ПРОИЗВОДНЫХ ХИНОЛИНА, ИЗОХИНОЛИНА И ИХ ФАРМАКОЛОГИЧЕСКИХ АНАЛОГОВ, ПУРИНА План лекции: 1. Физико-химические и токсикологические свойства, метаболизм и ХТА хинина. 2. Физико-химические и токсикологические свойства, метаболизм и ХТА опиатов и опиоидов. 3. Физико-химические и токсикологические свойства, метаболизм и ХТА алкалоидов производных пурина.
 Алкалоиды производные хинолина Хинин Основной алкалоид хинного дерева (Cinchona) Токсикологическое значение хинина При остром отравлении хинин изменяет состояние ЦНС, сердечно-сосудистой системы и стимулирует мускулатуру матки. Токсические дозы (4 -6 г) вызывают расстройства слуха и слепоту, прерывают беременность. При патологоморфологическом исследовании отмечают отек мозга и легких. Физико-химические свойства Основание хинина – кристаллическое вещество, растворимо в этаноле, хлороформе, диэтиловом эфире, мало растворимо в воде. Соли хинина (сульфаты и хлориды) растворимы в этаноле, хлороформе, воде и мало растворимы в диэтиловом эфире. 99
Алкалоиды производные хинолина Хинин Основной алкалоид хинного дерева (Cinchona) Токсикологическое значение хинина При остром отравлении хинин изменяет состояние ЦНС, сердечно-сосудистой системы и стимулирует мускулатуру матки. Токсические дозы (4 -6 г) вызывают расстройства слуха и слепоту, прерывают беременность. При патологоморфологическом исследовании отмечают отек мозга и легких. Физико-химические свойства Основание хинина – кристаллическое вещество, растворимо в этаноле, хлороформе, диэтиловом эфире, мало растворимо в воде. Соли хинина (сульфаты и хлориды) растворимы в этаноле, хлороформе, воде и мало растворимы в диэтиловом эфире. 99
 Биотрансформация хинина 1 фаза гидроксилирование дигидроксихинин 6 -метокси-4 -кетохинолинкарбоновая кислота (гемохинная кислота) 2 фаза хинетин Образование конъюгатов 10
Биотрансформация хинина 1 фаза гидроксилирование дигидроксихинин 6 -метокси-4 -кетохинолинкарбоновая кислота (гемохинная кислота) 2 фаза хинетин Образование конъюгатов 10
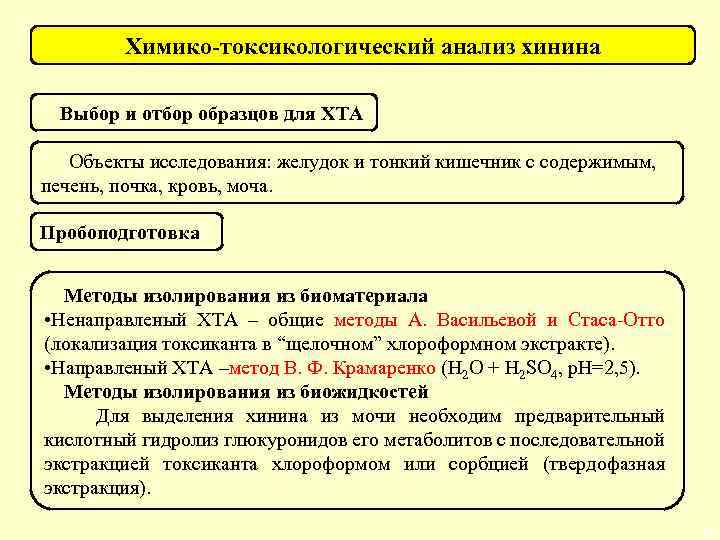 Химико-токсикологический анализ хинина Выбор и отбор образцов для ХТА Объекты исследования: желудок и тонкий кишечник с содержимым, печень, почка, кровь, моча. Пробоподготовка Методы изолирования из биоматериала • Ненаправленый ХТА – общие методы А. Васильевой и Стаса-Отто (локализация токсиканта в “щелочном” хлороформном экстракте). • Направленый ХТА –метод В. Ф. Крамаренко (H 2 O + H 2 SO 4, p. H=2, 5). Методы изолирования из биожидкостей Для выделения хинина из мочи необходим предварительный кислотный гидролиз глюкуронидов его метаболитов с последовательной экстракцией токсиканта хлороформом или сорбцией (твердофазная экстракция). 10
Химико-токсикологический анализ хинина Выбор и отбор образцов для ХТА Объекты исследования: желудок и тонкий кишечник с содержимым, печень, почка, кровь, моча. Пробоподготовка Методы изолирования из биоматериала • Ненаправленый ХТА – общие методы А. Васильевой и Стаса-Отто (локализация токсиканта в “щелочном” хлороформном экстракте). • Направленый ХТА –метод В. Ф. Крамаренко (H 2 O + H 2 SO 4, p. H=2, 5). Методы изолирования из биожидкостей Для выделения хинина из мочи необходим предварительный кислотный гидролиз глюкуронидов его метаболитов с последовательной экстракцией токсиканта хлороформом или сорбцией (твердофазная экстракция). 10
 Обнаружение Предварительные исследования Методы скрининга • ТСХ-скрининг. Неподвижная фаза – силикагель КСК. Подвижная фаза – системы растворителей хлороформ-диоксан-ацетон-25 % NH 4 OH (45: 47, 5: 5: 2, 5) и диетиловый эфир-ацетон-25 % NH 4 OH (40: 2). Стандарт – 0, 01 % раствор хинина в хлороформе. Проявитель – 10 % H 2 SO 4 + УФ-свет (светящееся голубое окрашивание пятна). Rf 0, 25 и 0, 39 соответственно. • ГЖХ-скрининг. Объект исследования – 10 мл мочи. Прибор ЛХМ-80, детектор азотно-фосфорный (NPD), колонка стеклянная (силанизированная), газ-носитель – азот. Для идентификации хроматографического пика определяют индекс удерживания (стандарт – смесь н-алканов Cn. H 2+1 с числом атомов углерода от 10 до 32). Индекс удерживания хинина 3110. Реакции с осадительными реактивами Хинин образует осадки с реактивами Драгендорфа, Бушарда, Вагнера, Майєра, Зонненшейна и др. 10
Обнаружение Предварительные исследования Методы скрининга • ТСХ-скрининг. Неподвижная фаза – силикагель КСК. Подвижная фаза – системы растворителей хлороформ-диоксан-ацетон-25 % NH 4 OH (45: 47, 5: 5: 2, 5) и диетиловый эфир-ацетон-25 % NH 4 OH (40: 2). Стандарт – 0, 01 % раствор хинина в хлороформе. Проявитель – 10 % H 2 SO 4 + УФ-свет (светящееся голубое окрашивание пятна). Rf 0, 25 и 0, 39 соответственно. • ГЖХ-скрининг. Объект исследования – 10 мл мочи. Прибор ЛХМ-80, детектор азотно-фосфорный (NPD), колонка стеклянная (силанизированная), газ-носитель – азот. Для идентификации хроматографического пика определяют индекс удерживания (стандарт – смесь н-алканов Cn. H 2+1 с числом атомов углерода от 10 до 32). Индекс удерживания хинина 3110. Реакции с осадительными реактивами Хинин образует осадки с реактивами Драгендорфа, Бушарда, Вагнера, Майєра, Зонненшейна и др. 10
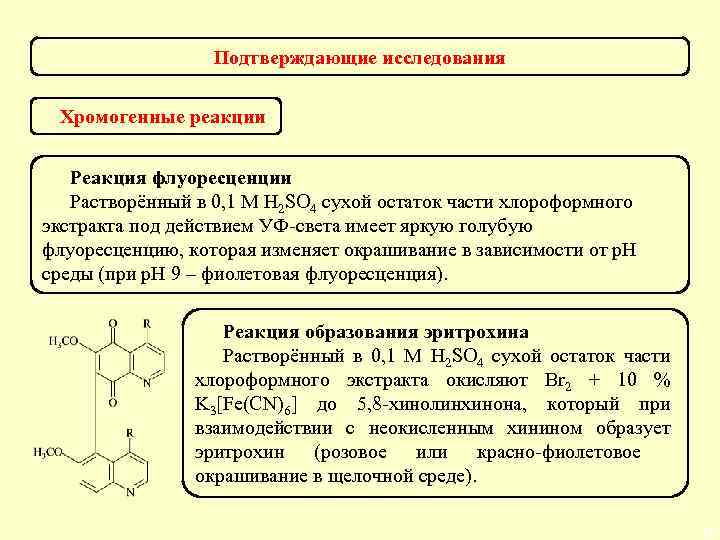 Подтверждающие исследования Хромогенные реакции Реакция флуоресценции Растворённый в 0, 1 М H 2 SO 4 сухой остаток части хлороформного экстракта под действием УФ-света имеет яркую голубую флуоресценцию, которая изменяет окрашивание в зависимости от р. Н среды (при р. Н 9 – фиолетовая флуоресценция). Реакция образования эритрохина Растворённый в 0, 1 М H 2 SO 4 сухой остаток части хлороформного экстракта окисляют Br 2 + 10 % K 3[Fe(CN)6] до 5, 8 -хинолинхинона, который при взаимодействии с неокисленным хинином образует эритрохин (розовое или красно-фиолетовое окрашивание в щелочной среде). 10
Подтверждающие исследования Хромогенные реакции Реакция флуоресценции Растворённый в 0, 1 М H 2 SO 4 сухой остаток части хлороформного экстракта под действием УФ-света имеет яркую голубую флуоресценцию, которая изменяет окрашивание в зависимости от р. Н среды (при р. Н 9 – фиолетовая флуоресценция). Реакция образования эритрохина Растворённый в 0, 1 М H 2 SO 4 сухой остаток части хлороформного экстракта окисляют Br 2 + 10 % K 3[Fe(CN)6] до 5, 8 -хинолинхинона, который при взаимодействии с неокисленным хинином образует эритрохин (розовое или красно-фиолетовое окрашивание в щелочной среде). 10
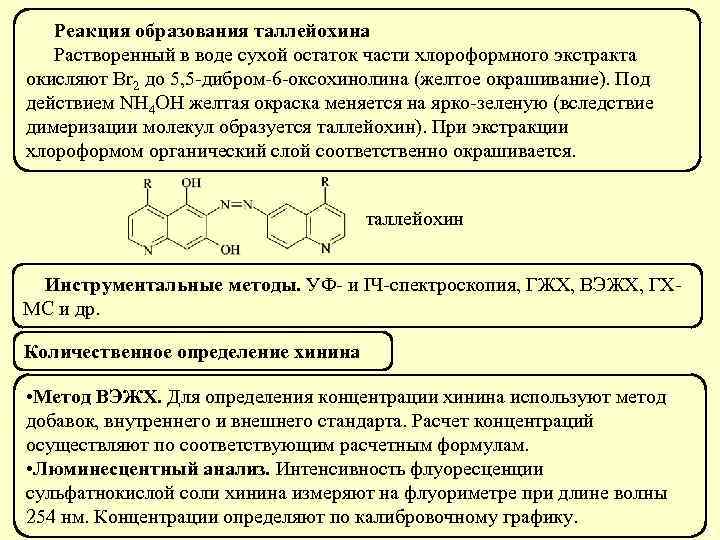 Реакция образования таллейохина Растворенный в воде сухой остаток части хлороформного экстракта окисляют Br 2 до 5, 5 -дибром-6 -оксохинолина (желтое окрашивание). Под действием NH 4 OH желтая окраска меняется на ярко-зеленую (вследствие димеризации молекул образуется таллейохин). При экстракции хлороформом органический слой соответственно окрашивается. таллейохин Инструментальные методы. УФ- и ІЧ-спектроскопия, ГЖХ, ВЭЖХ, ГХМС и др. Количественное определение хинина • Метод ВЭЖХ. Для определения концентрации хинина используют метод добавок, внутреннего и внешнего стандарта. Расчет концентраций осуществляют по соответствующим расчетным формулам. • Люминесцентный анализ. Интенсивность флуоресценции сульфатнокислой соли хинина измеряют на флуориметре при длине волны 254 нм. Концентрации определяют по калибровочному графику. 10
Реакция образования таллейохина Растворенный в воде сухой остаток части хлороформного экстракта окисляют Br 2 до 5, 5 -дибром-6 -оксохинолина (желтое окрашивание). Под действием NH 4 OH желтая окраска меняется на ярко-зеленую (вследствие димеризации молекул образуется таллейохин). При экстракции хлороформом органический слой соответственно окрашивается. таллейохин Инструментальные методы. УФ- и ІЧ-спектроскопия, ГЖХ, ВЭЖХ, ГХМС и др. Количественное определение хинина • Метод ВЭЖХ. Для определения концентрации хинина используют метод добавок, внутреннего и внешнего стандарта. Расчет концентраций осуществляют по соответствующим расчетным формулам. • Люминесцентный анализ. Интенсивность флуоресценции сульфатнокислой соли хинина измеряют на флуориметре при длине волны 254 нм. Концентрации определяют по калибровочному графику. 10
 Алкалоиды производные изохинолина Опиаты – производные изохинолина алкалоиды Papaver somniferum (морфин, кодеин и др. ), а также полусинтетические производные морфинанового ряда (етилморфин, диацетилморфин и др. ). Опий (Opium): морфин (3 -30 %), кодеин (1 -5 %), носкапин (4 -15 %), папаверин (1 -6 %), тебаин (1 -4 %), другие алкалоиди (0, 5 -2 %), меконовая кислота (5 -10 %) и другие соединения до 60 %. 10
Алкалоиды производные изохинолина Опиаты – производные изохинолина алкалоиды Papaver somniferum (морфин, кодеин и др. ), а также полусинтетические производные морфинанового ряда (етилморфин, диацетилморфин и др. ). Опий (Opium): морфин (3 -30 %), кодеин (1 -5 %), носкапин (4 -15 %), папаверин (1 -6 %), тебаин (1 -4 %), другие алкалоиди (0, 5 -2 %), меконовая кислота (5 -10 %) и другие соединения до 60 %. 10
 Основные составляющие опия морфин 3 -окси-4 -пирон-2, 6 дикарбоновая кислота (меконовая) тебаин кодеин носкапин (наркотин) 106
Основные составляющие опия морфин 3 -окси-4 -пирон-2, 6 дикарбоновая кислота (меконовая) тебаин кодеин носкапин (наркотин) 106
 Токсикологические свойства растительных опиатов Морфин – наркотический анальгетик, вызывает ейфорию, при повторном применении вызывает пристрастие (морфинизм). При остром отравлении нарушается сердечная деяльность – паралич дыхания. Летальная доза 0, 3 -1, 4 г. Кодеин – по характеру фармакологического действия подобен морфину, анальгетические свойства менее выражены, угнетает возбуждение кашлевого центра, при повторном использовании вызывает пристрастие (кодеиномания). При остром отравлении – коллапс, потеря рефлексов, остановка дыхання. Летальная доза 0, 5 г. Папаверин и носкапин (наркотин) не проявляют наркотических свойств. Носкапин имеет судебно-токсикологическое значения как вещественное доказательство отравления опием и омнопоном. 107
Токсикологические свойства растительных опиатов Морфин – наркотический анальгетик, вызывает ейфорию, при повторном применении вызывает пристрастие (морфинизм). При остром отравлении нарушается сердечная деяльность – паралич дыхания. Летальная доза 0, 3 -1, 4 г. Кодеин – по характеру фармакологического действия подобен морфину, анальгетические свойства менее выражены, угнетает возбуждение кашлевого центра, при повторном использовании вызывает пристрастие (кодеиномания). При остром отравлении – коллапс, потеря рефлексов, остановка дыхання. Летальная доза 0, 5 г. Папаверин и носкапин (наркотин) не проявляют наркотических свойств. Носкапин имеет судебно-токсикологическое значения как вещественное доказательство отравления опием и омнопоном. 107
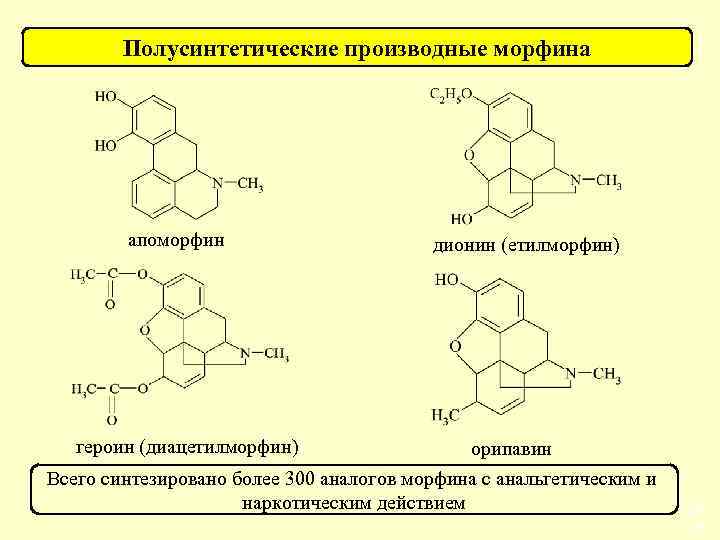 Полусинтетические производные морфина апоморфин дионин (етилморфин) героин (диацетилморфин) орипавин Всего синтезировано более 300 аналогов морфина с анальгетическим и наркотическим действием 10 8
Полусинтетические производные морфина апоморфин дионин (етилморфин) героин (диацетилморфин) орипавин Всего синтезировано более 300 аналогов морфина с анальгетическим и наркотическим действием 10 8
 Токсикологические свойства полусинтетических опиатов Героин – наркотический анальгетик. Получают по реакции ацетилирования из морфина, опия, маковой соломки и др. Пристрастие развивается после первого применения. Последствиями действия героина является депрессия, психопатические реакции, склонность к суициду, психическая и физическая деградация, нарушение эндокринного баланса. Дионин – по фармакологическим и токсикологическим свойствам подобен кодеину. Получают синтетическим путём. Наркотические свойства менее выражены по сравнению с морфином. Токсичные дозы дионина парализуют средний отдел головного мозга. Апоморфин – не проявляет анальгетического действия, является стимулятором ЦНС (особенно рвотного центра продолговатого мозга). Получают при окислении морфина. Токсичные дозы вызывают потерю сознания, рвоту, коллапс. 109
Токсикологические свойства полусинтетических опиатов Героин – наркотический анальгетик. Получают по реакции ацетилирования из морфина, опия, маковой соломки и др. Пристрастие развивается после первого применения. Последствиями действия героина является депрессия, психопатические реакции, склонность к суициду, психическая и физическая деградация, нарушение эндокринного баланса. Дионин – по фармакологическим и токсикологическим свойствам подобен кодеину. Получают синтетическим путём. Наркотические свойства менее выражены по сравнению с морфином. Токсичные дозы дионина парализуют средний отдел головного мозга. Апоморфин – не проявляет анальгетического действия, является стимулятором ЦНС (особенно рвотного центра продолговатого мозга). Получают при окислении морфина. Токсичные дозы вызывают потерю сознания, рвоту, коллапс. 109
 Биотрансформация опиатов 1 фаза – дезалкилирование и гидролиз N-дезалкилирование норморфин-1% (норкодеин, нордионин) морфин (кодеин, дионин) О-дезалкилирование кодеин (дионин) морфин 5 -15 % 110
Биотрансформация опиатов 1 фаза – дезалкилирование и гидролиз N-дезалкилирование норморфин-1% (норкодеин, нордионин) морфин (кодеин, дионин) О-дезалкилирование кодеин (дионин) морфин 5 -15 % 110
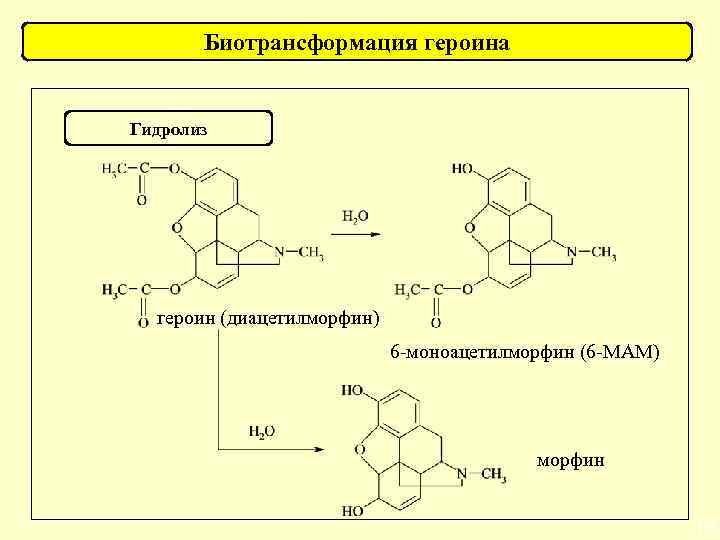 Биотрансформация героина Гидролиз героин (диацетилморфин) 6 -моноацетилморфин (6 -МАМ) морфин 111
Биотрансформация героина Гидролиз героин (диацетилморфин) 6 -моноацетилморфин (6 -МАМ) морфин 111
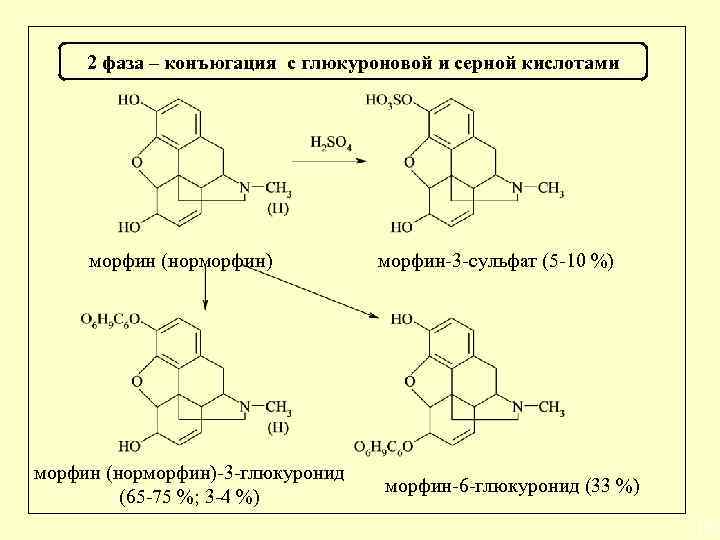 2 фаза – конъюгация с глюкуроновой и серной кислотами морфин (норморфин)-3 -глюкуронид (65 -75 %; 3 -4 %) морфин-3 -сульфат (5 -10 %) морфин-6 -глюкуронид (33 %) 112
2 фаза – конъюгация с глюкуроновой и серной кислотами морфин (норморфин)-3 -глюкуронид (65 -75 %; 3 -4 %) морфин-3 -сульфат (5 -10 %) морфин-6 -глюкуронид (33 %) 112
 При отравлении морфином – морфин-6 -глюкуронид и морфин-3 -глюкуронид (1: 2). При отравлении опием и омнопоном – меконовая кислота, носкапин, метаболиты морфина и кодеина. Основные вещественные доказательств а отравления опиатами При отравлении кодеином – кодеин 6 -глюкуронид. При отравлении героином – 6 -моно-ацетилморфин (6 -МАМ), морфин и его метаболиты. Другие алкалоиды при метаболизме 6 -МАМ не образуют. 113
При отравлении морфином – морфин-6 -глюкуронид и морфин-3 -глюкуронид (1: 2). При отравлении опием и омнопоном – меконовая кислота, носкапин, метаболиты морфина и кодеина. Основные вещественные доказательств а отравления опиатами При отравлении кодеином – кодеин 6 -глюкуронид. При отравлении героином – 6 -моно-ацетилморфин (6 -МАМ), морфин и его метаболиты. Другие алкалоиды при метаболизме 6 -МАМ не образуют. 113
 Химико-токсикологический анализ опиатов Выбор и отбор образцов для анализа Пробоподготовка. Изолирование: • При ненаправленном ХТА – общими методами (Стаса-Отто и А. А. Васильевой). • При направленном ХТА – специальными методами (В. Ф. Крамаренко). Предварительные исследования • ТСХ-скрининг кислого хлороформного екстракта (папаверин, наркотин) и щелочного хлороформного екстракта (морфин, кодеин, героин, дионин, папаверин и наркотин). Реактив Драгендорфа окрашивает пятна на хроматограмме в оранжевый цвет. • Аналитический скрининг – по продуктам реакции с общеалкалоидными реактивами (фосфорно-вольфрамовая кислота, фосфорно-молибденовая кислота, реактивы Драгендорфа, Бушарда, Майєра) и цветными реактивами (реактивы Марки, Фреде, Манделина и Эрдмана). 114
Химико-токсикологический анализ опиатов Выбор и отбор образцов для анализа Пробоподготовка. Изолирование: • При ненаправленном ХТА – общими методами (Стаса-Отто и А. А. Васильевой). • При направленном ХТА – специальными методами (В. Ф. Крамаренко). Предварительные исследования • ТСХ-скрининг кислого хлороформного екстракта (папаверин, наркотин) и щелочного хлороформного екстракта (морфин, кодеин, героин, дионин, папаверин и наркотин). Реактив Драгендорфа окрашивает пятна на хроматограмме в оранжевый цвет. • Аналитический скрининг – по продуктам реакции с общеалкалоидными реактивами (фосфорно-вольфрамовая кислота, фосфорно-молибденовая кислота, реактивы Драгендорфа, Бушарда, Майєра) и цветными реактивами (реактивы Марки, Фреде, Манделина и Эрдмана). 114
 Подтверждающие исследования Результаты реакций и окрашивание с реактивами Вещество Манделина Марки Фреде Эрдмана Морфин фиолетовое красно-фиолетовое красное→ жёлтое Кодеин зелёное→ синее сине-фиолетовое→ зелёное→ синее – Героин фиолетовое красное→ фиолетовое→ зелёное→розовое – Дионин зелёное синее→ фиолетовое зелёное→ синее – Наркотин красное→ фиолетовое→ зелёное→жёлтое сине-зелёное→ при tºС красное→ фиолетовокрасное Папаверин сине-фиолетовое розовое→ фиолетовое зелёное красное 11
Подтверждающие исследования Результаты реакций и окрашивание с реактивами Вещество Манделина Марки Фреде Эрдмана Морфин фиолетовое красно-фиолетовое красное→ жёлтое Кодеин зелёное→ синее сине-фиолетовое→ зелёное→ синее – Героин фиолетовое красное→ фиолетовое→ зелёное→розовое – Дионин зелёное синее→ фиолетовое зелёное→ синее – Наркотин красное→ фиолетовое→ зелёное→жёлтое сине-зелёное→ при tºС красное→ фиолетовокрасное Папаверин сине-фиолетовое розовое→ фиолетовое зелёное красное 11
 Морфин • Реакция с Fe. Cl 3 на фенольний гидроксил – синее окрашивание. • Реакция с HNO 3 конц. – красное окрашивание → жёлтое. • Сухой остаток хлороформного екстракта + 10 % Na. OH + диазотированая сульфаниловая кислота → красное окрашивание. Героин • Реакция с H 2 SO 4 конц. → синее окрашивание. • Реакция с HNO 3 конц. → жёлтое окрашивание. • Реакция образования уксусноэтилового эфира. Исследуемое вещество + H 2 SO 4 + C 2 H 5 OH (запах яблочной ессенции). УФ-спектрофотометрия Етанольные растворы λmax: морфин 287 нм, кодеин 286 нм, героин 281 нм, наркотин 291 и 310 нм. 0, 1 М HCl λmax: морфин 285 нм, кодеин 211 та 285 нм, героин 278 нм, папаверин 250, 284 та 310 нм. 11
Морфин • Реакция с Fe. Cl 3 на фенольний гидроксил – синее окрашивание. • Реакция с HNO 3 конц. – красное окрашивание → жёлтое. • Сухой остаток хлороформного екстракта + 10 % Na. OH + диазотированая сульфаниловая кислота → красное окрашивание. Героин • Реакция с H 2 SO 4 конц. → синее окрашивание. • Реакция с HNO 3 конц. → жёлтое окрашивание. • Реакция образования уксусноэтилового эфира. Исследуемое вещество + H 2 SO 4 + C 2 H 5 OH (запах яблочной ессенции). УФ-спектрофотометрия Етанольные растворы λmax: морфин 287 нм, кодеин 286 нм, героин 281 нм, наркотин 291 и 310 нм. 0, 1 М HCl λmax: морфин 285 нм, кодеин 211 та 285 нм, героин 278 нм, папаверин 250, 284 та 310 нм. 11
 Опиоиды – фармакологические аналоги морфина, имеющие другое химическое строение. промедол фентанил трамадол метадон 11
Опиоиды – фармакологические аналоги морфина, имеющие другое химическое строение. промедол фентанил трамадол метадон 11
 Химико-токсикологический анализ на опиоиды Выбор и отбор образцов для анализа (биоматериал, биожидкости, лекарственные средства). Пробоподготовка Изолирование из биожидкостей: • Жидкость-жидкостная экстракция органическими растворителями при р. Н>7. • Твёрдофазная экстракция органическими растворителями в специальных патронах. Обнаружение Метод ТСХ: Промедол. Подвижная фаза – етилацетат-етанол-25% NH 4 OH (9: 1: 0, 5); Rf=0, 69. Метадон. Подвижная фаза – бензол-етанол-диетиламин (9: 1: 1); Rf=0, 80. Трамадол. Подвижная фаза – толуен-етанол-триетиламин (9: 1: 1); Rf=0, 74. Проявители: УФ-свет λmax 254 нм (гашение флуоресцеина) и реактив Драгендорфа (коричневое окрашивание пятен на жёлтом фоне). 11
Химико-токсикологический анализ на опиоиды Выбор и отбор образцов для анализа (биоматериал, биожидкости, лекарственные средства). Пробоподготовка Изолирование из биожидкостей: • Жидкость-жидкостная экстракция органическими растворителями при р. Н>7. • Твёрдофазная экстракция органическими растворителями в специальных патронах. Обнаружение Метод ТСХ: Промедол. Подвижная фаза – етилацетат-етанол-25% NH 4 OH (9: 1: 0, 5); Rf=0, 69. Метадон. Подвижная фаза – бензол-етанол-диетиламин (9: 1: 1); Rf=0, 80. Трамадол. Подвижная фаза – толуен-етанол-триетиламин (9: 1: 1); Rf=0, 74. Проявители: УФ-свет λmax 254 нм (гашение флуоресцеина) и реактив Драгендорфа (коричневое окрашивание пятен на жёлтом фоне). 11
 Цветные реакции Реактив Марки. Промедол – красно-пурпурное окрашивание; трамадол – коричневое→грязно-зелёное; метадон – розово-красное→интенсивная флуоресценция. H 2 SO 4. Трамадол – жёлтое окрашивание. Реактив Либермана. Трамадол – оранжевое окрашивание. Реактив Манделина. Метадон – зелёное→голубое окрашивание. Реактив Фреде. Метадон – серо-коричневое окрашивание. Раствор 1 % лимонной кислоты. Фентанил – красно-фиолетовое окрашивание. Микрокристаллоскопические реакции Промедол. Сухой остаток + 0, 1 М HCl + 0, 2 % водный раствор ализаринового красного → образуются кристаллы в виде иголок. Инструментальные методы обнаружения: ВЭЖХ, газовая хроматография с масс-спектральным детектированием. 11
Цветные реакции Реактив Марки. Промедол – красно-пурпурное окрашивание; трамадол – коричневое→грязно-зелёное; метадон – розово-красное→интенсивная флуоресценция. H 2 SO 4. Трамадол – жёлтое окрашивание. Реактив Либермана. Трамадол – оранжевое окрашивание. Реактив Манделина. Метадон – зелёное→голубое окрашивание. Реактив Фреде. Метадон – серо-коричневое окрашивание. Раствор 1 % лимонной кислоты. Фентанил – красно-фиолетовое окрашивание. Микрокристаллоскопические реакции Промедол. Сухой остаток + 0, 1 М HCl + 0, 2 % водный раствор ализаринового красного → образуются кристаллы в виде иголок. Инструментальные методы обнаружения: ВЭЖХ, газовая хроматография с масс-спектральным детектированием. 11
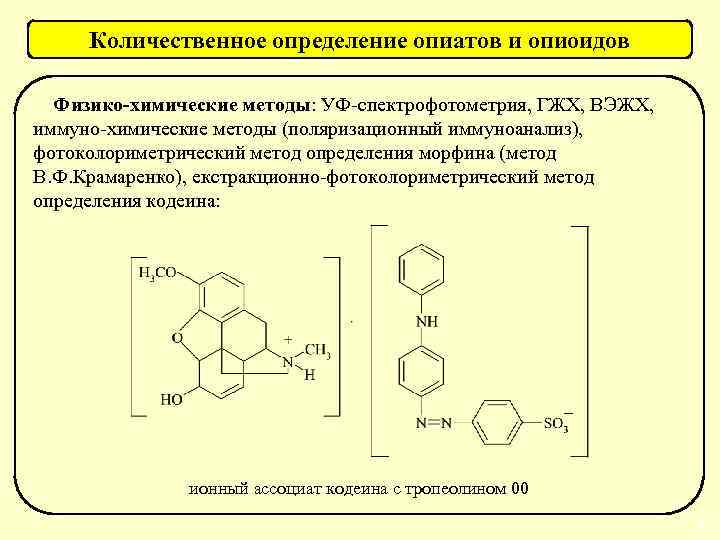 Количественное определение опиатов и опиоидов Физико-химические методы: УФ-спектрофотометрия, ГЖХ, ВЭЖХ, иммуно-химические методы (поляризационный иммуноанализ), фотоколориметрический метод определения морфина (метод В. Ф. Крамаренко), екстракционно-фотоколориметрический метод определения кодеина: ионный ассоциат кодеина с тропеолином 00 12
Количественное определение опиатов и опиоидов Физико-химические методы: УФ-спектрофотометрия, ГЖХ, ВЭЖХ, иммуно-химические методы (поляризационный иммуноанализ), фотоколориметрический метод определения морфина (метод В. Ф. Крамаренко), екстракционно-фотоколориметрический метод определения кодеина: ионный ассоциат кодеина с тропеолином 00 12
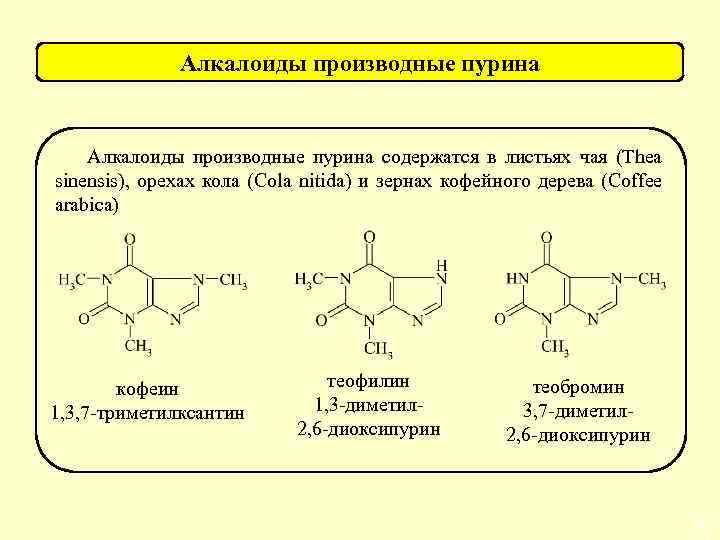 Алкалоиды производные пурина Алкалоиды производные пурина содержатся в листьях чая (Thea sinensis), орехах кола (Cola nitida) и зернах кофейного дерева (Coffee arabica) кофеин 1, 3, 7 -триметилксантин теофилин 1, 3 -диметил 2, 6 -диоксипурин теобромин 3, 7 -диметил 2, 6 -диоксипурин 12
Алкалоиды производные пурина Алкалоиды производные пурина содержатся в листьях чая (Thea sinensis), орехах кола (Cola nitida) и зернах кофейного дерева (Coffee arabica) кофеин 1, 3, 7 -триметилксантин теофилин 1, 3 -диметил 2, 6 -диоксипурин теобромин 3, 7 -диметил 2, 6 -диоксипурин 12
 Токсикологическое значение и физико-химические свойства Токсикологическое значение Кофеин является стимулятором ЦНС. Острая интоксикация характеризуется эйфорией, усилением активности, ясностью мышления, что требует увеличения дозы (100 -200 таб. по 0, 1 г). Большие дозы кофеина способствуют к снижению артериального давления, клонико-тоническим судорогам, рвоте и т. п. Хроническая интоксикация – истощением ЦНС и суицидальным мыслям. Физико-химическте свойства Кофеин – кристаллическое вещество, летуче на воздухе и при нагревании, медленно растворимо в воде (1: 60), мало растворимо в этаноле, практически не растворимо в диэтиловом эфире, легко растворимо в хлороформе; с кислотами образует нестойкие к гидролизу соли (р. Ка=0, 6). 12
Токсикологическое значение и физико-химические свойства Токсикологическое значение Кофеин является стимулятором ЦНС. Острая интоксикация характеризуется эйфорией, усилением активности, ясностью мышления, что требует увеличения дозы (100 -200 таб. по 0, 1 г). Большие дозы кофеина способствуют к снижению артериального давления, клонико-тоническим судорогам, рвоте и т. п. Хроническая интоксикация – истощением ЦНС и суицидальным мыслям. Физико-химическте свойства Кофеин – кристаллическое вещество, летуче на воздухе и при нагревании, медленно растворимо в воде (1: 60), мало растворимо в этаноле, практически не растворимо в диэтиловом эфире, легко растворимо в хлороформе; с кислотами образует нестойкие к гидролизу соли (р. Ка=0, 6). 12
 Биотрансформация кофеина Деметилирование (по 1 и 7 пол. ) 3 -метилксантин (по 3 и 7 пол. ) 1 -метилксантин Окисление продуктов деметилирования 1 -метилмочевая кислота 12
Биотрансформация кофеина Деметилирование (по 1 и 7 пол. ) 3 -метилксантин (по 3 и 7 пол. ) 1 -метилксантин Окисление продуктов деметилирования 1 -метилмочевая кислота 12
 Химико-токсикологический анализ на кофеин Выбор и отбор образцов для анализа Пробоподготовка. Изолирование: • Ненаправленный ХТА – общие методы А. А. Васильевой и Стаса-Отто (локализация токсиканта в «кислом» хлороформном экстракте). • Направленный ХТА – метод В. Ф. Крамаренко (H 2 O + H 2 SO 4). Предварительные исследования ТСХ-скрининг. Кофеин на хроматографической пластине в общих системах растворителей обнаруживается реактивом Драгендорфа в виде оранжевых пятен на желтом фоне (Rf 0, 25 для «кислого» хлороформного экстракта и 0, 65 для «щелочного» хлороформного экстракта). Аналитический скрининг. Кофеин обнаруживают с использованием общеосадительных реактивов (Драгендорфа, Бушарда, Вагнера и др. ). 12
Химико-токсикологический анализ на кофеин Выбор и отбор образцов для анализа Пробоподготовка. Изолирование: • Ненаправленный ХТА – общие методы А. А. Васильевой и Стаса-Отто (локализация токсиканта в «кислом» хлороформном экстракте). • Направленный ХТА – метод В. Ф. Крамаренко (H 2 O + H 2 SO 4). Предварительные исследования ТСХ-скрининг. Кофеин на хроматографической пластине в общих системах растворителей обнаруживается реактивом Драгендорфа в виде оранжевых пятен на желтом фоне (Rf 0, 25 для «кислого» хлороформного экстракта и 0, 65 для «щелочного» хлороформного экстракта). Аналитический скрининг. Кофеин обнаруживают с использованием общеосадительных реактивов (Драгендорфа, Бушарда, Вагнера и др. ). 12
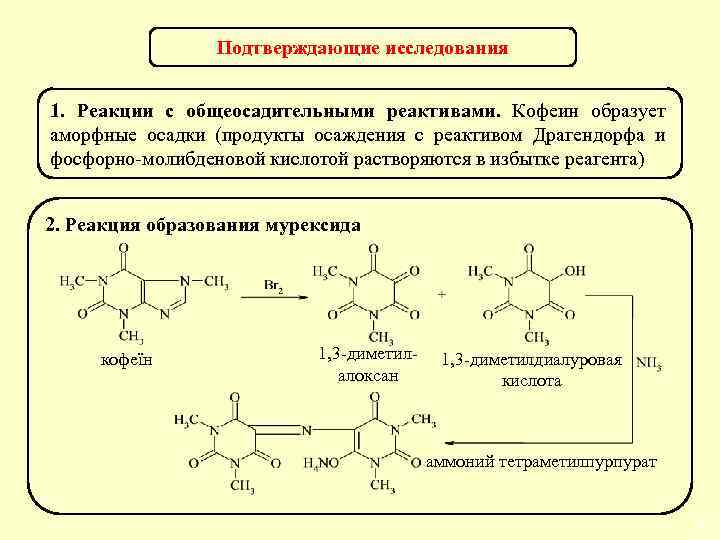 Подтверждающие исследования 1. Реакции с общеосадительными реактивами. Кофеин образует аморфные осадки (продукты осаждения с реактивом Драгендорфа и фосфорно-молибденовой кислотой растворяются в избытке реагента) 2. Реакция образования мурексида кофеїн 1, 3 -диметилалоксан 1, 3 -диметилдиалуровая кислота аммоний тетраметилпурпурат 12
Подтверждающие исследования 1. Реакции с общеосадительными реактивами. Кофеин образует аморфные осадки (продукты осаждения с реактивом Драгендорфа и фосфорно-молибденовой кислотой растворяются в избытке реагента) 2. Реакция образования мурексида кофеїн 1, 3 -диметилалоксан 1, 3 -диметилдиалуровая кислота аммоний тетраметилпурпурат 12
 3. Микрокристаллоскопические реакции: • Реакция с ртути (ІІ) хлоридом. Образуются бесцветные игольчатые кристаллы; • Реакция с золотобромоводородной кислотой. Образуются крупные желто-коричневые иголчатые кристаллы. 4. Инструментальные методы: • УФ-спектрофотометрия. λ max 272± 2 нм в 0, 1 М HCl; • ИК-спектроскопия. Характеристические полосы при 1695, 1658 и 745 см-1; • Методы ГЖХ и ВЭЖХ (идентификация по времени удерживания). Количественное определение: • Метод ГЖХ. Определение концентрации по калибровочному графику; • Метод ВЭЖХ. Определение концентрации методом добавок, внутреннего и внешнего стандарта. Рассчет концентрации – по соответствующим формулам. 12
3. Микрокристаллоскопические реакции: • Реакция с ртути (ІІ) хлоридом. Образуются бесцветные игольчатые кристаллы; • Реакция с золотобромоводородной кислотой. Образуются крупные желто-коричневые иголчатые кристаллы. 4. Инструментальные методы: • УФ-спектрофотометрия. λ max 272± 2 нм в 0, 1 М HCl; • ИК-спектроскопия. Характеристические полосы при 1695, 1658 и 745 см-1; • Методы ГЖХ и ВЭЖХ (идентификация по времени удерживания). Количественное определение: • Метод ГЖХ. Определение концентрации по калибровочному графику; • Метод ВЭЖХ. Определение концентрации методом добавок, внутреннего и внешнего стандарта. Рассчет концентрации – по соответствующим формулам. 12
 НАЦИОНАЛЬНИЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРОИЗВОДНЫХ 1, 4 БЕНЗОДИАЗЕПИНА, ФЕНОТИАЗИНА И ПАБК План лекции 1. Химико-токсикологический анализ лекарственных средств производных 1, 4 -бензодиазепина. 2. Химико-токсикологический анализ лекарственных средств производных фенотиазина. 3. Химико-токсикологический анализ лекарственных средств производных ПАБК.
НАЦИОНАЛЬНИЙ ФАРМАЦЕВТИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ ХИМИКО-ТОКСИКОЛОГИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРОИЗВОДНЫХ 1, 4 БЕНЗОДИАЗЕПИНА, ФЕНОТИАЗИНА И ПАБК План лекции 1. Химико-токсикологический анализ лекарственных средств производных 1, 4 -бензодиазепина. 2. Химико-токсикологический анализ лекарственных средств производных фенотиазина. 3. Химико-токсикологический анализ лекарственных средств производных ПАБК.
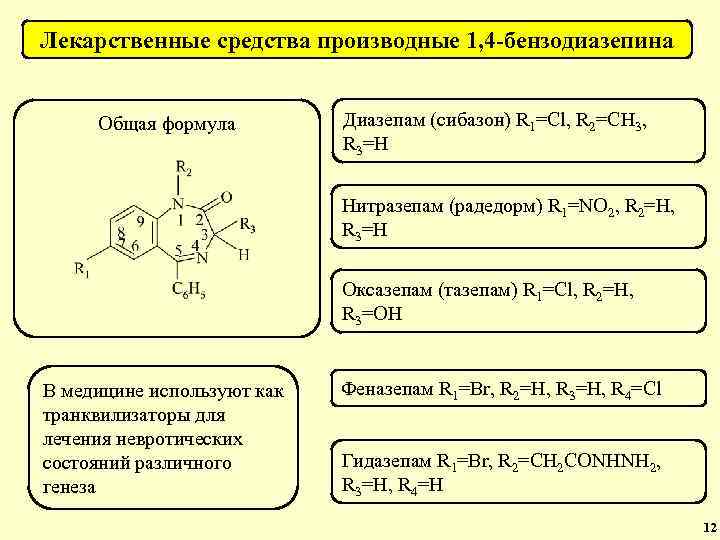 Лекарственные средства производные 1, 4 -бензодиазепина Общая формула Диазепам (сибазон) R 1=Cl, R 2=CH 3, R 3=H Нитразепам (радедорм) R 1=NO 2, R 2=Н, R 3=H Оксазепам (тазепам) R 1=Сl, R 2=H, R 3=OH В медицине используют как транквилизаторы для лечения невротических состояний различного генеза Феназепам R 1=Br, R 2=H, R 3=H, R 4=Cl Гидазепам R 1=Br, R 2=CH 2 CONHNH 2, R 3=H, R 4=H 12
Лекарственные средства производные 1, 4 -бензодиазепина Общая формула Диазепам (сибазон) R 1=Cl, R 2=CH 3, R 3=H Нитразепам (радедорм) R 1=NO 2, R 2=Н, R 3=H Оксазепам (тазепам) R 1=Сl, R 2=H, R 3=OH В медицине используют как транквилизаторы для лечения невротических состояний различного генеза Феназепам R 1=Br, R 2=H, R 3=H, R 4=Cl Гидазепам R 1=Br, R 2=CH 2 CONHNH 2, R 3=H, R 4=H 12
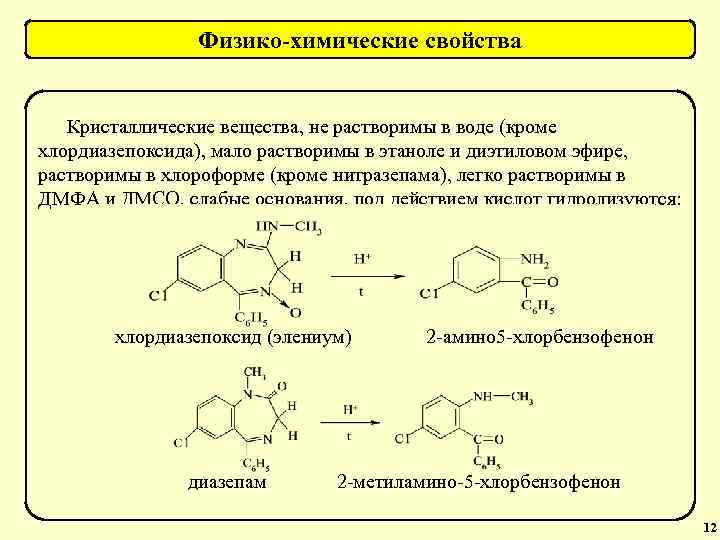 Физико-химические свойства Кристаллические вещества, не растворимы в воде (кроме хлордиазепоксида), мало растворимы в этаноле и диэтиловом эфире, растворимы в хлороформе (кроме нитразепама), легко растворимы в ДМФА и ДМСО, слабые основания, под действием кислот гидролизуются: хлордиазепоксид (элениум) 2 -амино 5 -хлорбензофенон диазепам 2 -метиламино-5 -хлорбензофенон 12
Физико-химические свойства Кристаллические вещества, не растворимы в воде (кроме хлордиазепоксида), мало растворимы в этаноле и диэтиловом эфире, растворимы в хлороформе (кроме нитразепама), легко растворимы в ДМФА и ДМСО, слабые основания, под действием кислот гидролизуются: хлордиазепоксид (элениум) 2 -амино 5 -хлорбензофенон диазепам 2 -метиламино-5 -хлорбензофенон 12
 Токсикологическое значение Токсикологические свойства Нейротоксическое (угнетают ЦНС, нейроны спинного мозга и таламуса). Анальгетические и антигистаминные средства усиливают токсическое действие 1, 4 -бенздиазепинов (делирийные психозы и психорганическией синдром). Высокие концентрации вызывают дыхательную и сердечно-сосудистую недостаточность (коллапс, остановка дыхания, отек легких). Острые отравления (преднамеренные и случайные) Легкой тяжести (вялость, торможение, сонливость, расширение зрачков). Средней тяжести (эйфория, мышечная гипотония, гиперемия лица, усиление симптомов легкого отравления). Тяжелая форма (головокружение, возбудимость, клонические судороги, галлюцинации, дыхательная и сердечная недостаточность). Смертельные дозы Взрослый человек – 0, 1 -0, 15 г/кг массы тела (68 -120 табл. хлордиазепоксида). Дети – 0, 02 -0, 15 г/ кг массы тела (29 табл. хлордиазепоксида). 13
Токсикологическое значение Токсикологические свойства Нейротоксическое (угнетают ЦНС, нейроны спинного мозга и таламуса). Анальгетические и антигистаминные средства усиливают токсическое действие 1, 4 -бенздиазепинов (делирийные психозы и психорганическией синдром). Высокие концентрации вызывают дыхательную и сердечно-сосудистую недостаточность (коллапс, остановка дыхания, отек легких). Острые отравления (преднамеренные и случайные) Легкой тяжести (вялость, торможение, сонливость, расширение зрачков). Средней тяжести (эйфория, мышечная гипотония, гиперемия лица, усиление симптомов легкого отравления). Тяжелая форма (головокружение, возбудимость, клонические судороги, галлюцинации, дыхательная и сердечная недостаточность). Смертельные дозы Взрослый человек – 0, 1 -0, 15 г/кг массы тела (68 -120 табл. хлордиазепоксида). Дети – 0, 02 -0, 15 г/ кг массы тела (29 табл. хлордиазепоксида). 13
 Метаболизм Абсорбция. В зависимости от формы применения (per os, парентерально и др. ). Распределение. После всасывания – активное связывание с белками (до 98 %), кумуляция в жировой ткани (мозг). Биотрансформация 1 -ая фаза: деметилирование (диазепам, хлордиазепоксид) по пол. 1 и 2, окисление по пол. 3 (образование ОН-группы), восстановление NO 2 -группы (нитразепам) по пол. 7. 2 -ая фаза: коньюгация с глюкуроновой и H 2 SO 4 (для веществ с ОН-группой в 3 пол. ) и коньюгация с уксусной кислотой (нитразепам). Экскреция Выводятся в виде метаболитов и нативных веществ – почками (>60 %) и через кишечник. 13
Метаболизм Абсорбция. В зависимости от формы применения (per os, парентерально и др. ). Распределение. После всасывания – активное связывание с белками (до 98 %), кумуляция в жировой ткани (мозг). Биотрансформация 1 -ая фаза: деметилирование (диазепам, хлордиазепоксид) по пол. 1 и 2, окисление по пол. 3 (образование ОН-группы), восстановление NO 2 -группы (нитразепам) по пол. 7. 2 -ая фаза: коньюгация с глюкуроновой и H 2 SO 4 (для веществ с ОН-группой в 3 пол. ) и коньюгация с уксусной кислотой (нитразепам). Экскреция Выводятся в виде метаболитов и нативных веществ – почками (>60 %) и через кишечник. 13
 Общая схема направленного ХТА Выбор объектов исследования Направление 2 Направление 1 Изолирование Общие методы (А. Васильевой, Стаса-Отто) Кислотный гидролиз части экстракта токсикантов Специальный (гидролизный) метод Б. Изотова Предварительные исследования (ТСХскриннинг), подтверждающие исследования и количественное определение. 13
Общая схема направленного ХТА Выбор объектов исследования Направление 2 Направление 1 Изолирование Общие методы (А. Васильевой, Стаса-Отто) Кислотный гидролиз части экстракта токсикантов Специальный (гидролизный) метод Б. Изотова Предварительные исследования (ТСХскриннинг), подтверждающие исследования и количественное определение. 13
 Химико-токсикологический анализ Объекты исследования – секционный материал, биожидкости, вещественные доказательства. Методы изолирования производных 1, 4 -бензодиазепина Направление 1. Позволяет определить нативные вещества и их метаболиты. Негативный результат исследования по этому направлению имеет судебнотоксикологическое значение. Пробоподготовка. Для изолирования токсикантов используют метод Изотова (по продуктам гидролиза – 2 -аминобензофенонам): • Настаивание биоматериала в 6 М р-ре HCl, при Т 140°C (гидролиз 1, 4 бензодиазепинов до 2 -аминобензофенонов). • Очистка гидролизата центрифугированием и фильтрованием. • Подщелачивание первичной водной вытяжки 10 % раствором Na. OH до р. Н 9 -10. • Экстракция 2 -аминобензофенонов смесью хлороформ-пентанол (9 : 1). 13
Химико-токсикологический анализ Объекты исследования – секционный материал, биожидкости, вещественные доказательства. Методы изолирования производных 1, 4 -бензодиазепина Направление 1. Позволяет определить нативные вещества и их метаболиты. Негативный результат исследования по этому направлению имеет судебнотоксикологическое значение. Пробоподготовка. Для изолирования токсикантов используют метод Изотова (по продуктам гидролиза – 2 -аминобензофенонам): • Настаивание биоматериала в 6 М р-ре HCl, при Т 140°C (гидролиз 1, 4 бензодиазепинов до 2 -аминобензофенонов). • Очистка гидролизата центрифугированием и фильтрованием. • Подщелачивание первичной водной вытяжки 10 % раствором Na. OH до р. Н 9 -10. • Экстракция 2 -аминобензофенонов смесью хлороформ-пентанол (9 : 1). 13
 Направление 2. Используют при получении положительного результата по направлению 1 исследований. Данное направление позволяет установить природу токсических веществ по нативным соединениям и их метаболитам. Пробоподготовка. Для изолирования токсикантов используют общие методы А. А. Васильевой и Стаса-Отто. Локализация токсикантов в "кислом" (хлордиазепоксид, диазепам) и "щелочном" (диазепам, оксазепам, нитразепам) хлороформных экстрактах. Основные етапы изолирования токсикантов: • Настаивание биоматериала в подкисленной воде или подкисленном спирте (р. Н 2 -3). • Экстракция хлороформом (хлордиазепоксид и диазепам). • Отделение и подщелачивание водной фазы 10 % Na. OH до р. Н 9 -10. • Экстракция хлороформом (диазепам, нитразепам и оксазепам). • Объединение хлороформных экстрактов и гидролиз части экстракта 6 М р -ром HCl (образование 2 -аминобензофенонов). 13
Направление 2. Используют при получении положительного результата по направлению 1 исследований. Данное направление позволяет установить природу токсических веществ по нативным соединениям и их метаболитам. Пробоподготовка. Для изолирования токсикантов используют общие методы А. А. Васильевой и Стаса-Отто. Локализация токсикантов в "кислом" (хлордиазепоксид, диазепам) и "щелочном" (диазепам, оксазепам, нитразепам) хлороформных экстрактах. Основные етапы изолирования токсикантов: • Настаивание биоматериала в подкисленной воде или подкисленном спирте (р. Н 2 -3). • Экстракция хлороформом (хлордиазепоксид и диазепам). • Отделение и подщелачивание водной фазы 10 % Na. OH до р. Н 9 -10. • Экстракция хлороформом (диазепам, нитразепам и оксазепам). • Объединение хлороформных экстрактов и гидролиз части экстракта 6 М р -ром HCl (образование 2 -аминобензофенонов). 13
 Предварительные исследования по направлению 1 ТСХ-скрининг по продуктам метаболизма (2 -аминобензофенонам). Подвижная фаза – бензол; проявитель: УФ-свет (флюоресценция); р-ция Браттона-Маршала (хлороформный экстракт + 0, 1 %, р-р Na. NO 2 + 2 М HCl → красное окрашивание). Интерпретация результатов исследования. Отрицательный результат – завершение исследования; положительный – проведение исследований по 2 -у направлению. Подтверждающие исследования Химические методы Реакции образования азокрасителя: • β-нафтолом (оранжевое окрашивание); • α-нафтилендиамином (розовое окрашивание). Инструментальные методы УФ-спектрофотометрия: р. Н<5 – λmax 265 нм; р. Н>7 – λmax 235 и 390 нм. 13
Предварительные исследования по направлению 1 ТСХ-скрининг по продуктам метаболизма (2 -аминобензофенонам). Подвижная фаза – бензол; проявитель: УФ-свет (флюоресценция); р-ция Браттона-Маршала (хлороформный экстракт + 0, 1 %, р-р Na. NO 2 + 2 М HCl → красное окрашивание). Интерпретация результатов исследования. Отрицательный результат – завершение исследования; положительный – проведение исследований по 2 -у направлению. Подтверждающие исследования Химические методы Реакции образования азокрасителя: • β-нафтолом (оранжевое окрашивание); • α-нафтилендиамином (розовое окрашивание). Инструментальные методы УФ-спектрофотометрия: р. Н<5 – λmax 265 нм; р. Н>7 – λmax 235 и 390 нм. 13
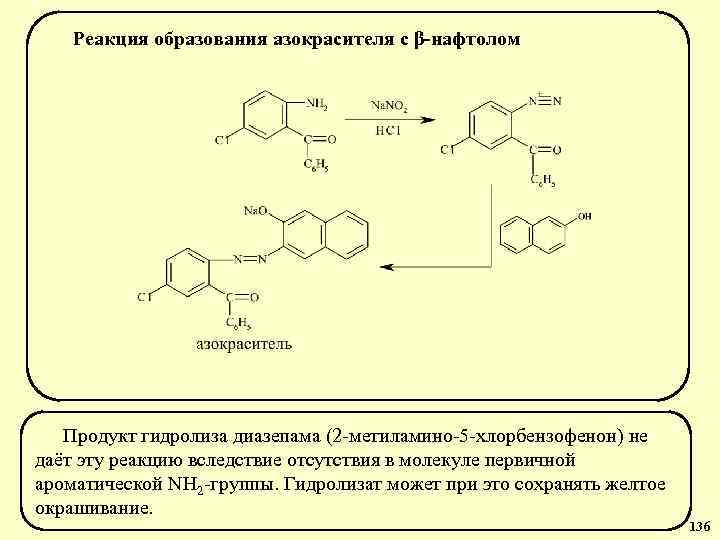 Реакция образования азокрасителя с β-нафтолом Продукт гидролиза диазепама (2 -метиламино-5 -хлорбензофенон) не даёт эту реакцию вследствие отсутствия в молекуле первичной ароматической NH 2 -группы. Гидролизат может при это сохранять желтое окрашивание. 136
Реакция образования азокрасителя с β-нафтолом Продукт гидролиза диазепама (2 -метиламино-5 -хлорбензофенон) не даёт эту реакцию вследствие отсутствия в молекуле первичной ароматической NH 2 -группы. Гидролизат может при это сохранять желтое окрашивание. 136
 Реакция Браттона-Маршала N-α-нафтилендиамин розовое окрашивание 13
Реакция Браттона-Маршала N-α-нафтилендиамин розовое окрашивание 13
 Предварительные исследования по направлению 2 ТСХ-скриннинг по нативным веществам и метаболитам Подвижная фаза – общие системы растворителей (этап 1). Проявители: • р-в Драгендорфа (желтое → коричневое окрашивание); • р-в Марки (желтое); • 5 % р-р нингидрина + Т 100 ºС (желтое окрашивание) + р-в FPN (Fe. Cl 3, HCl. O 4, HNO 3) → голубое окрашивание; • р-ция Браттона-Маршала после гидролиза (розовое окрашивание). Значение Rf: кислый хлороформный экстракт – 0, 41 -0, 64 (3 зона). щелочной хлороформный экстракт – 0, 61 -0, 98 (3 и 4 зона). Подвижная фаза – специальные системы растворителей (этап 2), проявитель р-в Драгендорфа по Мунье, вещества-свидетели – стандартные образцы нативных субстанций. Положительный результат – при совпадении значений Rf токсиканта и стандартного образца. Получение положительного результата ориентирует на проведение подтверждающих исследований. 13
Предварительные исследования по направлению 2 ТСХ-скриннинг по нативным веществам и метаболитам Подвижная фаза – общие системы растворителей (этап 1). Проявители: • р-в Драгендорфа (желтое → коричневое окрашивание); • р-в Марки (желтое); • 5 % р-р нингидрина + Т 100 ºС (желтое окрашивание) + р-в FPN (Fe. Cl 3, HCl. O 4, HNO 3) → голубое окрашивание; • р-ция Браттона-Маршала после гидролиза (розовое окрашивание). Значение Rf: кислый хлороформный экстракт – 0, 41 -0, 64 (3 зона). щелочной хлороформный экстракт – 0, 61 -0, 98 (3 и 4 зона). Подвижная фаза – специальные системы растворителей (этап 2), проявитель р-в Драгендорфа по Мунье, вещества-свидетели – стандартные образцы нативных субстанций. Положительный результат – при совпадении значений Rf токсиканта и стандартного образца. Получение положительного результата ориентирует на проведение подтверждающих исследований. 13
 Подтверждающие исследования. Определение нативных веществ и метаболитов. Химические методы • Реакция с нингидрином. При Т 100 ºС синее окрашивание) + 1 % Cu. SO 4: диазепам (красное); нитразепам (желтое) и хлордиазепоксид (коричневое). • Реакция с реактивами Марки или Фреде. Хлордиазепоксид→желтое окрашивание. Инструментальные методы • УФ-спектрофотометрия. 0, 1 М H 2 SO 4 (хлордиазепоксид – λmax 245 и 306 нм; диазепам – λmax 241, 284 и 359 нм; нитразепам – λmax 277 нм). • ИК-спектроскопия. Токсиканты идентифицируют по характеристическим полосам поглощения соответствующих фрагментов их молекул. • Метод ВЭЖХ. Токсиканты идентифицируют по времени их удерживания в неподвижной фазе. • Метод ГЖХ. Токсиканты идентифицируют по времени их удерживания в неподвижной фазе. 13
Подтверждающие исследования. Определение нативных веществ и метаболитов. Химические методы • Реакция с нингидрином. При Т 100 ºС синее окрашивание) + 1 % Cu. SO 4: диазепам (красное); нитразепам (желтое) и хлордиазепоксид (коричневое). • Реакция с реактивами Марки или Фреде. Хлордиазепоксид→желтое окрашивание. Инструментальные методы • УФ-спектрофотометрия. 0, 1 М H 2 SO 4 (хлордиазепоксид – λmax 245 и 306 нм; диазепам – λmax 241, 284 и 359 нм; нитразепам – λmax 277 нм). • ИК-спектроскопия. Токсиканты идентифицируют по характеристическим полосам поглощения соответствующих фрагментов их молекул. • Метод ВЭЖХ. Токсиканты идентифицируют по времени их удерживания в неподвижной фазе. • Метод ГЖХ. Токсиканты идентифицируют по времени их удерживания в неподвижной фазе. 13
 Количественное определение Метод ВЭЖХ Прибор: хроматограф “Милихром А-02”. Подвижная фаза: • 0, 05 М (NH 4)2 HPO 4 + ацетонитрил (65: 35) – для бензодиазепинов и их метаболитов; • 0, 05 М (NH 4)2 HPO 4 + ацетонитрил (45: 55) для бензофенонов (метаболитов). Для количественного определения 1, 4 -бензодиазепинов и бензофенонов используют метод добавок, внутреннего и внешнего стандартов. Расчет концентраций – по соответствующей формуле. Метод фотоэлектроколориметрии Прибор: ФЭК-56 Н. Определение по реакции Браттона-Маршала. Кювета толщиной 10 мм. Светлофильтр зеленый. Раствор сравнения – смесь реактивов (2 М HCl + 0, 1 % Na. NO 2 + 1 % (NH 4)2 SO 4). 14
Количественное определение Метод ВЭЖХ Прибор: хроматограф “Милихром А-02”. Подвижная фаза: • 0, 05 М (NH 4)2 HPO 4 + ацетонитрил (65: 35) – для бензодиазепинов и их метаболитов; • 0, 05 М (NH 4)2 HPO 4 + ацетонитрил (45: 55) для бензофенонов (метаболитов). Для количественного определения 1, 4 -бензодиазепинов и бензофенонов используют метод добавок, внутреннего и внешнего стандартов. Расчет концентраций – по соответствующей формуле. Метод фотоэлектроколориметрии Прибор: ФЭК-56 Н. Определение по реакции Браттона-Маршала. Кювета толщиной 10 мм. Светлофильтр зеленый. Раствор сравнения – смесь реактивов (2 М HCl + 0, 1 % Na. NO 2 + 1 % (NH 4)2 SO 4). 14
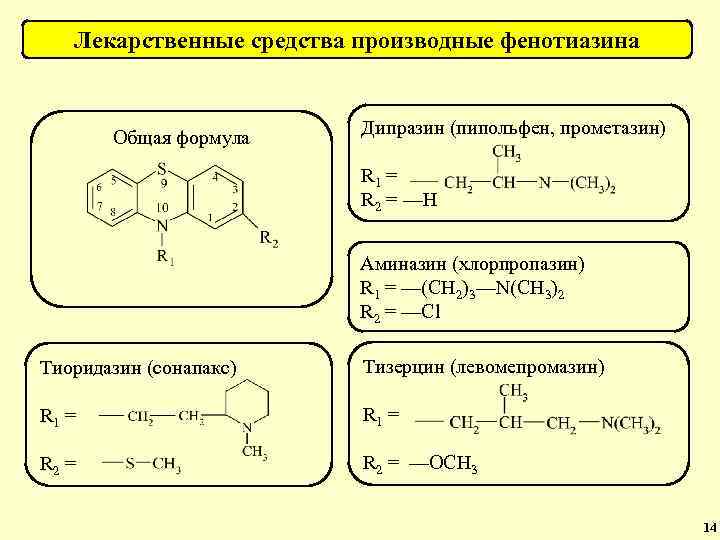 Лекарственные средства производные фенотиазина Общая формула Дипразин (пипольфен, прометазин) R 1 = R 2 = —H Аминазин (хлорпропазин) R 1 = —(CH 2)3—N(CH 3)2 R 2 = —Cl Тиоридазин (сонапакс) Тизерцин (левомепромазин) R 1 = R 2 = —OCH 3 14
Лекарственные средства производные фенотиазина Общая формула Дипразин (пипольфен, прометазин) R 1 = R 2 = —H Аминазин (хлорпропазин) R 1 = —(CH 2)3—N(CH 3)2 R 2 = —Cl Тиоридазин (сонапакс) Тизерцин (левомепромазин) R 1 = R 2 = —OCH 3 14
 Токсикологическое значение производных фенотиазина Производные фенотиазина проявляют нейротоксическое действие, оказывают негативное влияние на ЦНС (психические нарушения) и сердечно-сосудистую систему. Летальные последствия при отравлении обусловлены: • Умышленной (суицидальной) передозировкой. • Случайной (непреднамеренной) передозировкой. Симптомы острого отравления: Угнетение дыхательного центра, тахикардия, эпилептические судороги, снижение температуры тела и артериального давления, цианоз тканей, кома. Смерть наступает в результате сердечно-легочной недостаточности (отек мозга, нефротический некроз почек). Летальные дозы: От 5 до 10 г. Для аминазина – смертельная концентрация – 0, 03 -0, 12 г/л крови. Для детей смертельная доза аминазина – 0, 25 г. 142
Токсикологическое значение производных фенотиазина Производные фенотиазина проявляют нейротоксическое действие, оказывают негативное влияние на ЦНС (психические нарушения) и сердечно-сосудистую систему. Летальные последствия при отравлении обусловлены: • Умышленной (суицидальной) передозировкой. • Случайной (непреднамеренной) передозировкой. Симптомы острого отравления: Угнетение дыхательного центра, тахикардия, эпилептические судороги, снижение температуры тела и артериального давления, цианоз тканей, кома. Смерть наступает в результате сердечно-легочной недостаточности (отек мозга, нефротический некроз почек). Летальные дозы: От 5 до 10 г. Для аминазина – смертельная концентрация – 0, 03 -0, 12 г/л крови. Для детей смертельная доза аминазина – 0, 25 г. 142
 Физико-химические свойства Производные фенотиазина – кристаллические вещества, легко окисляются кислородом воздуха, проявляют основные свойства (наличие в молекуле гетероциклического и третичного атома азота в алифатической цепи радикала) р. Ка от 9, 1 до 9, 5. Основания фенотиазинов – творожистая масса, трудно растворима в воде, легко растворима в этаноле, диэтиловом эфире, хлороформе, этилацетате. Соли фенотиазинов легко растворимы в воде, этаноле, растворимы в хлороформе (локализуются в "кислом" хлороформном экстракте при изолировании методами А. А. Васильевой и Стаса-Отто), практически не растворимы в диэтиловом эфире и бензоле. 143
Физико-химические свойства Производные фенотиазина – кристаллические вещества, легко окисляются кислородом воздуха, проявляют основные свойства (наличие в молекуле гетероциклического и третичного атома азота в алифатической цепи радикала) р. Ка от 9, 1 до 9, 5. Основания фенотиазинов – творожистая масса, трудно растворима в воде, легко растворима в этаноле, диэтиловом эфире, хлороформе, этилацетате. Соли фенотиазинов легко растворимы в воде, этаноле, растворимы в хлороформе (локализуются в "кислом" хлороформном экстракте при изолировании методами А. А. Васильевой и Стаса-Отто), практически не растворимы в диэтиловом эфире и бензоле. 143
 Биотрансформация производных фенотиазина І фаза 1) гидроксилирование (по пол. 3 и 7) 2) дезалкилирование (пол. 10) и гидроксилирование (пол. 3 и 7) 3) образование сульфоксидов или сульфонов ІІ фаза (образование глюкуронидов) 14
Биотрансформация производных фенотиазина І фаза 1) гидроксилирование (по пол. 3 и 7) 2) дезалкилирование (пол. 10) и гидроксилирование (пол. 3 и 7) 3) образование сульфоксидов или сульфонов ІІ фаза (образование глюкуронидов) 14
 Химико-токсикологический анализ Пробоподготовка Изолирование из биологического материала: • Метод Е. Саломатина (модификация метода Стаса-Отто) этанолом, подкисленным щавелевой кислотой. • Метод Е. Саломатина (модификация метода Сшедзински) водой, подкисленной 10 % HCl с последующей экстракцией токсикантов ацетонитрилом. Предварительные исследования ТСХ-скрининг Подвижная фаза: общие и специальные системы растворителей для “щелочного” хлороформного экстракта. Проявители – Fe. Cl 3 (красное окрашивание пятна на пластинке) и реактив Драгендорфа (красное окрашивание → оранжевое). Аналитический скрининг. Общеосадительные реактивы (Драгендорфа, Марме, Майера и др. ). 14
Химико-токсикологический анализ Пробоподготовка Изолирование из биологического материала: • Метод Е. Саломатина (модификация метода Стаса-Отто) этанолом, подкисленным щавелевой кислотой. • Метод Е. Саломатина (модификация метода Сшедзински) водой, подкисленной 10 % HCl с последующей экстракцией токсикантов ацетонитрилом. Предварительные исследования ТСХ-скрининг Подвижная фаза: общие и специальные системы растворителей для “щелочного” хлороформного экстракта. Проявители – Fe. Cl 3 (красное окрашивание пятна на пластинке) и реактив Драгендорфа (красное окрашивание → оранжевое). Аналитический скрининг. Общеосадительные реактивы (Драгендорфа, Марме, Майера и др. ). 14
 Подтверждающие исследования Хромогенные реакции Производные фенотиазина Реактив Аминазин Дипразин Тизерцин Тиоридазин H 2 SO 4 конц. малиновое фиолетовое голубое HNO 3 конц. малиновое фиолетовое зеленое Марки малиновое желтое фиолетовое синее Манделина малиновое оранжевое фиолетовое зеленое Fe. Cl 3 малиновое желтое фиолетовое зеленое 14
Подтверждающие исследования Хромогенные реакции Производные фенотиазина Реактив Аминазин Дипразин Тизерцин Тиоридазин H 2 SO 4 конц. малиновое фиолетовое голубое HNO 3 конц. малиновое фиолетовое зеленое Марки малиновое желтое фиолетовое синее Манделина малиновое оранжевое фиолетовое зеленое Fe. Cl 3 малиновое желтое фиолетовое зеленое 14
 Количественное определение Метод ВЭЖХ Неподвижная фаза – сорбент “Силасорб С 18”. Подвижная фаза: элюент А – 0, 1 % р-р CCl 3 COOH и элюент Б – ацетонитрил; Время удерживания (мин): Аминазин – 18, 44; Дипразин – 16, 01; Тизерцин – 17, 45. Фотометрический метод • По реакции окрашивания с H 2 SO 4. Аминазин и дипразин → малиновое окрашивание раствора. • По реакции окрашивания с реактивом Манделина. Тизерцин и тиоридазин → малиновое и зеленое окрашивание раствора соответственно. Недостаток метода: обугливание соэкстрактивных веществ. 14
Количественное определение Метод ВЭЖХ Неподвижная фаза – сорбент “Силасорб С 18”. Подвижная фаза: элюент А – 0, 1 % р-р CCl 3 COOH и элюент Б – ацетонитрил; Время удерживания (мин): Аминазин – 18, 44; Дипразин – 16, 01; Тизерцин – 17, 45. Фотометрический метод • По реакции окрашивания с H 2 SO 4. Аминазин и дипразин → малиновое окрашивание раствора. • По реакции окрашивания с реактивом Манделина. Тизерцин и тиоридазин → малиновое и зеленое окрашивание раствора соответственно. Недостаток метода: обугливание соэкстрактивных веществ. 14
 Инструментальные методы УФ-спектрофотометрия Производные фенотиазина в 0, 5 М H 2 SO 4 характеризуются полосами поглощения при λmax 250 нм и 300 нм. Метаболиты фенотиазинов (сульфоксиды) в 0, 5 М H 2 SO 4 – полосами поглощения при λmax 239, 274, 300 и 341 нм. Метод ТСХ в присутствии веществ-свидетелей (стандартов). Для аминазина и дипразина подвижная фаза – бензол-диоксан-25 % NH 4 OH (75: 20: 5), для тизерцин и тиоридазина – 25 % NH 4 OH-этанол (1: 1). Проявители – Fe. Cl 3, H 2 SO 4, HNO 3 и др. ИК-спектроскопия. Токсиканты идентифицируют по характеристическим полосам поглощения соответствующих им фрагментов молекул. Методы ВЭЖХ, ГЖХ. Токсиканты идентифицируют по их времени удерживания в неподвижной фазе. 14
Инструментальные методы УФ-спектрофотометрия Производные фенотиазина в 0, 5 М H 2 SO 4 характеризуются полосами поглощения при λmax 250 нм и 300 нм. Метаболиты фенотиазинов (сульфоксиды) в 0, 5 М H 2 SO 4 – полосами поглощения при λmax 239, 274, 300 и 341 нм. Метод ТСХ в присутствии веществ-свидетелей (стандартов). Для аминазина и дипразина подвижная фаза – бензол-диоксан-25 % NH 4 OH (75: 20: 5), для тизерцин и тиоридазина – 25 % NH 4 OH-этанол (1: 1). Проявители – Fe. Cl 3, H 2 SO 4, HNO 3 и др. ИК-спектроскопия. Токсиканты идентифицируют по характеристическим полосам поглощения соответствующих им фрагментов молекул. Методы ВЭЖХ, ГЖХ. Токсиканты идентифицируют по их времени удерживания в неподвижной фазе. 14
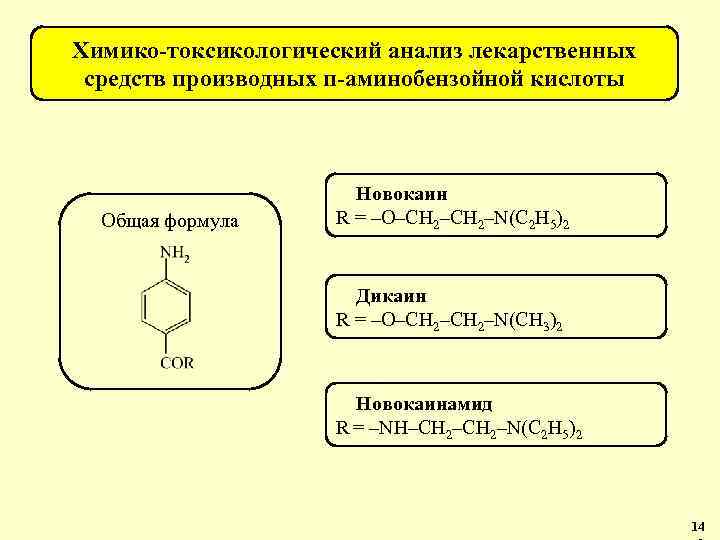 Химико-токсикологический анализ лекарственных средств производных п-аминобензойной кислоты Общая формула Новокаин R = –O–CH 2–N(C 2 H 5)2 Дикаин R = –O–CH 2–N(CH 3)2 Новокаинамид R = –NH–CH 2–N(C 2 H 5)2 14
Химико-токсикологический анализ лекарственных средств производных п-аминобензойной кислоты Общая формула Новокаин R = –O–CH 2–N(C 2 H 5)2 Дикаин R = –O–CH 2–N(CH 3)2 Новокаинамид R = –NH–CH 2–N(C 2 H 5)2 14
 Токсикологическое значение Отравление лекарственными средствами производными ПАБК в основном обусловлены медицинским применением (передозировка и аллергические реакции). Токсическое действие на организм Под влиянием токсических доз производные ПАБК вызывают возбуждение и паралич ЦНС, клонико-тонические судороги, нервно психические нарушения, сердечно-сосудистые расстройства (снижение артериального давления, коллапс), торможение дыхания (снижение амплитуды и частоты), аллергические реакции (отек кожи и слизистых оболочек, медикаментозная лихорадка). Физико-химические свойства Кристаллические вещества. Соли производных ПАБК растворимые в воде и этаноле, нерастворимы в хлороформе. Основания ПАБК растворимы в хлороформе и др. органических растворителях. 150
Токсикологическое значение Отравление лекарственными средствами производными ПАБК в основном обусловлены медицинским применением (передозировка и аллергические реакции). Токсическое действие на организм Под влиянием токсических доз производные ПАБК вызывают возбуждение и паралич ЦНС, клонико-тонические судороги, нервно психические нарушения, сердечно-сосудистые расстройства (снижение артериального давления, коллапс), торможение дыхания (снижение амплитуды и частоты), аллергические реакции (отек кожи и слизистых оболочек, медикаментозная лихорадка). Физико-химические свойства Кристаллические вещества. Соли производных ПАБК растворимые в воде и этаноле, нерастворимы в хлороформе. Основания ПАБК растворимы в хлороформе и др. органических растворителях. 150
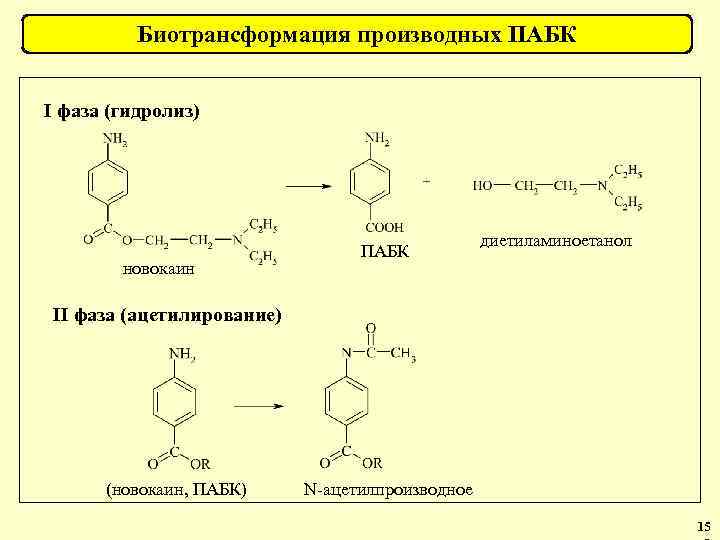 Биотрансформация производных ПАБК І фаза (гидролиз) новокаин ПАБК диетиламиноетанол ІІ фаза (ацетилирование) (новокаин, ПАБК) N-ацетилпроизводное 15
Биотрансформация производных ПАБК І фаза (гидролиз) новокаин ПАБК диетиламиноетанол ІІ фаза (ацетилирование) (новокаин, ПАБК) N-ацетилпроизводное 15
 Химико-токсикологический анализ Объекты исследования – секционный материал и биожидкости. Пробоподготовка. Для изолирования токсикантов применяют общие методы А. А. Васильевой и Стаса-Отто (локализация токсикантов в «щелочном» хлороформном экстракте). Предварительные исследования • ТСХ-скрининг. Общие и специальные системы растворителей для “щелочного” хлороформного экстракта. Проявитель – реактив Драгендорфа (оранжевое окрашивание). • Аналитический скрининг. Общеосадительные реактивы (Драгендорфа, Марме, Майера и др. ) → кристаллические или аморфные осадки. • ГЖХ-скрининг. Токсиканты идентифицируют по их времени удерживания в неподвижной фазе. 15
Химико-токсикологический анализ Объекты исследования – секционный материал и биожидкости. Пробоподготовка. Для изолирования токсикантов применяют общие методы А. А. Васильевой и Стаса-Отто (локализация токсикантов в «щелочном» хлороформном экстракте). Предварительные исследования • ТСХ-скрининг. Общие и специальные системы растворителей для “щелочного” хлороформного экстракта. Проявитель – реактив Драгендорфа (оранжевое окрашивание). • Аналитический скрининг. Общеосадительные реактивы (Драгендорфа, Марме, Майера и др. ) → кристаллические или аморфные осадки. • ГЖХ-скрининг. Токсиканты идентифицируют по их времени удерживания в неподвижной фазе. 15
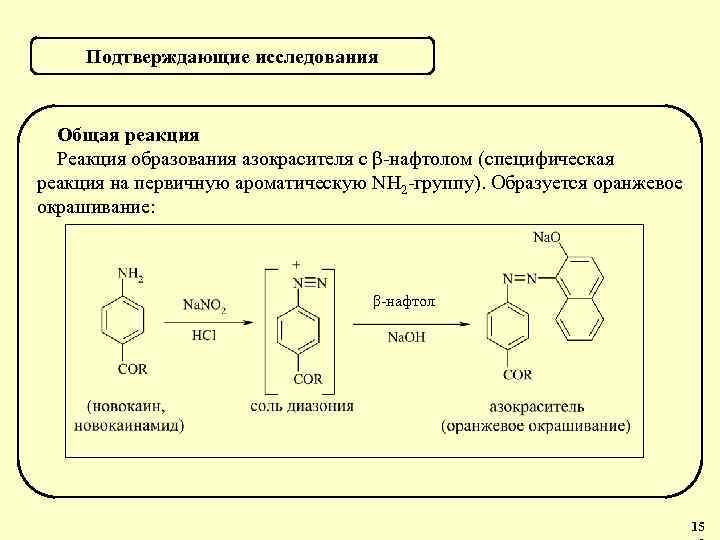 Подтверждающие исследования Общая реакция Реакция образования азокрасителя с β-нафтолом (специфическая реакция на первичную ароматическую NH 2 -группу). Образуется оранжевое окрашивание: β-нафтол 15
Подтверждающие исследования Общая реакция Реакция образования азокрасителя с β-нафтолом (специфическая реакция на первичную ароматическую NH 2 -группу). Образуется оранжевое окрашивание: β-нафтол 15
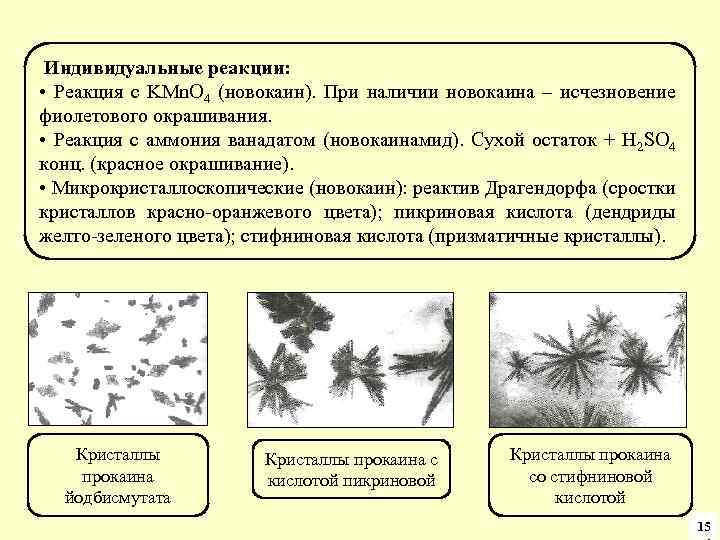 Индивидуальные реакции: • Реакция с KMn. O 4 (новокаин). При наличии новокаина – исчезновение фиолетового окрашивания. • Реакция с аммония ванадатом (новокаинамид). Сухой остаток + H 2 SO 4 конц. (красное окрашивание). • Микрокристаллоскопические (новокаин): реактив Драгендорфа (сростки кристаллов красно-оранжевого цвета); пикриновая кислота (дендриды желто-зеленого цвета); стифниновая кислота (призматичные кристаллы). Кристаллы прокаина йодбисмутата Кристаллы прокаина с кислотой пикриновой Кристаллы прокаина со стифниновой кислотой 15
Индивидуальные реакции: • Реакция с KMn. O 4 (новокаин). При наличии новокаина – исчезновение фиолетового окрашивания. • Реакция с аммония ванадатом (новокаинамид). Сухой остаток + H 2 SO 4 конц. (красное окрашивание). • Микрокристаллоскопические (новокаин): реактив Драгендорфа (сростки кристаллов красно-оранжевого цвета); пикриновая кислота (дендриды желто-зеленого цвета); стифниновая кислота (призматичные кристаллы). Кристаллы прокаина йодбисмутата Кристаллы прокаина с кислотой пикриновой Кристаллы прокаина со стифниновой кислотой 15
 Метод ТСХ Подвижная фаза циклогексан-бензол-диэтиламин (75: 10). Проявитель – реактив Драгендорфа по Мунье (оранжевое окрашивание). Токсиканты идентифицируют по совпадению их значений Rf на хроматограмме с аналогичными значениями веществ-свидетелей (стандартов). УФ-спектрофотометрия Водные растворы новокаина и новокаинамида имеют максимумы поглощения при длине волны λmax 290 нм и 278 нм соответственно. Раствор новокаина в 0, 2 М H 2 SO 4 – λmax 228 нм, 272 нм и 279 нм. Раствор новокаинамида в 0, 2 М H 2 SO 4 – λmax 224 нм. ИК-спектроскопия. Новокаин (диск с KBr) – 1274, 1690 и 1605 см-1. ВЭЖХ. Токсиканты идентифицируют по их времени удерживания в неподвижной фазе или спектральным соотношениям при разных длинах волн (Sλ/S 210). 15
Метод ТСХ Подвижная фаза циклогексан-бензол-диэтиламин (75: 10). Проявитель – реактив Драгендорфа по Мунье (оранжевое окрашивание). Токсиканты идентифицируют по совпадению их значений Rf на хроматограмме с аналогичными значениями веществ-свидетелей (стандартов). УФ-спектрофотометрия Водные растворы новокаина и новокаинамида имеют максимумы поглощения при длине волны λmax 290 нм и 278 нм соответственно. Раствор новокаина в 0, 2 М H 2 SO 4 – λmax 228 нм, 272 нм и 279 нм. Раствор новокаинамида в 0, 2 М H 2 SO 4 – λmax 224 нм. ИК-спектроскопия. Новокаин (диск с KBr) – 1274, 1690 и 1605 см-1. ВЭЖХ. Токсиканты идентифицируют по их времени удерживания в неподвижной фазе или спектральным соотношениям при разных длинах волн (Sλ/S 210). 15
 Количественное определение Фотометрический метод По реакции образования азокрасителя с β-нафтолом. Толщина слоя кюветы – 10 мм; светофильтр – зеленый; раствор сравнения – смесь реактивов. Определение концентрации новокаинамида – по калибровочному графику. ВЭЖХ Предварительная очистка хлороформного экстракта методом ТСХ. Для количественного определения токсикантов используют метод добавок, метод внутреннего или внешнего стандарта. Расчет концентрации – по соответствующей формуле. 15
Количественное определение Фотометрический метод По реакции образования азокрасителя с β-нафтолом. Толщина слоя кюветы – 10 мм; светофильтр – зеленый; раствор сравнения – смесь реактивов. Определение концентрации новокаинамида – по калибровочному графику. ВЭЖХ Предварительная очистка хлороформного экстракта методом ТСХ. Для количественного определения токсикантов используют метод добавок, метод внутреннего или внешнего стандарта. Расчет концентрации – по соответствующей формуле. 15


