 N и P • Химия N и P резко отличаются • N в высших степенях окисления – сильные окислители, P – нет • N - 4 -ковалентный (октет), P – 5 ковалентный • Простые вещества: N 2 (тройная связь), P 4 - одинарные связи 1
N и P • Химия N и P резко отличаются • N в высших степенях окисления – сильные окислители, P – нет • N - 4 -ковалентный (октет), P – 5 ковалентный • Простые вещества: N 2 (тройная связь), P 4 - одинарные связи 1
 Э = P, As, Sb, Bi • Возрастание металлических свойств • Увеличение окислительных свойств P 5+ Bi 5+; соединения Bi 5+ - сильные окислители • Увеличение восст. свойств P 3 - Bi 3 - 2
Э = P, As, Sb, Bi • Возрастание металлических свойств • Увеличение окислительных свойств P 5+ Bi 5+; соединения Bi 5+ - сильные окислители • Увеличение восст. свойств P 3 - Bi 3 - 2
 Получение Р, As, Sb, Bi Спекание в элекропечи: Ca 3(PO 4)2 + 5 C + 3 Si. O 2 = 1/2 P 4 +3 Ca. Si. O 3 + 5 СО (1500 o. C) Э = As, Sb, Bi 2 Э 2 S 3 + 9 O 2 = 2 Э 2 O 3 + 6 SO 2 (обжиг) Э 2 O 3 + 3 C = 3 CO + 2 Э (Т, восстановление) 3
Получение Р, As, Sb, Bi Спекание в элекропечи: Ca 3(PO 4)2 + 5 C + 3 Si. O 2 = 1/2 P 4 +3 Ca. Si. O 3 + 5 СО (1500 o. C) Э = As, Sb, Bi 2 Э 2 S 3 + 9 O 2 = 2 Э 2 O 3 + 6 SO 2 (обжиг) Э 2 O 3 + 3 C = 3 CO + 2 Э (Т, восстановление) 3
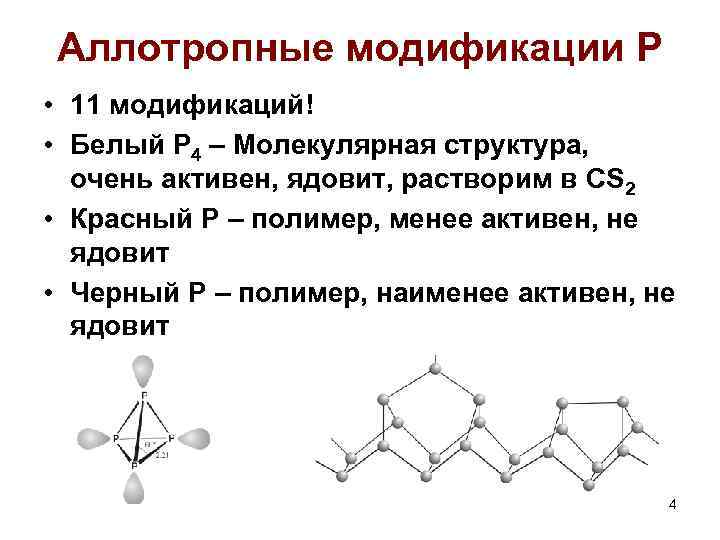 Аллотропные модификации Р • 11 модификаций! • Белый Р 4 – Молекулярная структура, очень активен, ядовит, растворим в CS 2 • Красный Р – полимер, менее активен, не ядовит • Черный Р – полимер, наименее активен, не ядовит 4
Аллотропные модификации Р • 11 модификаций! • Белый Р 4 – Молекулярная структура, очень активен, ядовит, растворим в CS 2 • Красный Р – полимер, менее активен, не ядовит • Черный Р – полимер, наименее активен, не ядовит 4
 Свойства Р, As, Sb, Bi • Реакции с кислородом: P образует P 4 O 6 и P 4 O 10, остальные Э 2 О 3 (Э 4 О 6 в газе). • Реакции с хлором: P, As, Sb образуют ЭCl 3 и ЭCl 5, Bi – Bi. Cl 3. As. Cl 5 и Sb. Cl 5 при нагревании разлагаются с выделением хлора. • Реакции с щелочами: P 4 + 3 KOHконц. +3 H 2 O = 3 KH 2 PO 2 + PH 3 (при Т) 5
Свойства Р, As, Sb, Bi • Реакции с кислородом: P образует P 4 O 6 и P 4 O 10, остальные Э 2 О 3 (Э 4 О 6 в газе). • Реакции с хлором: P, As, Sb образуют ЭCl 3 и ЭCl 5, Bi – Bi. Cl 3. As. Cl 5 и Sb. Cl 5 при нагревании разлагаются с выделением хлора. • Реакции с щелочами: P 4 + 3 KOHконц. +3 H 2 O = 3 KH 2 PO 2 + PH 3 (при Т) 5
 Свойства Р, As, Sb, Bi • Реакции с кислотами окислителями: Э + 5 HNO 3 конц. = H 3 ЭO 4 + 5 NO 2 + H 2 O (Э = P, As, Sb) 2 Sb + 6 H 2 SO 4 конц. = Sb 2(SO 4)3 + 3 SO 2 +6 H 2 O Bi +4 HNO 3 = Bi(NO 3)3 + NO + 2 H 2 O 6
Свойства Р, As, Sb, Bi • Реакции с кислотами окислителями: Э + 5 HNO 3 конц. = H 3 ЭO 4 + 5 NO 2 + H 2 O (Э = P, As, Sb) 2 Sb + 6 H 2 SO 4 конц. = Sb 2(SO 4)3 + 3 SO 2 +6 H 2 O Bi +4 HNO 3 = Bi(NO 3)3 + NO + 2 H 2 O 6
 Соединения с водородом PH 3 – фосфин, Получение через фосфиды – Ca 3 P 2 2 Э + 3 Ca = Ca 3 Э 2 (Э = P, As, Sb) Ca 3 Э 2 +3 H 2 O = 3 Ca(OH)2 +2 ЭH 3 Устойчивость в ряду PH 3 Bi. H 3 резко уменьшается, резко возрастают восстановительные св-ва: при нагревании 2 ЭH 3 = 2 Э + 3 Н 2 (Sb, As, Bi) 7
Соединения с водородом PH 3 – фосфин, Получение через фосфиды – Ca 3 P 2 2 Э + 3 Ca = Ca 3 Э 2 (Э = P, As, Sb) Ca 3 Э 2 +3 H 2 O = 3 Ca(OH)2 +2 ЭH 3 Устойчивость в ряду PH 3 Bi. H 3 резко уменьшается, резко возрастают восстановительные св-ва: при нагревании 2 ЭH 3 = 2 Э + 3 Н 2 (Sb, As, Bi) 7
 Криминалистика As 2 O 3 + 6 Zn + 6 H 2 SO 4 = 6 Zn. SO 4 + 2 As. H 3 + 3 H 2 O 2 As. H 3 = 3 H 2 + 2 As (600 о. С, блестящий налет) • Проба Ма рша — распространённое название качественной реакции на мышьяк в химии и криминалистике, по имени английского химика Джеймса Марша, опубликовавшего информацию о ней в 1836 году. До открытия пробы, триоксид мышьяка был распространённым средством отравителей, вследствие трудности его обнаружения существовавшими тогда методами. • Наиболее известным первым применением Пробы Марша в судебной токсикологии стало дело об отравлении Шарля Лафаржа его супругой Мари в 1840 г в Ле Гландье (Франция). Тогда эксперт Джеймс Орфила сумел с помощью Пробы Марша установить летальные дозы мышьяка в теле Шарля Лафаржа даже после 8 эксгумации.
Криминалистика As 2 O 3 + 6 Zn + 6 H 2 SO 4 = 6 Zn. SO 4 + 2 As. H 3 + 3 H 2 O 2 As. H 3 = 3 H 2 + 2 As (600 о. С, блестящий налет) • Проба Ма рша — распространённое название качественной реакции на мышьяк в химии и криминалистике, по имени английского химика Джеймса Марша, опубликовавшего информацию о ней в 1836 году. До открытия пробы, триоксид мышьяка был распространённым средством отравителей, вследствие трудности его обнаружения существовавшими тогда методами. • Наиболее известным первым применением Пробы Марша в судебной токсикологии стало дело об отравлении Шарля Лафаржа его супругой Мари в 1840 г в Ле Гландье (Франция). Тогда эксперт Джеймс Орфила сумел с помощью Пробы Марша установить летальные дозы мышьяка в теле Шарля Лафаржа даже после 8 эксгумации.
 Соединения с водородом • Отсутствие донорных св-в в водных р-рах: PH 3 г + HJ г = [PH 4]+J- (в газе) PH 4 J = PH 3 + H+ + J- (в H 2 O) В отличии от аммиака обладают восстановительными свойствами в растворе: 5 PH 3 + 8 Mn. O 4 - + 24 H+ = 8 Mn 2+ + 5 H 3 PO 4 + 12 H 2 O 9
Соединения с водородом • Отсутствие донорных св-в в водных р-рах: PH 3 г + HJ г = [PH 4]+J- (в газе) PH 4 J = PH 3 + H+ + J- (в H 2 O) В отличии от аммиака обладают восстановительными свойствами в растворе: 5 PH 3 + 8 Mn. O 4 - + 24 H+ = 8 Mn 2+ + 5 H 3 PO 4 + 12 H 2 O 9
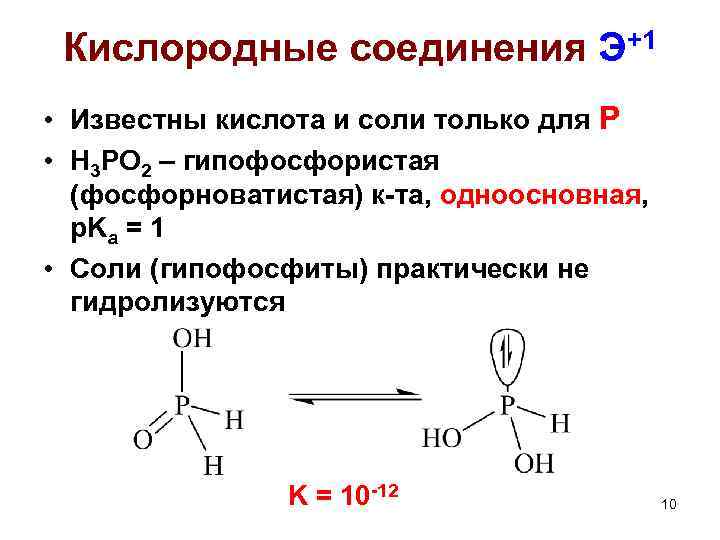 Кислородные соединения Э+1 • Известны кислота и соли только для Р • H 3 PO 2 – гипофосфористая (фосфорноватистая) к-та, одноосновная, p. Ka = 1 • Соли (гипофосфиты) практически не гидролизуются K = 10 -12 10
Кислородные соединения Э+1 • Известны кислота и соли только для Р • H 3 PO 2 – гипофосфористая (фосфорноватистая) к-та, одноосновная, p. Ka = 1 • Соли (гипофосфиты) практически не гидролизуются K = 10 -12 10
 Кислородные соединения Э+1 • Получение: 2 P 4 +3 Ba(OH)2 + 6 H 2 O = 2 PH 3 + 3 Ba(H 2 PO 2)2 + H 2 SO 4 = Ba. SO 4↓ + 2 H 3 PO 2 • УДОБНЫЕ ВОССТАНОВИТЕЛИ Na. H 2 PO 2 +4 Ag. NO 3 +2 H 2 O = Na. H 2 PO 4+4 Ag +4 HNO 3 11
Кислородные соединения Э+1 • Получение: 2 P 4 +3 Ba(OH)2 + 6 H 2 O = 2 PH 3 + 3 Ba(H 2 PO 2)2 + H 2 SO 4 = Ba. SO 4↓ + 2 H 3 PO 2 • УДОБНЫЕ ВОССТАНОВИТЕЛИ Na. H 2 PO 2 +4 Ag. NO 3 +2 H 2 O = Na. H 2 PO 4+4 Ag +4 HNO 3 11
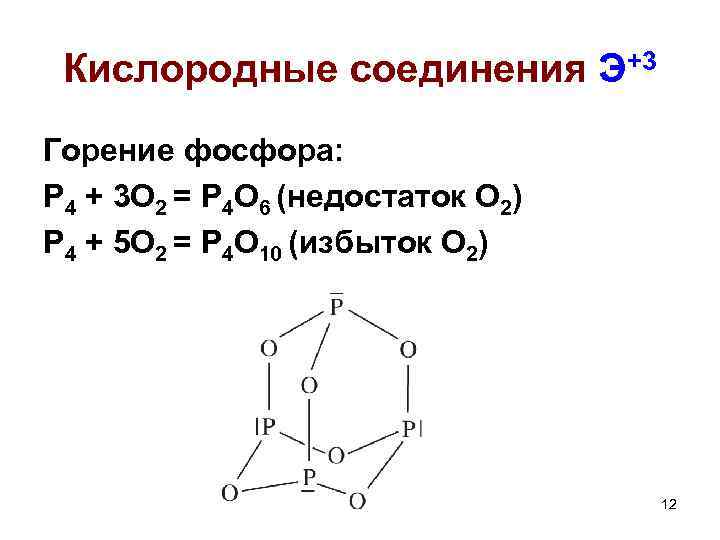 Кислородные соединения Э+3 Горение фосфора: Р 4 + 3 О 2 = Р 4 О 6 (недостаток О 2) Р 4 + 5 О 2 = Р 4 О 10 (избыток О 2) 12
Кислородные соединения Э+3 Горение фосфора: Р 4 + 3 О 2 = Р 4 О 6 (недостаток О 2) Р 4 + 5 О 2 = Р 4 О 10 (избыток О 2) 12
 Кислородные соединения Э+3 P 4 O 6 As 2 O 3 Sb 2 O 3 Bi 2 O 3 Св-ва Р-м в воде, кислот. К-ты H 3 PO 3 м/р, н/р, амфотерн. н/р, основн. HAs. O 2, H 3 As. O 3 Sb(OH)3= Sb 2 O 3 x. H 2 O Bi(OH)3 Соли Na 2 HPO 3 фосфит As. Cl 3 Na. As. O 2 арсенит Sb. Cl 3, Bi. Cl 3 Na 3[Sb(OH)6] 13
Кислородные соединения Э+3 P 4 O 6 As 2 O 3 Sb 2 O 3 Bi 2 O 3 Св-ва Р-м в воде, кислот. К-ты H 3 PO 3 м/р, н/р, амфотерн. н/р, основн. HAs. O 2, H 3 As. O 3 Sb(OH)3= Sb 2 O 3 x. H 2 O Bi(OH)3 Соли Na 2 HPO 3 фосфит As. Cl 3 Na. As. O 2 арсенит Sb. Cl 3, Bi. Cl 3 Na 3[Sb(OH)6] 13
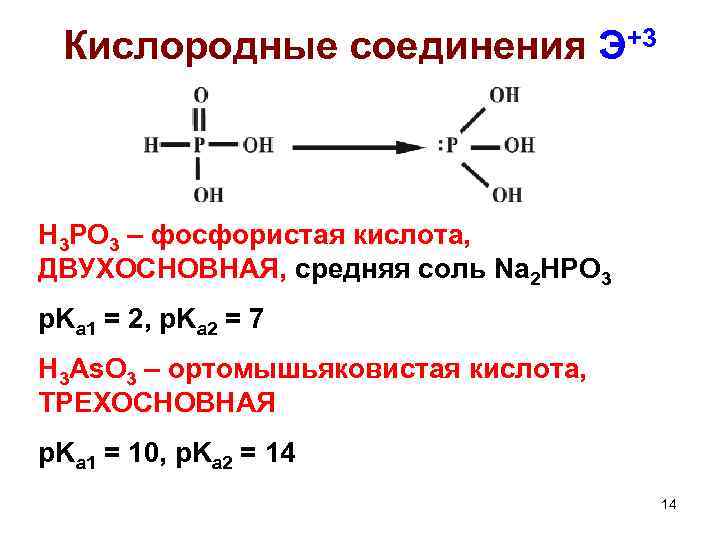 Кислородные соединения Э+3 H 3 PO 3 – фосфористая кислота, ДВУХОСНОВНАЯ, средняя соль Na 2 HPO 3 p. Ka 1 = 2, p. Ka 2 = 7 H 3 As. O 3 – ортомышьяковистая кислота, ТРЕХОСНОВНАЯ p. Ka 1 = 10, p. Ka 2 = 14 14
Кислородные соединения Э+3 H 3 PO 3 – фосфористая кислота, ДВУХОСНОВНАЯ, средняя соль Na 2 HPO 3 p. Ka 1 = 2, p. Ka 2 = 7 H 3 As. O 3 – ортомышьяковистая кислота, ТРЕХОСНОВНАЯ p. Ka 1 = 10, p. Ka 2 = 14 14
 Гидролиз ЭГ 3 ЭCl 3 + 3 H 2 O = H 3 ЭO 3 + 3 HCl (Э = P, As) – необратимо для Р, обратимо для As PCl 3 + 5 Na. OH = Na 2 HPO 3 + 3 Na. Cl + 2 H 2 O As. Cl 3 + 6 Na. OH = Na 3 As. O 3 + 3 Na. Cl + 3 H 2 O 15
Гидролиз ЭГ 3 ЭCl 3 + 3 H 2 O = H 3 ЭO 3 + 3 HCl (Э = P, As) – необратимо для Р, обратимо для As PCl 3 + 5 Na. OH = Na 2 HPO 3 + 3 Na. Cl + 2 H 2 O As. Cl 3 + 6 Na. OH = Na 3 As. O 3 + 3 Na. Cl + 3 H 2 O 15
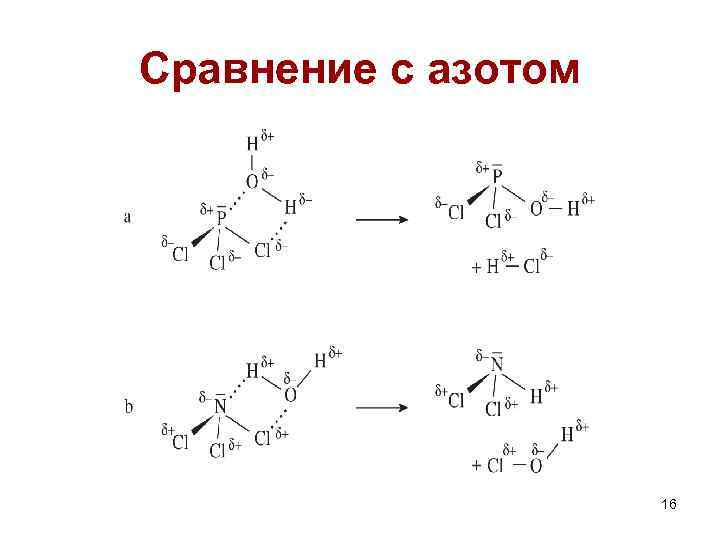 Сравнение с азотом 16
Сравнение с азотом 16
 Гидролиз ЭГ 3 1) ЭCl 3 + H 2 O = Э(OH)Сl 2 + HCl (Э = Sb, Bi) Э(OH)Сl 2 + H 2 O = Э(OH)2 Сl = H 2 O + (ЭО)Cl↓– соли стибила и висмутила АМФОТЕРНОСТЬ: 2) 2 Sb. Cl 3 + 3 Na 2 CO 3 + 3 H 2 O = 2 Sb(OH)3↓+ 3 CO 2 + 6 Na. Cl Sb. Cl 3 + 6 Na. OHизбыток = Na 3[Sb(OH)6] + 3 Na. Cl 3) Bi. Cl 3 + 3 Na. OH = Bi(OH)3↓ 17
Гидролиз ЭГ 3 1) ЭCl 3 + H 2 O = Э(OH)Сl 2 + HCl (Э = Sb, Bi) Э(OH)Сl 2 + H 2 O = Э(OH)2 Сl = H 2 O + (ЭО)Cl↓– соли стибила и висмутила АМФОТЕРНОСТЬ: 2) 2 Sb. Cl 3 + 3 Na 2 CO 3 + 3 H 2 O = 2 Sb(OH)3↓+ 3 CO 2 + 6 Na. Cl Sb. Cl 3 + 6 Na. OHизбыток = Na 3[Sb(OH)6] + 3 Na. Cl 3) Bi. Cl 3 + 3 Na. OH = Bi(OH)3↓ 17
 Ox/red св-ва кислородных соединений P+3 Диспропорционирование H 3 PO 3 4 H 3 PO 3 = 3 H 3 PO 4 + PH 3 (при Т) В кислой среде H 3 PO 3 восстановитель H 3 PO 3 + 2 Ag. NO 3 + H 2 O = H 3 PO 4 +2 Ag +2 HNO 3 18
Ox/red св-ва кислородных соединений P+3 Диспропорционирование H 3 PO 3 4 H 3 PO 3 = 3 H 3 PO 4 + PH 3 (при Т) В кислой среде H 3 PO 3 восстановитель H 3 PO 3 + 2 Ag. NO 3 + H 2 O = H 3 PO 4 +2 Ag +2 HNO 3 18
 Ox/red св-ва соединений Bi+3 • В щелочной среде Bi 3+ может быть окислен или восстановлен Bi(OH)3 + Cl 2 +3 KOH = KBi. O 3 + 2 KCl +3 H 2 O 2 Bi(OH)3 + 3[Sn(OH)4]2 - = 2 Bi + 3[Sn(OH)6]2 • В кислой среде Bi 3+ может быть восстановлен (но не окислен!) 2 Bi. Cl 3 + 3 Zn = 2 Bi + 3 Zn. Cl 2 (в среде HCl) 19
Ox/red св-ва соединений Bi+3 • В щелочной среде Bi 3+ может быть окислен или восстановлен Bi(OH)3 + Cl 2 +3 KOH = KBi. O 3 + 2 KCl +3 H 2 O 2 Bi(OH)3 + 3[Sn(OH)4]2 - = 2 Bi + 3[Sn(OH)6]2 • В кислой среде Bi 3+ может быть восстановлен (но не окислен!) 2 Bi. Cl 3 + 3 Zn = 2 Bi + 3 Zn. Cl 2 (в среде HCl) 19
 Кислородные соединения Э+5 P 4 O 10 Св-ва Р-м К-ты H 3 PO 4 As 2 O 5 Sb 2 O 5 Bi 2 O 5? Р-м н/р HAs. O 3 H 3 As. O 4 Соли Na 3 PO 4 Na 3 As. O 4 Na. PO 3 Na. As. O 3 Sb 2 O 5. x. H 2 O нет н/р Na 3 Sb. O 4 - орто Na. Bi. O 3 Na. Sb. O 3 - мета 20
Кислородные соединения Э+5 P 4 O 10 Св-ва Р-м К-ты H 3 PO 4 As 2 O 5 Sb 2 O 5 Bi 2 O 5? Р-м н/р HAs. O 3 H 3 As. O 4 Соли Na 3 PO 4 Na 3 As. O 4 Na. PO 3 Na. As. O 3 Sb 2 O 5. x. H 2 O нет н/р Na 3 Sb. O 4 - орто Na. Bi. O 3 Na. Sb. O 3 - мета 20
 Получение кислот Э+5 P 4 O 10 + 6 H 2 O = 4 H 3 PO 4 (Э = P, As, Sb) ЭCl 5 + 4 H 2 O = H 3 ЭO 4 + 5 HCl Э + 5 HNO 3 конц = H 3 ЭO 4 + 5 NO 2 +H 2 O Bi + 6 HNO 3 конц = Bi(NO 3)3 + 3 NO 2 + 3 H 2 O 21
Получение кислот Э+5 P 4 O 10 + 6 H 2 O = 4 H 3 PO 4 (Э = P, As, Sb) ЭCl 5 + 4 H 2 O = H 3 ЭO 4 + 5 HCl Э + 5 HNO 3 конц = H 3 ЭO 4 + 5 NO 2 +H 2 O Bi + 6 HNO 3 конц = Bi(NO 3)3 + 3 NO 2 + 3 H 2 O 21
 Ox свойства +5 Э • Соли Bi. O 3 - можно получить только в сильнощелочной среде • в кислой среде Bi. O 3 - ОЧЕНЬ СИЛЬНЫЙ ОКИСЛИТЕЛЬ 2 KBi. O 3 + 4 H 2 SO 4 =Bi 2(SO 4)3 + O 2 + K 2 SO 4 + 4 H 2 O • Cоединения P 5+ не являтся окислителями 22
Ox свойства +5 Э • Соли Bi. O 3 - можно получить только в сильнощелочной среде • в кислой среде Bi. O 3 - ОЧЕНЬ СИЛЬНЫЙ ОКИСЛИТЕЛЬ 2 KBi. O 3 + 4 H 2 SO 4 =Bi 2(SO 4)3 + O 2 + K 2 SO 4 + 4 H 2 O • Cоединения P 5+ не являтся окислителями 22
 Ox свойства Э+5 As 5+ и Sb 5+ слабые окислители и только в кислой среде: H 3 As. O 4 + 2 HJ = J 2 + HAs. O 2 + 2 H 2 O H 3 Sb. O 4 + 5 HClконц. = Sb. Cl 3 + Cl 2 + 4 H 2 O Но в щелочной среде: J 2 + Na. As. O 2 + 4 Na. OH = Na 3 As. O 4 + 2 Na. J + 2 H 2 O 23
Ox свойства Э+5 As 5+ и Sb 5+ слабые окислители и только в кислой среде: H 3 As. O 4 + 2 HJ = J 2 + HAs. O 2 + 2 H 2 O H 3 Sb. O 4 + 5 HClконц. = Sb. Cl 3 + Cl 2 + 4 H 2 O Но в щелочной среде: J 2 + Na. As. O 2 + 4 Na. OH = Na 3 As. O 4 + 2 Na. J + 2 H 2 O 23
 Орто-фосфорная кислота 100% H 3 PO 4, Tпл. = 42 o. C p. Ka 1 = 2; p. Ka 2 = 6, p. Ka 3 = 12 1% р-р Na 3 PO 4: p. H=12, 1 1% р-р Na 2 HPO 4: p. H= 8, 9 1% р-р Na. H 2 PO 4: p. H= 4, 6 2 H 3 PO 4 = H 4 P 2 O 7 + H 2 O↑ (конденсация при нагревании) 24
Орто-фосфорная кислота 100% H 3 PO 4, Tпл. = 42 o. C p. Ka 1 = 2; p. Ka 2 = 6, p. Ka 3 = 12 1% р-р Na 3 PO 4: p. H=12, 1 1% р-р Na 2 HPO 4: p. H= 8, 9 1% р-р Na. H 2 PO 4: p. H= 4, 6 2 H 3 PO 4 = H 4 P 2 O 7 + H 2 O↑ (конденсация при нагревании) 24
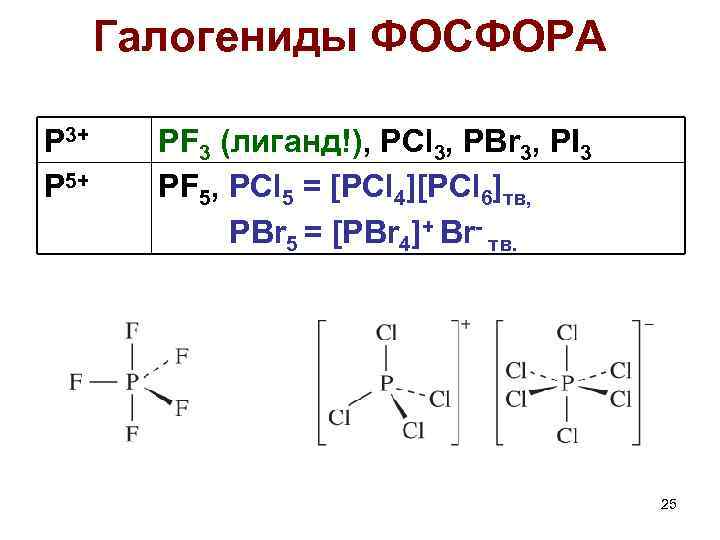 Галогениды ФОСФОРА P 3+ P 5+ PF 3 (лиганд!), PCl 3, PBr 3, PI 3 PF 5, PCl 5 = [PCl 4][PCl 6]тв, PBr 5 = [PBr 4]+ Br- тв. 25
Галогениды ФОСФОРА P 3+ P 5+ PF 3 (лиганд!), PCl 3, PBr 3, PI 3 PF 5, PCl 5 = [PCl 4][PCl 6]тв, PBr 5 = [PBr 4]+ Br- тв. 25
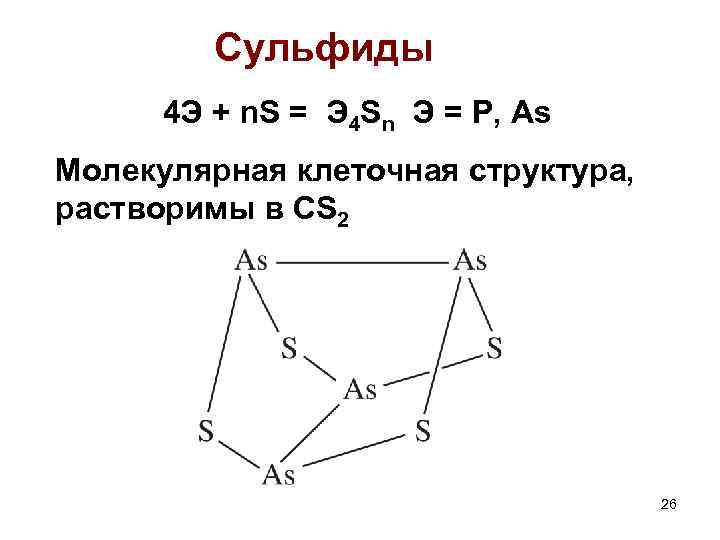 Сульфиды 4 Э + n. S = Э 4 Sn Э = P, As Молекулярная клеточная структура, растворимы в CS 2 26
Сульфиды 4 Э + n. S = Э 4 Sn Э = P, As Молекулярная клеточная структура, растворимы в CS 2 26
 Сульфиды 2 ЭCl 3 + 3 H 2 S = Э 2 S 3↓ + 6 HCl (в р-ре HCl) Э = As, Sb, Bi 2 ЭCl 5 + 5 H 2 S = Э 2 S 5↓ + 10 HCl (в р-ре HCl) Э = As, Sb (Bi 2 S 5 не существует) As 2 S 3, As 2 S 5 – желтые Sb 2 S 3, Sb 2 S 5 – оранжевые Bi 2 S 3 -черный 27
Сульфиды 2 ЭCl 3 + 3 H 2 S = Э 2 S 3↓ + 6 HCl (в р-ре HCl) Э = As, Sb, Bi 2 ЭCl 5 + 5 H 2 S = Э 2 S 5↓ + 10 HCl (в р-ре HCl) Э = As, Sb (Bi 2 S 5 не существует) As 2 S 3, As 2 S 5 – желтые Sb 2 S 3, Sb 2 S 5 – оранжевые Bi 2 S 3 -черный 27
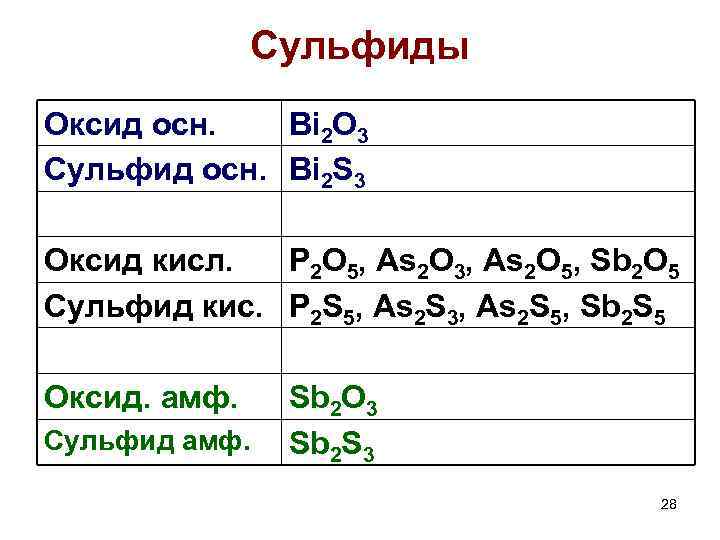 Сульфиды Оксид осн. Bi 2 O 3 Сульфид осн. Bi 2 S 3 Оксид кисл. P 2 O 5, As 2 O 3, As 2 O 5, Sb 2 O 5 Сульфид кис. P 2 S 5, As 2 S 3, As 2 S 5, Sb 2 S 5 Оксид. амф. Сульфид амф. Sb 2 O 3 Sb 2 S 3 28
Сульфиды Оксид осн. Bi 2 O 3 Сульфид осн. Bi 2 S 3 Оксид кисл. P 2 O 5, As 2 O 3, As 2 O 5, Sb 2 O 5 Сульфид кис. P 2 S 5, As 2 S 3, As 2 S 5, Sb 2 S 5 Оксид. амф. Сульфид амф. Sb 2 O 3 Sb 2 S 3 28
 Тиосоли Взаимодействие кислых оксидов (сульфидов) с основаниями: As 2 O 3 тв. + Na 2 O тв. = 2 Na. As. O 2 - арсенит As 2 S 3 тв. + Na 2 S р-р = 2 Na. As. S 2 - тиоарсенит Нет взаимодействия! Bi 2 O 3 тв + Na 2 O тв = нет реакции Bi 2 S 3 тв + Na 2 S р-р = нет реакции 29
Тиосоли Взаимодействие кислых оксидов (сульфидов) с основаниями: As 2 O 3 тв. + Na 2 O тв. = 2 Na. As. O 2 - арсенит As 2 S 3 тв. + Na 2 S р-р = 2 Na. As. S 2 - тиоарсенит Нет взаимодействия! Bi 2 O 3 тв + Na 2 O тв = нет реакции Bi 2 S 3 тв + Na 2 S р-р = нет реакции 29
 Тиосоли Э 3+ (Э = P, As, Sb): Na. ЭS 2 и Na 3 ЭS 3 метаорто. Э 5+ (Э = P, As, Sb): Na. ЭS 3 и Na 3 ЭS 4 метаорто. Получение сплавлением: 3 Na + P + 3 S = Na 3 PS 3 3 Na + P + 4 S = Na 3 PS 4 30
Тиосоли Э 3+ (Э = P, As, Sb): Na. ЭS 2 и Na 3 ЭS 3 метаорто. Э 5+ (Э = P, As, Sb): Na. ЭS 3 и Na 3 ЭS 4 метаорто. Получение сплавлением: 3 Na + P + 3 S = Na 3 PS 3 3 Na + P + 4 S = Na 3 PS 4 30
 Тиосоли Получение в растворе (Э = As, Sb): Э 2 S 3↓+ Na 2 S = 2 Na. ЭS 2 Э 2 S 5↓+ Na 2 S = 2 Na. ЭS 3 Э 2 S 3↓+ Na 2 S 2 = 2 Na. ЭS 3 + 2 S окислитель Реакции с кислотами: Na. As. S 2 + HCl = As 2 S 3↓ + H 2 S + Na. Cl As 2 S 3 + 28 HNO 3 = 2 H 3 As. O 4 + 3 H 2 SO 4 +28 NO 2 +8 H 2 O КОНЦ. 31
Тиосоли Получение в растворе (Э = As, Sb): Э 2 S 3↓+ Na 2 S = 2 Na. ЭS 2 Э 2 S 5↓+ Na 2 S = 2 Na. ЭS 3 Э 2 S 3↓+ Na 2 S 2 = 2 Na. ЭS 3 + 2 S окислитель Реакции с кислотами: Na. As. S 2 + HCl = As 2 S 3↓ + H 2 S + Na. Cl As 2 S 3 + 28 HNO 3 = 2 H 3 As. O 4 + 3 H 2 SO 4 +28 NO 2 +8 H 2 O КОНЦ. 31
 Побочная подгруппа V группы периодической системы 32
Побочная подгруппа V группы периодической системы 32
 V, Nb, Ta Эл. конф. Степени окисления V Nb 3 d 34 s 2 4 d 45 s 1 +5, +4, (+3), (+2), 0 +5, +4, (+3), 0 Ta 5 d 36 s 2 +5, +4, (+3), 0 Свойства Nb и Ta очень похожи и сильно отличаются от свойств V. В ряду V-Nb-Ta стабилизируются высшие степени окисления. 33
V, Nb, Ta Эл. конф. Степени окисления V Nb 3 d 34 s 2 4 d 45 s 1 +5, +4, (+3), (+2), 0 +5, +4, (+3), 0 Ta 5 d 36 s 2 +5, +4, (+3), 0 Свойства Nb и Ta очень похожи и сильно отличаются от свойств V. В ряду V-Nb-Ta стабилизируются высшие степени окисления. 33
 Содержание в земной коре и минералы • V – 22 место, рассеян, VS 2. V 2 S 5 (патронит) • Nb – 64 место, рассеян и редкий, M(Nb. O 3)2 (M = Mn, Fe) – колумбит • Ta – 65 место, рассеян и редкий, M(Ta. O 3)2 (M = Mn, Fe) – танталит 34
Содержание в земной коре и минералы • V – 22 место, рассеян, VS 2. V 2 S 5 (патронит) • Nb – 64 место, рассеян и редкий, M(Nb. O 3)2 (M = Mn, Fe) – колумбит • Ta – 65 место, рассеян и редкий, M(Ta. O 3)2 (M = Mn, Fe) – танталит 34
 Открытие элементов • V – 1801 г. Мексиканец дель Рио, «Ванадис» - древнегреческая богиня красоты • Nb – 1801 г. Англ. Гетгет в минерале колумбит и название колумбий. От греч. «Ниобея» - дочь Тантала • Ta – 1802 г. Швед Экеберг, по имени греческого полубога Тантала. 35
Открытие элементов • V – 1801 г. Мексиканец дель Рио, «Ванадис» - древнегреческая богиня красоты • Nb – 1801 г. Англ. Гетгет в минерале колумбит и название колумбий. От греч. «Ниобея» - дочь Тантала • Ta – 1802 г. Швед Экеберг, по имени греческого полубога Тантала. 35
 Простые вещества Получение сложное, проблема разделения Nb и Ta M 2 O 5 + 5 Ca = 5 Ca. O + 2 M V – стали, танковая броня Nb, Ta – химическая аппаратура Ta – костная и пластическая хирургия 36
Простые вещества Получение сложное, проблема разделения Nb и Ta M 2 O 5 + 5 Ca = 5 Ca. O + 2 M V – стали, танковая броня Nb, Ta – химическая аппаратура Ta – костная и пластическая хирургия 36
 Известный "автомобильный король" Генри Форд сказал: "Если бы не было ванадия" - не было бы автомобиля". Незначительная добавка (0, 2%) ванадия к обычной стали сообщает ей целый ряд ценных свойств: увеличивается ее упругость, прочность на истирание и сопротивление разрыву, что особенно важно для таких ответственных частей автомобиля, как рессоры, оси, валы, шестерни. Из ванадиевой стали изготовляют автомобильные моторы, цилиндры высокого давления, тормозные колодки. Если бы не ванадиевая сталь, автомобиль весил бы в два раза больше, в два раза увеличился бы расход горючего, износ покрышек, сократился срок службы дорожного покрытия. 37
Известный "автомобильный король" Генри Форд сказал: "Если бы не было ванадия" - не было бы автомобиля". Незначительная добавка (0, 2%) ванадия к обычной стали сообщает ей целый ряд ценных свойств: увеличивается ее упругость, прочность на истирание и сопротивление разрыву, что особенно важно для таких ответственных частей автомобиля, как рессоры, оси, валы, шестерни. Из ванадиевой стали изготовляют автомобильные моторы, цилиндры высокого давления, тормозные колодки. Если бы не ванадиевая сталь, автомобиль весил бы в два раза больше, в два раза увеличился бы расход горючего, износ покрышек, сократился срок службы дорожного покрытия. 37
![Простые вещества Химически инертные 2 V + 12 HF = 2 H[VF 6] + Простые вещества Химически инертные 2 V + 12 HF = 2 H[VF 6] +](https://present5.com/presentation/181398164_157984001/image-38.jpg) Простые вещества Химически инертные 2 V + 12 HF = 2 H[VF 6] + 5 H 2 V + 6 HNO 3 = [VO 2]NO 3 + 5 NO 2 + 3 H 2 O 3 V + 5 HNO 3 + 3 HCl = 3[VO 2]Cl + 5 NO+ 4 H 2 O Nb, Ta + царская водка = нет реакции Nb + 5 HNO 3 + 7 HF = H 2[Nb. F 7] +5 NO 2 +5 H 2 O [Ta. F 8]34 M + 12 KOHрасплав + 5 O 2 = 4 K 3 MO 4 + 6 H 2 O 38
Простые вещества Химически инертные 2 V + 12 HF = 2 H[VF 6] + 5 H 2 V + 6 HNO 3 = [VO 2]NO 3 + 5 NO 2 + 3 H 2 O 3 V + 5 HNO 3 + 3 HCl = 3[VO 2]Cl + 5 NO+ 4 H 2 O Nb, Ta + царская водка = нет реакции Nb + 5 HNO 3 + 7 HF = H 2[Nb. F 7] +5 NO 2 +5 H 2 O [Ta. F 8]34 M + 12 KOHрасплав + 5 O 2 = 4 K 3 MO 4 + 6 H 2 O 38
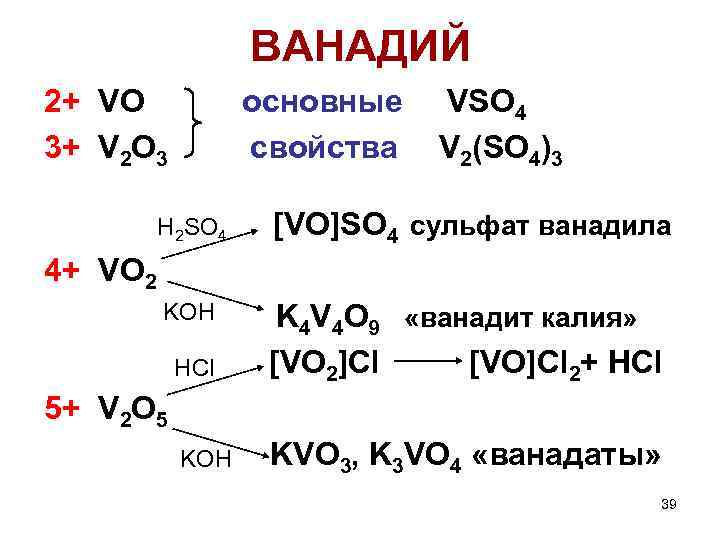 ВАНАДИЙ 2+ VO 3+ V 2 O 3 основные свойства VSO 4 V 2(SO 4)3 H 2 SO 4 [VO]SO 4 сульфат ванадила KOH HCl K 4 V 4 O 9 «ванадит калия» [VO 2]Cl [VO]Cl 2+ HCl KOH KVO 3, K 3 VO 4 «ванадаты» 4+ VO 2 5+ V 2 O 5 39
ВАНАДИЙ 2+ VO 3+ V 2 O 3 основные свойства VSO 4 V 2(SO 4)3 H 2 SO 4 [VO]SO 4 сульфат ванадила KOH HCl K 4 V 4 O 9 «ванадит калия» [VO 2]Cl [VO]Cl 2+ HCl KOH KVO 3, K 3 VO 4 «ванадаты» 4+ VO 2 5+ V 2 O 5 39
 Кислородные соединения V 5+ V 2 O 5 + H 2 O = 2 HVO 3 (равновесие влево, кислота не получена) V 2 O 5 + 2 Na. OH = 2 Na. VO 3 + H 2 O (медленно в растворе, быстро в расплаве), Na 3 VO 4 2 HVO 3 + 2 HXконц = 2[VO 2]X + 2 H 2 O Катализаторы на основе V 2 O 5 , заменили платину при 40 производстве серной кислоты
Кислородные соединения V 5+ V 2 O 5 + H 2 O = 2 HVO 3 (равновесие влево, кислота не получена) V 2 O 5 + 2 Na. OH = 2 Na. VO 3 + H 2 O (медленно в растворе, быстро в расплаве), Na 3 VO 4 2 HVO 3 + 2 HXконц = 2[VO 2]X + 2 H 2 O Катализаторы на основе V 2 O 5 , заменили платину при 40 производстве серной кислоты
 Разложение пероксида водорода в присутствии катализатора 3 H 2 O 2 + 2 KMn. O 4 → 2 Mn. O 2 +3 O 2↑ + 2 KOH + 2 H 2 O Mn. O 2 2 H 2 O 2 → 2 H 2 O + O 2↑ Действие H 2 SO 4 конц. на древесину и сахар C 12 H 22 O 11 (древесина) H 2 SO 4 конц → 12 C + 11 H 2 O C 12 H 22 O 11 (сахар) + 8 H 2 SO 4 → 8 SO 2↑ + 19 H 2 O + 8 C + 4 CO 2↑
Разложение пероксида водорода в присутствии катализатора 3 H 2 O 2 + 2 KMn. O 4 → 2 Mn. O 2 +3 O 2↑ + 2 KOH + 2 H 2 O Mn. O 2 2 H 2 O 2 → 2 H 2 O + O 2↑ Действие H 2 SO 4 конц. на древесину и сахар C 12 H 22 O 11 (древесина) H 2 SO 4 конц → 12 C + 11 H 2 O C 12 H 22 O 11 (сахар) + 8 H 2 SO 4 → 8 SO 2↑ + 19 H 2 O + 8 C + 4 CO 2↑
 Окислительные свойства Mn 2 O 7 (Химические спички) 2 KMn. O 4 + H 2 SO 4 → Mn 2 O 7 + K 2 SO 4 + H 2 O 4 Mn 2 O 7 + 2 C 2 H 5 OH → 4 CO 2↑ + 8 Mn. O 2+ 6 H 2 O Горение KMn. O 4 под слоем спирта 2 KMn. O 4 + C 2 H 5 OH + H 2 SO 4 → 2 CO 2↑ + 2 Mn. O 2+ K 2 SO 4 + H 2 O
Окислительные свойства Mn 2 O 7 (Химические спички) 2 KMn. O 4 + H 2 SO 4 → Mn 2 O 7 + K 2 SO 4 + H 2 O 4 Mn 2 O 7 + 2 C 2 H 5 OH → 4 CO 2↑ + 8 Mn. O 2+ 6 H 2 O Горение KMn. O 4 под слоем спирта 2 KMn. O 4 + C 2 H 5 OH + H 2 SO 4 → 2 CO 2↑ + 2 Mn. O 2+ K 2 SO 4 + H 2 O
 Растворимость NH 3 в воде Температура, K Кол-во объемов в 1 объеме H 2 O 273 ~ 1200 293 ~ 700 Окисление NH 3 кислородом в присутствии катализатора Cr 2 O 3 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O 2 NO + O 2 → 2 NO 2 Взаимодействие угля с KNO 3 2 KNO 3 + C → 2 KNO 2 + CO 2↑
Растворимость NH 3 в воде Температура, K Кол-во объемов в 1 объеме H 2 O 273 ~ 1200 293 ~ 700 Окисление NH 3 кислородом в присутствии катализатора Cr 2 O 3 4 NH 3 + 5 O 2 → 4 NO + 6 H 2 O 2 NO + O 2 → 2 NO 2 Взаимодействие угля с KNO 3 2 KNO 3 + C → 2 KNO 2 + CO 2↑


