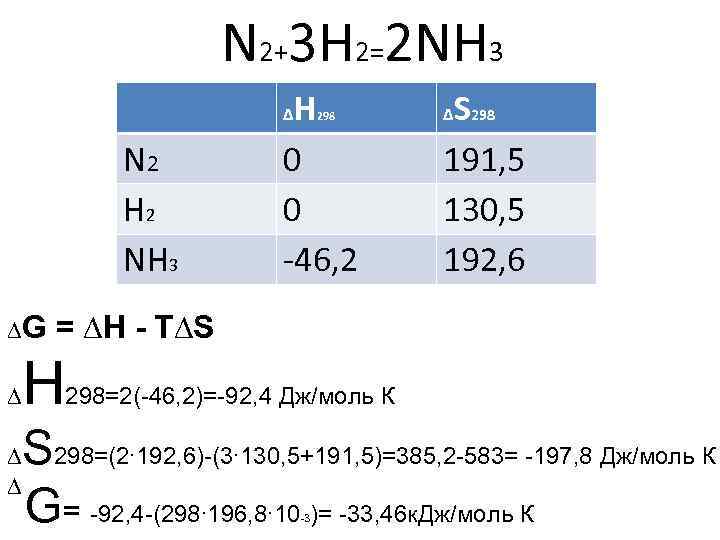
 N 2+3 H 2=2 NH 3 H 0 0 -46, 2 ∆ N 2 H 2 NH 3 ∆G ∆ ∆ ∆ 298 S 191, 5 130, 5 192, 6 ∆ 298 = ∆H - T∆S H 298=2(-46, 2)=-92, 4 Дж/моль К S 298=(2∙ 192, 6)-(3∙ 130, 5+191, 5)=385, 2 -583= -197, 8 Дж/моль К G= -92, 4 -(298∙ 196, 8∙ 10 )= -33, 46 к. Дж/моль К -3
N 2+3 H 2=2 NH 3 H 0 0 -46, 2 ∆ N 2 H 2 NH 3 ∆G ∆ ∆ ∆ 298 S 191, 5 130, 5 192, 6 ∆ 298 = ∆H - T∆S H 298=2(-46, 2)=-92, 4 Дж/моль К S 298=(2∙ 192, 6)-(3∙ 130, 5+191, 5)=385, 2 -583= -197, 8 Дж/моль К G= -92, 4 -(298∙ 196, 8∙ 10 )= -33, 46 к. Дж/моль К -3
 Температура начала химического равновесия •
Температура начала химического равновесия •
 Химизм производства и оптимальные условия N 2 + 3 H 2 2 NH 3 + Q Данная реакция: ü ü обратимая экзотермическая каталитическая гетерогенная (катализатор – твердое вещество) Оптимальные условия: 1. 2. 3. 0 температура 400 -500 С давление 15 -30 МПа катализатор – порошкообразное железо с примесью оксидов алюминия и калия
Химизм производства и оптимальные условия N 2 + 3 H 2 2 NH 3 + Q Данная реакция: ü ü обратимая экзотермическая каталитическая гетерогенная (катализатор – твердое вещество) Оптимальные условия: 1. 2. 3. 0 температура 400 -500 С давление 15 -30 МПа катализатор – порошкообразное железо с примесью оксидов алюминия и калия
 Выводы: • ∆H≤ 0 – реакция экзотермическая • ∆G≤ 0 – реакция идет
Выводы: • ∆H≤ 0 – реакция экзотермическая • ∆G≤ 0 – реакция идет
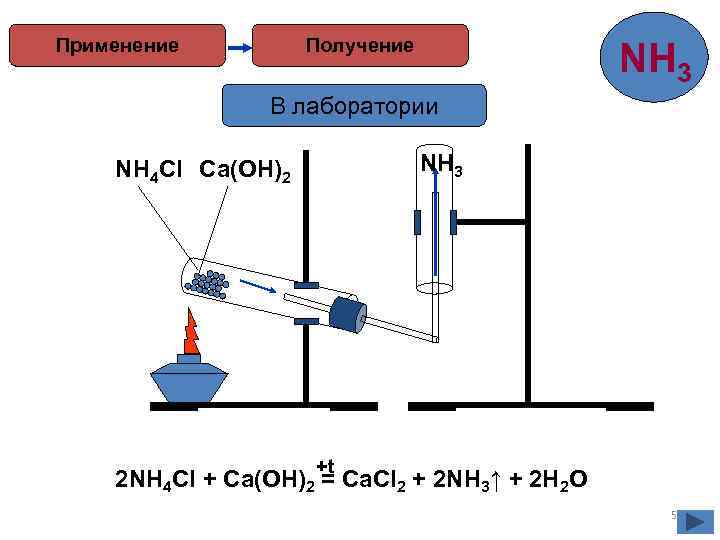 Применение Получение NH 3 В лаборатории NH 3 NH 4 Cl Ca(OH)2 +t 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3↑ + 2 H 2 O 5
Применение Получение NH 3 В лаборатории NH 3 NH 4 Cl Ca(OH)2 +t 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3↑ + 2 H 2 O 5
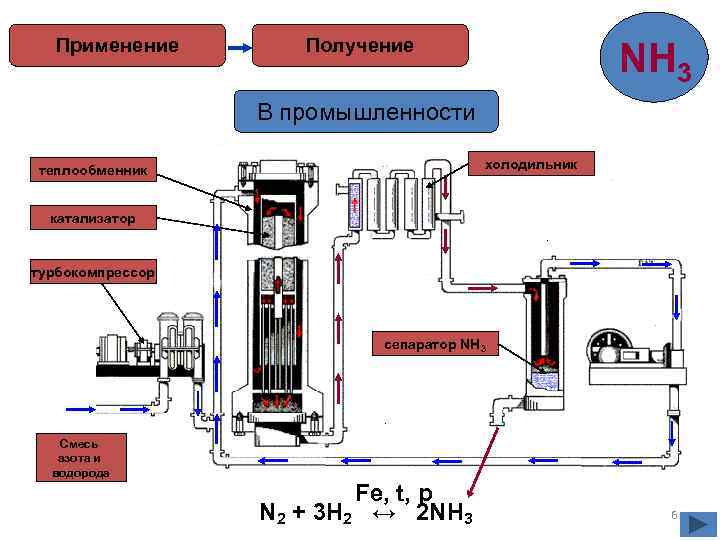 Применение Получение NH 3 В промышленности холодильник теплообменник катализатор турбокомпрессор сепаратор NH 3 Смесь азота и водорода Fe, t, p N 2 + 3 H 2 ↔ 2 NH 3 6
Применение Получение NH 3 В промышленности холодильник теплообменник катализатор турбокомпрессор сепаратор NH 3 Смесь азота и водорода Fe, t, p N 2 + 3 H 2 ↔ 2 NH 3 6