MG_5.ppt
- Количество слайдов: 25

Мутанти бактерій і бактеріофагів q Мутанти бактерій, стійкі до антибактерійних агентів 1
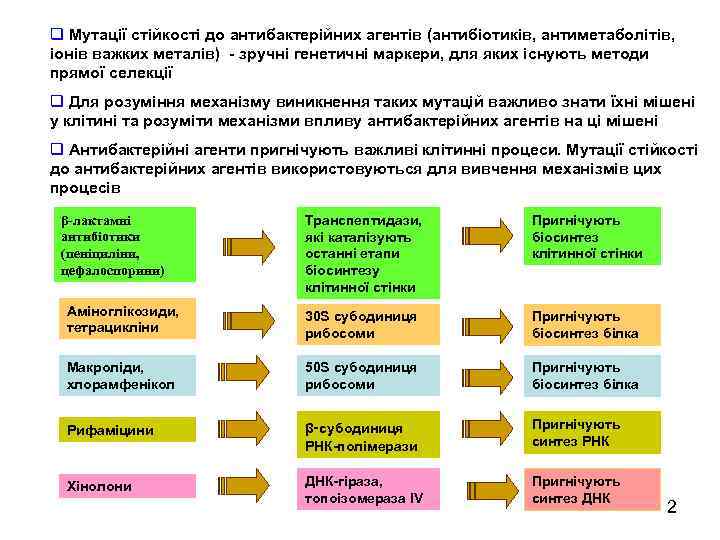
q Мутації стійкості до антибактерійних агентів (антибіотиків, антиметаболітів, іонів важких металів) - зручні генетичні маркери, для яких існують методи прямої селекції q Для розуміння механізму виникнення таких мутацій важливо знати їхні мішені у клітині та розуміти механізми впливу антибактерійних агентів на ці мішені q Антибактерійні агенти пригнічують важливі клітинні процеси. Мутації стійкості до антибактерійних агентів використовуються для вивчення механізмів цих процесів Транспептидази, які каталізують останні етапи біосинтезу клітинної стінки Пригнічують біосинтез клітинної стінки Аміноглікозиди, тетрацикліни 30 S субодиниця рибосоми Пригнічують біосинтез білка Макроліди, хлорамфенікол 50 S субодиниця рибосоми Пригнічують біосинтез білка Рифаміцини β-субодиниця РНК-полімерази Пригнічують синтез РНК Хінолони ДНК-гіраза, топоізомераза IV Пригнічують синтез ДНК β-лактамні антибіотики (пеніциліни, цефалоспорини) 2
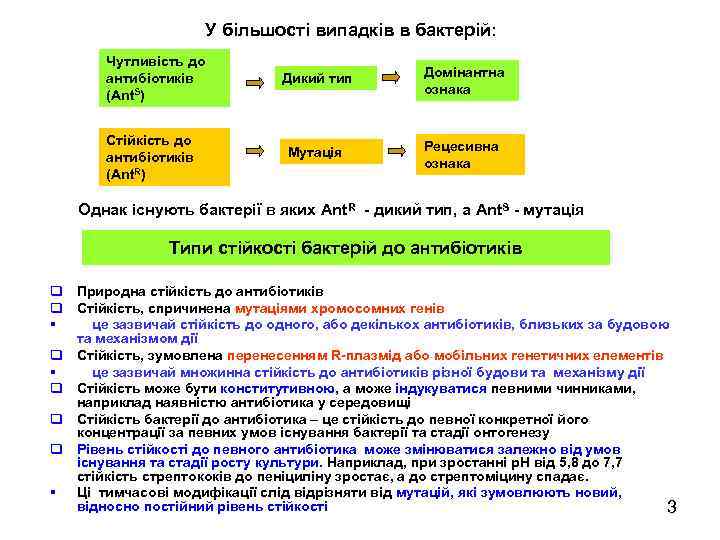
У більшості випадків в бактерій: Чутливість до антибіотиків (Ant. S) Стійкість до антибіотиків (Ant. R) Дикий тип Домінантна ознака Мутація Рецесивна ознака Однак існують бактерії в яких Ant. R - дикий тип, а Ant. S - мутація Типи стійкості бактерій до антибіотиків q Природна стійкість до антибіотиків q Стійкість, спричинена мутаціями хромосомних генів § це зазвичай стійкість до одного, або декількох антибіотиків, близьких за будовою та механізмом дії q Стійкість, зумовлена перенесенням R-плазмід або мобільних генетичних елементів § це зазвичай множинна стійкість до антибіотиків різної будови та механізму дії q Стійкість може бути конститутивною, а може індукуватися певними чинниками, наприклад наявністю антибіотика у середовищі q Стійкість бактерії до антибіотика – це стійкість до певної конкретної його концентрації за певних умов існування бактерії та стадії онтогенезу q Рівень стійкості до певного антибіотика може змінюватися залежно від умов існування та стадії росту культури. Наприклад, при зростанні р. Н від 5, 8 до 7, 7 стійкість стрептококів до пеніциліну зростає, а до стрептоміцину спадає. § Ці тимчасові модифікації слід відрізняти від мутацій, які зумовлюють новий, відносно постійний рівень стійкості 3

Етапи виділення і аналізу мутантів, стійких до антибіотиків 1. Визначення спектру стійкості досліджуваного штаму бактерій до антибіотиків 2. Кількісна оцінка рівнів стійкості штаму до окремих антибіотиків 3. Підбір концентрацій антибіотиків, які можна використовувати для селекції мутантів 4. Виділення спонтанних мутантів штаму, стійких до антибіотиків 5. Виділення мутантів штаму, стійких до антибіотика, індукованих мутагенами 6. Опис і класифікація спонтанних та індукованих мутантів за рівнем стійкості до антибіотика, морфологічними та іншими ознаками, а також за спектром стійкості до інших антибіотиків 7. Перевірка стабільності збереження мутантами фенотипу резистентності і можливості виникнення ревертантів до дикого фенотипу 8. Визначення умов підтримуючої селекції мутантів 9. Збереження мутантів у колекції та періодична перевірка ознак мутанта 4
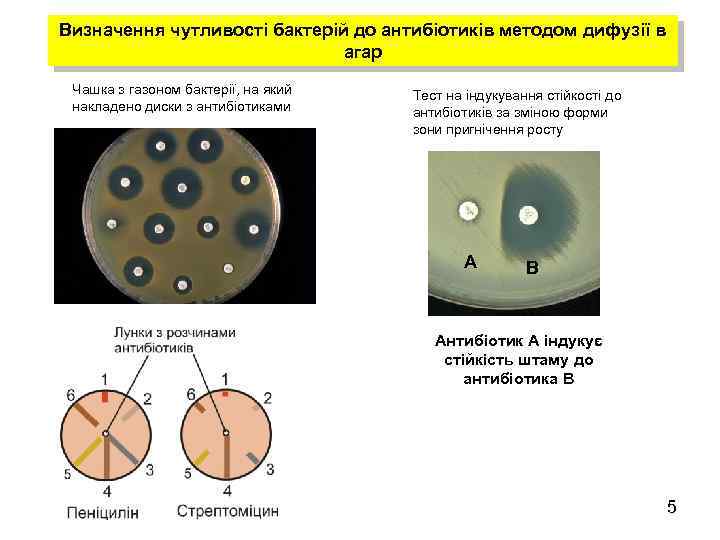
Визначення чутливості бактерій до антибіотиків методом дифузії в агар Чашка з газоном бактерії, на який накладено диски з антибіотиками Тест на індукування стійкості до антибіотиків за зміною форми зони пригнічення росту А В Антибіотик А індукує стійкість штаму до антибіотика В 5
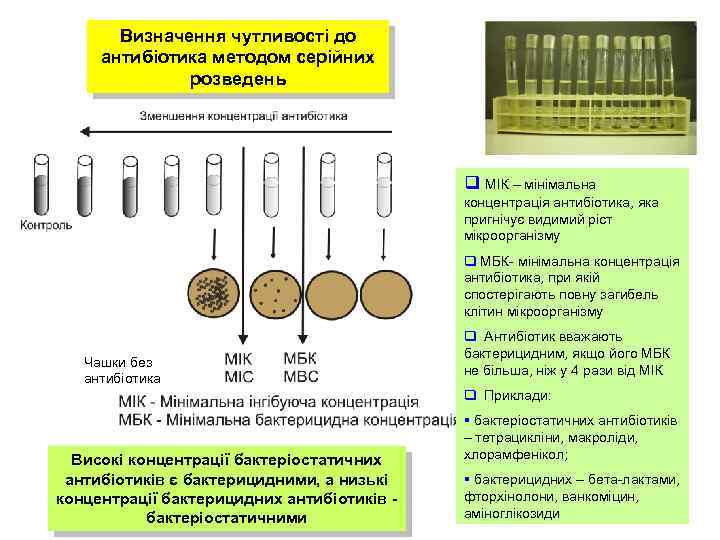
Визначення чутливості до антибіотика методом серійних розведень q МІК – мінімальна концентрація антибіотика, яка пригнічує видимий ріст мікроорганізму q МБК- мінімальна концентрація антибіотика, при якій спостерігають повну загибель клітин мікроорганізму Чашки без антибіотика q Антибіотик вважають бактерицидним, якщо його МБК не більша, ніж у 4 рази від МІК q Приклади: Високі концентрації бактеріостатичних антибіотиків є бактерицидними, а низькі концентрації бактерицидних антибіотиків бактеріостатичними § бактеріостатичних антибіотиків – тетрацикліни, макроліди, хлорамфенікол; § бактерицидних – бета-лактами, фторхінолони, ванкоміцин, 6 аміноглікозиди
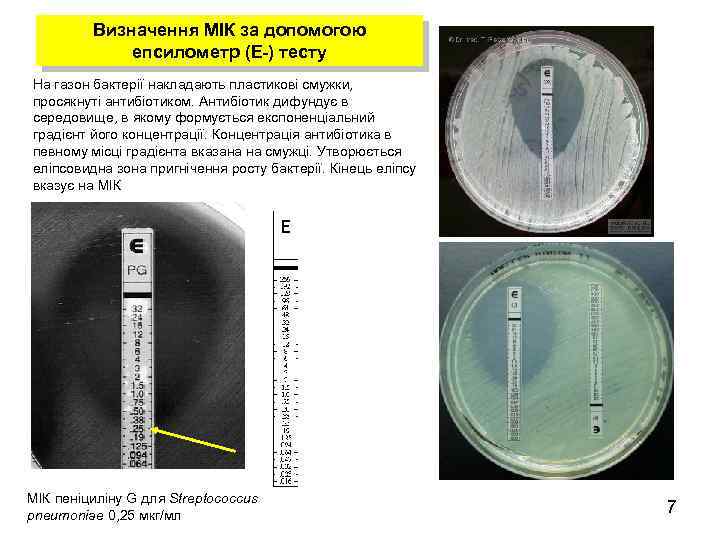
Визначення МІК за допомогою епсилометр (Е-) тесту На газон бактерії накладають пластикові смужки, просякнуті антибіотиком. Антибіотик дифундує в середовище, в якому формується експоненціальний градієнт його концентрації. Концентрація антибіотика в певному місці градієнта вказана на смужці. Утворюється еліпсовидна зона пригнічення росту бактерії. Кінець еліпсу вказує на МІК пеніциліну G для Streptococcus pneumoniae 0, 25 мкг/мл 7
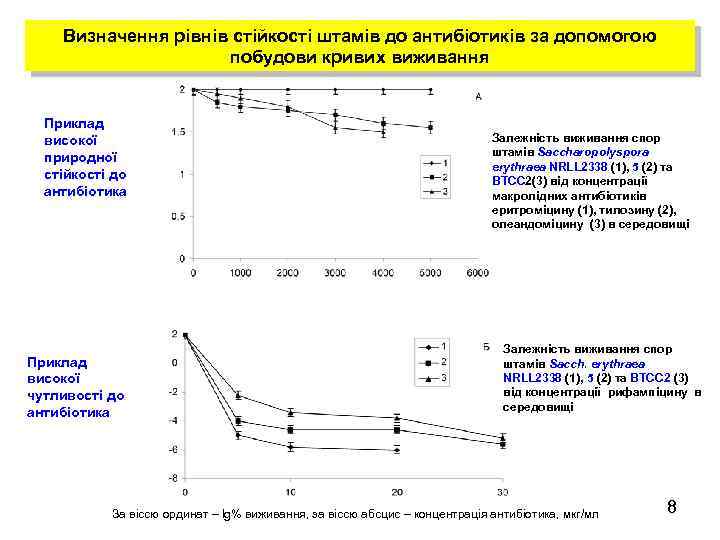
Визначення рівнів стійкості штамів до антибіотиків за допомогою побудови кривих виживання Приклад високої природної стійкості до антибіотика Приклад високої чутливості до антибіотика Залежність виживання спор штамів Saccharopolyspora erythraea NRLL 2338 (1), 5 (2) та ВТСС 2(3) від концентрації макролідних антибіотиків еритроміцину (1), тилозину (2), олеандоміцину (3) в середовищі Залежність виживання спор штамів Sacch. erythraea NRLL 2338 (1), 5 (2) та ВТСС 2 (3) від концентрації рифампіцину в середовищі За віссю ординат – lg% виживання, за віссю абсцис – концентрація антибіотика, мкг/мл 8
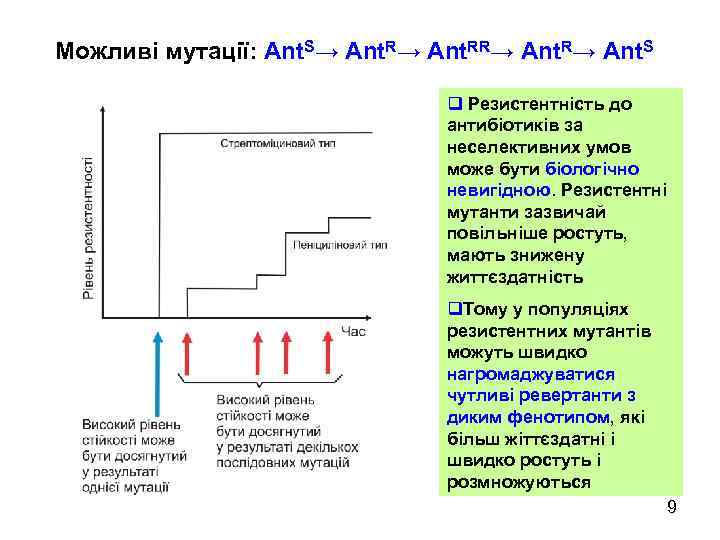
Можливі мутації: Ant. S→ Ant. RR→ Ant. S q Резистентність до антибіотиків за неселективних умов може бути біологічно невигідною. Резистентні мутанти зазвичай повільніше ростуть, мають знижену життєздатність q. Тому у популяціях резистентних мутантів можуть швидко нагромаджуватися чутливі ревертанти з диким фенотипом, які більш жіттєздатні і швидко ростуть і розмножуються 9
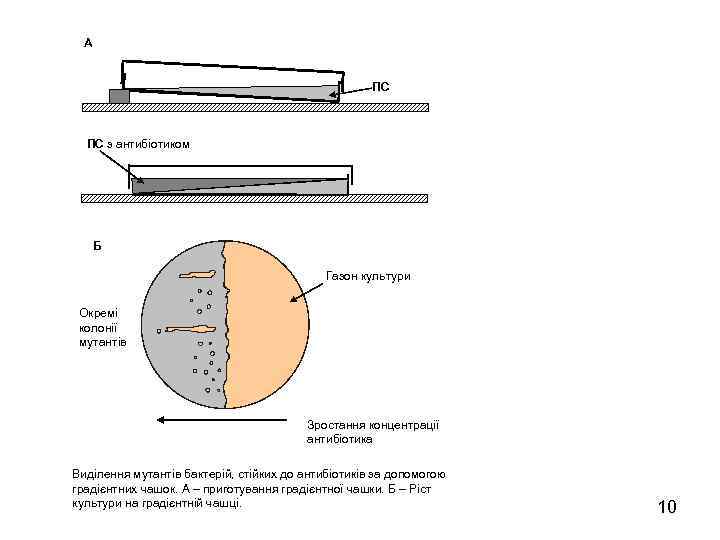
А ПС ПС з антибіотиком Б Газон культури Окремі колонії мутантів Зростання концентрації антибіотика Виділення мутантів бактерій, стійких до антибіотиків за допомогою градієнтних чашок. А – приготування градієнтної чашки. Б – Ріст культури на градієнтній чашці. 10
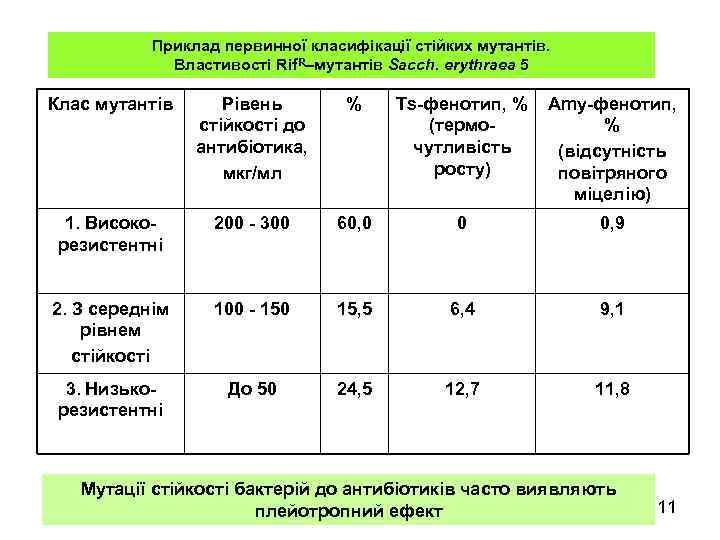
Приклад первинної класифікації стійких мутантів. Властивості Rif. R–мутантів Sacch. erythraea 5 Клас мутантів Рівень стійкості до антибіотика, мкг/мл % Ts-фенотип, % (термочутливість росту) Amy-фенотип, % (відсутність повітряного міцелію) 1. Високорезистентні 200 - 300 60, 0 0 0, 9 2. З середнім рівнем стійкості 100 - 150 15, 5 6, 4 9, 1 3. Низькорезистентні До 50 24, 5 12, 7 11, 8 Мутації стійкості бактерій до антибіотиків часто виявляють плейотропний ефект 11
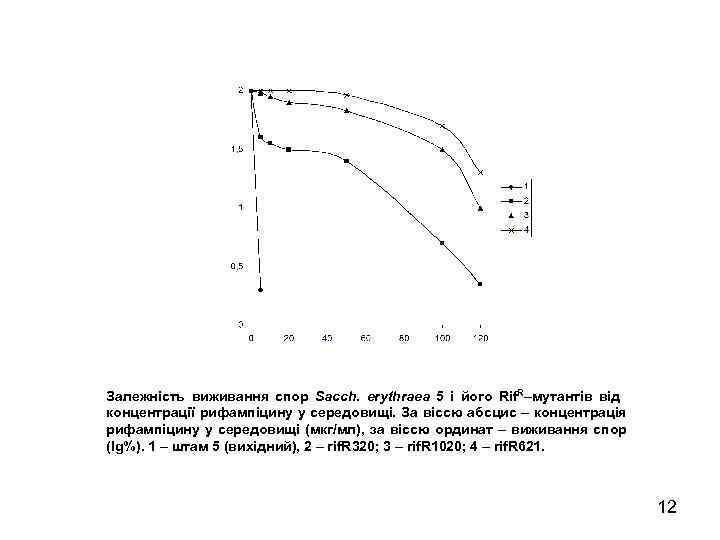
Залежність виживання спор Sacch. erythraea 5 і його Rif. R–мутантів від концентрації рифампіцину у середовищі. За віссю абсцис – концентрація рифампіцину у середовищі (мкг/мл), за віссю ординат – виживання спор (lg%). 1 – штам 5 (вихідний), 2 – rif. R 320; 3 – rif. R 1020; 4 – rif. R 621. 12

Основні механізми стійкості бактерій до антибіотиків 1. Модифікація мішені дії антибіотика, яка елімінує або зменшує зв’язування антибіотика 2. Надпродукція мішені антибіотика (антибіотика “не вистачає” для зв’язування з мішенню) 3. Інактивація антибіотика шляхом ензиматичної інактивації: (гідроліз, дериватизація - ацетилювання, фосфорилювання, нуклеотидилювання (аденілювання), глікозилювання, перенесення залишку глутатіону) 4. Зміни у транспортуванні антибіотика в клітину/ з клітини, що приводить до зниженого нагромадження антибіотика в клітині. Активне випомповування (effux) антибіотика з клітини за допомогою мембранних транспортерів 5. “Ізолювання” антибіотиків шляхом зв’язування з білками 6. Активування метаболічних шунтових шляхів (bypass) замість метаболічної ланки, яка інгібується антибіотиком У клітині можуть одночасно діяти два або декілька механізмів, що забезпечують стійкість до антибіотика 13
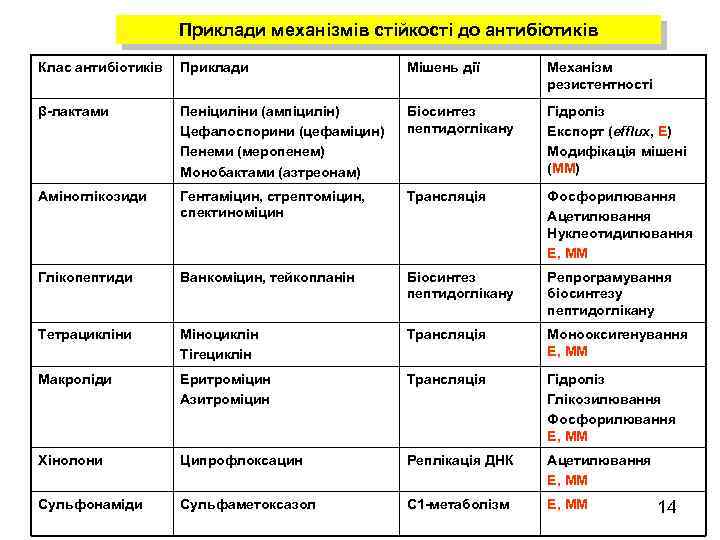
Приклади механізмів стійкості до антибіотиків Клас антибіотиків Приклади Мішень дії Механізм резистентності β-лактами Пеніциліни (ампіцилін) Цефалоспорини (цефаміцин) Пенеми (меропенем) Монобактами (азтреонам) Біосинтез пептидоглікану Гідроліз Експорт (efflux, Е) Модифікація мішені (ММ) Аміноглікозиди Гентаміцин, стрептоміцин, спектиноміцин Трансляція Фосфорилювання Ацетилювання Нуклеотидилювання Е, ММ Глікопептиди Ванкоміцин, тейкопланін Біосинтез пептидоглікану Репрограмування біосинтезу пептидоглікану Тетрацикліни Міноциклін Тігециклін Трансляція Монооксигенування Е, ММ Макроліди Еритроміцин Азитроміцин Трансляція Гідроліз Глікозилювання Фосфорилювання Е, ММ Хінолони Ципрофлоксацин Реплікація ДНК Ацетилювання Е, ММ Сульфонаміди Сульфаметоксазол С 1 -метаболізм Е, ММ 14
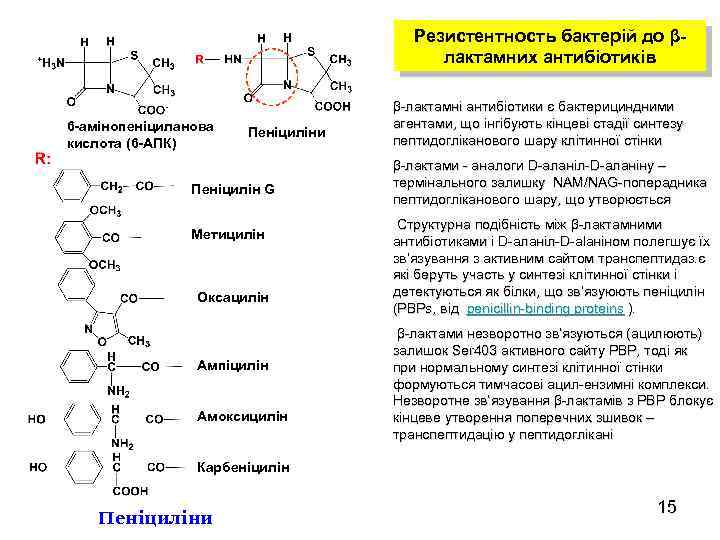
Резистентность бактерій до βлактамних антибіотиків 6 -амінопеніциланова кислота (6 -АПК) Пеніциліни Пеніцилін G Метицилін Оксацилін Ампіцилін Амоксицилін β-лактамні антибіотики є бактерициндними агентами, що інгібують кінцеві стадії синтезу пептидогліканового шару клітинної стінки β-лактами - аналоги D-aланіл-D-aланіну – термінального залишку NAM/NAG-поперадника пептидогліканового шару, що утворюється Структурна подібність між β-лактамними антибіотиками і D-aланіл-D-alaніном полегшує їх зв’язування з активним сайтом транспептидаз. є які беруть участь у синтезі клітинної стінки і детектуються як білки, що зв’язуюють пеніцилін (PBPs, від penicillin-binding proteins ). β-лактами незворотно зв’язуються (ацилюють) залишок Ser 403 активного сайту PBP, тоді як при нормальному синтезі клітинної стінки формуються тимчасові ацил-ензимні комплекси. Незворотне зв’язування β-лактамів з PBP блокує кінцеве утворення поперечних зшивок – транспептидацію у пептидоглікані Карбеніцилін Пеніциліни 15
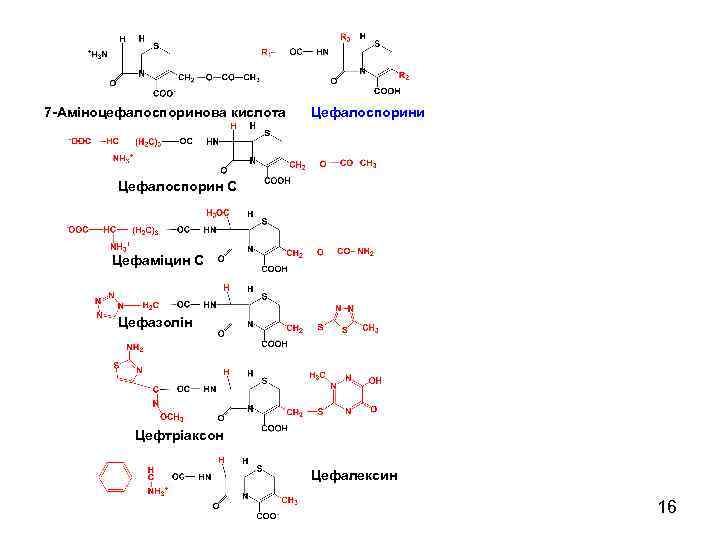
7 -Аміноцефалоспоринова кислота Цефалоспорини Цефалоспорин С Цефаміцин С Цефазолін Цефтріаксон Цефалексин 16
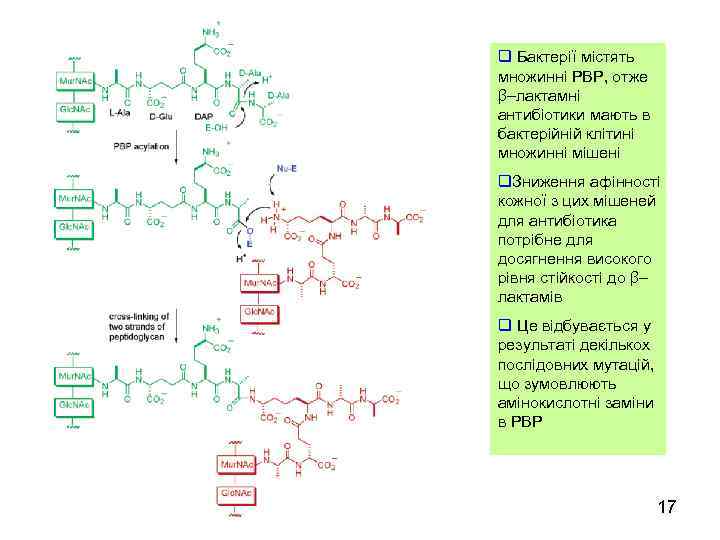
q Бактерії містять множинні PBP, отже β–лактамні антибіотики мають в бактерійній клітині множинні мішені q. Зниження афінності кожної з цих мішеней для антибіотика потрібне для досягнення високого рівня стійкості до β– лактамів q Це відбувається у результаті декількох послідовних мутацій, що зумовлюють амінокислотні заміни в PBP 17
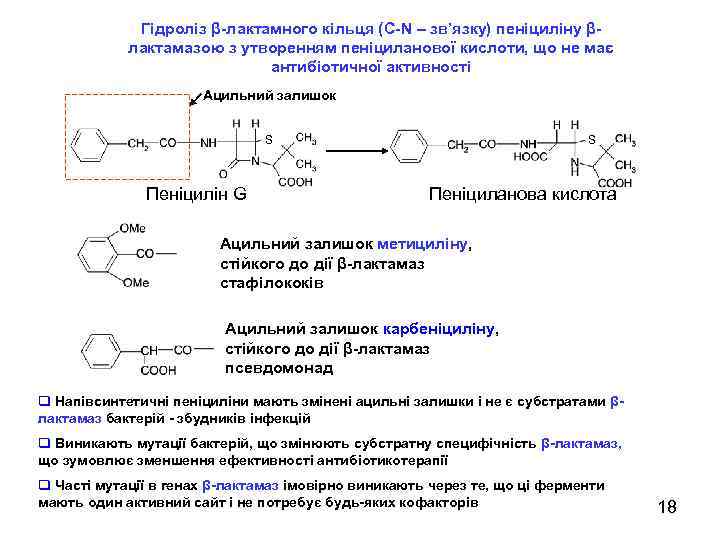
Гідроліз β-лактамного кільця (С-N – зв’язку) пеніциліну βлактамазою з утворенням пеніциланової кислоти, що не має антибіотичної активності Ацильний залишок S Пеніцилін G S Пеніциланова кислота Ацильний залишок метициліну, стійкого до дії β-лактамаз стафілококів Ацильний залишок карбеніциліну, стійкого до дії β-лактамаз псевдомонад q Напівсинтетичні пеніциліни мають змінені ацильні залишки і не є субстратами βлактамаз бактерій - збудників інфекцій q Виникають мутації бактерій, що змінюють субстратну специфічність β-лактамаз, що зумовлює зменшення ефективності антибіотикотерапії q Часті мутації в генах β-лактамаз імовірно виникають через те, що ці ферменти мають один активний сайт і не потребує будь-яких кофакторів 18
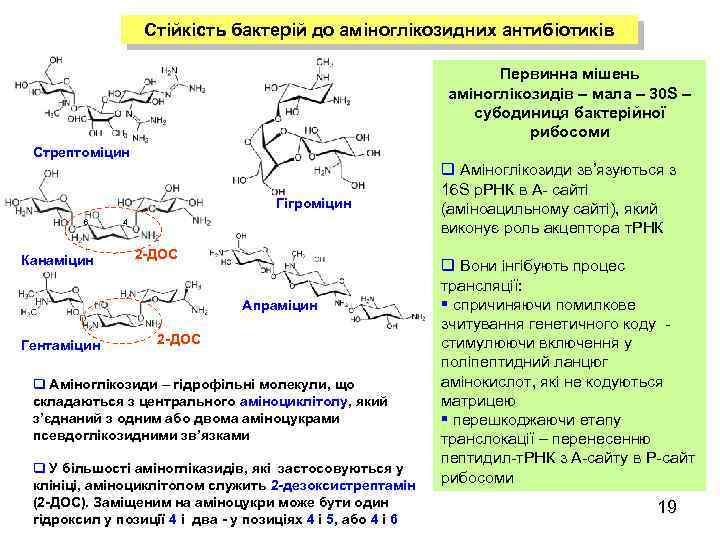
Стійкість бактерій до аміноглікозидних антибіотиків Первинна мішень аміноглікозидів – мала – 30 S – субодиниця бактерійної рибосоми Стрептоміцин Гігроміцин 6 Канаміцин 4 2 -ДОС Апраміцин Гентаміцин 2 -ДОС q Aміноглікозиди – гідрофільні молекули, що складаються з центрального аміноциклітолу, який з’єднаний з одним або двома аміноцукрами псевдоглікозидними зв’язками q У більшості аміногліказидів, які застосовуються у клініці, аміноциклітолом служить 2 -дезоксистрептамін (2 -ДОС). Заміщеним на аміноцукри може бути один гідроксил у позиції 4 і два - у позиціях 4 і 5, або 4 і 6 q Аміноглікозиди зв’язуються з 16 S р. РНК в A- сайті (аміноацильному сайті), який виконує роль акцептора т. РНК q Вони інгібують процес трансляції: § спричиняючи помилкове зчитування генетичного коду стимулюючи включення у поліпептидний ланцюг амінокислот, які не кодуються матрицею § перешкоджаючи етапу транслокації – перенесенню пептидил-т. РНК з А-сайту в Р-сайт рибосоми 19
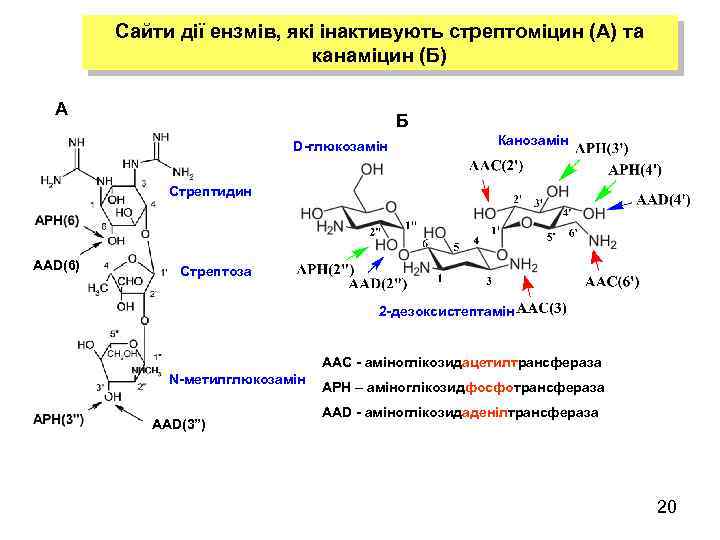
Сайти дії ензмів, які інактивують стрептоміцин (А) та канаміцин (Б) А Б D-глюкозамін Канозамін Стрептидин AAD(6) Стрептоза 2 -дезоксистептамін ААС - аміноглікозидацетилтрансфераза N-метилглюкозамін AAD(3”) APH – аміноглікозидфосфотрансфераза AAD - аміноглікозидаденілтрансфераза 20
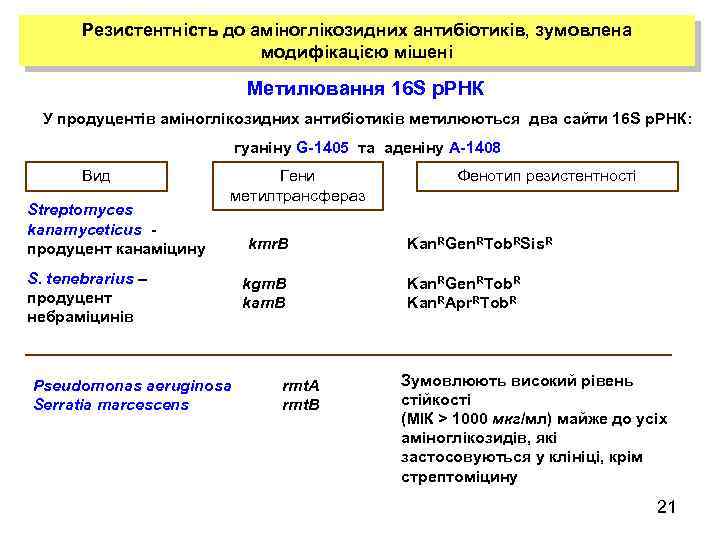
Резистентність до аміноглікозидних антибіотиків, зумовлена модифікацією мішені Метилювання 16 S р. РНК У продуцентів аміноглікозидних антибіотиків метилюються два сайти 16 S р. РНК: гуаніну G-1405 та аденіну А-1408 Вид Streptomyces kanamyceticus продуцент канаміцину Гени метилтрансфераз S. tenebrarius – продуцент небраміцинів Pseudomonas aeruginosa Serratia marcescens kmr. В kgm. B kam. B rmt. A rmt. B Фенотип резистентності Kan. RGen. RTob. RSis. R Kan. RGen. RTob. R Kan. RApr. RTob. R Зумовлюють високий рівень стійкості (MIК > 1000 мкг/мл) майже до усіх аміноглікозидів, які застосовуються у клініці, крім стрептоміцину 21
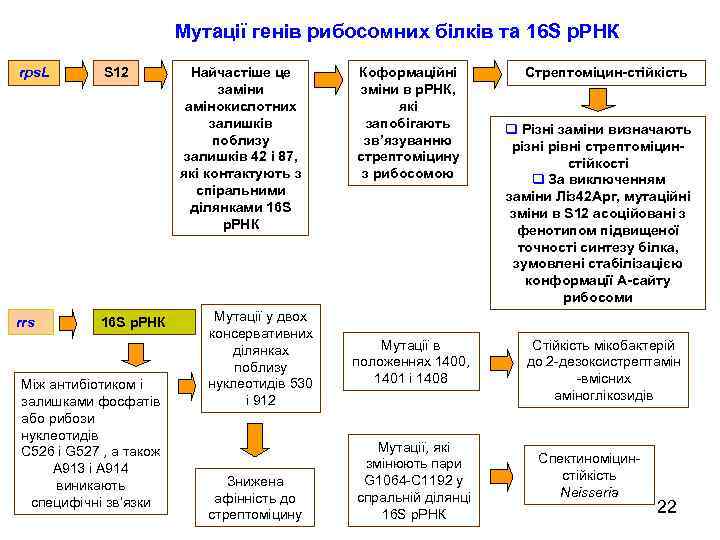
Мутації генів рибосомних білків та 16 S р. РНК rps. L rrs S 12 16 S р. РНК Між антибіотиком і залишками фосфатів або рибози нуклеотидів C 526 і G 527 , а також A 913 і A 914 виникають специфічні зв’язки Найчастіше це заміни амінокислотних залишків поблизу залишків 42 і 87, які контактують з спіральними ділянками 16 S р. РНК Мутації у двох консервативних ділянках поблизу нуклеотидів 530 і 912 Знижена афінність до стрептоміцину Коформаційні зміни в р. РНК, які запобігають зв’язуванню стрептоміцину з рибосомою Мутації в положеннях 1400, 1401 і 1408 Мутації, які змінюють пари G 1064 -C 1192 у спральній ділянці 16 S р. РНК Стрептоміцин-стійкість q Різні заміни визначають різні рівні стрептоміцинстійкості q За виключенням заміни Ліз 42 Арг, мутаційні зміни в S 12 асоційовані з фенотипом підвищеної точності синтезу білка, зумовлені стабілізацією конформації А-сайту рибосоми Стійкість мікобактерій до 2 -дезоксистрептамін -вмісних аміноглікозидів Спектиноміцинстійкість Neisseria 22
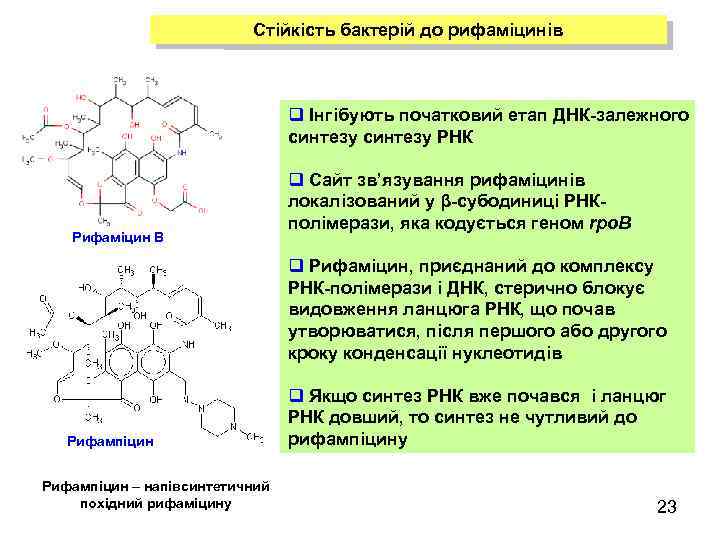
Стійкість бактерій до рифаміцинів q Інгібують початковий етап ДНК-залежного синтезу РНК Рифаміцин В q Сайт зв’язування рифаміцинів локалізований у β-субодиниці РНКполімерази, яка кодується геном rpo. B q Рифаміцин, приєднаний до комплексу РНК-полімерази і ДНК, стерично блокує видовження ланцюга РНК, що почав утворюватися, після першого або другого кроку конденсації нуклеотидів Рифампіцин – напівсинтетичний похідний рифаміцину q Якщо синтез РНК вже почався і ланцюг РНК довший, то синтез не чутливий до рифампіцину 23
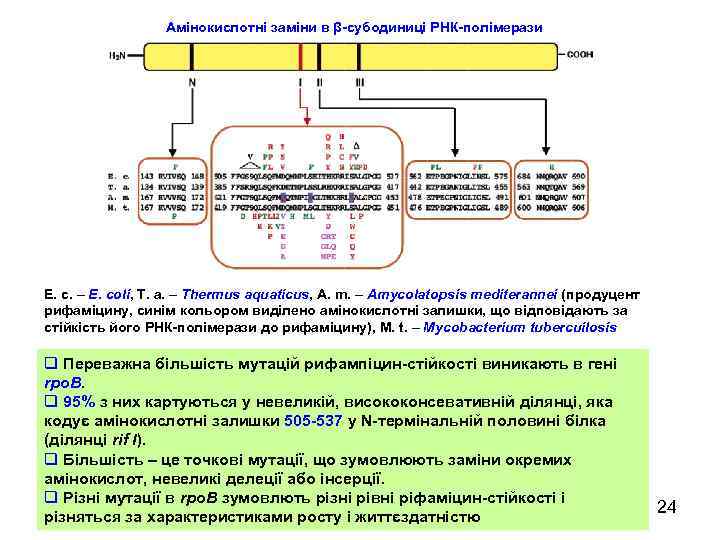
Амінокислотні заміни в β-субодиниці РНК-полімерази E. c. – E. coli, T. a. – Thermus aquaticus, A. m. – Amycolatopsis mediterannei (продуцент рифаміцину, синім кольором виділено амінокислотні залишки, що відповідають за стійкість його РНК-полімерази до рифаміцину), M. t. – Mycobacterium tubercuilosis q Переважна більшість мутацій рифампіцин-стійкості виникають в гені rpo. B. q 95% з них картуються у невеликій, висококонсевативній ділянці, яка кодує амінокислотні залишки 505 -537 у N-термінальній половині білка (ділянці rif I). q Більшість – це точкові мутації, що зумовлюють заміни окремих амінокислот, невеликі делеції або інсерції. q Різні мутації в rpo. B зумовлють різні рівні ріфаміцин-стійкості і різняться за характеристиками росту і життєздатністю 24
Стійкість бактерій до блеоміцину q Блеоміцин – протираковий глікопептидний антибіотик, який продукується Streptomyces verticillus q Блеоміцин викликає розриви в ланцюгах ДНК q Вважають, що блеоміцин зв’язує іони металів формуючи псевдоензим, який реагує з киснем, утворюючи супероксид- і гідроксидрадикали, що розщеплюють ДНК q Штам S. verticillus - продуцент блеоміцину, має два зчеплених гени блеоміцин-стійкості – blm. A та blm. B q Продукт гена blm. A – білок, що зв’язує блеоміцин, а гена blm. B – N-ацетилтрансфераза 25
MG_5.ppt