MG4.ppt
- Количество слайдов: 24

Мутанти бактерій і бактеріофагів “Біохімічні” мутанти 1

q “Біохімічні” мутанти – умовний термін, оскільки всі мутації змінюють біохімічні процеси в клітині q Вузьке значення цього терміну – мутанти зі змінами шляхів метаболізму: § мутанти, не здатні синтезувати певні продукти первинного метаболізму (ауксотрофи), або вторинного метаболізму (Ant-, Pig-) § мутанти зі змінами рівня синтезу певних метаболітів (надпродуценти) § мутанти зі зміненою здатністю до використання певних джерел живлення q Зазвичай бактерії дикого типу – прототрофи – здані рости на синтетичних (мінімальних) середовищах (МС), які зазвичай містять глюкозу як джерело вуглецю та неорганічні солі (джерела N, P, S, Mg тощо) q Ауксотрофи не ростуть на МС, оскільки не здатні синтезувати певні амінокислоти, нуклеотиди, вітаміни. Вони ростуть на повноцінних середовищах (ПС), які містять потрібні їм фактори росту у складі певних рослинних екстрактів, м’ясного бульйону, які додаються до ПС q Однак існують бактерії дикого типу, які є природними ауксотрофами, наприклад збудник чуми Yersinia pestis (не здатна синтезувати цистеїн, метіонін, фенілаланін, ізолейцин і валін). Молочнокислі бактерії позбавлені генів біосинтезу амінокислот q Існують бактерії зі зниженою здатністю до синтезу певних первинних метаболітів (наприклад, амінокислот). Для них характерний дуже слабкий ріст на МС. Такі штами називають leaky-ауксотрофами 2
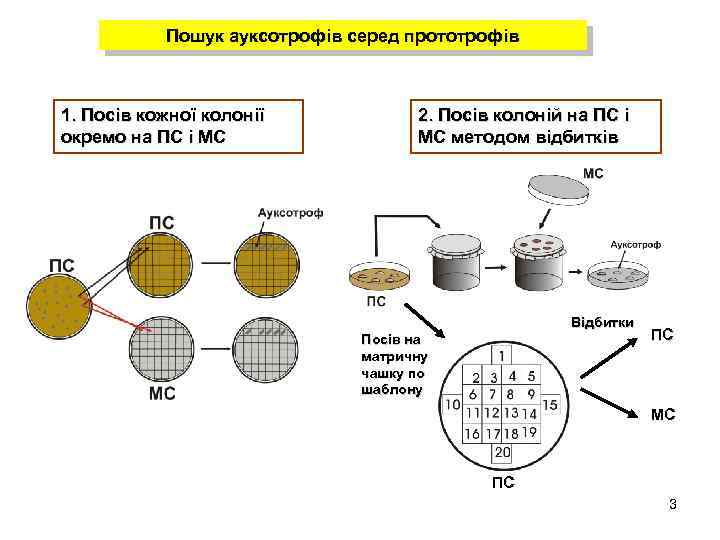
Пошук ауксотрофів серед прототрофів 1. Посів кожної колонії окремо на ПС і МС 2. Посів колоній на ПС і МС методом відбитків Відбитки Посів на матричну чашку по шаблону ПС МС ПС 3
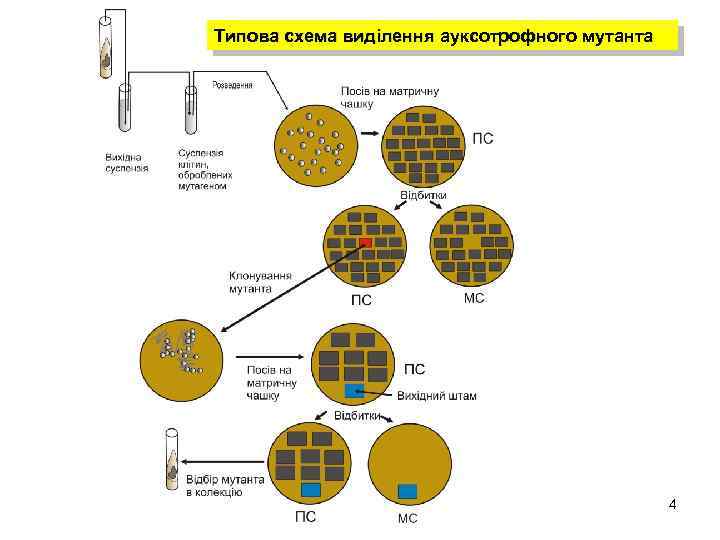
Типова схема виділення ауксотрофного мутанта 4
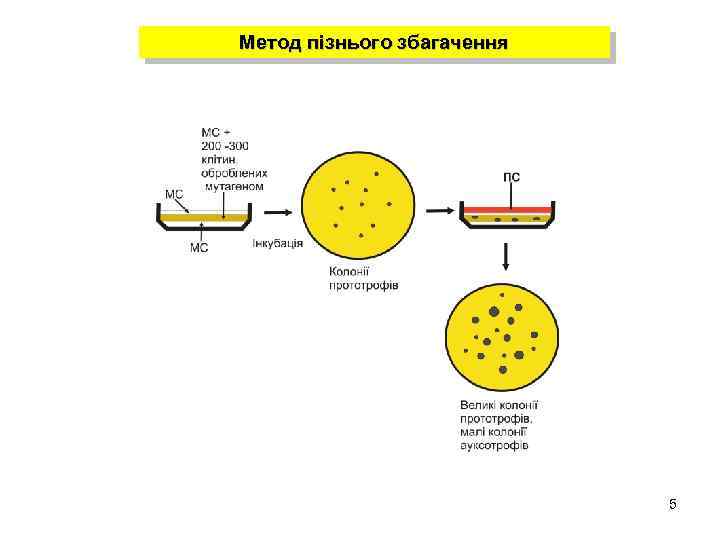
Метод пізнього збагачення 5
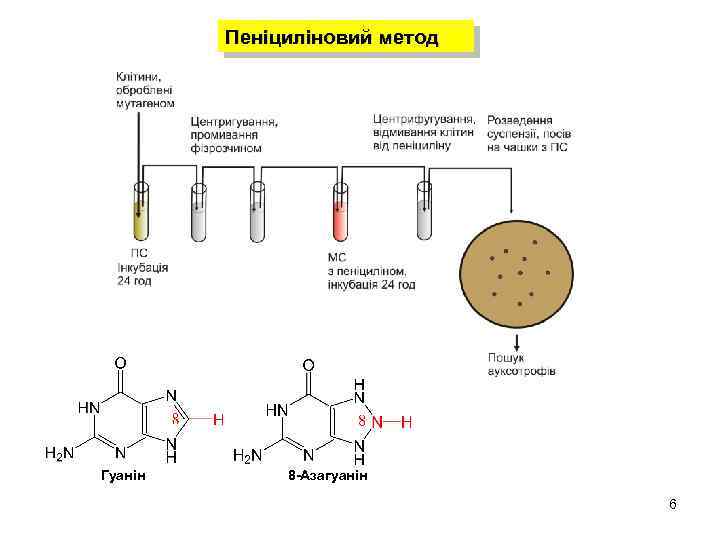
Пеніциліновий метод Гуанін 8 -Азагуанін 6
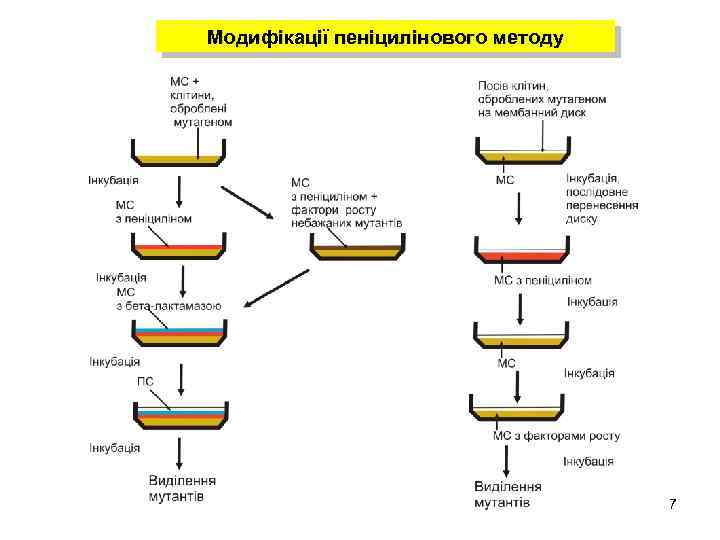
Модифікації пеніцилінового методу 7
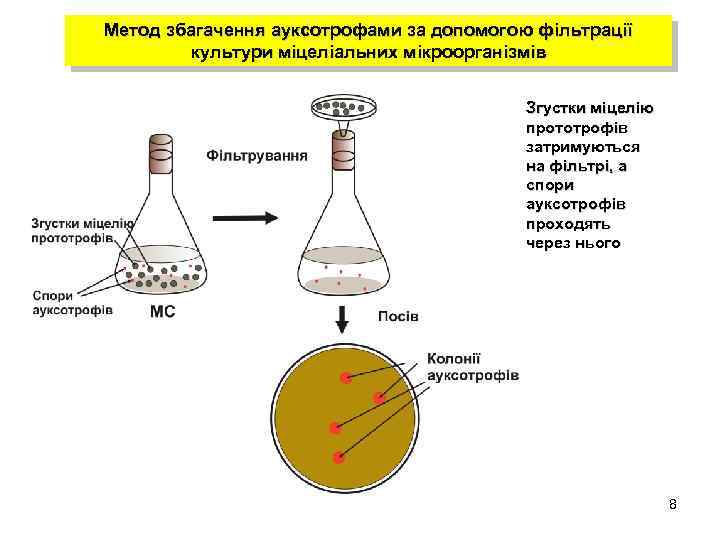
Метод збагачення ауксотрофами за допомогою фільтрації культури міцеліальних мікроорганізмів Згустки міцелію прототрофів затримуються на фільтрі, а спори ауксотрофів проходять через нього 8
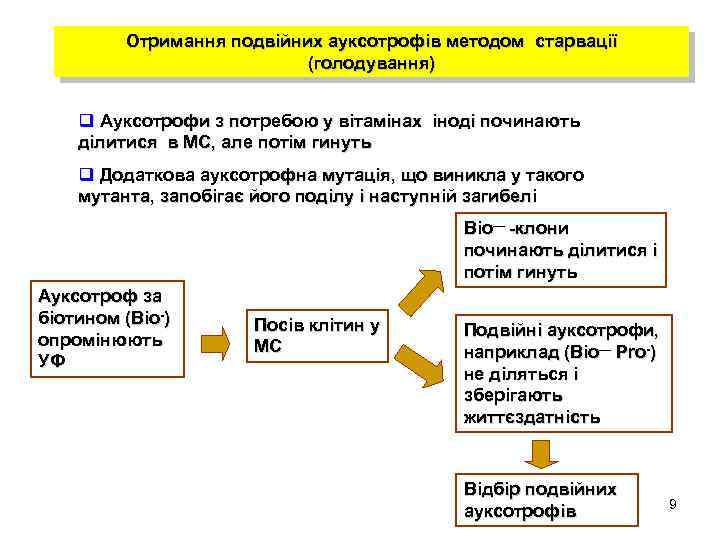
Отримання подвійних ауксотрофів методом старвації (голодування) q Ауксотрофи з потребою у вітамінах іноді починають ділитися в МС, але потім гинуть q Додаткова ауксотрофна мутація, що виникла у такого мутанта, запобігає його поділу і наступній загибелі Bio— -клони починають ділитися і потім гинуть Ауксотроф за біотином (Bio-) опромінюють УФ Посів клітин у МС Подвійні ауксотрофи, наприклад (Bio— Pro-) не діляться і зберігають життєздатність Відбір подвійних ауксотрофів 9
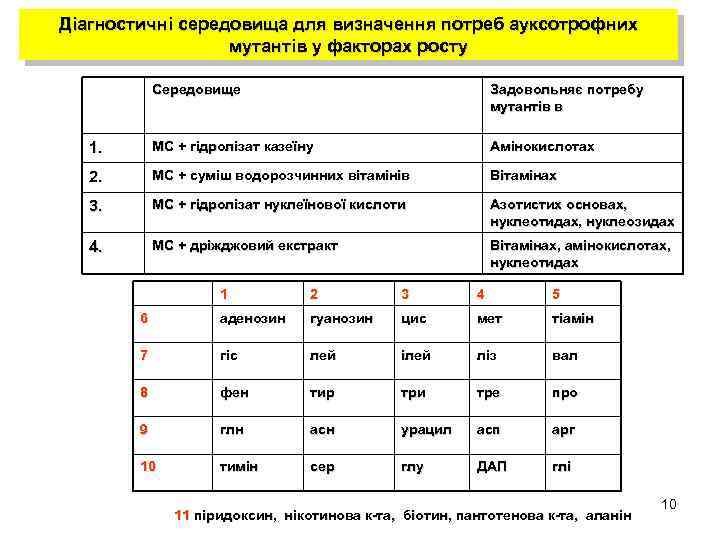
Діагностичні середовища для визначення потреб ауксотрофних мутантів у факторах росту Середовище Задовольняє потребу мутантів в 1. МС + гідролізат казеїну Амінокислотах 2. МС + суміш водорозчинних вітамінів Вітамінах 3. МС + гідролізат нуклеїнової кислоти Азотистих основах, нуклеотидах, нуклеозидах 4. МС + дріжджовий екстракт Вітамінах, амінокислотах, нуклеотидах 1 2 3 4 5 6 аденозин гуанозин цис мет тіамін 7 гіс лей ілей ліз вал 8 фен тир три тре про 9 глн асн урацил асп арг 10 тимін сер глу ДАП глі 11 піридоксин, нікотинова к-та, біотин, пантотенова к-та, аланін 10
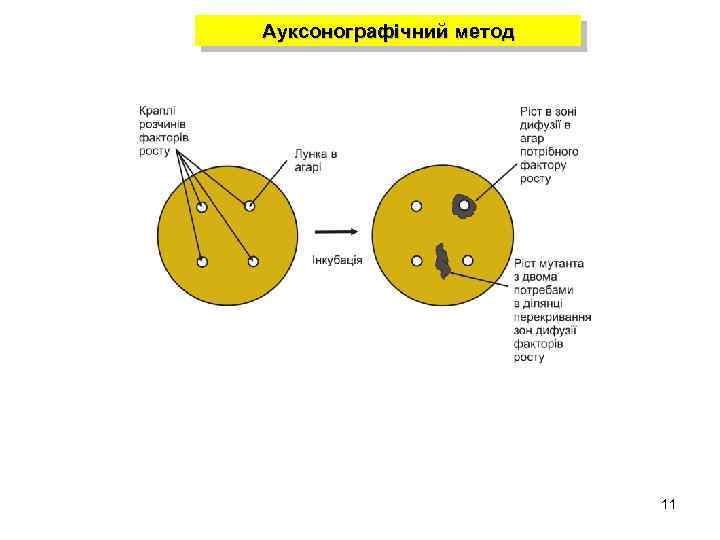
Ауксонографічний метод 11

Використання індикаторних чашок Індикаторні чашки містять середовище, на якому можна спостерігати зміну кольору колоній бактерій залежно від функціонування певних генів Типи індикаторних чашок Індикаторні чашки на зброджування вуглеводів Індикаторні чашки, що містять субстрати певних ензимів q Використовують відміни в р. Н між колоніями, які метаболізують певні вуглеводи і спирти, і тими, що не здатні до цього q Під дією ферментів, які утворює колонія, субстрати, розщеплюються з утворенням барвника q Клітини, що зброджують їх, знижують р. Н за рахунок утворення кислот q Якщо колонія продукує ензим, то вона забарвлена, якщо не продукує його – її колір не змінюється q У середовищах містяться сполуки, які змінюють свій колір при зміні р. Н Середовища: ЕМС, Мак-Конкі, з тетразолієм Середовища: з о-нітрофенілβ-D-галактозидом, з Х-Gal, Х 12 Gluc
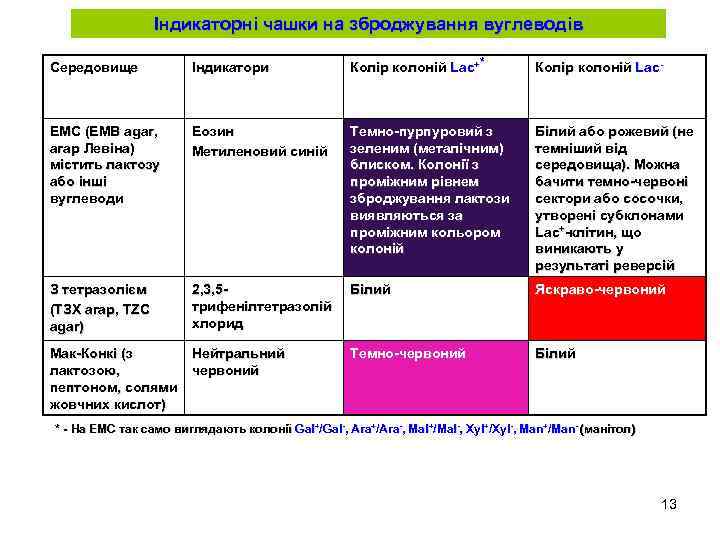
Індикаторні чашки на зброджування вуглеводів Середовище Індикатори Колір колоній Lac+* Колір колоній Lac- ЕМС (EMB agar, агар Левіна) містить лактозу або інші вуглеводи Еозин Метиленовий синій Темно-пурпуровий з зеленим (металічним) блиском. Колонії з проміжним рівнем зброджування лактози виявляються за проміжним кольором колоній Білий або рожевий (не темніший від середовища). Можна бачити темно-червоні сектори або сосочки, утворені субклонами Lac+-клітин, що виникають у результаті реверсій З тетразолієм (ТЗХ агар, TZC agar) 2, 3, 5 трифенілтетразолій хлорид Білий Яскраво-червоний Мак-Конкі (з лактозою, пептоном, солями жовчних кислот) Нейтральний червоний Темно-червоний Білий * - На ЕМС так само виглядають колонії Gal+/Gal-, Ara+/Ara-, Mal+/Mal-, Xyl+/Xyl-, Man+/Man- (манітол) 13
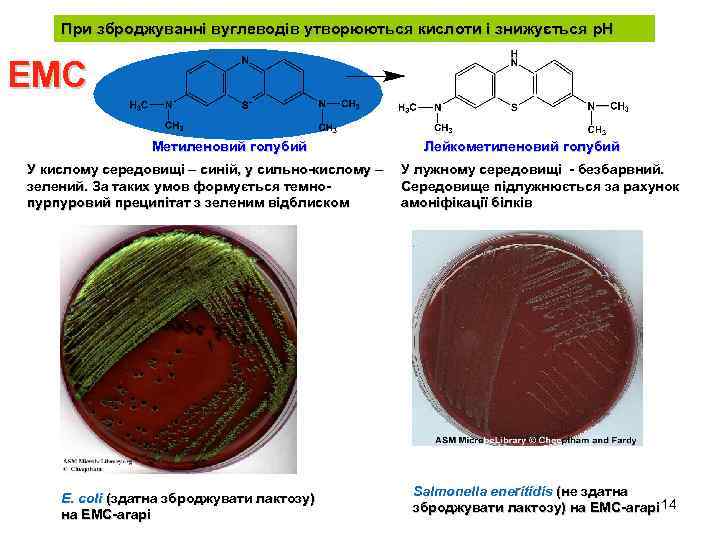
При зброджуванні вуглеводів утворюються кислоти і знижується р. Н ЕМС Метиленовий голубий У кислому середовищі – синій, у сильно-кислому – зелений. За таких умов формується темнопурпуровий преципітат з зеленим відблиском E. coli (здатна зброджувати лактозу) на ЕМС-агарі Лейкометиленовий голубий У лужному середовищі - безбарвний. Середовище підлужнюється за рахунок амоніфікації білків Salmonella eneritidis (не здатна зброджувати лактозу) на ЕМС-агарі 14
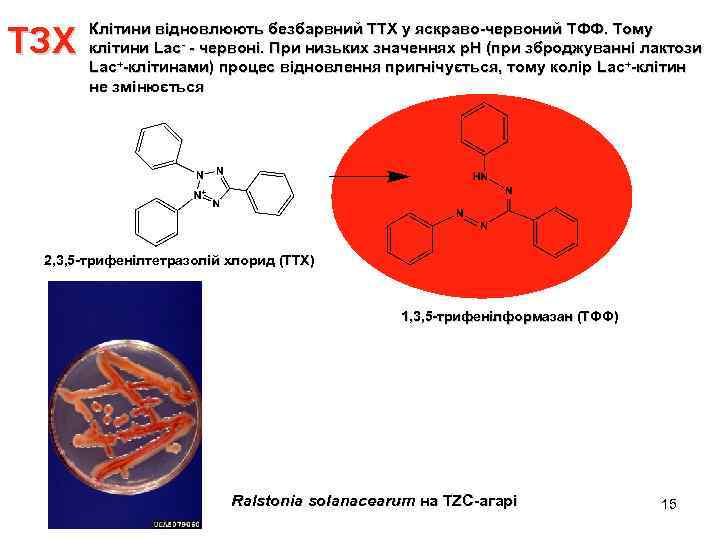
ТЗХ Клітини відновлюють безбарвний ТТХ у яскраво-червоний TФФ. Тому клітини Lac- - червоні. При низьких значеннях р. Н (при зброджуванні лактози Lac+-клітинами) процес відновлення пригнічується, тому колір Lac+-клітин не змінюється 2, 3, 5 -трифенілтетразолій хлорид (TTХ) 1, 3, 5 -трифенілформазан (TФФ) Ralstonia solanacearum на TZC-агарі 15
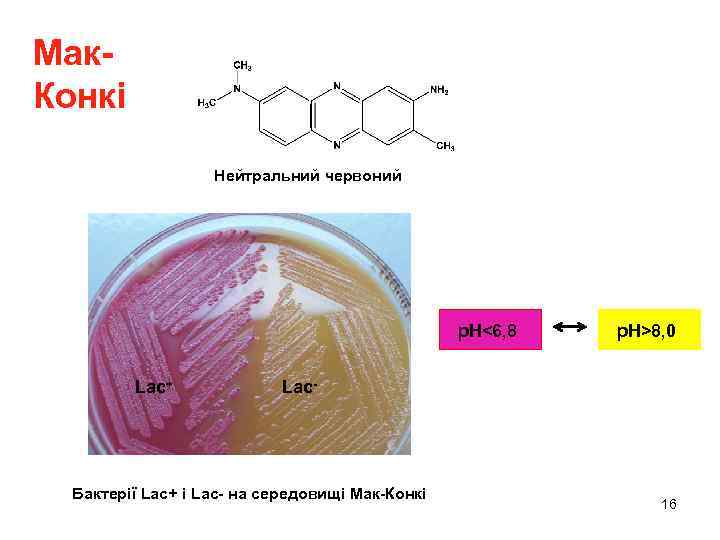
Мак. Конкі Нейтральний червоний p. H<6, 8 Lac+ p. H>8, 0 Lac- Бактерії Lac+ і Lac- на середовищі Мак-Конкі 16
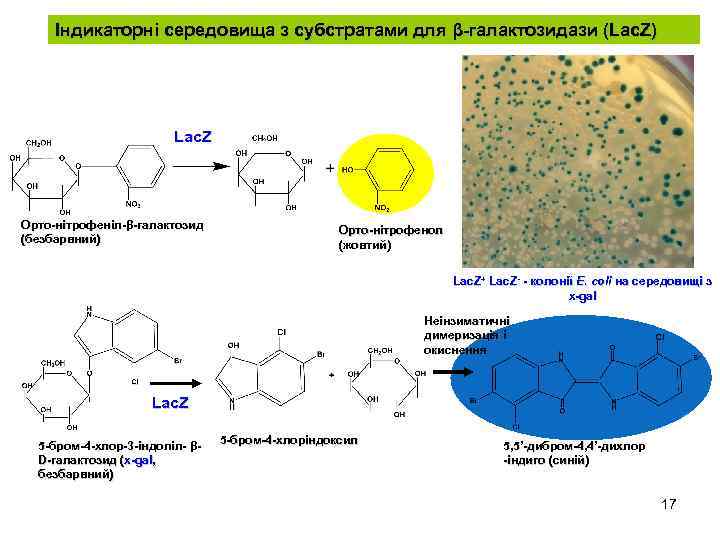
Індикаторні середовища з субстратами для β-галактозидази (Lac. Z) Lac. Z Орто-нітрофеніл-β-галактозид Орто-нітрофеніл-β (безбарвний) Орто-нітрофенол (жовтий) Lac. Z+ Lac. Z- - колонії E. coli на середовищі з x-gal Неінзиматичні димеризація і окиснення Lac. Z 5 -бром-4 -хлор-3 -індоліл- βD-галактозид (x-gal, безбарвний) 5 -бром-4 -хлоріндоксил 5, 5’-дибром-4, 4’-дихлор -індиго (синій) 17
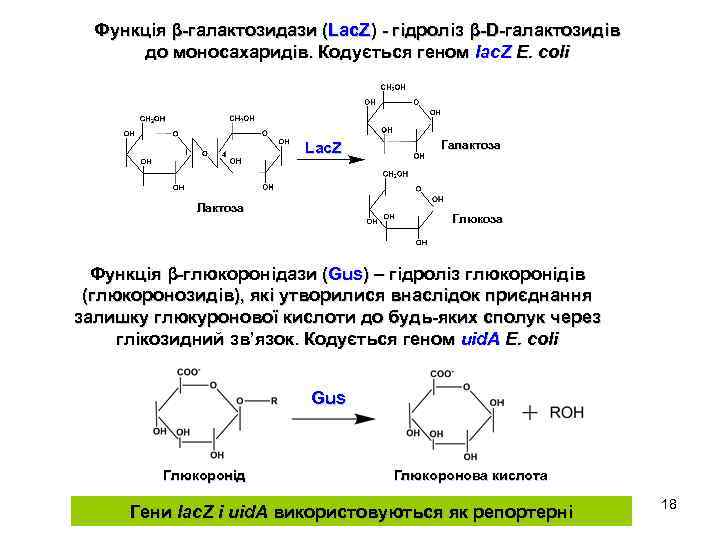
Функція β-галактозидази (Lac. Z) - гідроліз β-D-галактозидів до моносахаридів. Кодується геном lac. Z E. coli Lac. Z Лактоза Галактоза Глюкоза Функція β-глюкоронідази (Gus) – гідроліз глюкоронідів (глюкоронозидів), які утворилися внаслідок приєднання залишку глюкуронової кислоти до будь-яких сполук через глікозидний зв’язок. Кодується геном uid. A E. coli Gus Глюкоронід Глюкоронова кислота Гени lac. Z і uid. A використовуються як репортерні 18
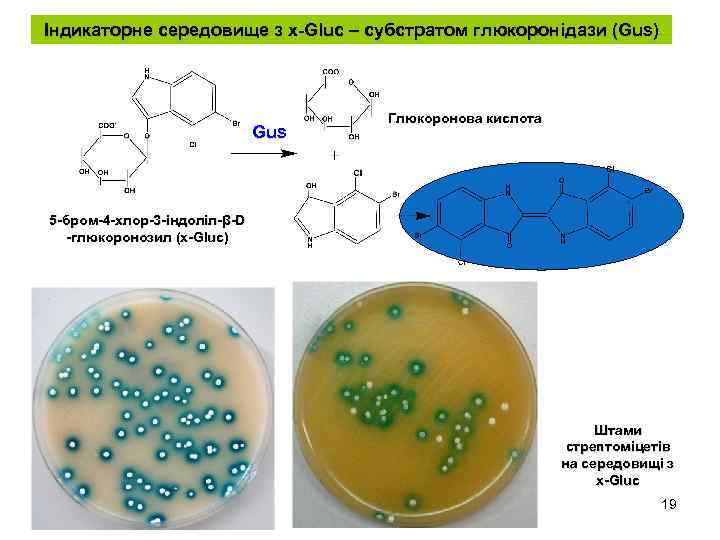
Індикаторне середовище з x-Gluc – субстратом глюкоронідази (Gus) Gus Глюкоронова кислота 5 -бром-4 -хлор-3 -індоліл-β-D -глюкоронозил (x-Gluc) Штами стрептоміцетів на середовищі з х-Gluc 19
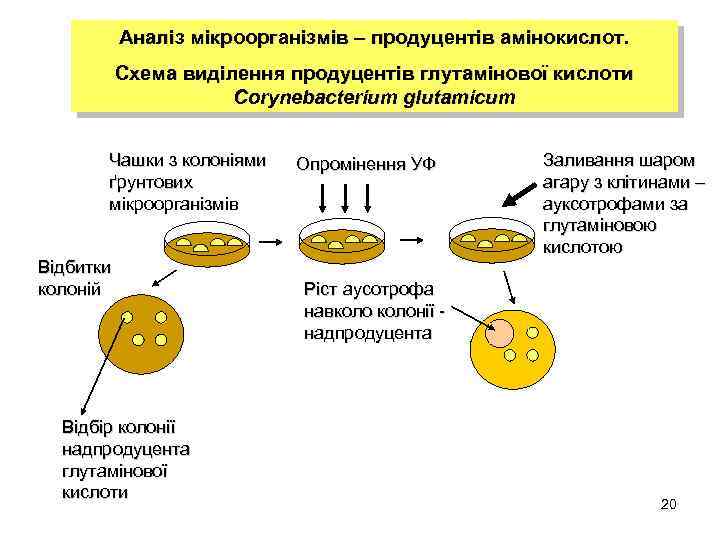
Аналіз мікроорганізмів – продуцентів амінокислот. Схема виділення продуцентів глутамінової кислоти Corynebacterium glutamicum Чашки з колоніями ґрунтових мікроорганізмів Відбитки колоній Відбір колонії надпродуцента глутамінової кислоти Опромінення УФ Заливання шаром агару з клітинами – ауксотрофами за глутаміновою кислотою Ріст аусотрофа навколонії надпродуцента 20
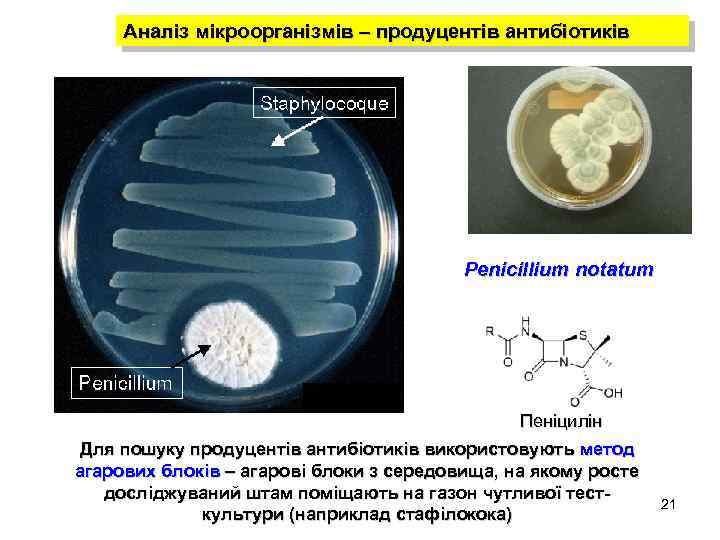
Аналіз мікроорганізмів – продуцентів антибіотиків Penicillium notatum Пеніцилін Для пошуку продуцентів антибіотиків використовують метод агарових блоків – агарові блоки з середовища, на якому росте досліджуваний штам поміщають на газон чутливої тесткультури (наприклад стафілокока) 21

Для аналізу антибіотичної активності великої кількості клонів важливо, що клони росли окремо і не обмінювалися своїми метаболітами, які виділяються у середовище У лунках імунологічного планшета вирощують окремі клони Клони оцінюють за індексами продуктивності (ІП) – відношенням діаметру зон пригнічення росту тест-культури до діаметру колонії 22
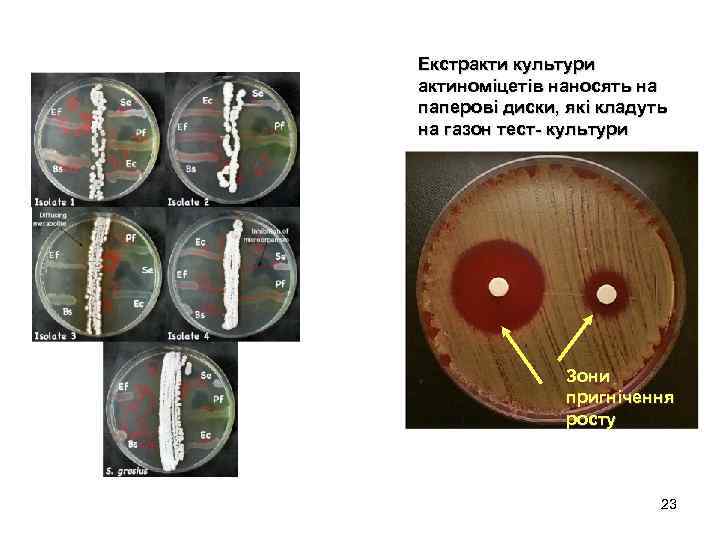
Екстракти культури актиноміцетів наносять на паперові диски, які кладуть на газон тест- культури Зони пригнічення росту 23
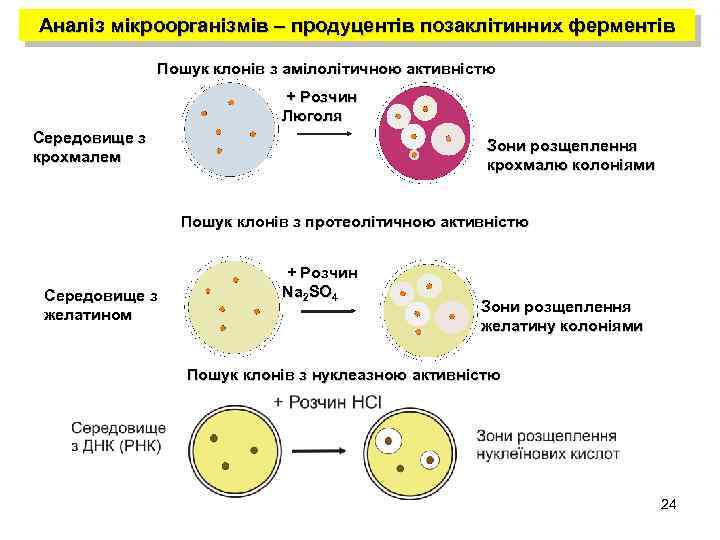
Аналіз мікроорганізмів – продуцентів позаклітинних ферментів Пошук клонів з амілолітичною активністю + Розчин Люголя Середовище з крохмалем Зони розщеплення крохмалю колоніями Пошук клонів з протеолітичною активністю Середовище з желатином + Розчин Na 2 SO 4 Зони розщеплення желатину колоніями Пошук клонів з нуклеазною активністю 24
MG4.ppt