763cf38f5438dba1e1595a21858588ab.ppt
- Количество слайдов: 24

МУНИЦИПАЛЬНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА № 25 ХУТОРА ПЕРВАЯ СИНЮХА ЛАБИНСКИЙ РАЙОН Учитель химии: Серикова Елена Владимировна

Среди металлов самый славный, Важнейший, древний элемент. В тяжелой индустрии - главный, Знаком с ним школьник и студент. Родился в огненной стихии, Расплав его течет рекой. Важнее нет в металлургии, Он нужен всей стране родной.


Цели : Образовательная: дать школьникам представления об элементе и простом веществе - железе, его физических и химических свойствах. Опираясь на знания зависимости свойств металлов от строения их атомов, предсказать характерные химические свойства железа. Воспитательная: формирование у учащихся самостоятельности в достижении поставленной цели, повышение творческой активности учащихся, познавательного интереса к химии; воспитание культуры общения. Развивающая: сформировать у учащихся познавательный интерес, умения логически рассуждать, обобщать и делать выводы из полученных знаний. Оборудование: мультимедийная установка; экран; на столах у учащихся – план урока; итоговое задание, написанное на листочках; штатив. Реактивы железный гвоздь, раствор хлорида меди (II). :

1. Порядковый номер железа 2. Номер периода 3. Номер группы 4. Электронную формулу атома 5. Степень окисления атома железа

Порядковый номер: 26 Период: IV Группа: VIII Электронная формула атома: 2 е, 8 е, 14 е, 2 е Степень окисления : +2, +3

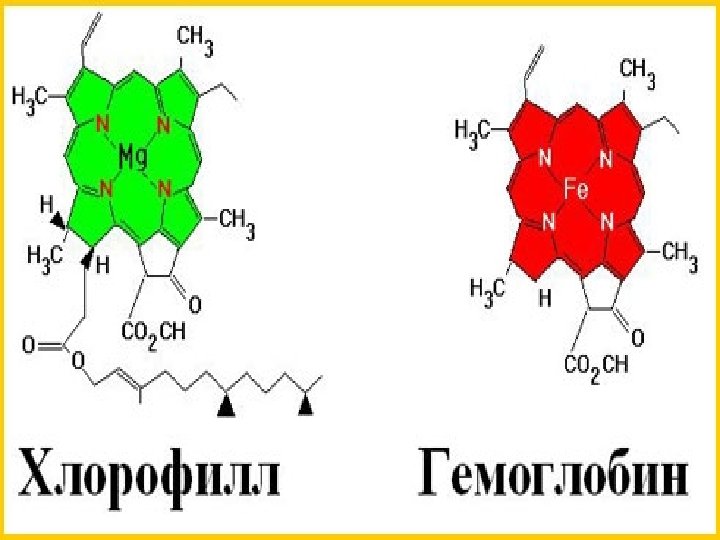
«Железо не только основа всего мира, самый главный металл окружающей нас природы, оно - основа культуры и промышленности, оно - орудие войны и мирного труда. И трудно во всей таблице Менделеева найти другой элемент, который был бы так связан с прошлыми, настоящими и будущими судьбами человечества» . Ферсман А. Е.


Кораблестроение Машиностроение Военное дело Строительство железных дорог

капуста



Цвет: серебристо-белый Твердость: твердый из-за примесей Пластичность: пластичный Плотность: 7, 87 г/см 3 Температура плавления: 1539 0 С)

Без нагревания При нагревании С кислородом во влажном воздухе образуется Fe 2 O 3 * n. H 2 O 3 Fe +2 O 2=Fe 2 O 3 * Fe. O C разбавленными HСl и H 2 SO 4 Fe +2 HCl = Fe. Cl 2 + H 2 0 + 2+ Fe + 2 H = Fe + H 20 С HNO 3 (разб. ) и H 2 SO 4 (разб. ) не реагирует C хлором 2 Fe +3 Cl 2=2 Fe. Cl 3 ( ОВР) C серой Fe +S= Fe. S ( ОВР) С солями Fe +Cu. Cl 2 = Fe. Cl 2 + Cu С водой 3 Fe +4 H 2 O = Fe 3 O 4 + 4 H 2 0 2+ 2+ 0 Fe + Cu = Fe +Cu C HNO 3 (конц. ) и H 2 SO 4 (конц. ) реагирует Fe + HNO 3 = Fe(NO 3) + Fe + H 2 SO 4= Fe SO 4 +

Fe 3 O 4 + CO = ? + ? Fe. O + C = ? + ? Fe. O + H 2 = ? + ? Fe 2 O 3 + Al = ? + ?

Д. И. Менделееев Эмиль Лекок де Буабодран. А. М. Бутлеров

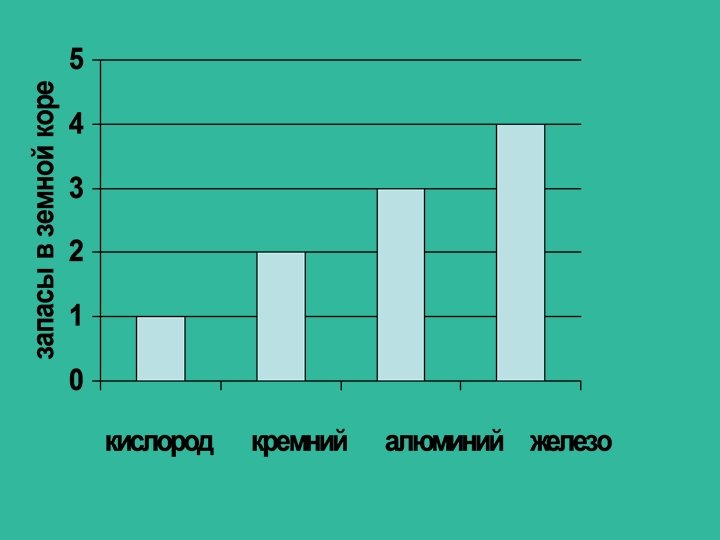
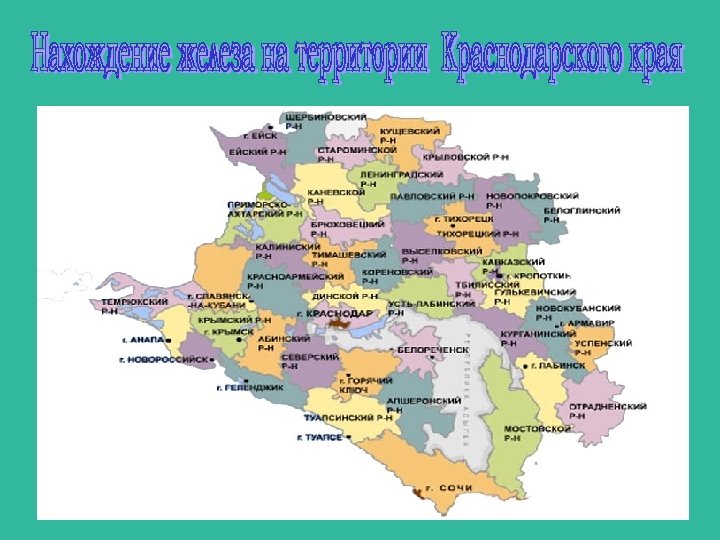
Есть ли в Краснодарском крае залежи железной руды? (Al, Fe) Да Железо в поэмах Гомера названо «многотрудным металлом» . Почему его так называли? (В древние времена добывание железа требовало больших затрат труда. Кроме того, железо труднее поддается плавке, чем медь) Где железо ржавеет быстрее: в Ялте, в Москве, в хуторе Первая Синюха? (В Москве, так как в городе много заводов, которые выделяют газы, способствующие тому, что на железе очень скоро появляется ржавчина. )

Как удалить ржавое пятно с белой ткани? (При помощи лимонной кислоты. Для этого концентрированный раствор этой кислоты нагревают до кипения и опускают в него ткань на 5 -6 мин, выжимают и прополаскивают в воде, а затем в слабом растворе соды. ) Одинаковы ли понятия железо и жесть? (Железо, покрытое оловом, называется жестью, оно более устойчиво, чем железо. ) Как доказать с помощью опыта, что железо более активно, чем медь? (В пробирку с раствором соли меди опускают железный гвоздь. )

Демонстративный опыт ( выполняет учащийся): взаимодействие железного гвоздя с хлоридом меди) Железо в химических реакциях проявляет свойства окислителя или восстановителя? Восстановителя

763cf38f5438dba1e1595a21858588ab.ppt