TED.ppt
- Количество слайдов: 8

Муниципальное образовательное учреждение «Средняя общеобразовательная школа № 16» города Вологды Теория электролитической диссоциации Кузнецова Ирина Владимировна, учитель химии

Электролитическая диссоциация – процесс распада электролита на ионы при растворении его в воде или расплавлении 1887 г Сванте Аррениус (швед. ) – сформулировал основные положения теории электролитической диссоциации

Основные положения современной ТЭД 1. 2. 3. 4. 5. 6. 7. Электролиты- сложные вещества, водные растворы или расплавы которых проводят эклектический ток; Электролиты распадаются на положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы); Наиболее легко диссоциируют вещества с ионной связью, процесс диссоциации веществ с ковалентной полярной связью проходит через гидратацию (процесс присоединения диполей воды) и последующую ионизацию частиц; Причиной диссоциации электролитов в водных растворах является взаимодействие с молекулами полярного растворителя-воды и образованием гидратированных ионов (ионы окруженные диполями воды); Раствор электролита суммарно нейтрален, так как сумма положительных и отрицательных зарядов равны Электролиты делятся на сильные и слабые. Сильные электролиты диссоциируют практически необратимо. Диссоциация слабых – процесс обратимый. Обратный процесс называется ассоциация (молизация); Под действием электрического тока катионы движутся к катоду, а анионы к аноду
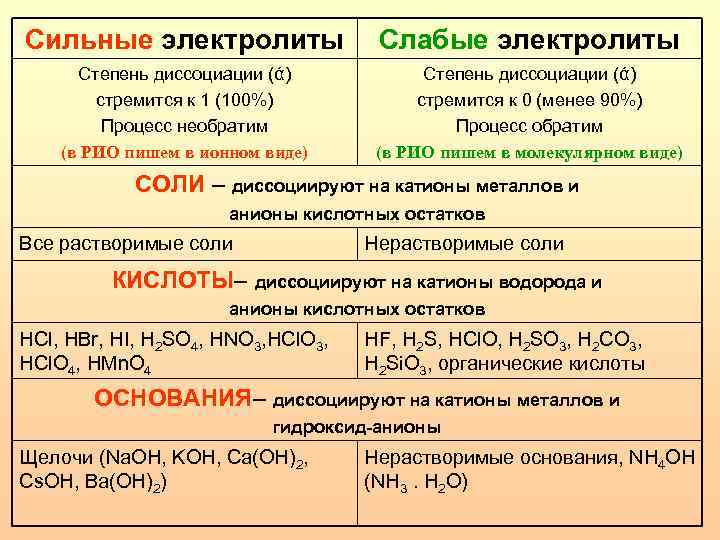
Сильные электролиты Слабые электролиты Степень диссоциации (ά) стремится к 1 (100%) Процесс необратим (в РИО пишем в ионном виде) Степень диссоциации (ά) стремится к 0 (менее 90%) Процесс обратим (в РИО пишем в молекулярном виде) СОЛИ – диссоциируют на катионы металлов и анионы кислотных остатков Все растворимые соли Нерастворимые соли КИСЛОТЫ– диссоциируют на катионы водорода и анионы кислотных остатков HCl, HBr, HI, H 2 SO 4, HNO 3, HCl. O 3, HCl. O 4, HMn. O 4 HF, H 2 S, HCl. O, H 2 SO 3, H 2 CO 3, H 2 Si. O 3, органические кислоты ОСНОВАНИЯ– диссоциируют на катионы металлов и гидроксид-анионы Щелочи (Na. OH, KOH, Ca(OH)2, Cs. OH, Ba(OH)2) Нерастворимые основания, NH 4 OH (NH 3. H 2 O)

Из приведенного перечня веществ выберите электролиты и напишите возможные уравнения диссоциации SО 2, Na. OH, Mg, HBr, СО 2, Ag. NO 3, Сu, N 2, CH 3 COOH H 2, Fe. Cl 3, Н 2 О, Cu(NO 3)2, Al, Na 2 CО 3, HCOOH, HCl, Na 2 O, C 6 H 6, Са. Вг 2, I 2, Cu(OH)2, HI, Cu. O, Сu. Сl 2, Zn, Fe(NO 3)2, Na. Cl, Zn. Cl 2, CH 3 CHO, Fe(OH)2, Na. NO 3.

Закончите уравнения реакций: Напишите молекулярные, полные и сокращенные ионные уравнения. а) Na. OH + НСI → ж) HCl + Са. СОз → б) HCl + Mg → з) HCl + Ag. NO 3 → в) Аl(ОН)3 + ЗНСl → и) Ca. Cl 2 + Na 2 CO 3 → г) Na. OH + СО 2 → к) H 2 SO 4 + Fe → д) КОН + Сu. СI 2 → л) Cu. Cl 2 + Ca(OH)2 → е) H 2 SO 4 + Cu. O → м) H 3 PO 4 + Li. OH →

По сокращенному ионному уравнению напишите молекулярное уравнение реакции Cu 2+ + 2 OH– = Cu(OH)2 Al 2 O 3 + 6 H+ = 2 Al 3+ + 3 H 2 O. S 2– + 2 H+ = H 2 S Ag+ + Cl– = Ag. Cl , Сa. CO 3 + Cu 2+ + H 2 O = Cu(OH)2+Ca 2++CO 2

СПАСИБО за внимание!!!
TED.ppt