аминокислоты.ppt
- Количество слайдов: 21

Московский государственный медико-стоматологический университет АМИНОКИСЛОТЫ Кафедра общей и биоорганической химии
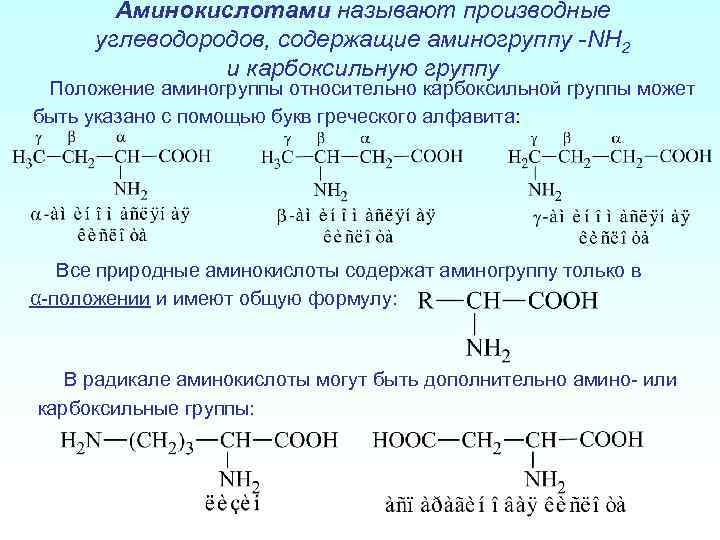
Аминокислотами называют производные углеводородов, содержащие аминогруппу -NH 2 и карбоксильную группу Положение аминогруппы относительно карбоксильной группы может быть указано с помощью букв греческого алфавита: Все природные аминокислоты содержат аминогруппу только в α-положении и имеют общую формулу: В радикале аминокислоты могут быть дополнительно амино- или карбоксильные группы:
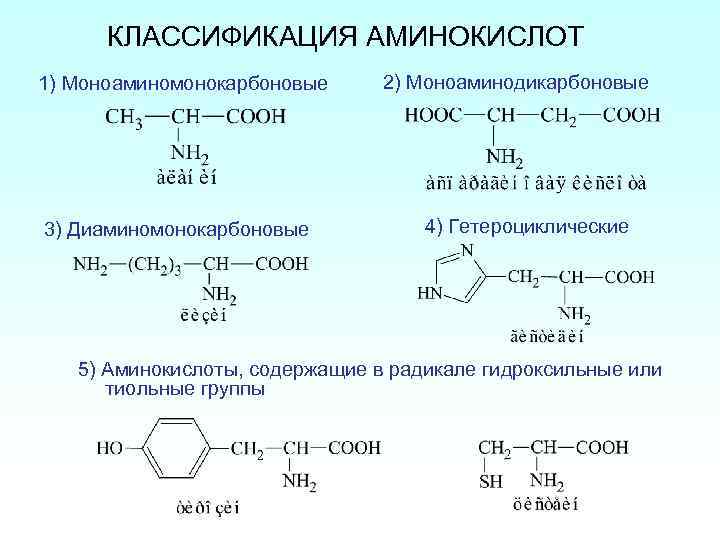
КЛАССИФИКАЦИЯ АМИНОКИСЛОТ 1) Моноаминомонокарбоновые 3) Диаминомонокарбоновые 2) Моноаминодикарбоновые 4) Гетероциклические 5) Аминокислоты, содержащие в радикале гидроксильные или тиольные группы

СТЕРЕОИЗОМЕРИЯ АМИНОКИСЛОТ Все природные α-аминокислоты, кроме глицина (NH 2 COOH), содержат один, а некоторые и два асимметрических центра. Стереоизомеры α-аминокислот выводят из D- и L-глицериновых альдегидов: Иногда в качестве стереохимического эталона используют серин:
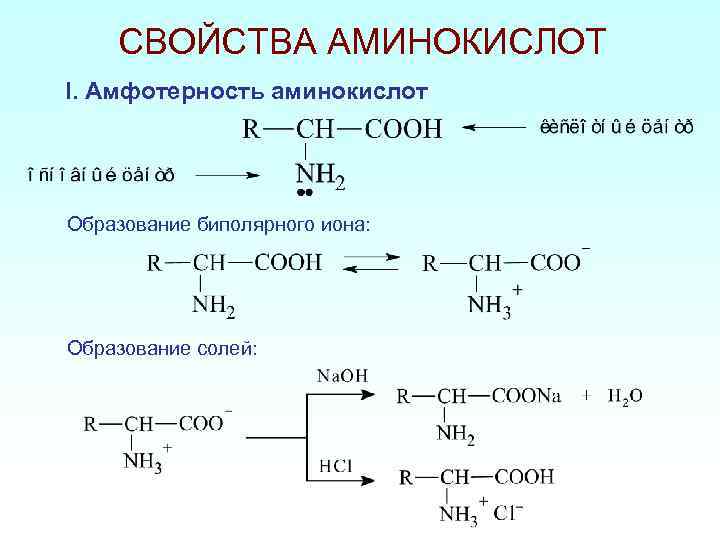
СВОЙСТВА АМИНОКИСЛОТ I. Амфотерность аминокислот Образование биполярного иона: Образование солей:
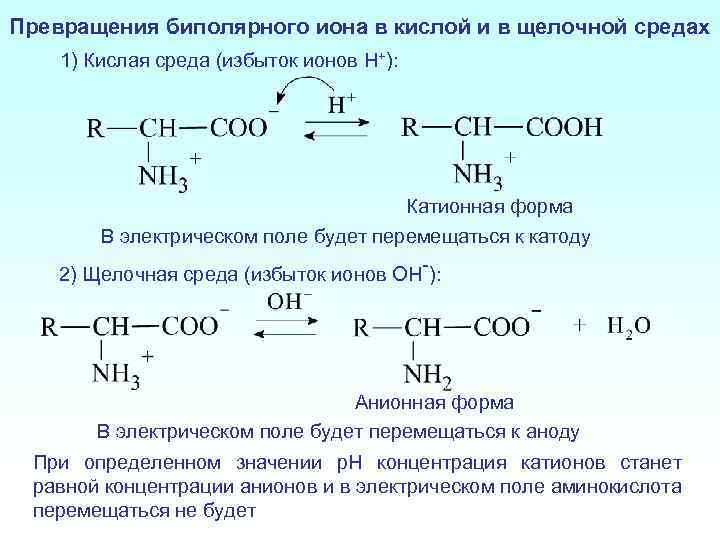
Превращения биполярного иона в кислой и в щелочной средах 1) Кислая среда (избыток ионов H+): Катионная форма В электрическом поле будет перемещаться к катоду 2) Щелочная среда (избыток ионов OH-): Анионная форма В электрическом поле будет перемещаться к аноду При определенном значении p. H концентрация катионов станет равной концентрации анионов и в электрическом поле аминокислота перемещаться не будет
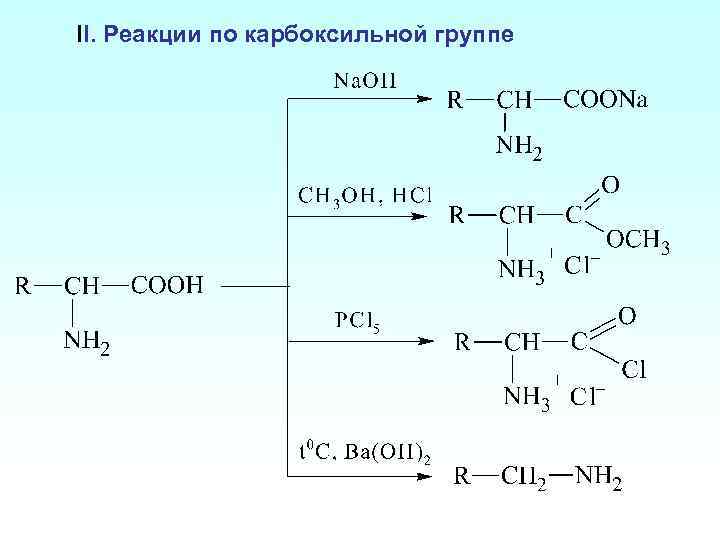
II. Реакции по карбоксильной группе
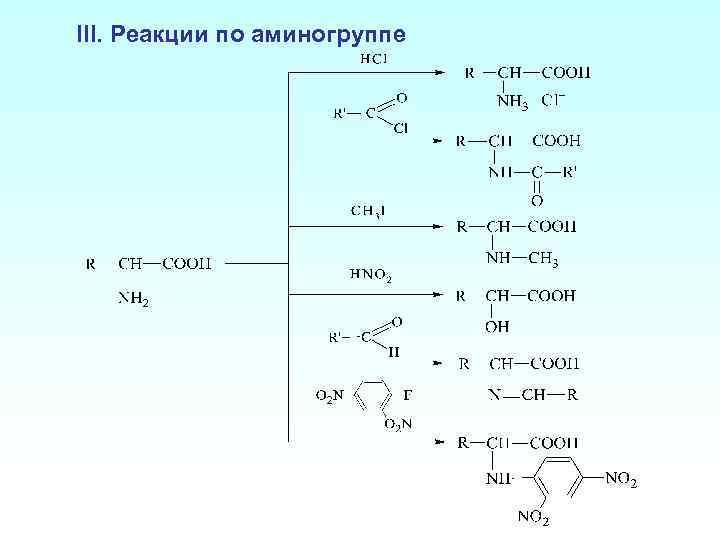
III. Реакции по аминогруппе
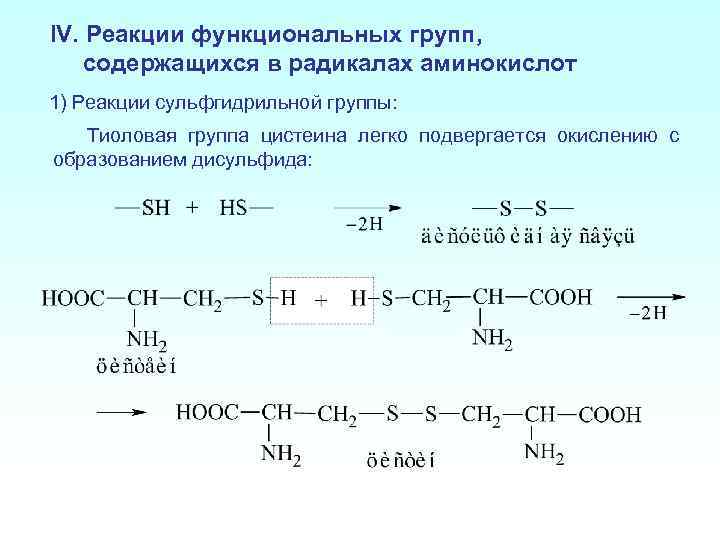
IV. Реакции функциональных групп, содержащихся в радикалах аминокислот 1) Реакции сульфгидрильной группы: Тиоловая группа цистеина легко подвергается окислению с образованием дисульфида:
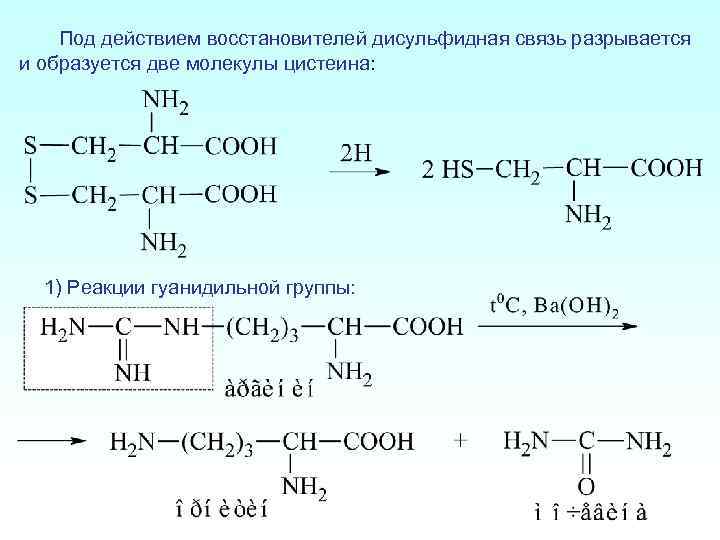
Под действием восстановителей дисульфидная связь разрывается и образуется две молекулы цистеина: 1) Реакции гуанидильной группы:
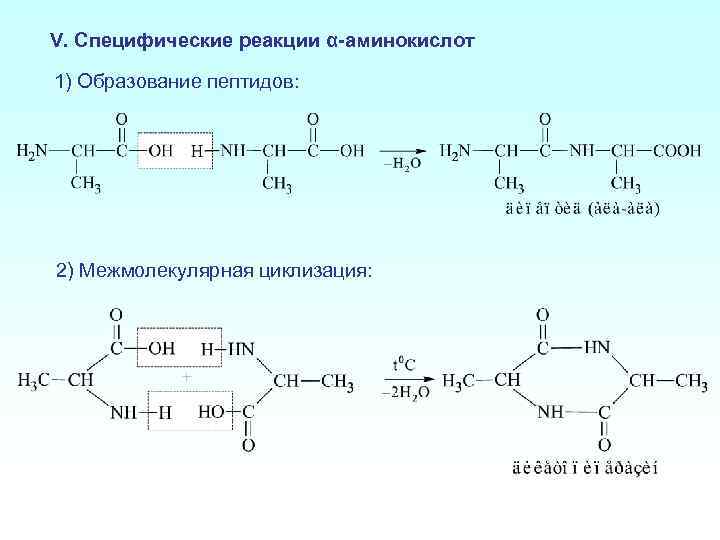
V. Специфические реакции α-аминокислот 1) Образование пептидов: 2) Межмолекулярная циклизация:

Реакции аминокислот in vivo I. Дезаминирование 1) Неокислительное дезаминирование: 2) Окислительное дезаминирование: Реакции дезаминирования позволяют организму удалять избыток аминокислот
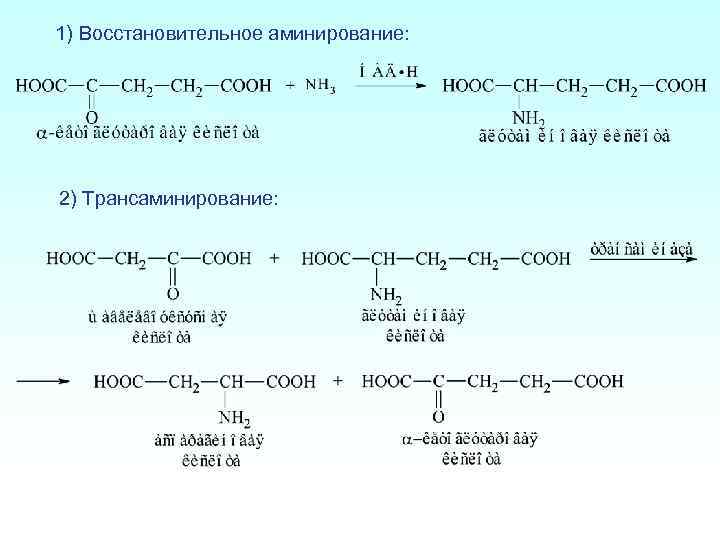
1) Восстановительное аминирование: 2) Трансаминирование:
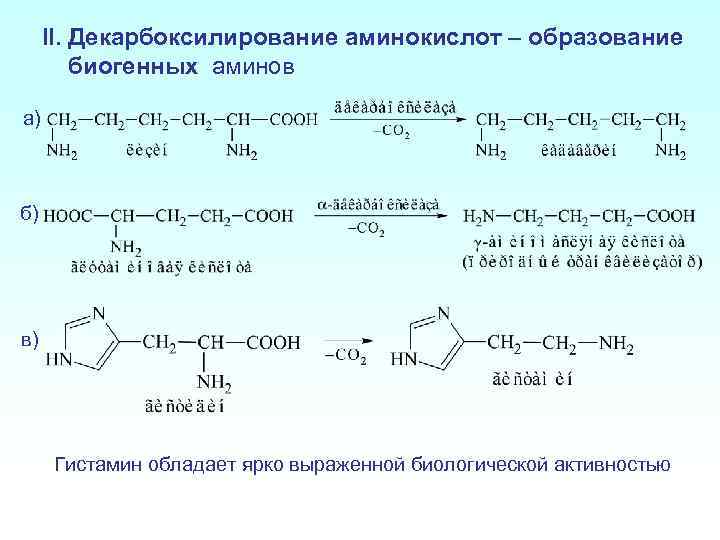
II. Декарбоксилирование аминокислот – образование биогенных аминов а) б) в) Гистамин обладает ярко выраженной биологической активностью
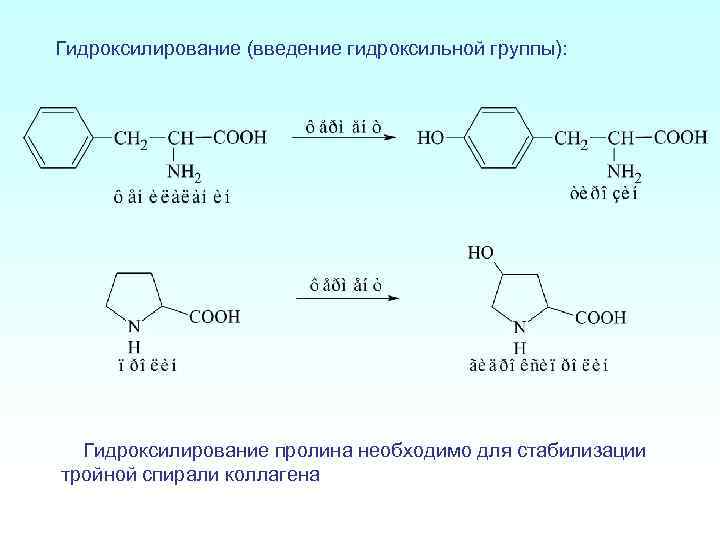
Гидроксилирование (введение гидроксильной группы): Гидроксилирование пролина необходимо для стабилизации тройной спирали коллагена

ПЕПТИДЫ Реакция конденсации, протекающая между аминогруппой одной кислоты и карбоксильной группой другой. В результате образуется полипептид: Пептиды делят на олигопептиды (содержат до 10 аминокислотных остатков) и полипептиды. Полипептиды, содержащие более 50 аминокислотных остатков называют белками.
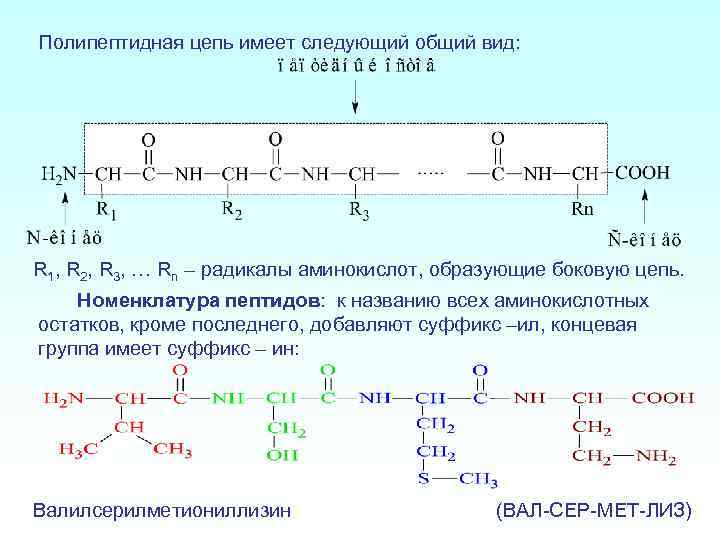
Полипептидная цепь имеет следующий общий вид: R 1, R 2, R 3, … Rn – радикалы аминокислот, образующие боковую цепь. Номенклатура пептидов: к названию всех аминокислотных остатков, кроме последнего, добавляют суффикс –ил, концевая группа имеет суффикс – ин: Валилсерилметиониллизин (ВАЛ-СЕР-МЕТ-ЛИЗ)

Изоэлектрическая точка пептидов (ИЭТ) Для определения области p. H, в которой может находиться ИЭТ исследуемого пептида, достаточно сравнить число свободных амино- и карбоксильных групп, включая N- и С-концевые группы. Если число аминогрупп превышает число карбоксильных групп, то ИЭТ пептида будет находиться в щелочной области (p. H > 7). Если число карбоксильных групп превышает число аминогрупп, то ИЭТ пептида будет находиться в кислой области (p. H < 7). Например: ФЕН – АСП – ЦИС ИЭТ в кислой среде p. I = p. H < 7
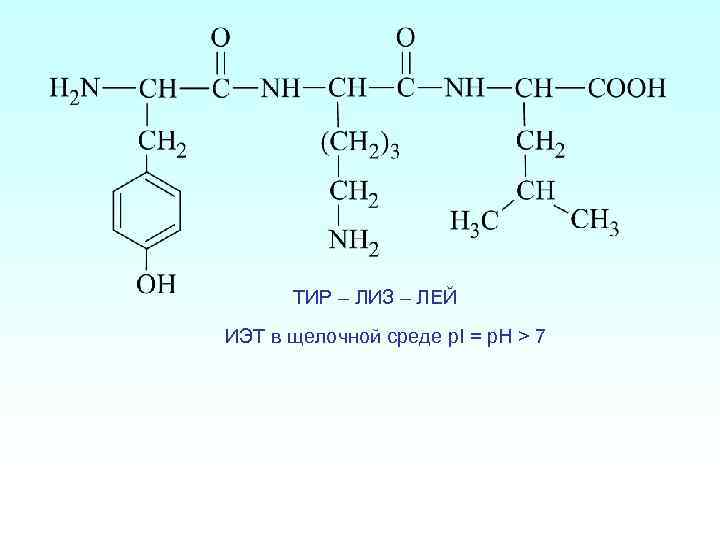
ТИР – ЛИЗ – ЛЕЙ ИЭТ в щелочной среде p. I = p. H > 7
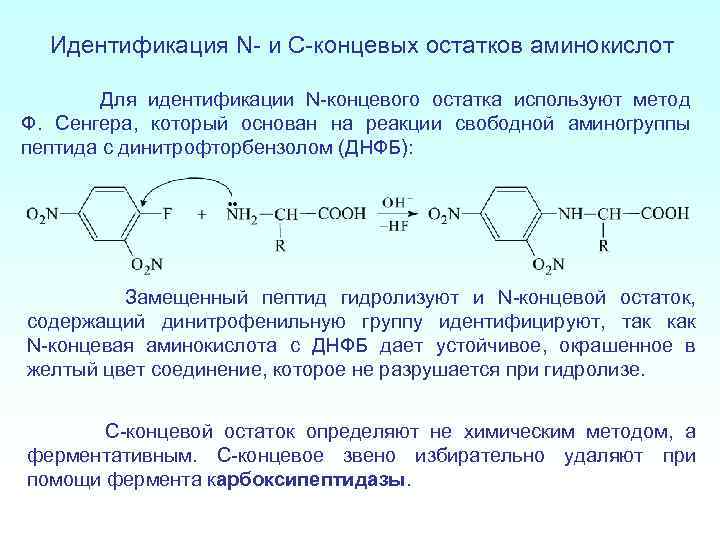
Идентификация N- и C-концевых остатков аминокислот Для идентификации N-концевого остатка используют метод Ф. Сенгера, который основан на реакции свободной аминогруппы пептида с динитрофторбензолом (ДНФБ): Замещенный пептид гидролизуют и N-концевой остаток, содержащий динитрофенильную группу идентифицируют, так как N-концевая аминокислота с ДНФБ дает устойчивое, окрашенное в желтый цвет соединение, которое не разрушается при гидролизе. С-концевой остаток определяют не химическим методом, а ферментативным. С-концевое звено избирательно удаляют при помощи фермента карбоксипептидазы.

аминокислоты.ppt