Художественное материаловедение-часть1.pptx
- Количество слайдов: 58

Московский государственный горный университет Кафедра «Технология художественной обработки материалов» Павлов Ю. А. Художественное материаловедение Часть 1 (Введение, глаы 1 – 3) Презентация лекционного курса для студентов (5 семестр) Москва 2014


Цель изучения курса дисциплины – получение базовых теоретических знаний по прикладным разделам материаловедения для обоснованного выбора вида материала заготовки и инструмента при изготовлении декоративно художественных и ювелирных изделий. Основными задачами дисциплины являются: • ознакомление с основными понятиями и определениями в области прикладного материаловедения; • изучение структуры и общих физико химических свойств материалов для камнеобрабатывающего, гранильного и ювелирного производств; • изучение структуры, свойств и классификационных признаков сплавов чёрных и цветных металлов для изготовления декоративно художественных изделий; • изучение состава и свойств сплавов драгоценных металлов; • систематизация минералогического определения свойств и классификаций цветных камней; • изучение свойств и классификаций облицовочных и декоративных камней; • изучение состава, структуры и классификации инструментальных материалов для обработки металлов и камней.

Дисциплины, для которых данный курс является предшествующим: Б. 2. Математический и естественнонаучный цикл. Б. 2. 2. Вариативная часть, в т. ч. дисциплины по выбору студента: «Кристаллофизика самоцветов» , «Основы физической химии» и «Физика и применение сверхтвёрдых материалов» . Профиль 1: «Месторождения и оценка декоративных камней» и «Технологические свойства горных пород и минералов» . Профиль 2: «Самоцветные провинции мира» и «Методы контроля качества материалов» . Б. 3. Профессиональный цикл. Б. 3. 1. Базовая часть. Б. 3. 1. 1. Техническая часть : «Технология обработки материалов» ; Б. 3. 1. 2. Вариативная часть, в т. ч. дисциплины по выбору студента: «Синтез и модификация минералов» Б. 3. 2. 2. Вариативная часть, в т. ч. дисциплины по выбору студента: «Композиционные материалы» и «Фантазийная огранка самоцветов» . Профиль 1 : «Технология добычи и переработки камня» и «Декоративные камни в архитектуре и строительстве» . Профиль 2: «Технология обогащения и сортировка самоцветов» и «Технология огранки алмазов и цветных камней»

В результате изучения курса дисциплины студенты должны: Знать: • основные классы материалов, используемых для изготовления облицовочных, декоративно художественных и ювелирных изделий; • теоретические принципы описания структуры металлических и неметаллических материалов различных классов; • физико химические, механические, технологические свойства и дефекты материалов; • факторы, определяющие классификационные признаки материалов, используемых в конкретных прикладных областях применения; • критерии выбора материалов, обладающих необходимым комплексом функциональных и эстетических свойств. Уметь: • выбирать материалы для изготовления архитектурно строительных, декоративно художественных и ювелирных изделий; • выявлять связь между составом, структурой и свойствами материалов разных классов; • выбирать методы формирования структуры и получения требуемого комплекса свойств материалов каждого класса для изготавливаемых изделий. Уметь применять: справочники и Интернет ресурсы для поиска характеристик материалов при решении практических задач. Владеть практическими навыками: • работы с инструментальными средствами для определения функциональных и эстетических характеристик материалов разных классов; • работы с информационными базами данных материалов, используемых в камнеобрабатывающем, гранильном и ювелирном производствах.
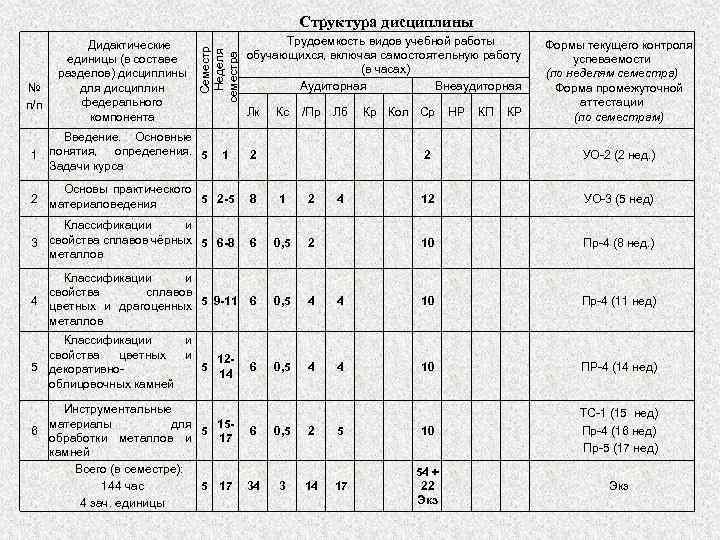
№ п/п Дидактические единицы (в составе разделов) дисциплины для дисциплин федерального компонента Семестр Неделя семестра Структура дисциплины Введение. Основные понятия, определения. 5 1 Задачи курса Трудоемкость видов учебной работы обучающихся, включая самостоятельную работу (в часах) Аудиторная Внеаудиторная Лк 1 Кс /Пр Лб 2 Кр Кол Ср НР КП КР Формы текущего контроля успеваемости (по неделям семестра) Форма промежуточной аттестации (по семестрам) 2 УО 2 (2 нед. ) 12 УО 3 (5 нед) 10 Пр 4 (8 нед. ) Основы практического 2 материаловедения 5 2 -5 8 1 2 Классификации и свойства сплавов чёрных 5 6 -8 3 металлов 6 0, 5 2 Классификации и свойства сплавов 4 цветных и драгоценных 5 9 -11 металлов 6 0, 5 4 4 10 Пр 4 (11 нед) Классификации и свойства цветных и 125 декоративно 5 14 облицовочных камней 6 0, 5 4 4 10 ПР 4 (14 нед) 5 10 ТС 1 (15 нед) Пр 4 (16 нед) Пр 5 (17 нед) 17 54 + 22 Экз Инструментальные материалы для 156 5 обработки металлов и 17 камней Всего (в семестре): 5 17 144 час 4 зач. единицы 6 34 0, 5 3 2 14 4
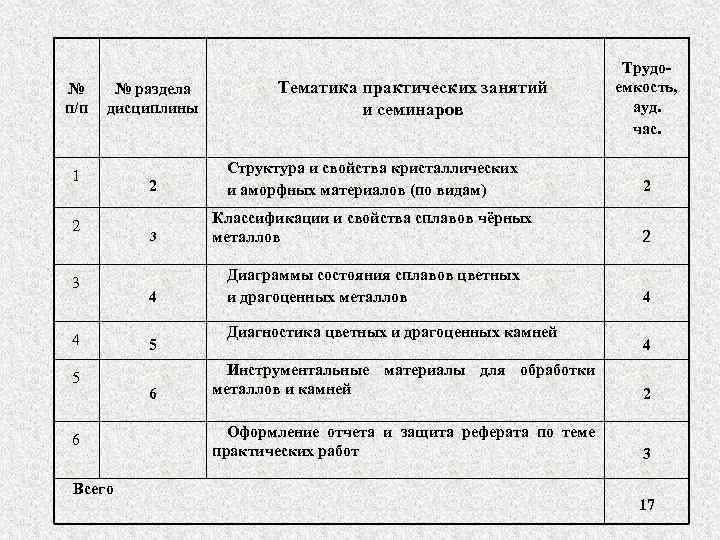
№ п/п № раздела дисциплины 1 2 3 4 5 6 Всего Тематика практических занятий и семинаров Трудоемкость, ауд. час. 2 Структура и свойства кристаллических и аморфных материалов (по видам) 2 3 Классификации и свойства сплавов чёрных металлов 2 4 Диаграммы состояния сплавов цветных и драгоценных металлов 4 5 6 Диагностика цветных и драгоценных камней 4 Инструментальные материалы для обработки металлов и камней 2 Оформление отчета и защита реферата по теме практических работ 3 17
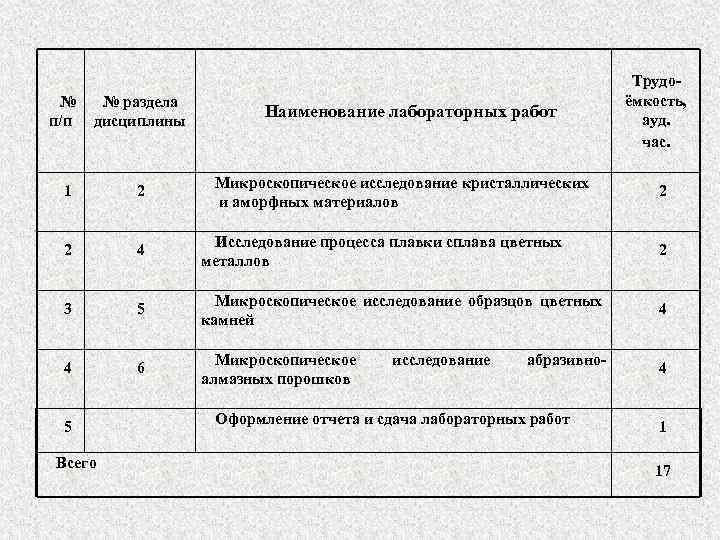
№ п/п № раздела дисциплины Наименование лабораторных работ Микроскопическое исследование кристаллических и аморфных материалов Трудоёмкость, ауд. час. 1 2 2 4 Исследование процесса плавки сплава цветных металлов 2 3 5 Микроскопическое исследование образцов цветных камней 4 4 6 Микроскопическое алмазных порошков 4 5 Всего исследование абразивно- Оформление отчета и сдача лабораторных работ 2 1 17

Виды самостоятельной работы студентов, консультаций и контроля её выполнения преподавателем: Устный опрос по разделам дисциплины Сбор информационных материалов по разделам 1 – 6 дисциплины с использованием интернет ресурсов для подготовки реферата 24 час. Консультации и контроль подготовки реферата в электронном виде Приём защиты реферата в форме электронной презентации Подготовка к практическим занятиям и лабораторным работам с использованием учебного пособия [1] 24 час. Устный опрос по темам практических занятий. Подготовка отчёта по практическим занятиям – 3 час. Подготовка отчёта по лабораторным работам – 3 час Подготовка к экзамену с использованием учебного пособия [1] 22 час. Консультация и приём экзамена.

Примерная тематика рефератов Провести обзор природных камней или ювелирных материалов для заданного вида изделий с анализом их физико технических характеристик и технологических особенностей обработки. Учебно-методическое и информационное обеспечение дисциплины а) основная литература: 1. Павлов Ю. А. , Кривоносов А. В. Материаловедение для технологов камнеобрабатывающих, гранильных и ювелирных производств: Учебное пособие. М. : МГГУ, 2012. – 208 с. б) дополнительная литература: 1. Гальперин А. М. , Зайцев В. С. Геология: Часть IV. Инженерная геология: Учебник для вузов. — М. : Изд во «Горная книга» , МГГУ, 2009. – 359 с. 2. Гаршин А. П. , Федотова С. М. Абразивные материалы и инструмен ты. Технология производства: Учебное пособие / Под общ. ред. проф. А. П. Гаршина. — С. Петербург: Изд во Политехнического университета, 2008. – 1010 с. 3. ГОСТ 30629 99. Межгосударственный стандарт. Материалы и изделия облицовочные из горных пород. Методы испытаний. – М. : Госстрой РФ, 2000 4. Куманин В. И. , Ковалёва Л. А. , Лобацкая Р. М. и др. Художественное материаловедение по видам материалов: Учебник / Под обшей ред. проф. Михайлова Б. М. : МГАПИ, 2005. – 182 с. 5. Куманин В. И. , Мамедова И. Ю. Материаловедение и технология конструкционных материалов: Учебник / Под обшей ред. проф. Михайлова Б. М. : МГАПИ, 2005. – 140 с. 6. Казарян Ж. А. Добыча, обработка, применение природного камня: Справочник. 2 е изд. — М. : «Петракомплект» , 2005. – 320 с. в) программное обеспечение: Электронные библиотеки и базы данных цветных и драгоценных металлов и камней.

Основы практического материаловедения

1. Структура и общие физико-химические свойства материалов Материалом называется вещество, обладающее необходимым комплексом свойств, для выполнения заданной функции отдельно или в совокупности с другими веществами. Материаловедение является разделом физики и химии, которые занимаются изучением свойств материалов. Прикладное материаловедение охватывает материалы конкретных практических областей применения, например технической и художественной. К изучаемым свойствам относятся структура веществ, химические, физико механические, термические, оптические и другие характеристики этих веществ. Физико-химические свойства вещества определяются электронным строением его атомов. Взаимодействие атомов связано, в первую очередь, с взаимодействием их электронных оболочек: изменение электронного состояния влияет на свойства химических элементов

Макроструктура – это структура материала, которую можно видеть невооруженным глазом. Традиционно микроструктуру подразделяют на кристаллическую, аморфную и аморфно кристаллическую. Микроструктура – это структура материала, которую можно рассматривать, изучать с помощью оптических, электронных, рентгеновских и других приборов. Кристаллическая структура – это такая микроструктура, которой свойственно упорядоченное расположение частиц в строго определенных точках пространства, которые образуют кристаллическую решётку (рис. а): В кристаллической решётке можно выделить минимальный объём — элементарную ячейку, с помощью которого можно описать положение атомов и свойства решётки в целом (рис. б). Ребро такого параллелепипеда называется периодом, или параметром, решётки.

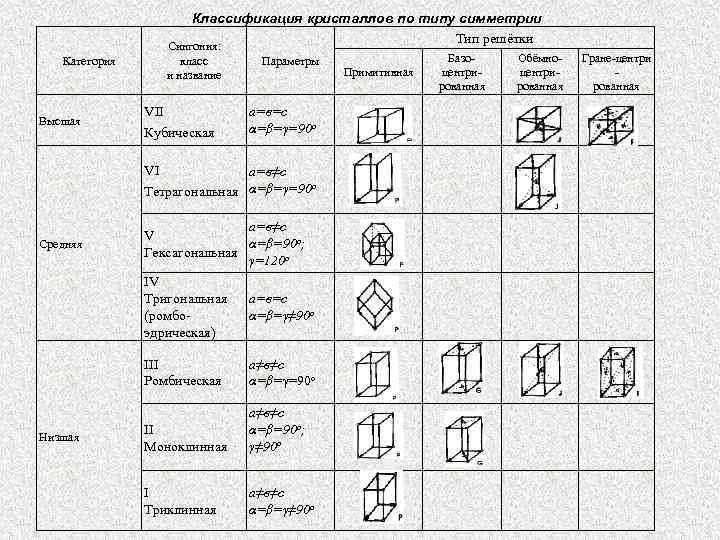
Характеристики симметрии и центрирования кристаллов. Кристаллы характеризуются внешней симметрией в расположении частиц, которая выражается наличием трёх элементов симметрии: центра, оси и плоскости симметрии. Всё многообразие кристаллических форм по сочетанию элементов симметрии (сингонии) сводится к семи типам: правильная (кубическая), тригональная, гексагональная, тетрагональная, ромбическая, моноклинная и триклинная По симметрии элементарные ячейки и кристаллические решётки, разделены на три категории: низшую, среднюю и высшую. Кристаллы низшей сингонии характеризуются меньшей симметрией; кристаллы более высокой категории сингонии имеют более совершенную форму кристаллической решётки и, следовательно, являются более устойчивыми в определенных условиях существования. Наименее симметрична триклинная сингония, наиболее симметрична кубическая. Кристаллические решётки и элементарные ячейки принято разделять также на простые (примитивные) и сложные. В простых решётках атомы расположены только в вершинах элементарной ячейки. Существуют три типа сложных решёток: базоцентрированные, гранецентрированные, объёмноцентрированные. В базоцентрированной решётке дополнительный атом центрирует одну грань ячейки. В гранецентрированной решётке дополнительные атомы расположены в центре всех граней ячейки. В объёмноцентрированной решётке дополнительный атом находится в центре тяжести.
Классификация кристаллов по типу симметрии Тип решётки Сингония: класс и название Категория Высшая VII Кубическая Параметры а=в=с α=β=γ=90 о VI а=в≠с о Тетрагональная α=β=γ=90 Средняя а=в≠с V α=β=90 о; Гексагональная γ=120 о IV Тригональная (ромбоэдрическая) III Ромбическая Низшая а=в=с α=β=γ≠ 90 о а≠в≠с α=β=γ=90 о II Моноклинная а≠в≠с α=β=90 о; γ≠ 90 о I Триклинная а≠в≠с α=β=γ≠ 90 о Примитивная Базоцентрированная Обёмноцентрированная Гране-центри рованная

Свободная энергия кристаллических решёток Стабильное состояние вещества в неживой природе — состояние с минимумом свободной энергии. Оно возникает в том случае, когда атомы занимают минимальный объём в пространстве, а значит, они касаются друга в определённых направлениях. В простых решётках атомы касаются друга в направлении ребра; параметр решётки (а) связан с размером атома (rат ) соотношением: a = 2 rат. (1. 1) В гранецентрированной решётке — атомы касаются друга в направлении плоской диагонали, и параметр решётки: a = 2√ 2 rат. (1. 2) В объемноцентрированной решётке — атомы касаются друга в направлении объёмной диагонали, и параметр решётки: a = 2√ 3 rат. (1. 3) При описании кристаллических решёток используют также понятия координационное число и плотность упаковки. Координационное число — количество ближайших однотипных атомов, окружающих данный атом в кристаллической решётке. В простых решётках таких соседних атомов 6; в объёмноцентрированных — 8, а в гранецентрированных — 12. Плотность упаковки это отношение объёма, занятого атомами, к общему объёму элементарной ячейки. Чем больше координационное число, тем выше плотность упаковки. Плотность упаковки простой решётки составляет ~ 50%, объёмноцентрированной — 68%, гранецентрированной — 74%.

Дефекты реальных кристаллов Реальный кристалл не имеет абсолютно правильного расположения атомов по всему объёму. В нём всегда существуют незначительные по объёму отклонения от правильного, периодического порядка в чередовании атомов дефекты кристаллической решётки. Дефекты кристаллической решётки образуются в результате изменения равновесных условий роста кристаллов, захвата примесей при кристаллизации, а также под влиянием различного рода внешних воздействий. Различают следующие атомные дефекты: точечные или нульмерные – это вакансии (тип а) и межузельные атомы (тип б): Дислокация линейный дефект кристаллической решётки, нарушающий правильное чередование атомных плоскостей и образующий внутри кристалла границу зоны сдвига. В простых решётках существует два вида дислокаций — краевая и винтовая. Краевая дислокация

Химические связи частиц кристаллической решётки Природа частиц, находящихся в узлах кристаллической решётки, и преобладающие силы взаимодействия определяют энергетический характер кристаллической решётки: атомный, молекулярный, ионный, металлический. Атомная решётка состоит из нейтральных атомов, связанных между собой ковалентными связями, обладающие большой энергией. Вещества с ковалентными связями отличаются высокой твёрдостью, тугоплавкостью, нерастворимостью в воде и в большинстве других растворителях. Примерами атомных решёток являются алмаз и графит. Молекулярная решётка построена из молекул, объединённых межмолекулярными или водородными связями, называемыми ван дер ваальсовыми. Межмолекулярные связи имеют небольшую величину энергии. Поэтому вещества с молекулярной решёткой имеют невысокую прочность, низкую температуру плавления, высокую летучесть. Такие вещества не проводят электрический ток. К веществам с молекулярной решёткой относятся органические материалы, газы, некоторые неорганические вещества (I 2, Cl 2, CO 2 и т. д. ). Ионная решётка образуется атомами, сильно отличающимися по отрицательному электрическому заряду. Она характерна для соединений щелочных и щёлочно земельных металлов с галогенами (например, Na. Cl). Вещества с ионной решёткой характеризуются высокой температурой плавления, малой летучестью, высокой прочностью и значительной энергией кристаллической решётки. Металлические решётки образуют металлы. В узлах решёток находятся ионы металлов, а валентные электроны распределены по всему кристаллу.
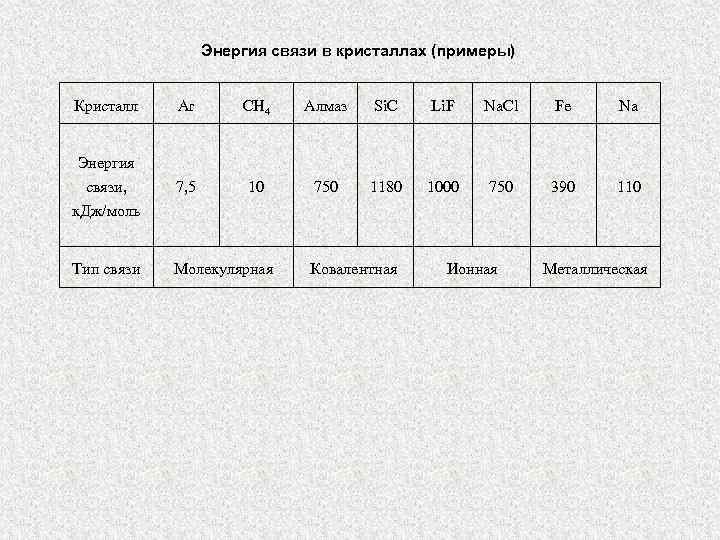
Энергия связи в кристаллах (примеры) Кристалл Ar CH 4 Алмаз Si. C Li. F Na. Cl Fe Na Энергия связи, к. Дж/моль 7, 5 10 750 1180 1000 750 390 110 Тип связи Молекулярная Ковалентная Ионная Металлическая

Некристаллические структуры твёрдых тел Аморфная структура является одним из физических состояний твёрдых тел. Аморфные вещества характеризуются двумя особенностями: • свойства таких веществ при обычных условиях не зависят от выбранного направления, т. е. они изотропны; • при повышении температуры происходит размягчение аморфного вещества и постепенный переход его в жидкое состояние, при этом точное значение температуры плавления отсутствует. Аморфные вещества подразделяют на витроиды, дисперсные системы и полимеры. Витроиды – это твёрдые тела в аморфном состоянии, имеющие стекловидную структуру. Как уже отмечалось, стёкла образуются в результате быстрого охлаждения, преимущественно силикатных расплавов. Быстрое охлаждение препятствует созданию упорядоченной структуры. Дисперсные системы – мельчайшие частицы размером 10 7 10 9 м. К ним относятся коллоиды, золи, пасты, клеи, мастики краски, латексы. К дисперсным аморфным системам относятся также некоторые горные породы (диатомит, опоки), имеющие общую формулу Si. O 2·n. H 2 O, а также активный кремнезём, который образуется в результате разложения глин при их нагревании. Полимеры – вещества, характерной особенностью которых является большой размер и большая молекулярная масса молекул, которыеобъединены в структурные единицы, включающие 103 105 молекул мономеров.

Аморфно-кристаллическая структура твёрдых тел Аморфно-кристаллическая структура характерна для многих природных и искусственных каменных материалов, которые в своём составе содержат кристаллические и аморфные фазы. Соотношение между объёмами кристаллической и аморфной фаз, а также их взаимное расположение оказывают большое влияние на свойства материалов, имеющих такую структуру. Типичными представителями подобных искусственных материалов являются ситаллы, фарфор и другие керамические материалы. Свойства материалов с аморфно кристаллической структурой зависят не только от количества этих фаз, но и от их качества и взаимного расположения относительно друга – от микро и макроструктуры. Макроструктура – это видимая невооруженным глазом или при небольшом увеличении (до 6 раз) внутренняя или поверхностная часть материала. Часто при рассмотрении материалов употребляют термины «плотная» или «пористая» структура. При изучении макроструктуры материалов часто используют термин «текстура» , который уточняет характеристику данного материала. Текстура материала – это преимущественно ориентированное расположение составляющих материал элементов, характеризующее рисунок его внутренних слоёв или поверхности, например, «волокнистая» , «зернистая» , «чешуйчатая» текстуры. Текстура, в отличие от структуры, не имеет такой логической связи с составом, химическими связями и свойствами материала.

Структура и свойства поверхностного и внутреннего слоев аморфно-кристаллических материалов Структура поверхностного слоя природных камней отличается от структуры внутренних слоёв по двум причинам: 1. Атомы и молекулы, расположенные на поверхности, имеют избыточную энергию по сравнению с частицами, расположенными внутри материала; 2. Поверхностный слой постоянно взаимодействует с окружающей средой, благодаря чему он претерпевает постоянные изменения как в процессе изготовления изделий, так и в процессе их эксплуатации. Избыточная энергия поверхностного слоя возникает вследствие того, что каждая частица на поверхности твёрдого тела и жидкости имеет некомпенсированные химические связи, которые образуют на поверхности несимметричное силовое поле. Это силовое поле втягивает поверхностные частицы внутрь материала, создавая на поверхности напряжение сжатия. Поверхностный слой, таким образом, постоянно находится в упруго напряжённом состоянии, а его частицы обладают значительно большим запасом потенциальной энергии, чем частицы внутреннего слоя. Благодаря этому частицы поверхностного слоя более активно реагируют с окружающей средой и вступают в химические реакции. Величина энергии поверхностного слоя прямо пропорциональна энергии химической связи данного материала и зависит от параметров окружающей среды. Так, например, поверхностная энергия твёрдого тела на границе с жидкостью, которая его смачивает, уменьшается на величину, равную силе взаимодействия поверхностных частиц с жидкостью. Макроструктура внутреннего слоя каменного материала достаточно хорошо просматривается на срезе невооруженным глазом или через обычную лупу. В состав структуры входят отдельные твёрдые тела (зёрна) различной крупности, поры и матрица, объединяющая зёрна в единый монолит. В качестве матрицы могут быть затвердевший цементный камень, алюмосиликатное или полимерное стекло, затвердевшая глина и другие материалы.

Большое влияние на строение поверхностных и внутренних слоев материала оказывают примеси, смачивание поверхности активными жидкостями, диффузионные процессы. Примеси оказывают неоднозначное влияние на свойства внешних и внутренних слоёв. Если примеси имеют меньшую поверхностную энергию, чем материал, то они равномерно распределяются по поверхности, уменьшая его энергию. При большей поверхностной энергии примеси концентрируются на отдельных участках поверхности или перемещаются во внутренние слои материала, где могут оказывать как положительное, так и отрицательное влияние на его свойства. Смачивание имеет большое значение при формировании композиционных материалов, искусственных каменных конгломератов. Смачивание компонентов искусственных смесей необходимо для уменьшения энергии поверхностей твёрдых составляющих, что позволяет получать более плотные их упаковки в искусственных конгломератах. Диффузия представляет собой самопроизвольное перемещение частиц вещества, в результате которого устанавливается равновесное распределение концентрации этих частиц в объёме газа, жидкости, твёрдого тела. Перенос частиц методом диффузии происходит, например, при обжиге строительной керамики, глазуровании керамических плит, получении фарфора. Высокая прочность фарфора не в малой степени определена диффузией расплава в направлении кристаллической части материала, в результате чего уплотняется структура и упрочняется зона контакта.

Пористость внутренней структуры материалов Пористость – степень заполнения объёма материала порами, которая обычно выражают в %: П = [(V ест – Vп)/Vест]· 100, (1. 4) где Vест – объём твёрдого тела вместе с порами; Vп – объём твёрдой фазы тела. Чаще пористость рассчитывают, исходя из кажущейся ρm и истинной ρ плотности материала: П = (1 – ρm / ρ)· 100. (1. 5) Помимо объёма пор на свойства материалов большое влияние оказывают геометрическая и структурная характеристики пор. К геометрической характеристике относят размер пор, их общую удельную поверхность, общий объём пор. К структурной характеристике относят форму пор (ячеистую, замкнутую, волокнистую) и характер пор (открытые, замкнутые, сообщающиеся). Наиболее общей для различных видов материалов является классификация по размеру пор: макропоры > 10 мкм; капиллярные поры > 1 мкм; контракционные (связаны с уменьшением объёма) – 1 10 2 мкм; поры геля (соединяют внутренние пространства между гелевыми частицами, содержащими большое количество испаряющейся воды) – 10 2 10 4 мкм. Значения пористости некоторых материалов Наименование материала Гранит Тяжёлый бетон Древесина Плотность, кг/м 3 истинная 2700 - 2800 2600 - 2700 1500 - 1600 кажущаяся 2600 - 2700 2200 - 2500 400 - 800 Пористость, % 0, 5 - 1 8 - 12 45 - 70

Свойства каменных и керамических материалов, связанные с их пористостью Пористость как основная характеристика структуры во многом определяет такие свойства каменных и керамических материалов, как теплопроводность, прочность и другие. Газопроницаемость — свойство пористой структуры пропускать газ при перепаде давлений. Газопроницаемость зависит от размеров и вида пор, поэтому этот показатель часто используют при оценке равномерности структуры материалов. Наибольшее значение газопроницаемости соответствует размеру порядка 20. . . 100 мкм. Однако проницаемость газов через каменные материалы может происходить и при более низких значениях размера пор (0, 1 мкм и ниже), например, в тонких трещинах. Газопроницаемость чувствительна к изменению структуры изделий. Так, если при некотором изменении структуры открытая пористость изменилась в 2 раза, то газопроницаемость меняется более чем в 100 раз. Паропроницаемость является разновидностью газопроницаемости, с той лишь особенностью, что пар способен в зависимости от условий изменять свое агрегатное состояние, т. е. конденсироваться, вытесняя газовую фазу, и значительно изменять свойство структуры. Паропроницаемость как характеристику структуры рассматривают в двух аспектах: материаловедческом — защита структуры и конструкции в целом от разрушительного действия конденсата; теплофизическом — например, создание надлежащего тепловлажностного режима помещения. В обоих случаях устраивают пароизоляцию с внутренней стороны ограждающих конструкций, в частности наружных стен и облицовки здания, из газопаронепроницаемых материалов. Качество таких материалов характеризуется сопротивлением паропроницанию Rn, м 2·ч·Па·с/мг. Водопроницаемость — способность пористой структуры пропускать воду (жидкие среды) под давлением. Как характеристика структуры водопроницаемость аналогична газопроницаемости и подчиняется тем же законам течения жидкости под давлением. Методы определения водопроницаемости позволяют полнее судить о характере пористой структуры.

Механические свойства материалов Механические свойства условно могут быть разделены на три основные группы. Первая группа содержит комплекс характеристик, определяемых при однократном кратковременном нагружении. 1. Упругие свойства материала: • модуль нормальной упругости (Юнга) Е, ГПа — коэффициент пропорциональности между нормальным напряжением и относи тельным удлинением; • модуль сдвига (модуль касательной упруго сти)G, ГПа — коэффициент пропорциональности между касательным напряжением и относительным сдвигом; • коэффициент Пуассона μ — абсолютное значение отношения поперечной деформации к продольной в упругой области. Для практически изотропных поликристаллических металлических материалов упругие константы связаны соотноше нием. Е = 2 G(1+μ). Сопротивление малым упругопластическим деформациям определяют: предел упругости σупр, МПа — напряжение, при нагружении до которого деформации возрастают пропорционально напряжениям; предел пропорциональности σпц, МПа — напряжение, при котором отклонение приращения деформации от линейного закона достигает определенного значения, обычно 50%; предел текучести (условный) σ0, 2 — напряжение, при котором остаточная деформация после снятия нагрузки составляет 0, 2 %.

2. Прочностные свойства материала: временное сопротивление (предел прочности), прочность на разрыв (для неметаллических материалов) σв, МПа — напряжение, соответствующее наибольшей нагрузке, выдерживаемой образцом при испытании; сопротивления срезу τср, МПа и сдвигу τсдв, МПа — касательные напряжения, соответствующие наибольшей нагрузке, выдерживаемой образцом при испытании на срез и сдвиг соответственно 3. Характеристики твёрдости материалов: твёрдость по Бринеллю НВ, МПа — среднее напряжение, приходящееся на единицу поверхности сферического отпечатка, который получается вдавливанием стального шарика в испытуемый материал; микротвёрдость Нμ, ГПа — сопротивление вдавливанию алмазного наконечника при очень малых нагрузках с получением микроразмеров отпечатка (методы определения по Роквеллу – шкалы НRА, HRB или НRC в зависимости от нагрузки на индентор, по Виккерсу – HV, по Кнуппу – HK); твёрдость по шкале Мооса — сопротивление механическому воздействию минералов и других материалов, определяемое царапанием (эталонами твёрдости являются 1 тальк, 2 гипс, 3 кальций, 4 флюорит, 5 апатит, 6 ортоклаз, 7 кварц, 8 топаз, 9 корунд, 10 – алмаз). 4. Пластичность материалов: относительное удлинение δ, % — отношение абсолютного остаточного удлинения образца после разрыва к начальной расчётной длине; относительно сужение ψ, % — отношение уменьшения площади поперечного сечения образца после разрыва к начальной площади.

Вторая группа включает параметры, оценивающие выносливость материалов — сопротивление переменным и длительным статическим нагрузкам. Характеристиками выносливости материалов являются: предел выносливости при симметричном изгибе σ-1, МПа — наибольшее напряжение цикла, при действии которого не происходит усталостного разрушения образца после произвольно большого числа циклов или при заданной базе испытаний N=107 2· 107 циклов; предел выносливости образца с надрезом или отверстием σн-1, МПа — наибольшее напряжение цикла, определяемое при Kt = 2, 2 2, 6, где Kt — теоретический коэффициент концентрации напряжений; предел выносливости (малоцикловой усталости) при асимметричном растяжении гладкого (Kt = 1) или надрезанного (Kt = 2, 2 2, 6) образца σmax, МПа — наибольшее напряжение цикла, при котором не происходит разрушение при заданной базе испытаний N.

Третью группу составляют характеристики разрушения, которые определяются на образцах с заранее выращенными начальными трещинами и оцениваются следующи ми основными параметрами: коэффициент интенсивности напряжений К, МПа·м 1/2 — характеризует концентрацию напряжений в вершине трещины; в общем виде: К= y·σ , (1. 11) где σ — напряжение в сечении образца, МПа, l — половина длины трещины, м, y – функция, зависящая от геометрии образца и трещины; критический коэффициент интенсивности напряжений Ккр, МПа·м 1/2 —значение определяют по моменту, при котором наступает нестабильный рост трещин; вязкость разрушения К 1 с, МПа·м 1/2 — условный критический коэффициент интенсивности напряжений при плоском напряженном состоянии; обычно оценивают для металлов по результатам испытания внецентренным растяжением образцов, толщина которых обеспечивает наиболее стеснённые условия для пластической деформации перед фронтом трещины и рассчитывается по формуле: h = 2, 5(К 1 с / σ0, 2)2; (1. 12) 6·м/цикл — определяется для металлов на скорость роста трещины усталости v=dl/d. N, 10 пластинах с центральной щелью размером 2 l = 6 10 мм при циклическом растяжении с базой испытаний N; графическое дифференцирование кривой Δ· 2 l=f(N), где Δ — прирост трещины, позволяет получить зависимость v=а(ΔК), где ΔК— размах коэффициента интенсивности напряжений, МПа·м 1/2: , ΔК=y·Δσ (1. 13) где Δσ= σmax - σmin — размах напряжений цикла, МПа.

Выводы по главе 1 1. Прикладное материаловедение является базовым предметом изучения, поскольку на его основе возможно дальнейшая специализация студентов как области дизайна художественных изделий из традиционных и новых материалов, так и в современных технологиях их обработки. 2. Подготовка специалистов по технологии художественной обработки материалов традиционно специализирует выпускников либо в области облицовочных и поделочных природных камней, либо в области ювелирных камней и драгоценных металлов. 3. Необходимы условием получения высокой квалификации бакалавров является освоение основных направлений фундаментальных наук, на которых базируются прикладные разделы художественного материаловедения: кристаллографии, петрологии, геммологии, физики и химии твёрдого тела, термодинамики, механики и металловедения.

Классификации и свойства сплавов чёрных металлов

2. 1. Классификация, структура и свойства металлов и сплавов По принятой в России классификации металлы, к которым относятся 76 из 106 всех химических элементов, делятся на две большие группы: чёрные — железо и его сплавы, и цветные — все остальные металлы и их сплавы. Между металлами и неметаллами находятся полуметаллы (металлоиды) Si, Gе, Аs, Sb, Те, Po, At. Основное применение в промышленности полуметаллы нашли в производстве полупроводников. Металлы и сплавы характеризуются комплексом физических, химических, механических и технологических свойств. К характерным физическим свойствам металлов и сплавов относятся цвет, блеск, плотность, температура плавления, электропроводность, теплопроводность и магнитная восприимчивость. К химическим свойствам металлов и сплавов относятся коррозионная стойкость и растворимость. К основным механическим свойствам металлов и сплавов относятся пластичность, прочность, твёрдость и износостойкость. Под технологическими свойствами металлов и сплавов понимают их способность подвергаться различным видам обработки. К технологическим свойствам металлов и сплавов относятся: литейные, деформационные — ковкость или пластичность в горячем и холодном состоянии, механические — обрабатываемость резанием, термические – свариваемость, спекаемость, закаливаемость и прокаливаемость. В зависимости от области применения того или другого сплава их делят на следующие большие группы: конструкционные, инструментальные, специальные с особыми физическими и химическими свойствами (нержавеющие, жаропрочные, магнитные стали, ковкие чугуны, электротехнические и другие), ювелирные цветные сплавы и драгоценные металлы.
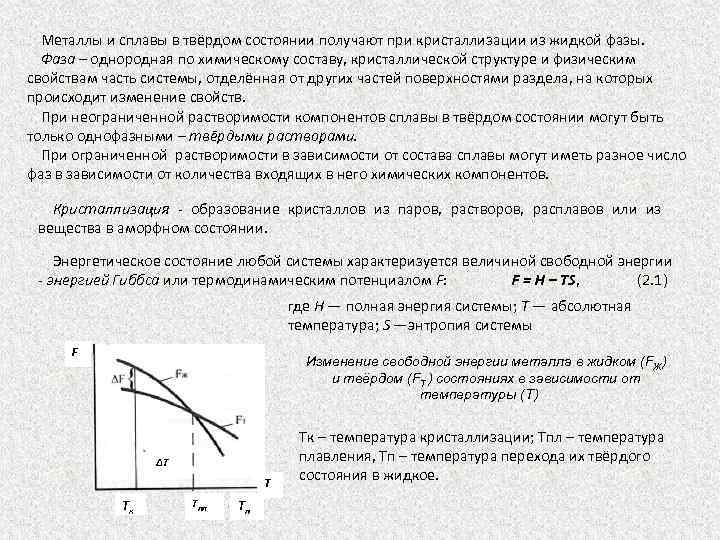
Металлы и сплавы в твёрдом состоянии получают при кристаллизации из жидкой фазы. Фаза – однородная по химическому составу, кристаллической структуре и физическим свойствам часть системы, отделённая от других частей поверхностями раздела, на которых происходит изменение свойств. При неограниченной растворимости компонентов сплавы в твёрдом состоянии могут быть только однофазными – твёрдыми растворами. При ограниченной растворимости в зависимости от состава сплавы могут иметь разное число фаз в зависимости от количества входящих в него химических компонентов. Кристаллизация образование кристаллов из паров, растворов, расплавов или из вещества в аморфном состоянии. Энергетическое состояние любой системы характеризуется величиной свободной энергии энергией Гиббса или термодинамическим потенциалом F: F = Н – ТS, (2. 1) где Н — полная энергия системы; Т — абсолютная температура; S —энтропия системы F Изменение свободной энергии металла в жидком (FЖ) и твёрдом (FT ) состояниях в зависимости от температуры (Т) ΔT T Тк Tпл Тп Тк – температура кристаллизации; Тпл – температура плавления, Тп – температура перехода их твёрдого состояния в жидкое.

Устойчивым является состояние с минимумом свободной энергии: • ниже температуры плавления Тпл металл устойчив в твёрдом состоянии при FT< FЖ; • выше температуры плавления — в жидком состоянии при FT > FЖ. Температура плавления Тпл соответствует равновесной температуре кристаллизации, когда FЖ = FT, т. е. твёрдая и жидкая фазы существуют одновременно и находятся в состоянии равновесия. Для начала кристаллизации при Тк необходимо, чтобы процесс шёл в термодинамическом направлении, выгодном системе, т. е. в сторону уменьшения свободной энергии. Эти условия выражены в разнице энергий твёрдой и жидкой фазы: FЖ - FT = ΔF, что реализуется при охлаждении ниже равновесной температуры Тпл, на величину ΔТ = Тпл - Тк. Аналогичные явления происходят и при обратном превращении из твёрдого состояния в жидкое, которое может протекать при температуре нагрева Тп >Тпл. Число степеней свободы системы, т. е. число переменных, которые можно изменять, не меняя состояния системы, определяется правилом Гиббса: с = к - ф + 1, (2. 2) где с — число степеней свободы, к — число компонентов, ф — число фаз. В однокомпонентной системе (чистый металл) в процессе кристаллизации (или плавления) сосуществуют две фазы — жидкость и твёрдое тело, т. е. ф = 2, с = 0. Система устойчива, и температура остается постоянной до полного отвердения, т. е. исчезновения жидкой фазы. Энергетически это связано с выделением скрытой теплоты кристаллизации, что компенсирует отвод тепла при охлаждении. В жидком, расплавленном состоянии сплавы из двух или более компонентов образуют однородную по составу в любой точке объёма жидкость. Все сплавы в твёрдом состоянии могут состоять из следующих структурных составляющих: кристаллов твёрдых растворов; кристаллов химических соединений; механической смеси кристаллов различных типов (кристаллов чистых компонентов, твёрдых растворов и химических соединений).
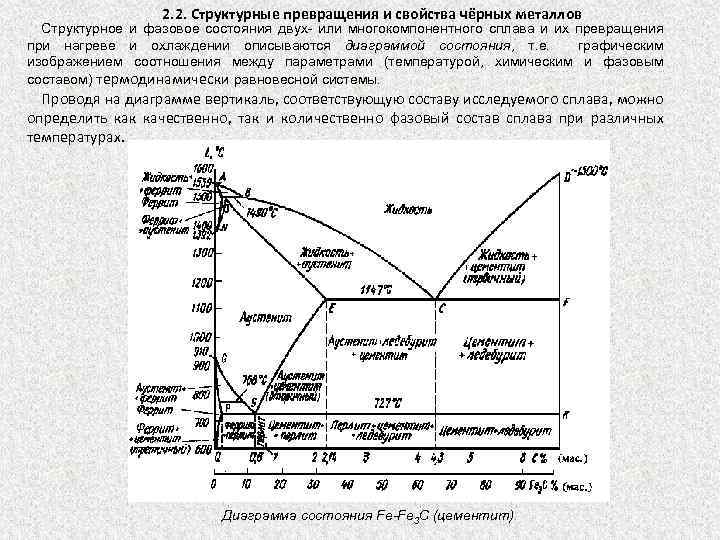
2. 2. Структурные превращения и свойства чёрных металлов Структурное и фазовое состояния двух или многокомпонентного сплава и их превращения при нагреве и охлаждении описываются диаграммой состояния, т. е. графическим изображением соотношения между параметрами (температурой, химическим и фазовым составом) термодинамически равновесной системы. Проводя на диаграмме вертикаль, соответствующую составу исследуемого сплава, можно определить как качественно, так и количественно фазовый состав сплава при различных температурах. Диаграмма состояния Fe-Fe 3 C (цементит)

В системе железо цементит (Fe Fе 3 С) имеются следующие фазы: жидкий раствор. твёрдые растворы феррит и аустенит, а также химическое соединение цементит. Феррит может иметь две модификации высоко и низкотемпературную. Высокотемпературная модификация d Fe и низкотемпературная a Fe представляют собой твердые растворы углерода, соответственно, в d и a железе. Предельное содержание углерода в a Fe при 723°С 0, 02%, а при 20°С 0, 006%. Низкотемпературный феррит a Fe по свойствам близок к чистому железу и имеет довольно низкие механические свойства, Аустенит g Fe твердый раствор углерода в g железе. Предельная растворимость углерода в g железе 2, 14%. Он устойчив только при высоких температурах, а с некоторым примесями (Мn, Сг и др. ) при обычных (даже низких) температурах. Аустенит обладает высокой пластичностью, низкими пределами текучести и прочности. Цементит (Fе 3 С) химическое соединение железа с углеродом, содержащее 6, 67% vглерода. Между атомами железа и углерода в цементите действуют металлическая и ковалентная связи. Температура плавления ~1250°С, обладает сравнительно высокими твердостью и хрупкостью. В системе железо цементит имеются две тонкие механические смеси фаз эвтектическая (ледебурит) и эвтектоидная (перлит). Ледебурит является смесью двух фаз g Fe + Fе 3 С, образующихся при 1130°С в сплавах, содержащих от 2, 0 до 6, 67%С, и наблюдается визуально как структурная составляющая чугунов. Ледебурит обладает достаточно высокими прочностью и хрупкостью. Перлит (до 2, 0%С) представляет собой смесь a Fe + Fе 3 С (в легированных сталях карбидов), образующуюся при 723°С и содержании углерода 0, 83% в процессе распада аустенита, и наблюдается визуально как структурная составляющая железоуглеродистых сплавов. Механические свойства перлита зависят от формы и дисперсности частичек цементита (прочность пластинчатого перлита несколько выше, чем зернистого).

Все линии на диаграмме состояния соответствуют критическим точкам, то есть температурам, при которых происходят фазовые и структурные превращения в железоуглеродистых сплавах. Линия ABCD линия начала кристаллизации сплава (ликвидус), линия AHJECF линия конца кристаллизации сплава (солидус). В области диаграммы HJCE находится смесь двух фаз: жидкого раствора и аустенита, а в области CFD жидкого раствора и цементита. В точке С при содержании 4, 3%С и температуре 1130°С происходит одновременная кристаллизация аустенита и цементита и образуется их тонкая механическая смесь ледебурит. Ледебурит присутствует во всех сплавах, содержащих от 2, 0 до 6, 67%С (чутуны). Точка Е соответствует предельному насыщению железа углеродом (2, 0%С). В области диаграммы AGSF находится аустенит. При охлаждении сплавов аустенит распадается с выделением по линии GS феррита, а по линии SE вторичного цементита. Линии GS и PS имеют большое практическое значение для установления режимов термической обработки сталей. Линию GS называют линией верхних критических точек, а линию PS нижних критических точек. В области диаграммы GSP находится смесь двух фаз феррита и распадющегося аустенита, а в области диаграммы SEE' смесь вторичного цементита и распадающегося аустенита. В точке S при содержании 0, 8%С и при температуре 723°С весь аустенит распадается и одновременно кристаллизуется тонкая механическая смесь феррита и цементита перлит. Линия PSK соответствует окончательному распаду аустенита и образованию перлита. В области ниже линии PSK никаких изменений структуры не происходит. Структурные превращения в сплавах, находящихся в твёрдом состоянии, вызваны следующими причинами: изменением растворимости углерода в железе в зависимости от температуры сплава (QP и SE), полиморфизмом железа (PSK) и влиянием содержания растворенного углерода на температуру полиморфных превращений (растворение углерода в железе способствует расширению температурной области существования аустенита и сужению области феррита).

На диаграмме состояния различают две области: стали и чугуны. Условия принятого разграничения возможность образования ледебурита (предельная растворимость углерода в аустените): • стали - до 2, 14% С, не содержат ледебурита; • чугуны - более 2, 14% С, содержат ледебурит. Промышленные стали — сплавы железа с углеродом, содержащие от 0, 03 до 2, 14% С. Механические свойства конструкционных сталей зависят от содержания углерода. Основными легирующими элементами являются Сг, Ni, Мn, Si, W, Мg, V, А 1, Сu, Тi, Nb, Zn, В. Часто сталь легируют не одним, а несколькими элементами, например, Сг и Ni — хромо никелевая сталь; Сг, Ni, Мо, V— хромо никель молибдено ванадиевая сталь. В обозначении марок отечественной конструкционной легированной стали первые две цифры указывают среднее содержание углерода в сотых долях процента, буквы за цифрами означают: А – азот, В – вольфрам, Д –медь, М – молибден, Р – бор, Т– титан, Ю – алюми ний, X –хром, Б–ниобий, Г– марганец, Е – селен, Н – никель, С – кремний, Ф – ванадий, К – кобальт, Ц – цирконий. Цифры после буквы характеризуют примерное процентное содержание легирующего элемента в целых единицах; отсутствие цифр означает, что в стали содержится до 1, 5% этого легирующего элемента. В конце наименова ния марки высококачественной стали ставится через тире буква А, а у особо высококачественной стали – буква Ш. Наименование марки литейной стали заканчивается буквой Л. Для изготовления изделий различного назначения применяют серый, ковкий или высокопрочный чугун. Принята следующая буквенно цифровая маркировка чугунов: серый чугун — СЧ, ковкий чугун — КЧ, высокопрочный чугун — ВЧ. Следующие за буквами цифры показывают величину, равную 1/10 от величины временного сопротивления разрушению (σв).

Выводы по главе 2 1. Из всех современных материалов наибольшее применение получили различные стали, которые позволяют достичь оптимального сочетания высокого конструктивного качества изделий с хорошей технологичностью и относительно низкой себестоимостью производства. 2. Чугуны, обладающие высокими литейными свойствами, широко используются как для выплавки стали (более 80%), так и для производства художественных изделий и различных промышленных конструкций.

Классификации и свойства сплавов цветных и драгоценных металлов

3. 1. Состав и свойства медных сплавов Медь и ее сплавы являются традиционными материалами для декоративно художественных и технических изделий. Медь – металл красного, в изломе розового цвета, кристаллическая решётка которого представляет собой гранецентрированный куб; температура плавления Тпл=1083º С, плотность ρ = 8, 94· 103 кг/м 3; твёрдость НВ = 350 МПа (50 НV), прочность σв =160 МПа, удельное электропроводимость g = 0, 56· 108 См/м. Чистая медь характеризуется высокой пластичностью; следовательно, она хорошо обрабатывается давлением, имеет низкие литейные свойства, плохо обрабатывается резанием. Из этого следуют плохие показатели шероховатости поверхностей даже при их обработке полированием. В зависимости от чистоты медь изготовляется следующих марок: М 00 (99, 99%); М 0 (99, 97 %) и М 1 (99, 7%). Примеси, входящие в состав, как правило, ухудшают её электропроводность. По характеру взаимодействия с медью примеси можно разделить на 3 группы: • Ni, Zn, Al, Fe, Аs и другие, образующие с медью твёрдые растворы; • Pb, Be, образующие легкоплавкую эвтектику, нерастворимую в меди; • O и S, образующие хрупкие химические соединения меди – оксиды Cu 2 O и сульфиды Cu. Fe. S 2, Cu. S 2. Используются следующие сплавы на основе меди: латунь, бронза, мельхиор, нейзильбер и другие цветные сплавы.
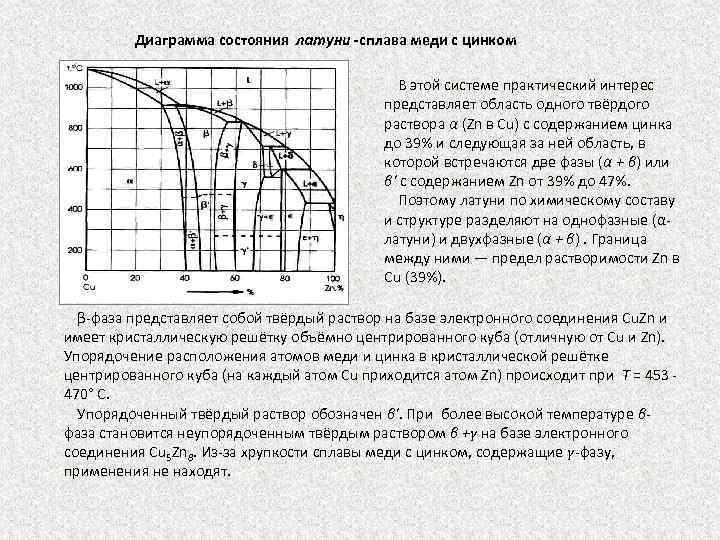
Диаграмма состояния латуни -сплава меди с цинком В этой системе практический интерес представляет область одного твёрдого раствора α (Zn в Сu) с содержанием цинка до 39% и следующая за ней область, в которой встречаются две фазы (α + β) или β' с содержанием Zn от 39% до 47%. Поэтому латуни по химическому составу и структуре разделяют на однофазные (α латуни) и двухфазные (α + β). Граница между ними — предел растворимости Zn в Сu (39%). β фаза представляет собой твёрдый раствор на базе электронного соединения Cu. Zn и имеет кристаллическую решётку объёмно центрированного куба (отличную от Сu и Zn). Упорядочение расположения атомов меди и цинка в кристаллической решётке центрированного куба (на каждый атом Сu приходится атом Zn) происходит при Т = 453 470° С. Упорядоченный твёрдый раствор обозначен β'. При более высокой температуре β фаза становится неупорядоченным твёрдым раствором β +γ на базе электронного соединения Cu 5 Zn 8. Из за хрупкости сплавы меди с цинком, содержащие γ-фазу, применения не находят.

Латуни маркируются буквой Л и цифрами, указывающими % содержания меди; например, Л 96, Л 74, Л 62. Кроме простых латуней применяются сложные специальные (легированные) латуни, в которых присутствуют и другие компоненты, придающие сплавам дополнительные свойства. Для улучшения обрабатываемости резанием добавляют свинец, для повышения антикоррозионных свойств — олово, для придания прочности, износостойкости — никель, алюминий, марганец и другие. Специальные латуни маркируются буквой Л, после которой идут буквы легирующих элементов. Группа цифр за буквами указывает содержание меди, следующая группа — содержание легирующих добавок в %. Количество цинка определяется по разности. Например, ЛС 60 2 расшифровывается как латунь специальная с содержанием меди 60%, свинца 2%, цинка 38%. В группу латуней входит томпак (90% меди, остальное—цинк); если сплавы содержат от 79 до 86% меди, то их называют полутомпаками. Они имеют желтоватый цвет и по свойствам близки к меди. По технологическим свойствам латуни подразделяют на деформируемые (по ГОСТ 15527 2004) и литейные (по ГОСТ 17711 93). Деформируемые медные сплавы поставляются в виде холодного проката (полосы, трубы, ленты, листы, проволока) в мягком (отожжённом и закалённом), полутвёрдом (обжатие 10 30%), твёрдом (обжатие 30 50%) и особо твёрдом (обжатие более 60%) состояниях, обладающих разными физико механическими свойствами (см. учебное пособие). Литейные латуни обладают высокой жидкотекучестью и износостойкостью, легко принимают различные художественные формы, противостоят коррозии и имеют хорошие механические и технологические свойства (см. учебное пособие). Литейные латуни подвергают диффузионному отжигу при температуре 700° С в течение 2 4 ч.
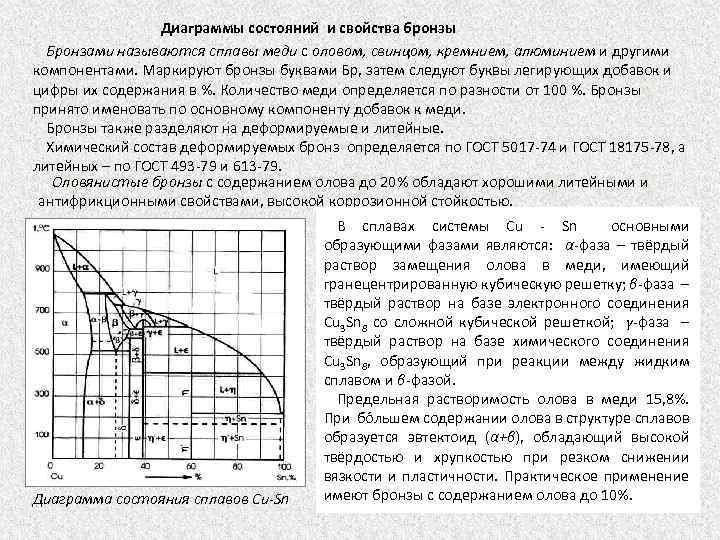
Диаграммы состояний и свойства бронзы Бронзами называются сплавы меди с оловом, свинцом, кремнием, алюминием и другими компонентами. Маркируют бронзы буквами Бр, затем следуют буквы легирующих добавок и цифры их содержания в %. Количество меди определяется по разности от 100 %. Бронзы принято именовать по основному компоненту добавок к меди. Бронзы также разделяют на деформируемые и литейные. Химический состав деформируемых бронз определяется по ГОСТ 5017 74 и ГОСТ 18175 78, а литейных – по ГОСТ 493 79 и 613 79. Оловянистые бронзы с содержанием олова до 20% обладают хорошими литейными и антифрикционными свойствами, высокой коррозионной стойкостью. Диаграмма состояния сплавов Сu-Sn В сплавах системы Сu Sn основными образующими фазами являются: α фаза – твёрдый раствор замещения олова в меди, имеющий гранецентрированную кубическую решетку; β фаза – твёрдый раствор на базе электронного соединения Cu 3 Sn 8 со сложной кубической решеткой; γ-фаза – твёрдый раствор на базе химического соединения Cu 3 Sn 8, образующий при реакции между жидким сплавом и β фазой. Предельная растворимость олова в меди 15, 8%. При бóльшем содержании олова в структуре сплавов образуется эвтектоид (α+β), обладающий высокой твёрдостью и хрупкостью при резком снижении вязкости и пластичности. Практическое применение имеют бронзы с содержанием олова до 10%.

Алюминиевые бронзы – сплавы меди с алюминием. Физико механические свойства бронз приведены учебном пособии. Медь с алюминием образуют α твёрдый раствор, концентрация Al в котором при понижении температуры с 1035 до 565° С увеличивается от 7, 4 до 9, 4%. Фаза α этого сплава пластична, но ее прочность невелика. Сплавы, содержащие до 4 5% Аl, обладают высокой прочностью и пластичностью; при содержании Al до 8% они хорошо обрабатываются давлением в холодном и горячем состоянии, а при содержании 8 10% Al обрабатываются только при высоких температурах. Фаза β – твёрдый раствор на базе электронного соединения Сu 3 Аl 2. При содержании алюминия более 9% в структуре появляется эвтектоид α+γ' (γ' электронное соединение Сu 32 Аl 19, обладающее высокой твёрдостью, но низкой пластичностью). Прочность сплавов уменьшается при содержании алюминия более 10 12%. Железо измельчает зерно, повышает ме ханические и антифрикционные свойства алюминиевых бронз. Ни кель улучшает механические свойства до Т = 500 600° С. Сплавы алюминиевой бронзы, содержащие никель, хорошо деформируются в горячем состоянии. Диаграмма состояния сплавов Cu-Al Кремнистые бронзы – антикоррозионные, превосходят по механическим свойствам оловянистые и более дешевы в производстве. Бериллиевые бронзы содержат 2 2, 5% Ве, имеют высокие прочность и упругость, стойкость против коррозии, хорошо свариваются, обрабатываются резанием, не дают искры при ударе о другой металл.
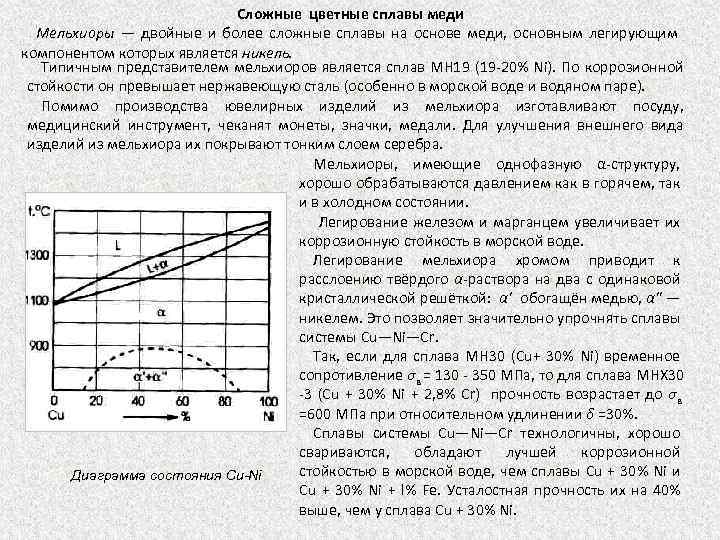
Сложные цветные сплавы меди Мельхиоры — двойные и более сложные сплавы на основе меди, основным легирующим компонентом которых является никель. Типичным представителем мельхиоров является сплав МН 19 (19 20% Ni). По коррозионной стойкости он превышает нержавеющую сталь (особенно в морской воде и водяном паре). Помимо производства ювелирных изделий из мельхиора изготавливают посуду, медицинский инструмент, чеканят монеты, значки, медали. Для улучшения внешнего вида изделий из мельхиора их покрывают тонким слоем серебра. Мельхиоры, имеющие однофазную α структуру, хорошо обрабатываются давлением как в горячем, так и в холодном состоянии. Легирование железом и марганцем увеличивает их коррозионную стойкость в морской воде. Легирование мельхиора хромом приводит к расслоению твёрдого α раствора на два с одинаковой кристаллической решёткой: α' обогащён медью, α" — никелем. Это позволяет значительно упрочнять сплавы системы Сu—Ni—Cr. Так, если для сплава МН 30 (Сu+ 30% Ni) временное сопротивление σв = 130 350 МПа, то для сплава МНХ 30 3 (Сu + 30% Ni + 2, 8% Cr) прочность возрастает до σв =600 МПа при относительном удлинении δ =30%. Сплавы системы Сu—Ni—Cr технологичны, хорошо свариваются, обладают лучшей коррозионной стойкостью в морской воде, чем сплавы Сu + 30% Ni и Диаграмма состояния Cu-Ni Сu + 30% Ni + l% Fe. Усталостная прочность их на 40% выше, чем у сплава Сu + 30% Ni.
Нейзильбер (в переводе с немецкого означает «новое серебро» ) – сплавы системы Cu—Ni—Zn , которые нашли широкое применение в художественном литье как материал по цвету и блеску похожий на серебро. Химический состав нейзильбера , например, марки МНЦС 16 29 1, 8: 28 35% цинк, 13, 5 16, 5% никель, 1, 6 1, 9 % свинец, а остальное – медь. Эти сплавы наряду с хорошими механическими свойствами имеют высокую коррозионную стойкость и удовлетворительную жидкотекучесть. Куниали (алюмоникелевые бронзы) — сплавы тройной системы Cu–Ni–Al. Алюминий растворяется в меди до 8%. С понижением температуры растворимость алюминия резко уменьшается, поэтому сплавы меди с алюминием можно подвергать упрочняющей термообработке: закалке и старению. В промышленности чаще всего применяют куниаль α-сплав (МНА 13 3) и куниаль β-сплав (МНА 6 1, 5). Серия специальных сплавов меди с цинком, алюминием, никелем, марганцем, платиной и другими металлами обладает широкой цветовой гаммой. Массовая доля компонентов, % (остальное медь) Марка сплава Назначение ЛМц. НА 69 -11 -3 -5 ЛАМц66 -6 -3 Zn 14 -17 26 -28 Al 1 -2 3 -5 Мn 10 -12 2 -4 Ni 2 -4 — Sn — — ЛСМц64 -2, 7 -2, 5 -0, 3 29 -31 — 2 -3 — — 2 -5 0, 2 -0, 6 и 2, 53, 5 Рb 6 -8 Бр. ОН 7 -3, 5 Под серебро Под золото 583 пробы Под золото 750 пробы Под золото 375 пробы Эти сплавы используются не только для хорошей имитации золотых и серебряных сплавов, но и для нанесения декоративного покрытия. Широкое применение в качестве заменителя золота получила кремнистая латунь ЛК 80 ЗЛ. Отливки, полученные из этого сплава, имеют гладкую поверхность и красивый золотистый цвет.

3. 2. Состав и свойства серебряных сплавов Серебро – мягкий и пластичный металл белого блестящего цвета; имеет кубическую гранецентрированную кристаллическую решетку, плотность ρ=10, 5· 10 3 кг/м 3 (при 20° С), температура плавления Тпл= 961°С; предел прочности при растяжении σв=140 180 МПа, предел текучести σт=10, 3 53, 5 МПа, твёрдость по Бринеллю НВ=245 250 МПа, т. е. 3 3, 5 единиц по шкале Мооса. Серебро очень хорошо полируется, имеет наивысшую отражательную способность: спектральный коэффициент отражения ρλ = 0, 913 0, 975, т. е. серебро отражает более 90 % световых лучей. Серебро является самым электро и теплопроводным металлом (g = 0, 625· 108 См/м; λ= 430 Вт/м·K). Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется. Серебро также легко растворяется в ртути, образуя амальгаму (жидкий сплав ртути и серебра). Во влажном воздухе в присутствии даже малейших следов двухвалентной серы (сероводород, тиосульфаты, резина) образуется налёт малорастворимого сульфида серебра, обусловливающего потемнение серебряных изделий. Серебро хорошо деформируется как в холодном, так и в горячем состоянии. Оно легко прокатывается в тончайшие листы до 0, 00025 мм и вытягивается в очень тонкую проволоку. Свет, проходящий через фольгу, приобретает голубовато зелёный оттенок. Серебро изготавливается с химическим составом в соответствии с ГОСТ 6836 2002 «Серебро и сплавы на его основе» . Наименование марок сплавов состоит из букв, обозначающих компоненты сплава, и следующих за ними цифр, указывающих номинальное содержание в % благородных металлов в сплаве. Например, сплав Ср. М 970 содержит 97, 3% Ag, 2, 61% Cu, остальное (0, 09%)– Pb (свинец), Fe (железо), Sb (сурьма), Bi (висмут).

Диаграмма состояния серебряно-медных сплавов Твёрдый раствор меди в серебре является α-фазой сплава. Растворимость меди в серебре изменяется от 0, 2% при 200° С до максимального значения 8, 8% при Т=779° С. Растворимость серебра в меди (область β фазы раствора) изменяется от 0% при Т =200° С до 8, 8% при Т=779° Состав жидкой фазы изменяется по линии ликвидус, и при температуре 779° С жидкая фаза имеет эвтектический состав α+β, содержащий 28, 5% меди. Эвтектика это композиция из кристаллов , которые образуются при первичной кристаллизации из жидкого раствора (L). При вторичной кристаллизации в структуре сплава, содержащего более 8, 8% Cu при температуре ниже 779°С медь выделяется из α–твёрдого раствора по границам зёрен в виде кристаллов β–твёрдого раствора, т. е. из жидкой фазы кристаллизуются сразу два твёрдых раствора (α + β). На практике этот процесс выделения β кристаллов подавляется резким охлаждением, при которой структура сплава представляет собой α–твёрдый раствор. Сплавы, содержащие от 8, 8% до 28, 5% меди, называются доэвтектическими. Эти сплавы состоят из двух фаз: жидкого расплава, содержащего 28, 5% меди и 71, 5% серебра, и кристаллов α-твёрдого раствора меди в серебре. В ювелирном деле, как правило, используются доэвтектические сплавы, содержащие более 71, 5 % Ag. Механические свойства серебряно медных сплавов существенно зависят от содержания в них меди (см. учебное пособие).

Применение сплавов серебра с медью Сплав Ср. М 950 используют для эмалирования и чернения, для изготовления очень тонкой проволоки и струн музыкальных инструментов, а также при глубокой вытяжке и чеканке. Цвет этого сплава соответствует цвету чистого серебра. К недостаткам сплава серебра 950 й пробы относятся невысокие механические свойства Сплав Ср. М 925 иначе еще называется «стерлинговое» или «стандартное» серебро. Сплав пригоден для эмалирования и чернения. Наиболее широко сплав используется для изготовления ювелирных изделий и столовых принадлежностей, а также в монетном и медальном производстве. Цвет сплава такой же, как и у сплава серебра 950 й пробы, однако его механические свойства выше. Сплав Ср. М 916 широко применяется в отечественной ювелирной промышленности для изготовления столовых принадлежностей и ювелирных изделий. Сплав находится практически на границе области доэвтектических сплавов системы Ag–Cu. Сплав Ср. М 900 чаще применяется для изготовления ювелирных украшений. Цвет сплава несколько отличается от цвета чистого серебра. Содержание меди в сплаве Ср. М 900 превышает предел её растворимости (8, 8%) , т. е сплав содержит некоторое количество эвтектики. Поэтому этот сплав менее стоек на воздухе, чем сплавы 950 и 925 й проб, однако имеет хорошие литейные свойства, хорошо обрабатывается давлением. Подходит для литья, гибки, пайки, ковки и чеканки, но для исполнения тонких филигранных операций и глубокой чеканки он слишком твёрдый. Сплав Ср. М 800 применяется для изготовления посуды вместо сплава 925 й пробы, а также для изготовления украшений. Недостатком сплава является желтоватый цвет и малая химическая стойкость на воздухе. Пластичность у этого сплава значительно ниже, чем у сплава Ср. М 925,

3. 3. Состав и свойства сплавов золота Золото и его сплавы изготавливаются в соответствии с ГОСТ 6835 2002. Наименование марок сплавов состоит из букв, обозначающих компоненты сплава, и следующих за ними цифр, указывающих номинальное содержание в % благородных металлов (Ag, Pd, Pt). В обозначении марок сплавов золота буквы означают: Зл – золото, Ср – серебро, Пл – платина, М – медь, Н – никель, Ц – цинк, Пд – палладий, Ин – индий, И – иридий, Ит – иттрий, К – кобальт, Кд – кадмий, Рд – родий, Ре – рений, Ру – рутений. Цифры в марках сплавов обозначают: в золотых, золото серебряно медных, золото медных сплавах – массовую долю золота и серебра в тысячных долях (пробах); в марках золото никелевых, золото платиновых, золото палладиевых, золото медно никелево цинковых сплавах – массовую долю второго, третьего и четвертого компонентов. В ювелирной промышленности для изготовления золотых изделий используют в большинстве случаев сплавы системы Au Ag–Cu, которые могут содержать добавки других металлов. Au и Cu обладают неограниченной растворимостью в жидком, а при высоких температурах и в твёрдом состоянии, образуя непрерывный ряд твёрдых растворов L+α ниже линии ликвидуса, которая достигает минимума, практически совпадая с линией солидуса при 910° С и 59, 5 % Au. При понижении температуры в процессе упорядочения ГЦК образуются три промежуточные фазы Au. Cu 3, Au. Cu и Au 3 Cu. Распад твёрдого раствора протекает по перитектоидной реакции, при которой твёрдая фаза Au. Cu реагирует с твёрдым раствором с образованием при Т = 230 240° С единственной и отличной от исходных твёрдой фазы Au 3 Cu: Au. Cu+ твёрдый раствор→Au 3 Cu. Диаграмма состояния сплавов Сu-Au

Пробы золотых сплавов Сплавы 958 -й пробы – трехкомпонентные сплавы золота, серебра и меди (например, сплав Зл. Ср. М 958 20 (Au 95, 5 96, 1, Ag 1, 5 2, 5, Cu 1, 7 2, 5). Сплав считается высокопробным, имеет приятный ярко жёлтый цвет, близкий к цвету чистого золота. Сплавы золота этой пробы термически не упрочняются и являются очень мягкими, в результате чего полировка на изделиях из сплавов держится недолго. Сплавы золота 958 й пробы имеют наиболее высокую химическую стойкость. Из за низких механических свойств сплавы этой пробы используются только для изготовления обручальных колец в соответствии с ТУ 48 1 252 90 «Заготовки обручальных колец из сплавов марок Зл. Ср. М 958 20, Зл. Ср. М 585 80, Зл. Ср. Пд. М 375» Сплавы 917 -й пробы – мягкие, пластичные, легко подвергаемые вальцеванию, однако имеют небольшое распространение в ювелирном деле. Сплавы 750 -й пробы – многокомпонентные, кроме золота в составе сплавов этой пробы может быть серебро, медь, палладий и цинк. Сплавы 750 й пробы химически устойчивы против действия сильных кислот. Интервал плавления всех сплавов 750 й пробы находится ниже линии солидуса на 20 25° С; эти сплавы представляют собой однофазные твёрдые растворы. Особенностью сплавов марки Зл. Ср. М 750 является то, что в них никогда не наблюдается самопроизвольное растрескивание, что позволяет подвергать их многократной термической обработке и, соответственно, упрочнять либо разупрочнять сплав в результате фазовых превращений Сплавы золота 585 -й пробы имеют самое широкое применение при изготовлении ювелирных изделий. Эти и родственные сплавы 583 й пробы обладают хорошими технологическими свойствами, хорошо паяются, имеют красивый внешний вид, высокие антикоррозионные и механические свойства. По химической стойкости они относятся к группе растворимых в минеральных кислотах сплавов.
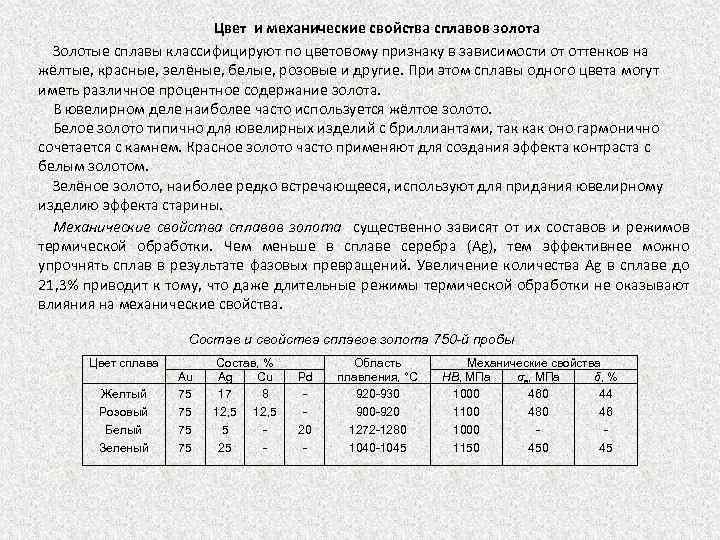
Цвет и механические свойства сплавов золота Золотые сплавы классифицируют по цветовому признаку в зависимости от оттенков на жёлтые, красные, зелёные, белые, розовые и другие. При этом сплавы одного цвета могут иметь различное процентное содержание золота. В ювелирном деле наиболее часто используется жёлтое золото. Белое золото типично для ювелирных изделий с бриллиантами, так как оно гармонично сочетается с камнем. Красное золото часто применяют для создания эффекта контраста с белым золотом. Зелёное золото, наиболее редко встречающееся, используют для придания ювелирному изделию эффекта старины. Механические свойства сплавов золота существенно зависят от их составов и режимов термической обработки. Чем меньше в сплаве серебра (Ag), тем эффективнее можно упрочнять сплав в результате фазовых превращений. Увеличение количества Ag в сплаве до 21, 3% приводит к тому, что даже длительные режимы термической обработки не оказывают влияния на механические свойства. Состав и свойства сплавов золота 750 -й пробы Цвет сплава Желтый Розовый Белый Зеленый Аu 75 75 Состав, % Ag Сu 17 8 12, 5 5 25 Pd 20 Область плавления, °С 920 930 900 920 1272 1280 1045 Механические свойства НВ, МПа σв, МПа δ, % 1000 460 44 1100 480 46 1000 1150 45

Платина и её сплавы Платина – тяжёлый металл, имеющий бело серую окраску, аналогичную окраске стали. Природная окраска платины, внешне похожая на белое золото, эффектно подчёркивает красоту бриллиантов, их прозрачность и блеск. Плотность платины ρ = 21, 37 · 103 кг/м 3 в 3 раза больше плотности железа; это очень прочный металл, обладающий хорошей тугоплавкостью (Тпл= 1772° С). Платина пластична, хорошо полируется, обладает высокой отражательной способностью, имеет низкую тепло и электропроводность, малую удельную теплоёмкость. Твёрдость платины по шкале Мооса составляет 4 4, 5. Платина в горячем состоянии хорошо прокатывается и сваривается. Может прокатываться в тончайшие листы (до 0, 0025 мм) и проволоку (до 0, 001 мм). Платина химически очень устойчива; не окисляется на воздухе даже при накаливании и, остывая, сохраняет свой цвет. Платина практически нерастворима в кислотах, за исключением горячей «царской водки» , при взаимодействии с которой Pt полностью растворяется: 3 Pt+4 HNO 3+18 HCl=3 H 2[Pt. Cl 6] +4 NO+8 H 2 O, образуя платино хлористо водородную кислоту H 2[Pt. Cl 6], которая при выпаривании раствора выделяется в виде красно бурых кристаллов состава H 2[Pt. Cl 6]·H 2 O. Платина в чистом виде очень мягкая, поэтому ее легируют, например Ir, Pd, Rh, Cu и другими металлами. Легирование платины иридием способствует резкому возрастанию твёрдости и прочностных характеристик сплавов. Комплексное легирование может усилить отдельные свойства сплавов платины. Например, введение 3 % Co и 2 7% Pd в сплавы платины 950 й или 900 й пробы улучшает литейные свойства и цвет, способность к полировке.
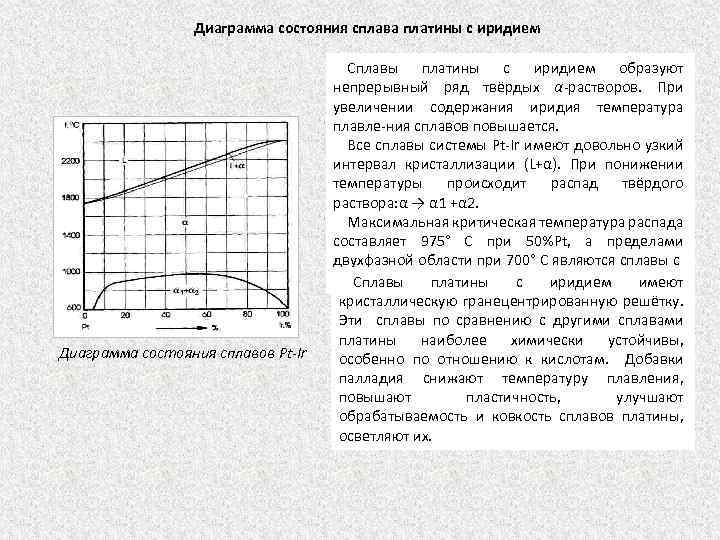
Диаграмма состояния сплава платины с иридием Диаграмма состояния сплавов Pt-Ir Сплавы платины с иридием образуют непрерывный ряд твёрдых α-растворов. При увеличении содержания иридия температура плавле ния сплавов повышается. Все сплавы системы Pt Ir имеют довольно узкий интервал кристаллизации (L+α). При понижении температуры происходит распад твёрдого раствора: α → α 1 +α 2. Максимальная критическая температура распада составляет 975° С при 50%Pt, a пределами двухфазной области при 700° С являются сплавы с 7 и 99% Ir. Сплавы платины с иридием имеют кристаллическую гранецентрированную решётку. Эти сплавы по сравнению с другими сплавами платины наиболее химически устойчивы, особенно по отношению к кислотам. Добавки палладия снижают температуру плавления, повышают пластичность, улучшают обрабатываемость и ковкость сплавов платины, осветляют их.
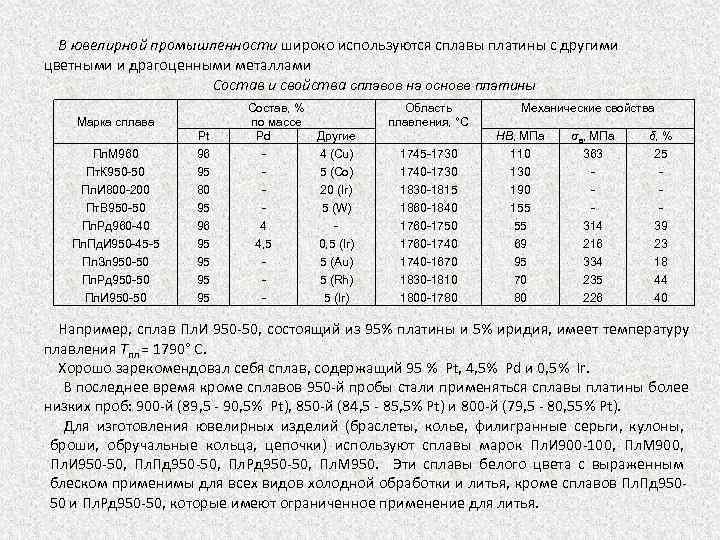
В ювелирной промышленности широко используются сплавы платины с другими цветными и драгоценными металлами Состав и свойства сплавов на основе платины Марка сплава Пл. М 960 Пт. К 950 50 Пл. И 800 200 Пт. В 950 50 Пл. Рд 960 40 Пл. Пд. И 950 45 5 Пл. Зл 950 50 Пл. Рд 950 50 Пл. И 950 50 Pt 96 95 80 95 96 95 95 Состав, % по массе Pd 4 4, 5 Область плавления, °С Другие 4 (Сu) 5 (Co) 20 (Ir) 5 (W) 0, 5 (Ir) 5 (Аu) 5 (Rh) 5 (Ir) 1745 1730 1740 1730 1815 1860 1840 1760 1750 1760 1740 1670 1830 1810 1800 1780 Механические свойства НВ, МПа 110 130 190 155 55 69 95 70 80 σв, МПа 363 314 216 334 235 226 δ, % 25 39 23 18 44 40 Например, сплав Пл. И 950 50, состоящий из 95% платины и 5% иридия, имеет температуру плавления Тпл = 1790° С. Хорошо зарекомендовал себя сплав, содержащий 95 % Pt, 4, 5% Pd и 0, 5% Ir. В последнее время кроме сплавов 950 й пробы стали применяться сплавы платины более низких проб: 900 й (89, 5 90, 5% Pt), 850 й (84, 5 85, 5% Pt) и 800 й (79, 5 80, 55% Pt). Для изготовления ювелирных изделий (браслеты, колье, филигранные серьги, кулоны, броши, обручальные кольца, цепочки) используют сплавы марок Пл. И 900 100, Пл. М 900, Пл. И 950 50, Пл. Пд 950 50, Пл. Рд 950 50, Пл. М 950. Эти сплавы белого цвета с выраженным блеском применимы для всех видов холодной обработки и литья, кроме сплавов Пл. Пд 950 50 и Пл. Рд 950 50, которые имеют ограниченное применение для литья.

Палладий и его сплавы Палладий – металл серебристо белого цвета, имеющий более светлую окраску, чем платина. Металл мягкий и ковкий, легко прокатывается в фольгу и протягивается в тонкую проволоку, твёрдость по Моосу равняется 5. По своим свойствам палладий близок к платине, но более лёгкий и пластичный, чем и привлекает ювелиров. Палладий не тускнеет на воздухе, на его поверхности не образуются царапины и трещины, а зеркальный блеск сохраняется десятилетиями. Благодаря тому, что палладий хорошо обрабатывается, обладает низкой температурой плавления и относительно недорогой по стоимости, он наиболее часто применяемый металл из всей группы платиновых металлов. По своим химическим свойствам палладий значительно уступает платине и другим платиновым металлам. Он растворяется в «царской водке» и разъедается в серной кислоте. Палладий химически устойчив на воздухе и в воде, в горячей немного разбавленной азотной кислоте растворяется с образованием нитрата палладия Pd(NO 3)2. В температурном диапазоне от 400 до 850° С палладий покрывается светло фиолетовым оксидным слоем, который исчезает при более высоких температурах. Палладий обычно используется в ювелирных сплавах в качестве легирующего элемента. Например, ювелирный сплав платины Пл. Пд 960 40 состоит из 96% платины и 4% палладия. В этом случае палладий добавляют в сплавы платины для придания им большей прочности и твердости. Как легирующий элемент палладий осветляет сплавы и используется при получении так называемого «белого золота» . Чаще всего для производства ювелирных украшений (колец, браслетов и других) используют сплавы палладия с медью, серебром и добавками никеля (ГОСТ 30649 99) , а также других металлов – иридия, родия, рутения
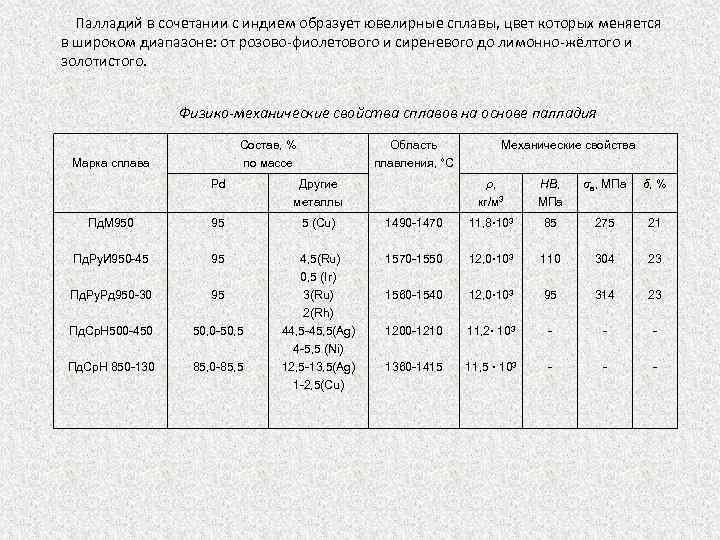
Палладий в сочетании с индием образует ювелирные сплавы, цвет которых меняется в широком диапазоне: от розово фиолетового и сиреневого до лимонно жёлтого и золотистого. Физико-механические свойства сплавов на основе палладия Состав, % по массе Марка сплава Область плавления, °С Pd Другие металлы Пд. М 950 95 5 (Сu) Пд. Ру. И 950 45 95 Пд. Ру. Рд 950 30 95 Пд. Ср. Н 500 450 50, 5 Пд. Ср. Н 850 130 85, 5 4, 5(Ru) 0, 5 (Ir) 3(Ru) 2(Rh) 44, 5 45, 5(Ag) 4 5, 5 (Ni) 12, 5 13, 5(Ag) 1 2, 5(Cu) Механические свойства ρ, кг/м 3 НВ, МПа σв, МПа δ, % 1490 1470 11, 8· 103 85 275 21 1570 1550 12, 0· 103 110 304 23 1560 1540 12, 0· 103 95 314 23 1200 1210 11, 2· 103 1360 1415 11, 5 · 103
Художественное материаловедение-часть1.pptx