tema2t.pptx
- Количество слайдов: 47

Морфология бактерий. Тинкториальные свойства бактерий. Окраска по Граму ТЕМА 2

Основные морфологические группы бактерий № 1 2

Морфологическая характеристика Форма бактерии Размер, характер деления, взаимное расположение Окраска Наличие поверхностных структур (капсула, жгутик, пили) Спорообразование
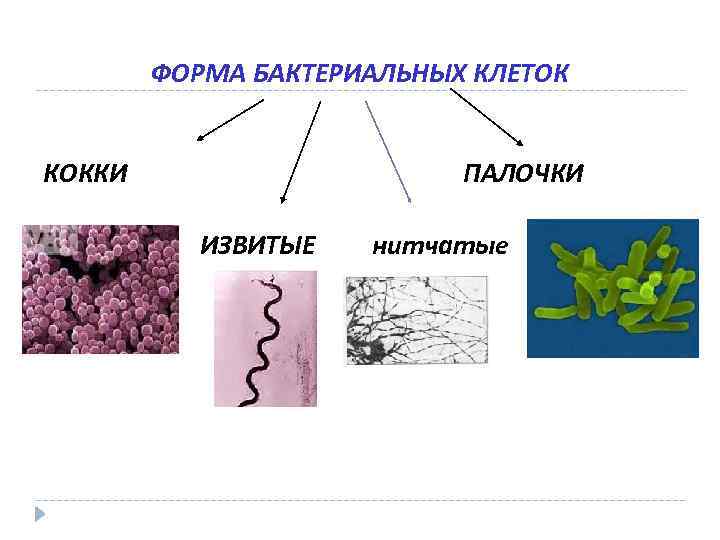
ФОРМА БАКТЕРИАЛЬНЫХ КЛЕТОК КОККИ ПАЛОЧКИ ИЗВИТЫЕ нитчатые
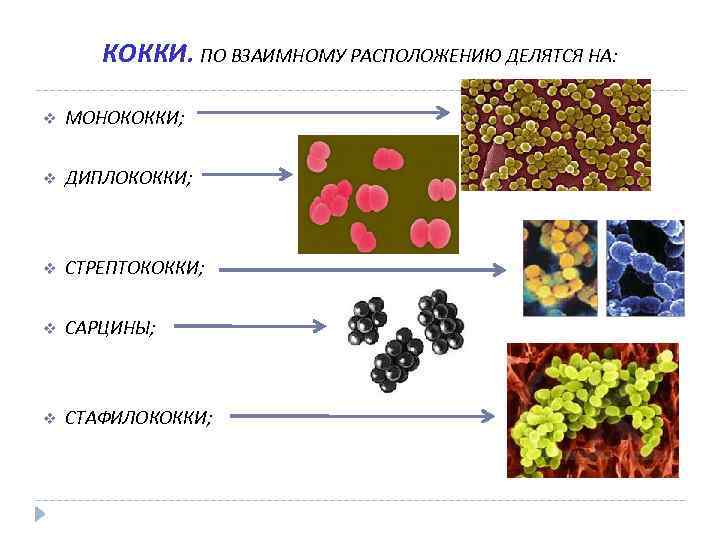
КОККИ. ПО ВЗАИМНОМУ РАСПОЛОЖЕНИЮ ДЕЛЯТСЯ НА: v МОНОКОККИ; v ДИПЛОКОККИ; v СТРЕПТОКОККИ; v САРЦИНЫ; v СТАФИЛОКОККИ;
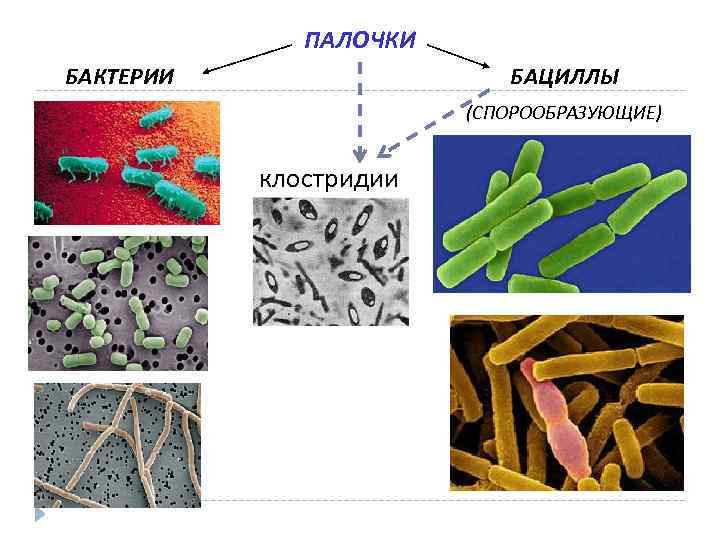
ПАЛОЧКИ БАКТЕРИИ БАЦИЛЛЫ (СПОРООБРАЗУЮЩИЕ) клостридии
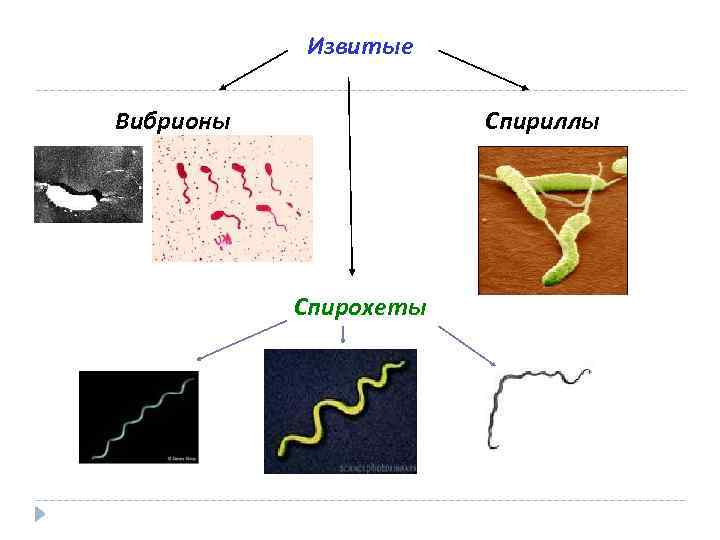
Извитые Вибрионы Спириллы Спирохеты

Нитчатые Актиномицеты 8

Особенности морфологии…. . № 2 9
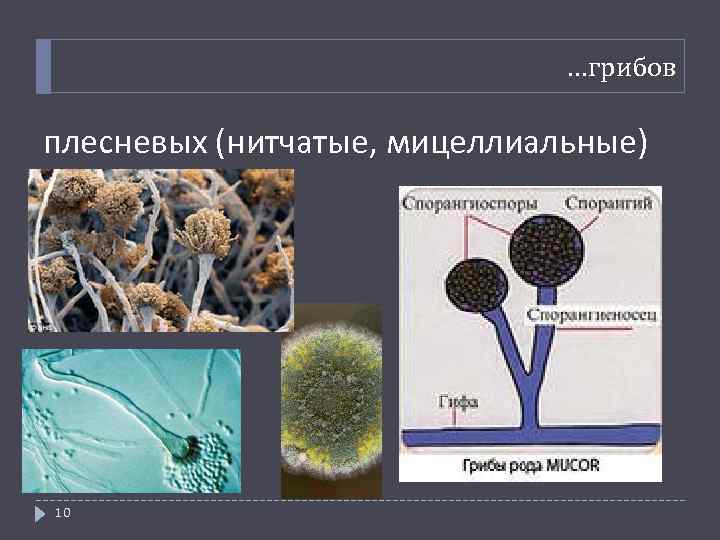
…грибов плесневых (нитчатые, мицеллиальные) 10
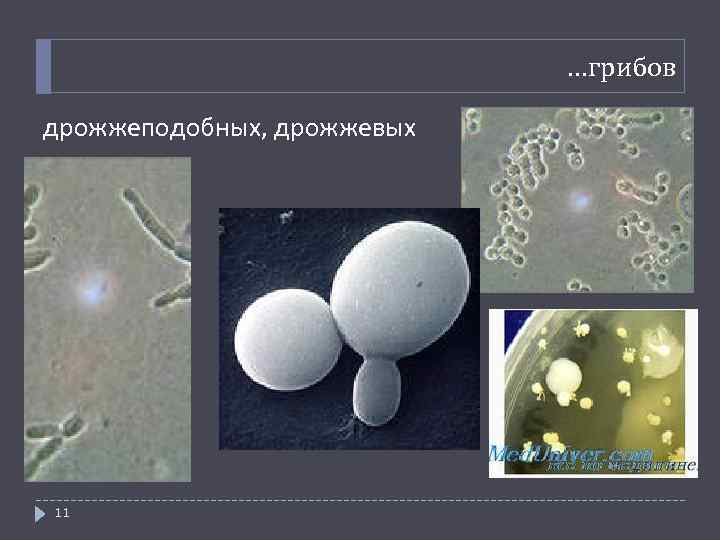
…грибов дрожжеподобных, дрожжевых 11
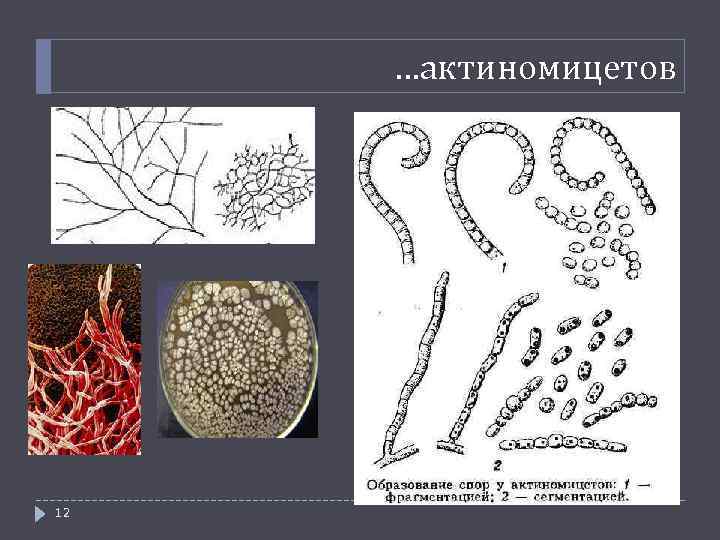
…актиномицетов 12
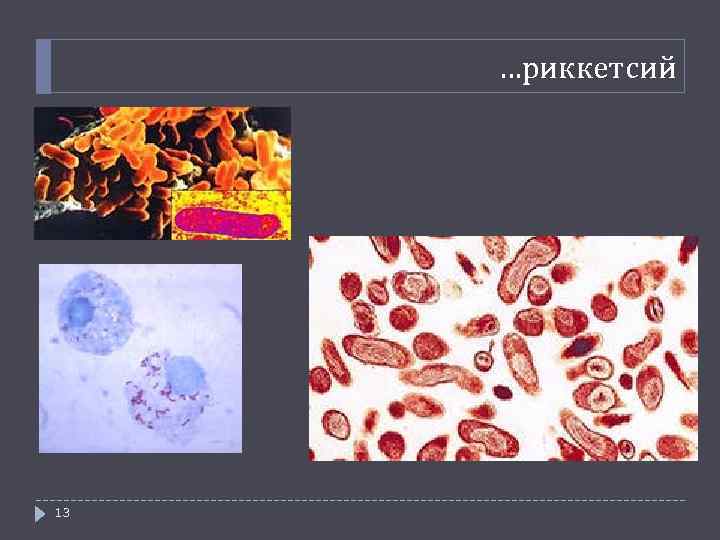
…риккетсий 13
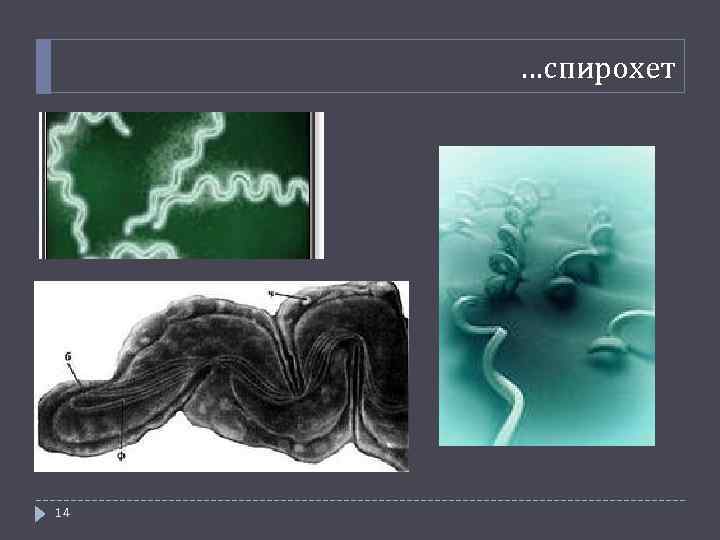
…спирохет 14
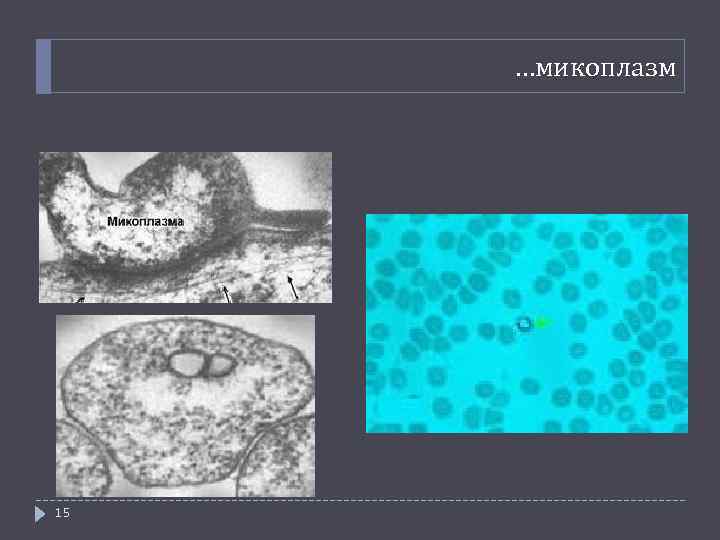
…микоплазм 15
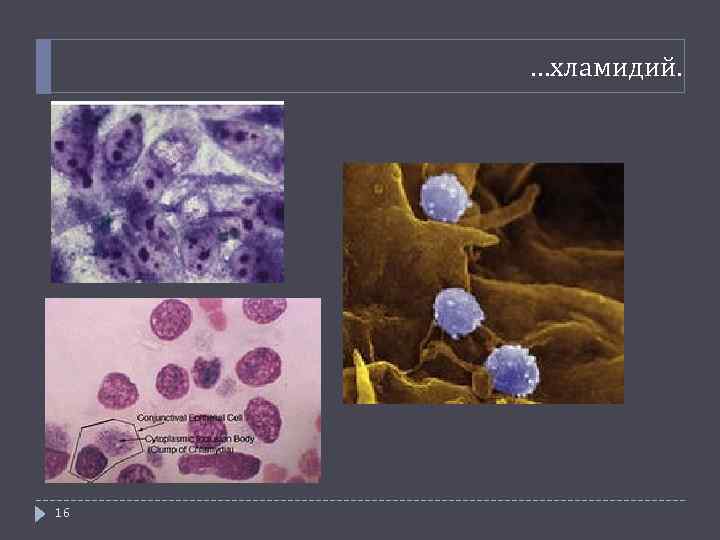
…хламидий. 16

Понятие о простых и сложных методах окраски № 3 17

Для приготовления мазков из клинических образцов в условиях бактериологической лаборатории врачклиницист забирает пробу с помощью отдельного ватного тампона, который помещается в стерильную пробирку и немедленно доставляется в бактериологическую лабораторию.

Тинкториальные свойства это свойства бактерий, грибов и простейших, характеризующие их способность вступать в реакцию с красителями и окрашиваться определенным образом. Источник: http: //mirslovarei. com/content_microslov/tinktorial-nyesvojstva-38950. html#ixzz 2 KQOEqu. DX 19
Задачи окраски микроорганизмов: Определение микробного пейзажа Определение чистоты выделенной культуры Изучение морфологических особенностей микроорганизмов

Микроскопический метод исследования позволяет оценить не только качественный, но и количественный состав возбудителей инфекционного процесса. С помощью этого метода можно обнаружить около 100. 000 (105) микробных клеток в 1 мл исследуемого образца и получить ответ уже через 40 -60 мин после поступления пробы в лабораторию. Поскольку этиологически значимым критерием для условно -патогенных возбудителей является 105 – 106 КОЕ/мл, то чувствительность метода бактериоскопии в большинстве случаев удовлетворяет потребностям клинической микробиологии.
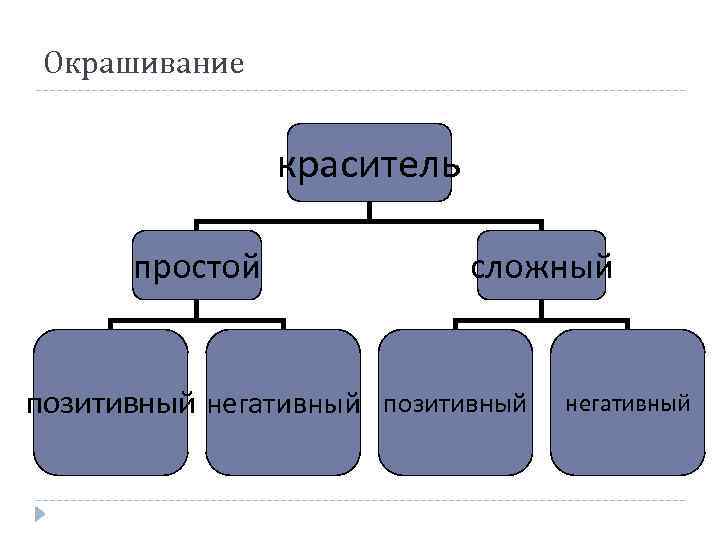
Окрашивание краситель простой сложный позитивный негативный

Красители Красящие растворы готовят из анилиновых красителей. Красители бывают основные (щелочные) и кислые. Кислые красители легко окрашивают элементы клеток, имеющие щелочную реакцию, конкретно протоплазму, поэтому их называют протоплазматическими. Кислые красители бактерий не окрашивают. Употребляют их лишь для прокрашивания фона препарата. Основные красители окрашивают ядра клеток, поэтому их называют ядерными. Бактерии окрашиваются почти исключительно основными красителями. Важнейшие основные красители: красные — нейтральрот, пиронин, сафранин, фуксин основной; фиолетовые — генцианвиолет, кристаллвиолет, метилвиолет, тионин; синие — метиленовая синь, виктория; зеленые — малахитовая зелень, метиловая зелень; коричневые — везувин, хризоидин; черный — индулин. Главные кислые красители: красные — кислый фуксин, эозин; желтые — ауранция, пикриновая кислота; черный — нигрозин. Красители имеют вид порошков или кристаллов, для окраски микробов из них готовят водные и спиртовые растворы. 23

Окраска метиленовой синью – простой позитивный Насыщенный спиртовый раствор метиленового синего 0, 01% раствор гидроокиси калия
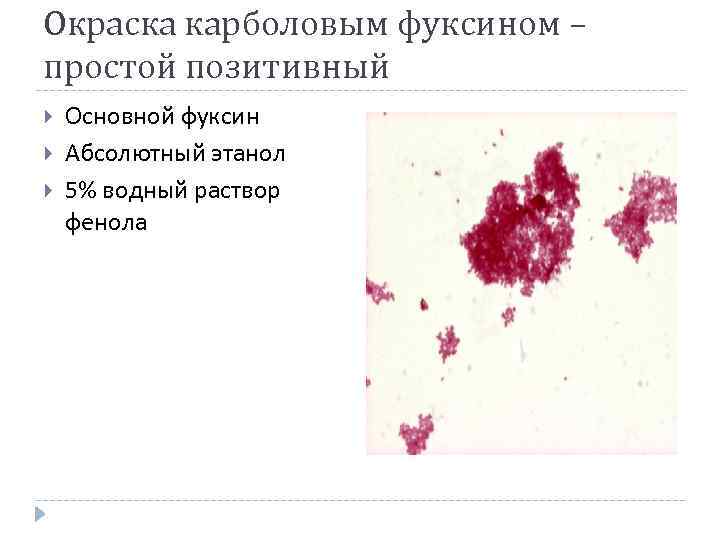
Окраска карболовым фуксином – простой позитивный Основной фуксин Абсолютный этанол 5% водный раствор фенола
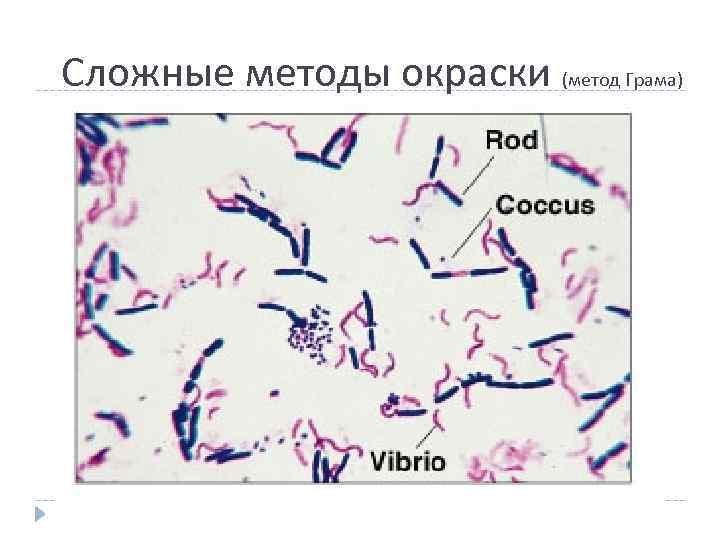
Сложные методы окраски (метод Грама)

Негативные простые красители Тушь Нигрозин Конго красный Кислый фуксин
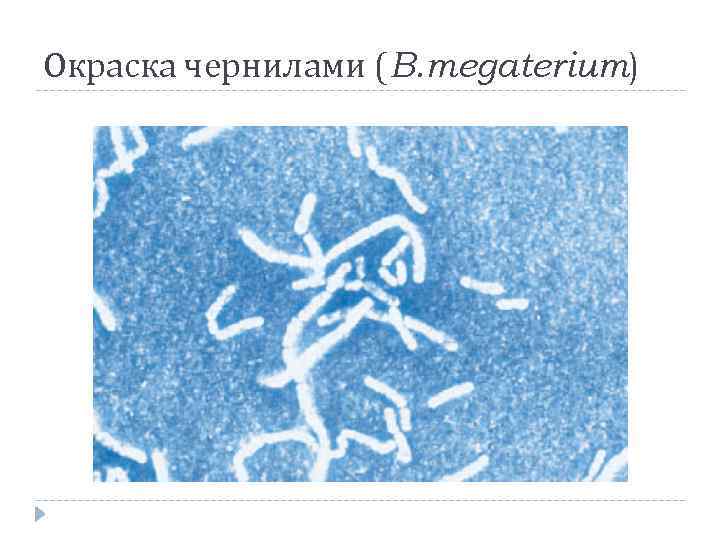
Окраска чернилами (B. megaterium)

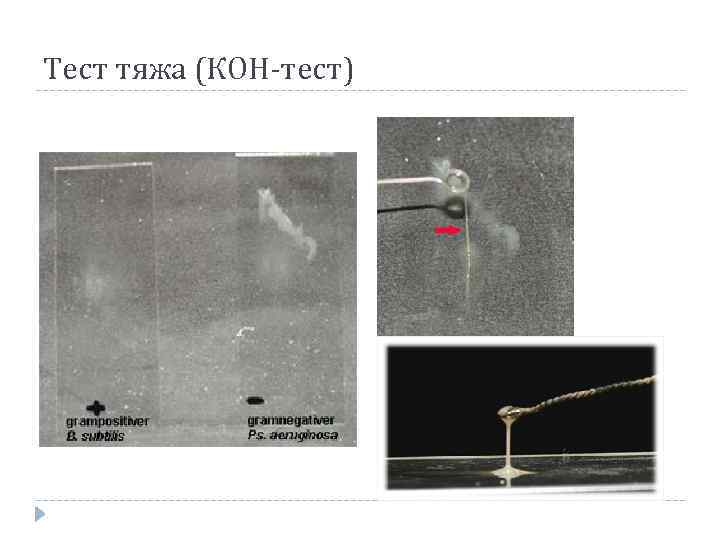
Выявлений различий в строении КС бактерий по Граму и КОН-теста 29

Историческая справка Метод был предложен датским физиком Кристианом Грамом в 1884 г.

Суть метода … Окраска основными красителями Фиксация йодом Промывание растворителем (спирт, реже – ацетон)
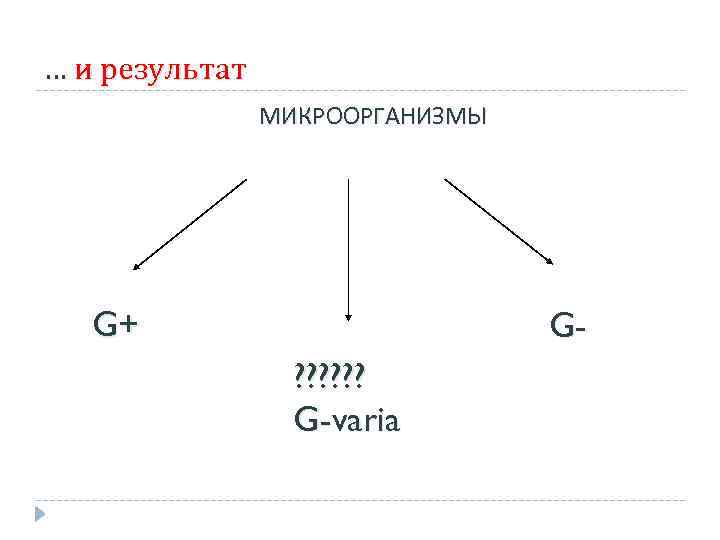
… и результат МИКРООРГАНИЗМЫ G+ G? ? ? G-varia

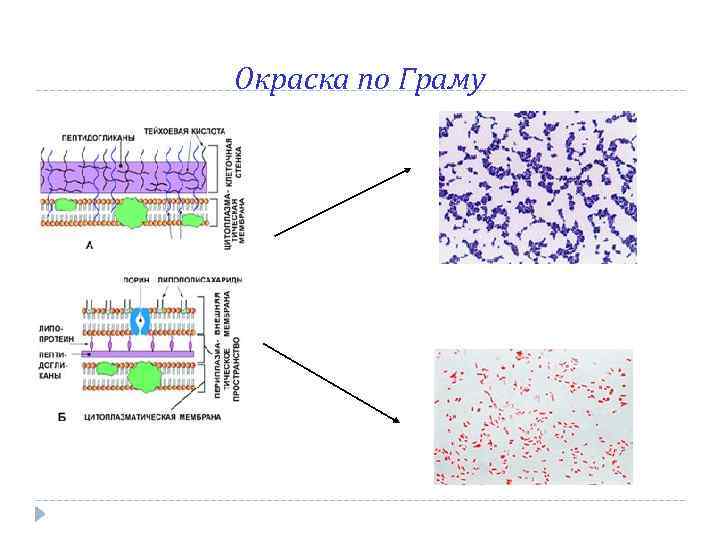
Грамположительные бактерии Преимущественно перитрихи Плазмалемма часто сращена со стенкой, периплазма отсутствует PG 1 – 150 нм, 40 – 90 % от массы стенки МО Нет пилей
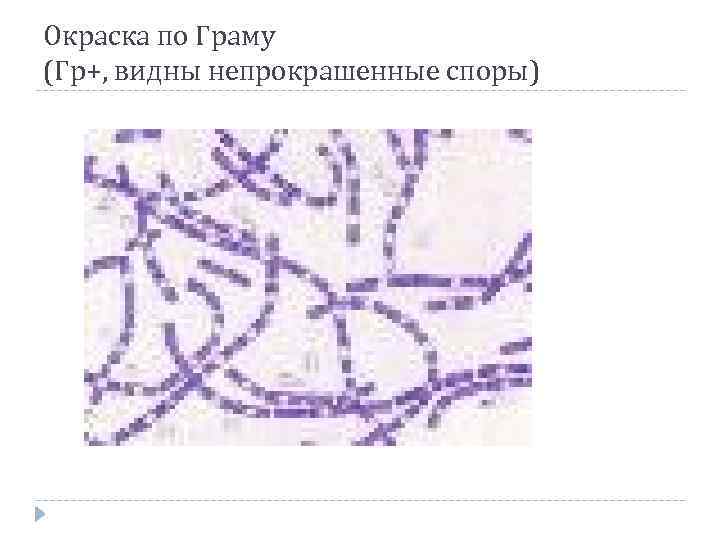
Окраска по Граму (Гр+, видны непрокрашенные споры)

Грамотрицательные бактерии Обладают наружной мембраной Стенка содержит липополисахарды и белок PG 2 – 4 нм, 5 – 10 % от массы стенки МО Имеют пили, жгутикование иного типа

Окраска по Граму (Гр-)
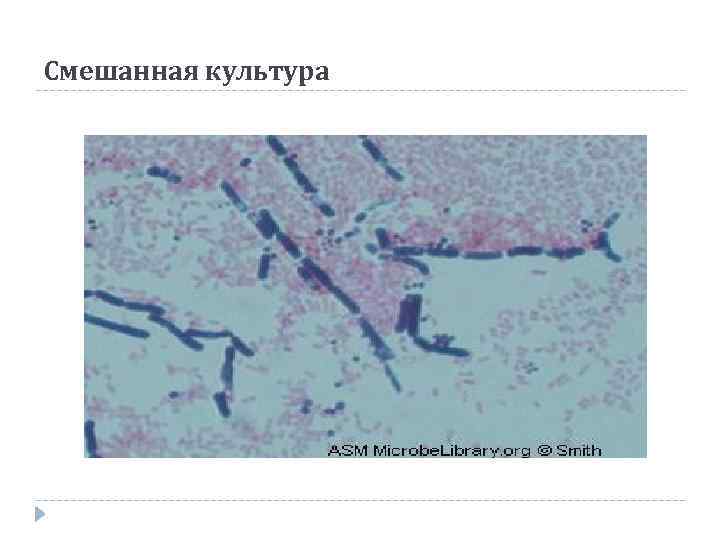
Смешанная культура

Причины разницы окрашивания (гипотезы) 1. 2. G+ имеют большее изоэлектрическое сродство к основным красителям, поэтому комплекс метилвиолет+KJ+J 2 более прочен. Синяя краска удерживается стенкой G+ из-за меньшей проницаемости их плазмалеммы, которая препятствует вымыванию этанолом.

3. Гипотеза химической обусловленности: G+ содержат в стенке рибонуклеат Mg : дезоксирибонуклеат Mg 8: 1; у G- это соотношение – 1, 3: 1, 0. По этой версии, именно рибонуклеат Mg обусловливает грамположительную окраску. Это подтверждается тем, что при экстракции этого соединения солями желчных кислот G+ перестают окрашиваться в синий цвет.
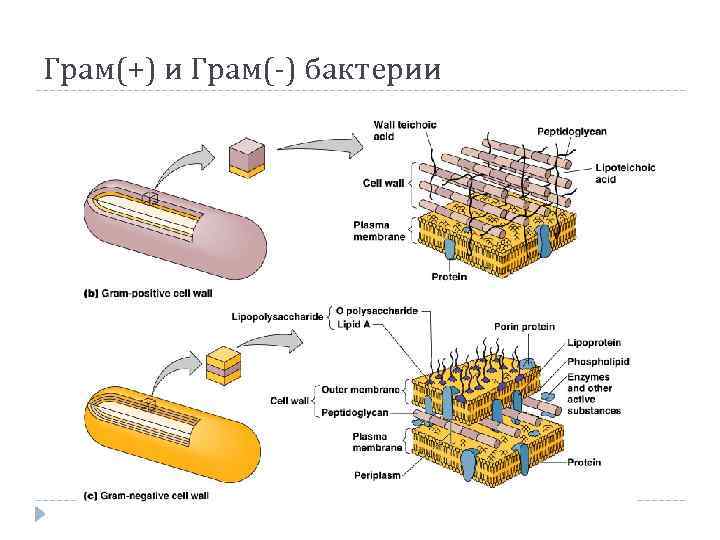
Грам(+) и Грам(-) бактерии
Окраска по Граму

Грамвариабельные бактерии Из вышесказанного очевидно, что причины разной окраски бактерий не вполне ясны. В случае с грамвариабельными бактериями, кроме того, на результаты окрашивания влияют также p. H и состав среды и возраст культуры.

G+ могут окрашиваться отрицательно в следующих случаях: 1. 2. 3. При потере жизнеспособности При активном росте Феномен неравноценного деления и «линьки» стареющих культур молочнокислых и коринеподобных бактерий.

G- окрашиваются положительно при: 1. 2. 3. 4. 5. Утолщении PG Наличии непостоянных поверхностных структур (капсулы, микрокапсулы). Эти слои состоят из белка на 90%; этот белок денатурирует при окрашивании, создает плотную оболочку и препятствует вымыванию краски Наличие толстого слоя гликокаликса Наличие крупных гранул полифосфатов При ошибках лаборанта (недообесцвечивание спиртом)

Параллельные тесты Ввиду частого несоответствия предложено использовать ряд более простых тестов – проба с дезоксихлоратом натрия, проба с KOH или NAOH, проба на аминопептидазную активность и люминисцентные методики.
Тест тяжа (КОН-тест)

Проба на аминопептидную активность Тест-полоски с реактивной зоной для обнаружения α-аланинаминопептидазы у микроорганизмов. α-аланинаминопептидаза — это фермент, локализованный в клеточной стенке, который отщепляет аминокислоту α-аланин от различных пептидов. Значительная активность фермента обнаружена только у грамотрицательных микроорганизмов; грампозитивные или грамвариабельные микроорганизмы, изученные до сих пор, проявляют слабую активность или не проявляют её совсем. Таким образом, аминопептидазный тест представляет собой надежный тест для определения окрашиваемости микроорганизмов по Граму. Он не заменяет окраски по Граму, поскольку не выявляет морфологии. Принцип действия Субстрат в тест-полосках расщепляется α-аланинаминопептидазой на α-аланин и 4 -нитро-анилин. Последний окрашивает бактериальную суспензию в желтый цвет, что делает очевидным присутствие α-аланин-аминопептидазы.
tema2t.pptx