МГ Лекция Нервно- мышечные б-ни.ppt
- Количество слайдов: 75

Моногенные болезни Болезни аминокислотного обмена Нервно – мышечные болезни.

Болезни аминокислотного обмена Фенилкетонурия (ФКУ). • Тип наследования - аутосомнорецессивный. Популяционная частота в европейских странах 1: 10000 новорожденных, а частота гетерозигот 1: 100. Ген ФКУ расположен в длинном плече 12 хромосомы, участке 12 q 22 - q 24. 1.

Этиология и патогенез ФКУ Этиология, патогенез: ФКУ - болезнь аминокислотного обмена. Патологические проявления связаны с недостаточностью печеночного фермента фенилаланин-4 -гидроксилазы (ФАГ). Недостаточность фермента ведет к нарушению процесса гидроксилирования фенилаланина в тирозин. Следствием этого является накопление фенилаланина в крови, образование избыточного количества фенилпировиноградной, фенилуксусной и фенилмолочной кислот, что приводит к нарушению формирования миелиновой оболочки вокруг аксона.

ФКУ Кроме того, высокая концентрация фенилаланина оказывает ингибирующее влияние на ряд ферментных систем, участвующих в метаболизме других аминокислот, снижает синтез медиаторов: серотонина, допамина, норадреналина, эпинефрина. Снижение уровня тирозина ведет к снижению или прекращению образования меланина, поэтому у больных отмечается уменьшенная пигментация кожных покровов, волос, радужной оболочки глаз.

Топический диагноз • Нарушение созревания мозга в 3 -ем триместре беременности (фокальные кортикальные дисплазии, нарушение миграции нейробластов, гетеротопия серого вещества). • Нарушение процессов миелинизации • Депигментация черного вещества и голубого пятна.

Возраст начала ФКУ Проявления болезни появляются у детей через несколько месяцев после рождения, когда в организм ребенка с питанием начинает поступать фенилаланин.

Клиника ФКУ Возникает апатия или повышенная возбудимость, гиперрефлексия, нарушения тонуса мышц, тремор, судорожные эпилептические приступы, характерный «мышиный запах» от тела и биологических жидкостей. Развивается умственная отсталость, которая может достигать тяжелой степени. Течение болезни прогредиентное.


Критерии диагноза ФКУ • Совокупноть генеалогических данных (возможен родственный брак) • Начало в первые месяцы жизни (обычно 2 -6 месяцев) • Характерный фенотип: светлые волосы, голубые глаза • Высокое содержание фенилпировиноградной кислоты в моче и гиперфенилаланина в крови • Характерный запах тела мочи • Гиперрефлексия, нарушение мышечного тонуса, тремор. • Эпилептические припадки, до 1 года - часто «инфантильный спазм» • Формирование умственной отсталости и тяжелых двигательных нарушений

Диагностика ФКУ • Должна проводиться рано. Это имеет практическое значение, поскольку позволяет назначить лечение – диету и, тем самым, предупредить развитие умственной отсталости. • Во всех родильных домах новорожденным проводится скринингисследование на ФКУ. • Для большинства семей возможна молекулярно – генетическая пренатальная диагностика и выявление гетерозигот. • В лаборатории ДНК -диагностики МГНЦ РАМН проводится прямая и косвенная диагностика ФКУ

Лечение ФКУ Единственным лечением является рано (до 2 -х месяцев) начатая диетотерапия: полное исключение из питания продуктов с высоким содержанием фенилаланина (мясо, рыба, яйца, творог, сыр, мучные изделия и каши из естественных круп, фасоль, орехи, шоколад) и назначение белковых гидролизатов (лефанолак, берлофен, гипофенат, пимогран) или аминокислотных смесей, лишенных фенилаланина. Белковые гидролизаты применяют с фруктовыми и овощными соками, пюре и супами.

Прогрессирующие нервно –мышечные заболевания • Большая группа наследственных болезней, при которых отмечается поражение мышечной ткани, периферических нервов и нередко передних рогов спинного мозга. • В настоящее время пользуемся классификацией наследственных нервномышечных заболеваний по Бадаляну Л. О)

Прогрессирующая мышечная дистрофия Дюшенна Болезнь наследуется по аутосомно рецессивному типу, сцепленному с Ххромосомой. Распространенность 9, 7 – 32, 6 на 100000 новорожденных мальчиков, что связано в значительной степени с высокой частотой новых мутаций. Болезнь сцеплена с локусом Хр21. Возникновение ПМД у девочек связано с наличием структурных изменений в Ххромосоме: либо транслокаций, либо сочетанием с с. ШТ 45 Х 0.

ПМД. Миодистрофия Дюшенна Ген ПМД идентифицирован с геном дистрофина. Считается, что именно недостаточность и взаимосвязь определенных изоформ дистрофина определяет тяжесть нервномышечных поражений в сочетании с нарушением интеллекта. ПМД относят к группе болезней дистрофинопатий.

ПМД. Болезнь Дюшенна Заболевание проявляется в возрасте 2 5 лет. Ранними признаками заболевания являются: неловкость, спотыкания, падения, двигательная пассивность. Походка быстро приобретает » утиный» характер. Появляется псевдогипертрофия икроножных мышц ( «икры гнома» ), дельтовидных, ягодичных. Мышечные атрофии первоначально локализуются в мышцах тазового пояса, в проксимальных отделах ног, затем распространяются на плечевой пояс, мышцы спины, проксимальные отделы рук.

ПМД. Болезнь Дюшенна Появляется «осиная» талия, крыловидные лопатки, лордоз, сколиоз, Мышечная слабость нарастает, больные при вставании демонстрируют приемы «взбирание лесенкой» , «по самому себе» . На ранней стадии заболевания исчезают сухожильные рефлексы, вначале коленные, затем остальные. Нередко долго сохраняются ахилловы рефлексы.

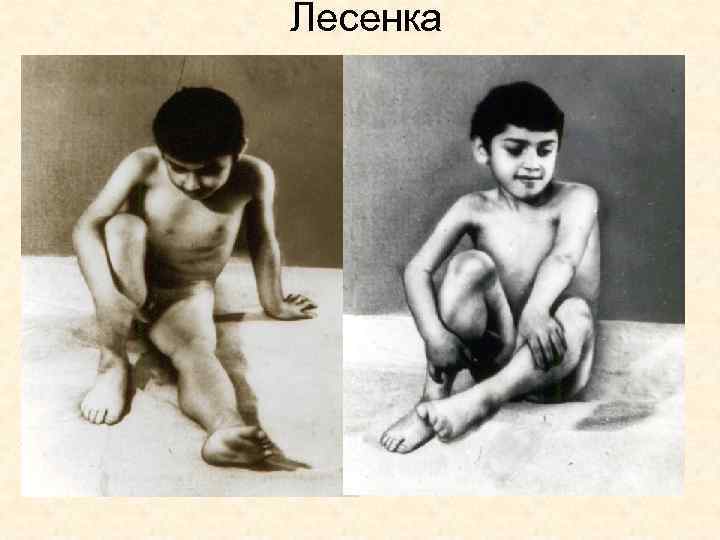
Лесенка




• • • Диагностика ПМД (болезни Дюшенна). Диагностика базируется: на оценке клинических симптомов, анализа уровня креатинфосфокиназы в крови (в 50 -100 раз выше нормы) даже в начальных стадиях болезни данных электромиографии - первично мышечный характер изменений компьютерной томографии скелетных мышц (выявляет зоны пониженной плотности, признаки мышечной атрофии) признаков первичной мышечной дистрофии в биоптатах скелетных мышц картирования гена больного и у беременной матери – кондуктора гена ПМД (пренатальная диагностика).

ПМД. Беккера Миодистрофия Беккера является аллельным вариантом ПМД - экспрессии единого генетического дефекта в локусе р21 Х-хромосомы. • Миодистрофия Беккера встречается в 3 -5 раз реже ПМД. При похожести клинической картины, марша и прогредиентности развития параличей и парезов, имеются различия.

ПМД Беккера • . При форме Беккера: • • • дебют заболевания после 5 – 10 лет жизни, течение болезни мягче нарушения интеллекта не характерны ретракции сухожилий не выражены кардиопатия может отсутствовать часть больных доживают до фертильного возраста и таким образом ПМД передается внукам

ПМД Беккера Для установления конкретной формы миодистрофии, выявления носительства гена и пренатальной диагностики проводится мутационный анализ, который базируется на оценке полиморфизма длины рестрикционных фрагментов и является общепринятым методом для диагностики болезней Дюшенна и Беккера.

ПМД Беккера • Помогает различить эти два заболевания анализ содержания дистрофина в мышцах с использованием иммуногистохимической реакции на дистрофин. • ПМД Беккера дифференцируют от проксимальных типов спинальных амиотрофий, полиомиелита, дерматомиозита, метаболических и эндокринных миопатий, Д - резистентного рахита.

ПМД Эмери -Дрейфуса (МДЭД) • Тип наследования: рецессивный, сцепленный с Х-хромосомой. • Топический диагноз - ген МДЭД картирован в дистальном отделе длинного плеча Х-хромосомы. • Продукт гена идентифицирован – это мембранный белок эмерин. Эмерин локализуется в ядерной мембране скелетных, гладких мышц и кардиомиоцитов.

ПМД Эмери -Дрейфуса (МДЭД ). • Клиника: Атрофии первоначально развиваются в трехглавой и двуглавой мышцах плеча. затем распространяются на мышцы тазового пояса и/или перонеальной группы. Быстро появляются ретракции ахилловых сухожилий, сгибательные контрактуры в локтевых суставах, тугоподвижность шеи, люмбальный лордоз. Больные ходят, опираясь на пальцы и наружный край стопы. Псевдогипертрофии мышц отсутствуют. Интеллект сохранен.

ПМД Эмери -Дрейфуса (МДЭД) • медленно прогрессирующий тип течения • активность ферментов в крови повышена, но не достигает таких высоких цифр, как при МДЭД и ПМД. • на ЭМГ выявляется первичномышечный тип изменений. • биопсия скелетных мышц свидетельствует об изменении первичного характера.

МДЭД • Критерии диагноза • рецессивный, сцепленный с Х-хромосомой, тип наследования • дебют в 4 -15 лет • ретракции ахилловых сухожилий, сгибательные контрактуры в локтевых суставах, тугоподвижность шеи. • первоначальное развитие атрофий в трехглавой и двуглавой мышцах плеча с последующим распространением на мышцы тазового пояса и/или перонеальной группы. • псевдогипертрофии мышц отсутствуют. • кардиомиопатии, нарушение сердечного ритма, проводимости.

• Течение болезни медленное, несколько десятилетий. Прогноз жизни определяется тяжестью поражения сердца. • В биоптатах скелетных мышц - умеренно выраженные неспецифические изменения первичного характера: вариабельные размеры мышечных волокон, некроз отдельных мышечных волокон, очаговая пролиферация соединительной ткани. Ферментно - гистохимический анализ выявляет атрофии мышечных волокон I типа, гипертрофию волокон II типа, отсутствие или уменьшение числа волокон II тип В типа,

Диагностика самым точным методом диагностики МДЭД является метод SSСР-анализа, выявляющий мутации во всех 6 экзонах гена эмерина. Дифференциальный диагноз с синдромом ригидного позвоночника. Лечение – специфической терапии нет

Прогрессирующая мышечная дистрофия (ПМД) Эрба - Рота • Тип наследования – аутосомно-рецессивный • Частота: 1, 5 на 100000 населения. • Первично-мышечное поражение. • Начало заболевания – 14 -16 лет. Клиника : мышечная слабость, утомляемость, изменение походки по типу «утиной» , атрофии мышц локализуются в проксимальных отделах ног. Иногда вместе поражаются мышцы тазового и плечевого пояса, затем вовлекаются мышцы спины и живота, возникают лордоз, «крыловидные лопатки» . «осиная талия» , больной встает «лесенкой» . Псевдогипертрофии не выражены. Снижение рефлексов появляется рано.

МПД Эрба – Рота. • Течение болезни быстро прогрессирующее • Инвалидизация наступает рано • Диагностика: – на основании данных анамнеза, – особенностей клиники (атрофии проксимальные, умеренные псевдогипертрофии), – первично-мышечный тип повреждения по данным ЭМГ. Дифференциальный диагноз: с МПД Беккера и СМА Кугельберга-Веландера.


Плече-лопаточно-лицевая форма МПД Ландузи – Дежерина. • • Тип наследования – аутосомно-доминантный. Частота 0, 9 -2, 0 на 100000 населения. Начало в возрасте 10 – 20 лет. Клиника: мышечная слабость и атрофии в мимической мускулатуре, в мышцах плеча, лопаток, губы типа «тапира» , гипомимичное лицо, «поперечная» улыбка, полированный лоб, атрофии мышц межлопаточной области, мышц плеча, большой грудной, передней зубчатой. трапциевидной (свободные надплечья, сколиоз. крыловидные лопатки). псевдогипертрофии умереннные. Сухожильные рефлексы низкие с рук. • Течение медленно-прогрессирующее. • Дифференциальный диагноз с другими формами ПМД.


Спинальные мышечные атрофии детского возраста (СМА) Спинальные амиотрофии (денервационные амиотрофии). Различают: • спинальную мышечную атрофию детского возраста, I тип (болезнь Верднига-Гоффманна), • спинальную мышечную атрофию детского возраста, II III тип ип (промежуточный и вариант) • спинальную мышечную атрофию детского возраста, III тип, болезнь Кугельберга-Веландера) Тип наследования - все три заболевания наследуются по аутосомно-рецессивному типу.

СМА • Эпидемиология: частота заболевания вариабельна в зависимости от географии, например: 1: 24570 детей в Италии (Венето) до 1: 8496 в Италии (Сицилия), 1994. . • Топика - все три типа сцеплены с локусом 5 q 11. 2 -13. 3. Характеризуются дегенерацией клеток передних рогов спинного мозга и двигательных ядрах черепно-мозговых нервов.

СМА • • • Возраст – зависит от типа спинальной мышечной атрофии: при I типе (болезнь Верднига-Гоффманна) начало внутриутробное или сразу после рождения. при I I типе - 8 - 14 месяцев. при I I I типе – после 18 месяцев жизни Течение: при I типе быстро прогрессирующее, летальный исход наступает к 1 -1, 5 годам, при I I типе – также неблагоприятное, летальный исход к 1 – 4 годам. при I I I типе – относительно доброкачественное

СМА • Спинальная мышечная атрофия детского возраста, I тип (болезнь Верднига-Гоффманна) Возраст – зависит от типа спинальной мышечной атрофии: • при I типе (болезнь Верднига-Гоффманна) начало внутриутробное или сразу после рождения. • при I I типе - 8 - 14 месяцев. • при I I I типе – после 18 месяцев жизни • Течение: при I типе быстро прогрессирующее, летальный исход наступает к 1 -1, 5 годам, • при I I типе – также неблагоприятное, летальный исход к 1 – 4 годам. • при I I I типе – относительно доброкачественное

СМА Спинальная мышечная атрофия детского возраста, I тип (болезнь Верднига-Гоффманна) Клиника. О заболевании свидетельствует позднее и слабое шевеление плода. С рождения у ребенка выраженная генерализованная мышечная гипотония (синдром вялого ребенка), очень вялые движения или их отсутствие. В первые месяцы жизни появляются фасцикулярные подергивания в мышцах спины, туловища, проксимальных отделах конечностей. В этих мышцах развиваются атрофии, Возникают ранние проявления бульбарных расстройств: слабый крик, вялое сосание, дисфагия, фибрилляция языка

СМА • Грудная клетка уплощена вследствие пареза межреберных мышц. Отмечаются частые аспирации, респираторные инфекции и пневмония. За несколько месяцев больные дети оказываются полностью парализованы, с диффузными атрофиями всех мышц и с нарастающим по тяжести бульбарным синдромом.

СМА • Течение - быстро прогрессирующее, летальный исход наступает к 1 -1, 5 годам, в связи с нарастающими парезами дыхательной мускулатуры. Непосредственной причиной смерти, как правило, бывает пневмония

СМА • Критерии диагноза • аутосомно-рецессивный тип наследования. • дебют заболевания – пренатальный период и первые полгода жизни • симптомокомплекс « вялый ребенок» • задержка моторного развития • ЭМГ – поражение передних рогов, признаки денервации • в биоптатах скелетных мышц обнаруживаются группы мелких круглых волокон, гипертрофированных волокон I типа и атрофированных волокон I и II типов • быстропрогрессирующее течение • неблагоприятный прогноз

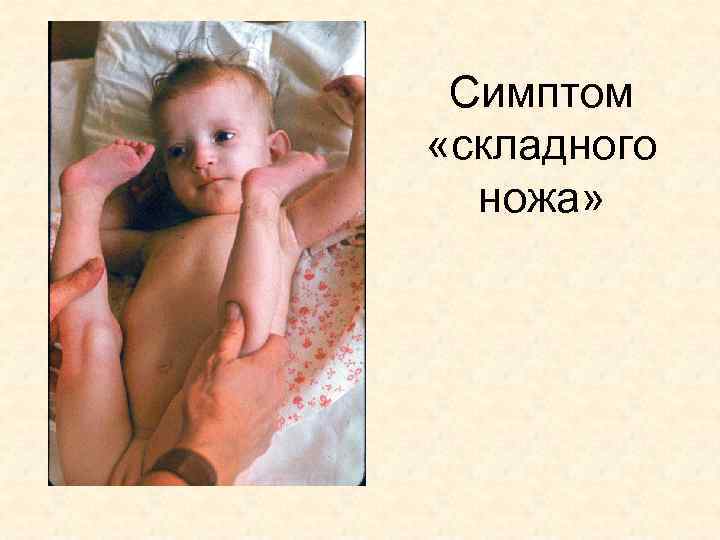
Симптом «складного ножа»

СМА Диагностика: • ЭМГ – поражение передних рогов. признаки денервации. • биохимический анализ крови выявляет нормальную или несколько повышенную КФК • в биоптатах скелетных мышц обнаруживаются группы мелких круглых волокон, гипертрофированных волокон I типа и атрофированных волокон I и II типов. • возможна ДНК-овая диагностика пренатальная и при наличии клинических проявлений.

СМА Дифференциальный диагноз: • спинальную мышечную атрофию детского возраста, I тип (болезнь Верднига-Гоффманна) необходимо дифференцировать от структурных миопатий (немалиновая. миотубулярная, болезнь центрального стержня), врожденных миопатий и органических ацидурий. – Лечение – синдромальное и симптоматическое.

Спинальная мышечная атрофия детского возраста, II тип (промежуточный вариант) отличается более поздним началом заболевания, обычно в 8 – 14 месяцев.

Клиника: • Начальные проявлениями в виде мышечной слабости и гипотонии. Диффузные атрофии мышц на ранних стадиях заболевания выражены мало, так как «завуалированы» жировой клетчаткой. характерны « обсосанные» пальцы, фасцикулярный тремор кончиков вытянутых пальцев, фасцикулярные и фибриллярные подергивания мышц проксимальных отделов. Сухожильные рефлексы исчезают к 2 годам. Грудная клетка уплощается из-за слабости дыхательной мускулатуры. нарастает степень моторной задержки. Наряду с ЗМР формируется кифосколиоз. • Течение неблагоприятное, летальный исход к 1 – 4 годам

Критерии диагноза: • аутосомно-рецессивный тип наследования • дебют заболевания – первые 18 месяцев жизни • симптомокомплекс « вялый ребенок» • задержка моторного развития • фасцикулярный тремор кончиков вытянутых пальцев, фасцикулярные и фибриллярные подергивания мышц проксимальных отделов

• диффузные атрофии мышц, преимущественно проксимальных отделов, «обсосанные» пальцы, • в биоптатах скелетных мышц обнаруживаются группы мелких круглых волокон, гипертрофированных волокон I типа и атрофированных волокон I и II типов • ЭМГ – признаки денервации • прогрессирующее течение • неблагоприятный прогноз

Дифференциальный диагноз проводится со структурными миопатиями и врожденными миопатиями (тип Фукуямы и др. ), атонически - астатической формой ДЦП.

СМА ( болезнь Кугельберга - Веландера) Спинальная мышечная атрофия детского возраста, III тип). Клиника: Дебют заболевания после 18 месяцев жизни с пиком манифестации в 2 – 5 лет. Первыми симптомами является слабость мышц тазового пояса и проксимальных отделов нижних конечностей. Дети не могут бегать, спотыкаются и падают, затрудняются при подъеме по лестнице, вставании.


СМА ( болезнь Кугельберга - Веландера) • Наличие в биоптатах скелетных мышц нормальных, атрофированных и гипертрофированных волокон. Отсутствие дифференцировки волокон на гистохимические типы. • На ЭМГ признаки денервации и поражения передних рогов спинного мозга • Медленно прогрессирующее течение • Относительно благоприятный прогноз, инвалидизация развивается поздно • Дифференциальный диагноз проводится с со структурными миопатиями, тазово поясными формами ПМД (Дюшенна, Эрба), гликогенозом У типа.

СМА ( болезнь Кугельберга - Веландер • В дальнейшем присоединяются атрофии мышц проксимальных отделов верхних конечностей, снижаются сухожильные рефлексы. • Атрофии, как правило, симметричные равномерные. У половины больных возникают умеренные гипертрофии икроножных мышц, иногда в дельтовидных. У большинства больных наблюдаются спонтанные фасцикуляции в мышцах плечевого и тазового пояса, реже в мышцах голени и предплечья. С нарастанием вялых парезов связано возникновение костных деформаций (сколиоза. деформации грудной клетки, контрактуры в крупных суставах и деформация стоп).

СМА ( болезнь Кугельберга - Веландера) • Наличие в биоптатах скелетных мышц нормальных, атрофированных и гипертрофированных волокон. Отсутствие дифференцировки волокон на гистохимические типы. • На ЭМГ признаки денервации и поражения передних рогов спинного мозга • Медленно прогрессирующее течение • Относительно благоприятный прогноз, инвалидизация развивается поздно • Дифференциальный диагноз проводится с со структурными миопатиями, тазово поясными формами ПМД (Дюшенна, Эрба), гликогенозом У типа.

Наследственные прогрессирующие полиневропатии.

Моторно-сенсорная невропатия Шарко-Мари-Тутта тип 1 • - гетерогенная группа наследственных заболеваний со сходным фенотипом и различным типом наследования. В большинстве случаев (до 90% семей) ШМТ -1 наследуется по аутосомно доминантному типу. Генный дефект выявлен на коротком плече 17 хромосомы. Реже встречается ШМТ-1 с аутосомно рецессивным типом наследования. Дефектный ген обнаружен нам длинном плече 8 хромосомы.

Шарко-Мари-Тутта Клиника: задержка моторного развития с первых месяцев жизни. Преобладает симметричная дистальная мышечная гипотрофия и слабость, снижение рефлексов, дистальное, обычно также симметричное, снижение чувствительности по полиневритическом типу. В начальной стадии заболевания характерен симптом «топтания» . Реже заболевание начинается с чувствительных расстройств: болей, парестезий. Атрофии появляются вначале в перонеальных и передних большеберцовых мышцах. Ноги приобретают форму «перевернутых бутылок» , у стоп формируется высокий свод. Меняется походка.

Шарко-Мари-Тутта Больной не может ходить на пятках. Амиотрофические изменения распространяются на руки, также симметрично на дистальные отделы. В тяжелых случаях формируется «когтистая» или «обезьянья» кисть. Типично неравномерное исчезновение рефлексов, атаксия, Появляются костносуставные деформации. Вегетативные расстройства в виде гипергидроза, дистальной гиперемии. Интеллект обычно не страдает.

Шарко-Мари-Тутта Критерии диагноза: • Аутосомно – рецессивный тип наследования • Дебют заболевания в первом десятилетии • Задержка моторного развития с первых месяцев жизни • Атрофии и слабость мышц дистальных отделов конечностей • Наличие атаксии и костно-суставных деформаций • Снижение скорости проведения импульсов по моторным и сенсорным волокнам • Гипертрофические изменения периферических нервов • Прогрессирующий характер течения

Шарко-Мари-Тутта • Точным методом диагностики является биопсия икроножного нерва с целью выявления участков некомпактного миелина «луковичных головок» . • Болезнь обычно прогрессирует медленно, тяжесть моторных и чувствительных нарушений зависит от генетических и, в некоторой степени, от средовых факторов. • Диагноз ставится на основании комплекса клинических, нейрофизиологических, патоморфологических методов и ДНКдиагностики

Шарко-Мари-Тутта Дифференциальный диагноз: другие формы мотосенсорной нейропатии, болезнь Фридрейха. Следует отметить, что нарушения чувствительности могут быть очень слабыми, что затрудняет дифференцирование от наследственной дистальной моторной невропатии, при которой не наблюдается нарушений чувствительности, и от наследственной сенсорно - вегетативной формы, для которой значительные сенсорные нарушения типичны. Лечение направлено на улучшение трофики мышц, усиление проводимости нервов.









МГ Лекция Нервно- мышечные б-ни.ppt