Lektsia-apoptoz-12_11_12-BFU.ppt
- Количество слайдов: 51
 Молекулярные мишени управления апоптозом и пролиферацией клеток: роль внутриклеточных и внеклеточных сигнальных систем Д-р мед. наук, профессор Рязанцева Н. В.
Молекулярные мишени управления апоптозом и пролиферацией клеток: роль внутриклеточных и внеклеточных сигнальных систем Д-р мед. наук, профессор Рязанцева Н. В.
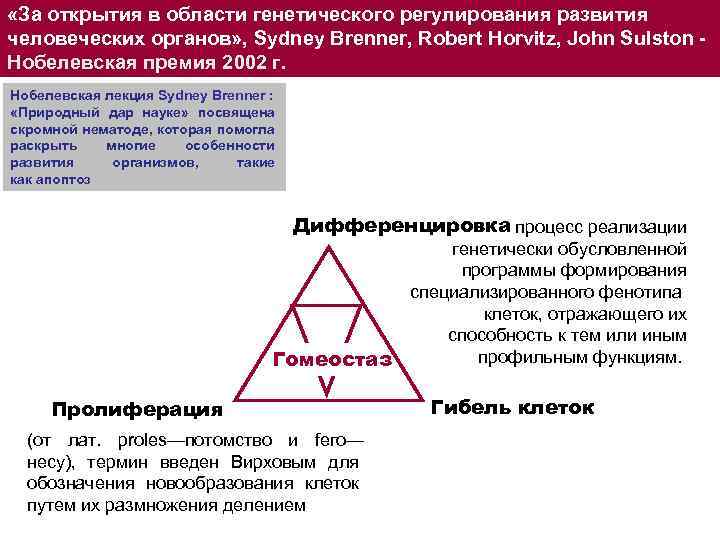 «За открытия в области генетического регулирования развития человеческих органов» , Sydney Brenner, Robert Horvitz, John Sulston - Нобелевская премия 2002 г. Нобелевская лекция Sydney Brenner : «Природный дар науке» посвящена скромной нематоде, которая помогла раскрыть многие особенности развития организмов, такие как апоптоз Дифференцировка процесс реализации Гомеостаз Пролиферация (от лат. proles—потомство и fего— несу), термин введен Вирховым для обозначения новообразования клеток путем их размножения делением генетически обусловленной программы формирования специализированного фенотипа клеток, отражающего их способность к тем или иным профильным функциям. Гибель клеток
«За открытия в области генетического регулирования развития человеческих органов» , Sydney Brenner, Robert Horvitz, John Sulston - Нобелевская премия 2002 г. Нобелевская лекция Sydney Brenner : «Природный дар науке» посвящена скромной нематоде, которая помогла раскрыть многие особенности развития организмов, такие как апоптоз Дифференцировка процесс реализации Гомеостаз Пролиферация (от лат. proles—потомство и fего— несу), термин введен Вирховым для обозначения новообразования клеток путем их размножения делением генетически обусловленной программы формирования специализированного фенотипа клеток, отражающего их способность к тем или иным профильным функциям. Гибель клеток
 Эволюция исследования апоптоза 2002 г. Нобелевская премия в области физиологии и медицины за фундаментальные исследования в области генетической регуляции роста и развития органов, а также процессов апоптоза Sydney Brenner Robert Horvitz John Sulston 1972 г. J. Kerr, A. Wyllie, A. Currie создали теорию апоптоза: апоптоз представлен как фундаментальное и универсальное явление в клеточной биологии 19651971 г. J. Kerr идентифицировал и подробно описал особый тип клеточной смерти, сходный с таковым у эмбриона 1951 г. A. Glucksmann описал морфологию ПГК как особого вида клеточной смерти, однако, приписывая ее лишь эмбриогенезу 1914 г. L. Graper, изучавший рак молочной железы, предположил существование механизмов, поддерживающих баланс массы клеток в активно пролиферирующих тканях 1890 г. С. Weigert провел первое целенаправленное морфологическое изучение клеточной смерти, ввел несколько терминов и понятий относительно микроскопических признаков гибели клеток: аутолиз, пикноз, кариолизис. 1885 г. W. Flemming et al. описали клеточную гибель как физиологическое явление в овариальном эпителии и лактирующей молочной железе.
Эволюция исследования апоптоза 2002 г. Нобелевская премия в области физиологии и медицины за фундаментальные исследования в области генетической регуляции роста и развития органов, а также процессов апоптоза Sydney Brenner Robert Horvitz John Sulston 1972 г. J. Kerr, A. Wyllie, A. Currie создали теорию апоптоза: апоптоз представлен как фундаментальное и универсальное явление в клеточной биологии 19651971 г. J. Kerr идентифицировал и подробно описал особый тип клеточной смерти, сходный с таковым у эмбриона 1951 г. A. Glucksmann описал морфологию ПГК как особого вида клеточной смерти, однако, приписывая ее лишь эмбриогенезу 1914 г. L. Graper, изучавший рак молочной железы, предположил существование механизмов, поддерживающих баланс массы клеток в активно пролиферирующих тканях 1890 г. С. Weigert провел первое целенаправленное морфологическое изучение клеточной смерти, ввел несколько терминов и понятий относительно микроскопических признаков гибели клеток: аутолиз, пикноз, кариолизис. 1885 г. W. Flemming et al. описали клеточную гибель как физиологическое явление в овариальном эпителии и лактирующей молочной железе.
 Основные виды клеточной гибели Апоптоз (греч. απόπτωσις — опадание листьев) это активная форма гибели клеток, являющаяся результатом реализации ее генетической программы или ответом на внешние факторы и требующая затрат энергии и синтеза макромолекул de novo. Аутофагия внутриклеточные Аноикис в случае потери контакта компоненты подвергаются деградации внутри лизосом с внеклеточным матриксом Митотическая катастрофа Сенессенс – биологическое старение Параптоз Аутохизис
Основные виды клеточной гибели Апоптоз (греч. απόπτωσις — опадание листьев) это активная форма гибели клеток, являющаяся результатом реализации ее генетической программы или ответом на внешние факторы и требующая затрат энергии и синтеза макромолекул de novo. Аутофагия внутриклеточные Аноикис в случае потери контакта компоненты подвергаются деградации внутри лизосом с внеклеточным матриксом Митотическая катастрофа Сенессенс – биологическое старение Параптоз Аутохизис
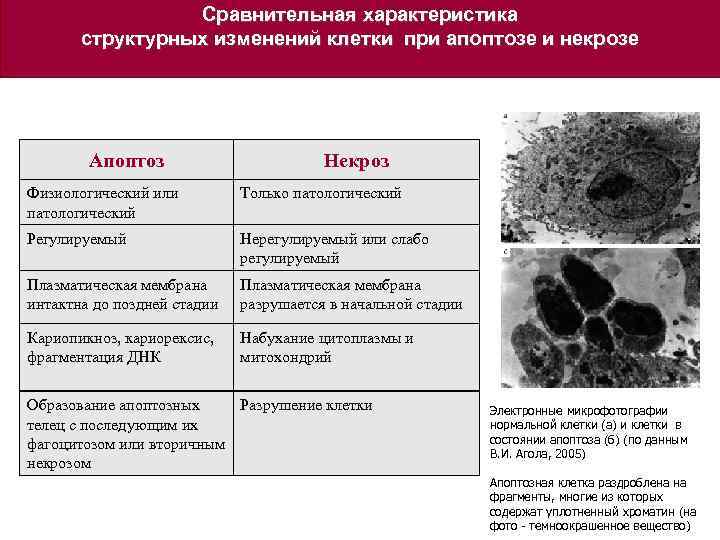 Сравнительная характеристика структурных изменений клетки при апоптозе и некрозе Апоптоз Некроз Физиологический или патологический Только патологический Регулируемый Нерегулируемый или слабо регулируемый Плазматическая мембрана интактна до поздней стадии Плазматическая мембрана разрушается в начальной стадии Кариопикноз, кариорексис, фрагментация ДНК Набухание цитоплазмы и митохондрий Образование апоптозных Разрушение клетки телец с последующим их фагоцитозом или вторичным некрозом Электронные микрофотографии нормальной клетки (а) и клетки в состоянии апоптоза (б) (по данным В. И. Агола, 2005) Апоптозная клетка раздроблена на фрагменты, многие из которых содержат уплотненный хроматин (на фото - темноокрашенное вещество)
Сравнительная характеристика структурных изменений клетки при апоптозе и некрозе Апоптоз Некроз Физиологический или патологический Только патологический Регулируемый Нерегулируемый или слабо регулируемый Плазматическая мембрана интактна до поздней стадии Плазматическая мембрана разрушается в начальной стадии Кариопикноз, кариорексис, фрагментация ДНК Набухание цитоплазмы и митохондрий Образование апоптозных Разрушение клетки телец с последующим их фагоцитозом или вторичным некрозом Электронные микрофотографии нормальной клетки (а) и клетки в состоянии апоптоза (б) (по данным В. И. Агола, 2005) Апоптозная клетка раздроблена на фрагменты, многие из которых содержат уплотненный хроматин (на фото - темноокрашенное вещество)
 Роль апоптоза в патологии Биологическая роль апоптоза Роль апоптоза в регуляции физиологических и патологических процессов (исследования в этом направлении продолжаются) • Эмбриогенез, инволюционные процессы (разрушение овариального фолликула, инволюция волосяного фолликула, селекция лимфоцитов в иммунной системе и др. ), элиминация генетически дефектных, инфицированных клеток • Заболевания, связанные с ингибированием апоптоза: опухолевые заболевания (карциномы с мутацией гена р53, рак молочной железы, рак яичника и др. ), аутоиммунные заболевания, хронические вирусные инфекции • Заболевания, связанные с усилением апоптоза: острые вирусные и бактериальные инфекции, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз и др. )
Роль апоптоза в патологии Биологическая роль апоптоза Роль апоптоза в регуляции физиологических и патологических процессов (исследования в этом направлении продолжаются) • Эмбриогенез, инволюционные процессы (разрушение овариального фолликула, инволюция волосяного фолликула, селекция лимфоцитов в иммунной системе и др. ), элиминация генетически дефектных, инфицированных клеток • Заболевания, связанные с ингибированием апоптоза: опухолевые заболевания (карциномы с мутацией гена р53, рак молочной железы, рак яичника и др. ), аутоиммунные заболевания, хронические вирусные инфекции • Заболевания, связанные с усилением апоптоза: острые вирусные и бактериальные инфекции, нейродегенеративные заболевания (болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз и др. )
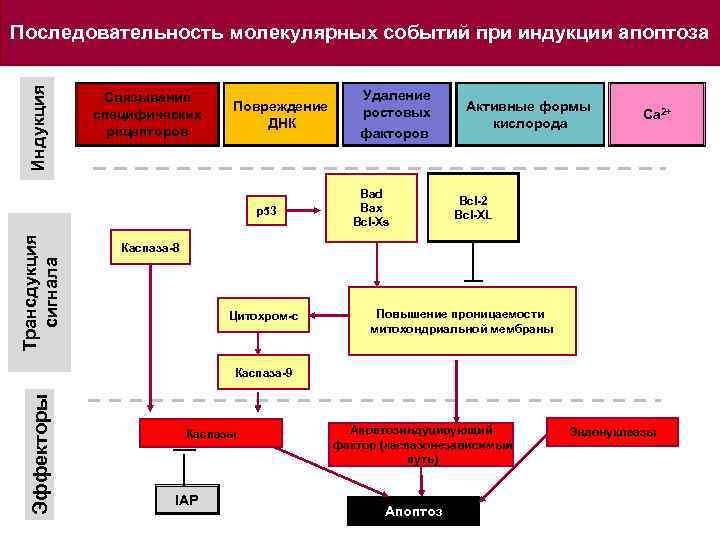 Индукция Последовательность молекулярных событий при индукции апоптоза Связывание специфических рецепторов Повреждение ДНК Трансдукция сигнала p 53 Удаление ростовых факторов Bad Bax Bcl-Xs Активные формы кислорода Са 2+ Bcl-2 Bcl-XL Каспаза-8 Цитохром-с Повышение проницаемости митохондриальной мембраны Эффекторы Каспаза-9 Каспазы IAP Апоптозиндуцирующий фактор (каспазонезависимый путь) Апоптоз Эндонуклеазы
Индукция Последовательность молекулярных событий при индукции апоптоза Связывание специфических рецепторов Повреждение ДНК Трансдукция сигнала p 53 Удаление ростовых факторов Bad Bax Bcl-Xs Активные формы кислорода Са 2+ Bcl-2 Bcl-XL Каспаза-8 Цитохром-с Повышение проницаемости митохондриальной мембраны Эффекторы Каспаза-9 Каспазы IAP Апоптозиндуцирующий фактор (каспазонезависимый путь) Апоптоз Эндонуклеазы
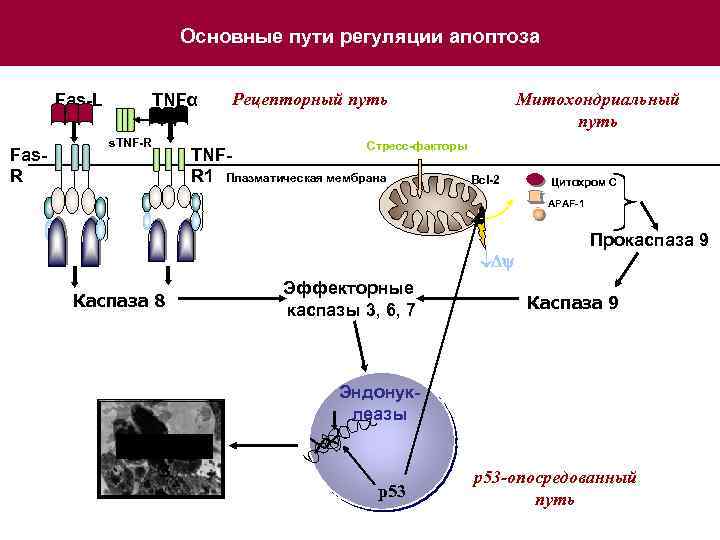 Основные пути регуляции апоптоза Fas-L TNFα s. TNF-R Fas. R Рецепторный путь Митохондриальный путь Стресс-факторы TNFR 1 Плазматическая мембрана Bcl-2 Цитохром С APAF-1 АТФ D D E E D D Dy Каспаза 8 Эффекторные каспазы 3, 6, 7 Прокаспаза 9 Каспаза 9 Эндонуклеазы АПОПТО З р53 -опосредованный путь
Основные пути регуляции апоптоза Fas-L TNFα s. TNF-R Fas. R Рецепторный путь Митохондриальный путь Стресс-факторы TNFR 1 Плазматическая мембрана Bcl-2 Цитохром С APAF-1 АТФ D D E E D D Dy Каспаза 8 Эффекторные каспазы 3, 6, 7 Прокаспаза 9 Каспаза 9 Эндонуклеазы АПОПТО З р53 -опосредованный путь
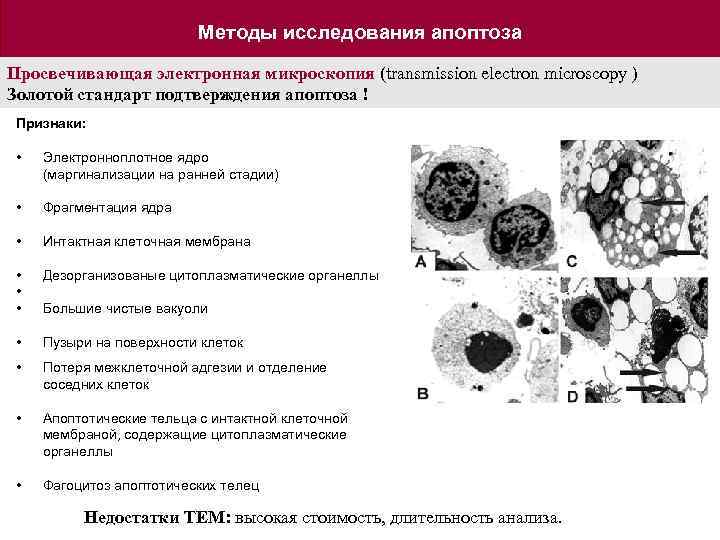 Методы исследования апоптоза Просвечивающая электронная микроскопия (transmission electron microscopy ) Золотой стандарт подтверждения апоптоза ! Признаки: • Электронноплотное ядро (маргинализации на ранней стадии) • Фрагментация ядра • Интактная клеточная мембрана • • • Дезорганизованые цитоплазматические органеллы Большие чистые вакуоли • Пузыри на поверхности клеток • Потеря межклеточной адгезии и отделение соседних клеток • Апоптотические тельца с интактной клеточной мембраной, содержащие цитоплазматические органеллы • Фагоцитоз апоптотических телец Недостатки TEM: высокая стоимость, длительность анализа.
Методы исследования апоптоза Просвечивающая электронная микроскопия (transmission electron microscopy ) Золотой стандарт подтверждения апоптоза ! Признаки: • Электронноплотное ядро (маргинализации на ранней стадии) • Фрагментация ядра • Интактная клеточная мембрана • • • Дезорганизованые цитоплазматические органеллы Большие чистые вакуоли • Пузыри на поверхности клеток • Потеря межклеточной адгезии и отделение соседних клеток • Апоптотические тельца с интактной клеточной мембраной, содержащие цитоплазматические органеллы • Фагоцитоз апоптотических телец Недостатки TEM: высокая стоимость, длительность анализа.
 Методы исследования апоптоза Метод TUNEL (Terminal d. UTP Nick End. Labeling) Western blot иммунноблоттинг Спектрофотометрия расщепленного субстрата каспаз PCR-RT Микроскопия, проточная цитометрия Фрагментация ДНК Содержание каспаз, белков семейства Bcl 2, p 53 и т. д. Активность каспаз Экспрессия генов, вовлеченных в апоптоз
Методы исследования апоптоза Метод TUNEL (Terminal d. UTP Nick End. Labeling) Western blot иммунноблоттинг Спектрофотометрия расщепленного субстрата каспаз PCR-RT Микроскопия, проточная цитометрия Фрагментация ДНК Содержание каспаз, белков семейства Bcl 2, p 53 и т. д. Активность каспаз Экспрессия генов, вовлеченных в апоптоз
 Методы исследования апоптоза Аннексиновый тест Микроскопия, проточная цитометрия Окрашивание с 7 AAD (7 -amino-actinomycin D) и PI (propidium iodide) Исследование потенциала митохондриальной мембраны Микроскопия, проточная цитометрия Выход фосфатидилсерина на внешнюю поверхность клеточной мембраны Проницаемость мембраны для низкомолекулярных красителей Целостность митохондриальной мембраны
Методы исследования апоптоза Аннексиновый тест Микроскопия, проточная цитометрия Окрашивание с 7 AAD (7 -amino-actinomycin D) и PI (propidium iodide) Исследование потенциала митохондриальной мембраны Микроскопия, проточная цитометрия Выход фосфатидилсерина на внешнюю поверхность клеточной мембраны Проницаемость мембраны для низкомолекулярных красителей Целостность митохондриальной мембраны
 Приоритетные направления исследований апоптоза: наиболее острые проблемы Приоритетные направления Молекулярные маркеры нарушения апоптоза при патологии Исследование фундаментальных механизмов регуляции Методологические подходы Геномика (структурная и функциональная) Молекулярная биология Протеомика Метаболомика Биоинформатика Геномная медицина Фармакогеномика, фармакогенетика Разработка инновационных лекарств Лабораторная медицина • Исследование молекулярных механизмов и кинетики течения различных этапов клеточной гибели • Идентификация роли внутриклеточных и внеклеточных сигнальных систем (газовые посредники, редокс-зависимые компоненты внутриклеточной сигнальной трансдукции, белки теплового шока, цитокины, галектины и др. ) в регуляции апоптоза, пролиферации и дифференцировки клеток • Изучение роли нарушения апоптоза в патогенезе заболеваний • Идентификация молекулярных мишеней нарушения индукции и реализации программированной гибели клеток при патологии разного генеза Разработка технологий селективного управления апоптозом с использованием экзо- и эндогенных модуляторов
Приоритетные направления исследований апоптоза: наиболее острые проблемы Приоритетные направления Молекулярные маркеры нарушения апоптоза при патологии Исследование фундаментальных механизмов регуляции Методологические подходы Геномика (структурная и функциональная) Молекулярная биология Протеомика Метаболомика Биоинформатика Геномная медицина Фармакогеномика, фармакогенетика Разработка инновационных лекарств Лабораторная медицина • Исследование молекулярных механизмов и кинетики течения различных этапов клеточной гибели • Идентификация роли внутриклеточных и внеклеточных сигнальных систем (газовые посредники, редокс-зависимые компоненты внутриклеточной сигнальной трансдукции, белки теплового шока, цитокины, галектины и др. ) в регуляции апоптоза, пролиферации и дифференцировки клеток • Изучение роли нарушения апоптоза в патогенезе заболеваний • Идентификация молекулярных мишеней нарушения индукции и реализации программированной гибели клеток при патологии разного генеза Разработка технологий селективного управления апоптозом с использованием экзо- и эндогенных модуляторов
 Точки приложения возможного влияния регуляторных (терапевтических) факторов на реализацию апоптоза Активность внеклеточных сигнальных молекул (например, цитокинов) Рецепторный путь реализации апоптоза Активность инициирующих и эффекторных каспаз Клеточный цикл Активация генов-регуляторов апоптоза Агонисты (например, рекомбинантные формы цитокинов), антагонисты, растворимые антитела, рецепторы-ловушки Антитела, антисмысловые олигонуклеотиды к м. РНК рецептора Ингибиторы каспаз Ингибиторы МАР-, циклинзависимых киназ Антисмысловые олигонуклеотиды к нуклеиновым кислотам
Точки приложения возможного влияния регуляторных (терапевтических) факторов на реализацию апоптоза Активность внеклеточных сигнальных молекул (например, цитокинов) Рецепторный путь реализации апоптоза Активность инициирующих и эффекторных каспаз Клеточный цикл Активация генов-регуляторов апоптоза Агонисты (например, рекомбинантные формы цитокинов), антагонисты, растворимые антитела, рецепторы-ловушки Антитела, антисмысловые олигонуклеотиды к м. РНК рецептора Ингибиторы каспаз Ингибиторы МАР-, циклинзависимых киназ Антисмысловые олигонуклеотиды к нуклеиновым кислотам
 1. АПОПТОЗ И ОКИСЛИТЕЛЬНЫЙ СТРЕСС
1. АПОПТОЗ И ОКИСЛИТЕЛЬНЫЙ СТРЕСС
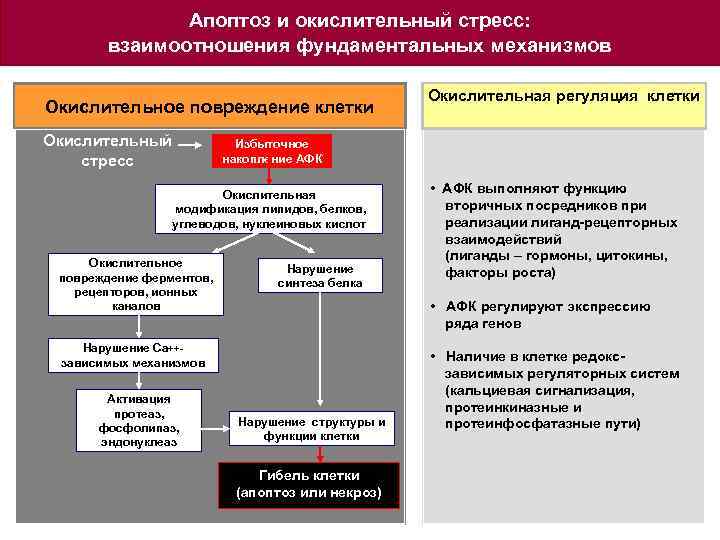 Апоптоз и окислительный стресс: взаимоотношения фундаментальных механизмов Окислительное повреждение клетки Окислительный стресс Избыточное накопление АФК Окислительная модификация липидов, белков, углеводов, нуклеиновых кислот Окислительное повреждение ферментов, рецепторов, ионных каналов Нарушение синтеза белка • АФК выполняют функцию вторичных посредников при реализации лиганд-рецепторных взаимодействий (лиганды – гормоны, цитокины, факторы роста) • АФК регулируют экспрессию ряда генов Нарушение Ca++зависимых механизмов Активация протеаз, фосфолипаз, эндонуклеаз Окислительная регуляция клетки Нарушение структуры и функции клетки Гибель клетки (апоптоз или некроз) • Наличие в клетке редокс зависимых регуляторных систем (кальциевая сигнализация, протеинкиназные и протеинфосфатазные пути)
Апоптоз и окислительный стресс: взаимоотношения фундаментальных механизмов Окислительное повреждение клетки Окислительный стресс Избыточное накопление АФК Окислительная модификация липидов, белков, углеводов, нуклеиновых кислот Окислительное повреждение ферментов, рецепторов, ионных каналов Нарушение синтеза белка • АФК выполняют функцию вторичных посредников при реализации лиганд-рецепторных взаимодействий (лиганды – гормоны, цитокины, факторы роста) • АФК регулируют экспрессию ряда генов Нарушение Ca++зависимых механизмов Активация протеаз, фосфолипаз, эндонуклеаз Окислительная регуляция клетки Нарушение структуры и функции клетки Гибель клетки (апоптоз или некроз) • Наличие в клетке редокс зависимых регуляторных систем (кальциевая сигнализация, протеинкиназные и протеинфосфатазные пути)
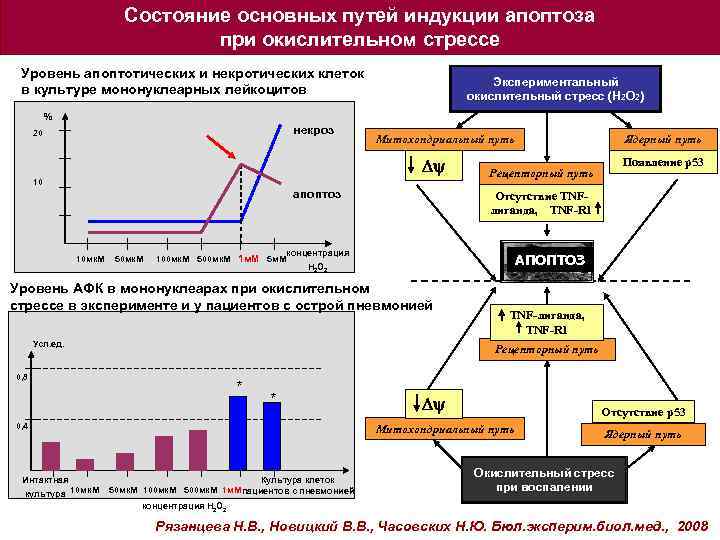 Состояние основных путей индукции апоптоза при окислительном стрессе Уровень апоптотических и некротических клеток в культуре мононуклеарных лейкоцитов Экспериментальный окислительный стресс (Н 2 О 2) % некроз 20 Митохондриальный путь Dy 10 апоптоз Ядерный путь Появление p 53 Рецепторный путь Отсутствие TNFлиганда, TNF-R 1 концентрация 10 мк. М 50 мк. М 100 мк. М 500 мк. М 1 м. М 5 м. М Н 2 О 2 АПОПТОЗ Уровень АФК в мононуклеарах при окислительном стрессе в эксперименте и у пациентов с острой пневмонией Усл. ед. TNF-лиганда, TNF-R 1 Рецепторный путь 0, 8 * 0, 4 * Dy Отсутствие p 53 Митохондриальный путь Интактная Культура клеток 10 мк. М 50 мк. М 100 мк. М 500 мк. М 1 м. Мпациентов с пневмонией культура Ядерный путь Окислительный стресс при воспалении концентрация Н 2 О 2 Рязанцева Н. В. , Новицкий В. В. , Часовских Н. Ю. Бюл. эксперим. биол. мед. , 2008
Состояние основных путей индукции апоптоза при окислительном стрессе Уровень апоптотических и некротических клеток в культуре мононуклеарных лейкоцитов Экспериментальный окислительный стресс (Н 2 О 2) % некроз 20 Митохондриальный путь Dy 10 апоптоз Ядерный путь Появление p 53 Рецепторный путь Отсутствие TNFлиганда, TNF-R 1 концентрация 10 мк. М 50 мк. М 100 мк. М 500 мк. М 1 м. М 5 м. М Н 2 О 2 АПОПТОЗ Уровень АФК в мононуклеарах при окислительном стрессе в эксперименте и у пациентов с острой пневмонией Усл. ед. TNF-лиганда, TNF-R 1 Рецепторный путь 0, 8 * 0, 4 * Dy Отсутствие p 53 Митохондриальный путь Интактная Культура клеток 10 мк. М 50 мк. М 100 мк. М 500 мк. М 1 м. Мпациентов с пневмонией культура Ядерный путь Окислительный стресс при воспалении концентрация Н 2 О 2 Рязанцева Н. В. , Новицкий В. В. , Часовских Н. Ю. Бюл. эксперим. биол. мед. , 2008
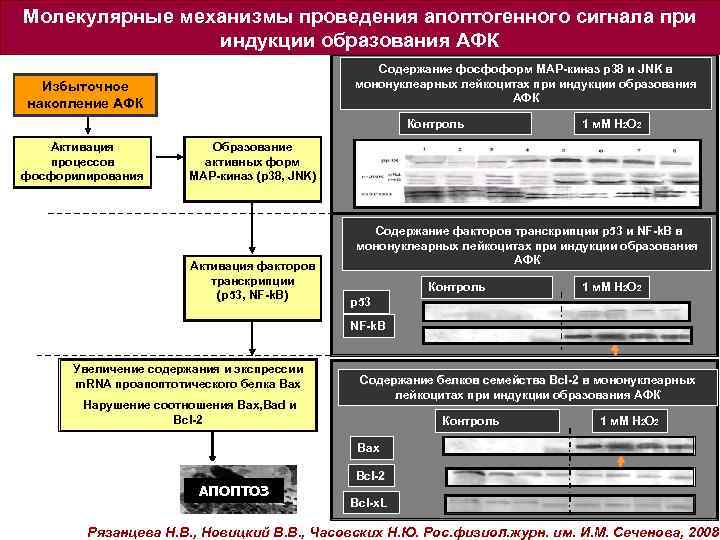 Молекулярные механизмы проведения апоптогенного сигнала при индукции образования АФК Содержание фосфоформ МАР-киназ р38 и JNK в мононуклеарных лейкоцитах при индукции образования АФК Избыточное накопление АФК Контроль Активация процессов фосфорилирования 1 м. М Н 2 О 2 Образование активных форм МАР-киназ (p 38, JNK) Содержание факторов транскрипции p 53 и NF-k. B в мононуклеарных лейкоцитах при индукции образования АФК Активация факторов транскрипции (p 53, NF-k. B) p 53 Контроль 1 м. М Н 2 О 2 NF-k. B Увеличение содержания и экспрессии m. RNA проапоптотического белка Bax Нарушение соотношения Ваx, Bad и Bcl-2 Содержание белков семейства Bcl-2 в мононуклеарных Содержание белков семейства Bcl-2 в лейкоцитах при индукции образования АФК Контроль 1 м. М Н 2 О 2 Bax АПОПТОЗ Bcl-2 Bcl-x. L Рязанцева Н. В. , Новицкий В. В. , Часовских Н. Ю. Рос. физиол. журн. им. И. М. Сеченова, 2008
Молекулярные механизмы проведения апоптогенного сигнала при индукции образования АФК Содержание фосфоформ МАР-киназ р38 и JNK в мононуклеарных лейкоцитах при индукции образования АФК Избыточное накопление АФК Контроль Активация процессов фосфорилирования 1 м. М Н 2 О 2 Образование активных форм МАР-киназ (p 38, JNK) Содержание факторов транскрипции p 53 и NF-k. B в мононуклеарных лейкоцитах при индукции образования АФК Активация факторов транскрипции (p 53, NF-k. B) p 53 Контроль 1 м. М Н 2 О 2 NF-k. B Увеличение содержания и экспрессии m. RNA проапоптотического белка Bax Нарушение соотношения Ваx, Bad и Bcl-2 Содержание белков семейства Bcl-2 в мононуклеарных Содержание белков семейства Bcl-2 в лейкоцитах при индукции образования АФК Контроль 1 м. М Н 2 О 2 Bax АПОПТОЗ Bcl-2 Bcl-x. L Рязанцева Н. В. , Новицкий В. В. , Часовских Н. Ю. Рос. физиол. журн. им. И. М. Сеченова, 2008
 Заключение по разделу «Апоптоз и окислительный стресс» : Реализация проектов Приоритетные результаты • Усиление программированной гибели мононуклеарных лейкоцитов крови в условиях окислительного стресса сопряжено с активацией митохондрийопосредованного и повышенной готовностью клеток к TNFα-рецепторному пути инициации апоптоза • В реализацию летальной программы мононуклеарных лейкоцитов при окислительном стрессе вовлечены редокс-чувствительные элементы внутриклеточной сигнальной трансдукции (МАР-киназы р38 и JNK, факторы транскрипции NF-k. B и р53, контролирующие экспрессию соответствующих генов) • Редокс-чувствительные элементы внутриклеточных сигналпередающих систем (МАР-киназы р38, JNK, факторы транскрипции и белки семейства Bcl-2) являются молекулярными мишенями для терапевтической коррекции нарушений апоптотической программы при окислительном стрессе • • • РФФИ, «Молекулярные механизмы управления программированной гибелью клеток с использованием регуляторных молекул» (№ 07 -04 -12150); «Разработка технологии селективного управления внутриклеточными редокс-зависимыми сигнальными системами» (№ 09 -04 -99026) ФЦП «Исследования и разработки…» , «Разработка способов коррекции нарушений регуляции апоптоза клеток при патологических процессах в условиях окислительного стресса» (ГК № 02. 442. 11. 7276) ФЦП «Научные и научно-педагогические кадры…» , «Разработка технологической платформы молекулярной диагностики и лечения социально значимых заболеваний и подготовка на ее основе научно-исследовательских кадров для молекулярной медицины» (ГК № 02. 740. 11. 0311)
Заключение по разделу «Апоптоз и окислительный стресс» : Реализация проектов Приоритетные результаты • Усиление программированной гибели мононуклеарных лейкоцитов крови в условиях окислительного стресса сопряжено с активацией митохондрийопосредованного и повышенной готовностью клеток к TNFα-рецепторному пути инициации апоптоза • В реализацию летальной программы мононуклеарных лейкоцитов при окислительном стрессе вовлечены редокс-чувствительные элементы внутриклеточной сигнальной трансдукции (МАР-киназы р38 и JNK, факторы транскрипции NF-k. B и р53, контролирующие экспрессию соответствующих генов) • Редокс-чувствительные элементы внутриклеточных сигналпередающих систем (МАР-киназы р38, JNK, факторы транскрипции и белки семейства Bcl-2) являются молекулярными мишенями для терапевтической коррекции нарушений апоптотической программы при окислительном стрессе • • • РФФИ, «Молекулярные механизмы управления программированной гибелью клеток с использованием регуляторных молекул» (№ 07 -04 -12150); «Разработка технологии селективного управления внутриклеточными редокс-зависимыми сигнальными системами» (№ 09 -04 -99026) ФЦП «Исследования и разработки…» , «Разработка способов коррекции нарушений регуляции апоптоза клеток при патологических процессах в условиях окислительного стресса» (ГК № 02. 442. 11. 7276) ФЦП «Научные и научно-педагогические кадры…» , «Разработка технологической платформы молекулярной диагностики и лечения социально значимых заболеваний и подготовка на ее основе научно-исследовательских кадров для молекулярной медицины» (ГК № 02. 740. 11. 0311)
 2. АПОПТОЗ И ЦИТОКИНЫ
2. АПОПТОЗ И ЦИТОКИНЫ
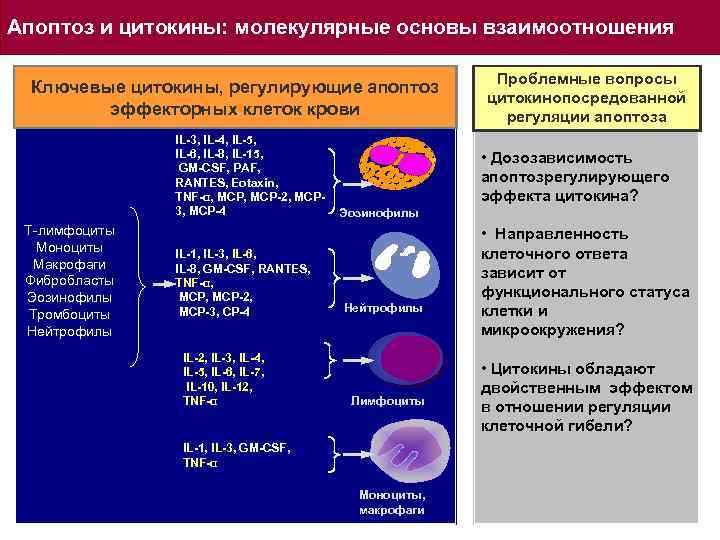 Апоптоз и цитокины: молекулярные основы взаимоотношения Ключевые цитокины, регулирующие апоптоз эффекторных клеток крови IL-3, IL-4, IL-5, IL-6, IL-8, IL-15, GM-CSF, PAF, RANTES, Eotaxin, TNF-α, MCP-2, MCP 3, MCP-4 Т-лимфоциты Моноциты Макрофаги Фибробласты Эозинофилы Тромбоциты Нейтрофилы IL-1, IL-3, IL-6, IL-8, GM-CSF, RANTES, TNF-α, MCP, MCP-2, MCP-3, CP-4 IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12, TNF-α Проблемные вопросы цитокинопосредованной регуляции апоптоза • Дозозависимость апоптозрегулирующего эффекта цитокина? Эозинофилы Нейтрофилы Лимфоциты IL-1, IL-3, GM-CSF, TNF-α Моноциты, макрофаги • Направленность клеточного ответа зависит от функционального статуса клетки и микроокружения? • Цитокины обладают двойственным эффектом в отношении регуляции клеточной гибели?
Апоптоз и цитокины: молекулярные основы взаимоотношения Ключевые цитокины, регулирующие апоптоз эффекторных клеток крови IL-3, IL-4, IL-5, IL-6, IL-8, IL-15, GM-CSF, PAF, RANTES, Eotaxin, TNF-α, MCP-2, MCP 3, MCP-4 Т-лимфоциты Моноциты Макрофаги Фибробласты Эозинофилы Тромбоциты Нейтрофилы IL-1, IL-3, IL-6, IL-8, GM-CSF, RANTES, TNF-α, MCP, MCP-2, MCP-3, CP-4 IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-10, IL-12, TNF-α Проблемные вопросы цитокинопосредованной регуляции апоптоза • Дозозависимость апоптозрегулирующего эффекта цитокина? Эозинофилы Нейтрофилы Лимфоциты IL-1, IL-3, GM-CSF, TNF-α Моноциты, макрофаги • Направленность клеточного ответа зависит от функционального статуса клетки и микроокружения? • Цитокины обладают двойственным эффектом в отношении регуляции клеточной гибели?
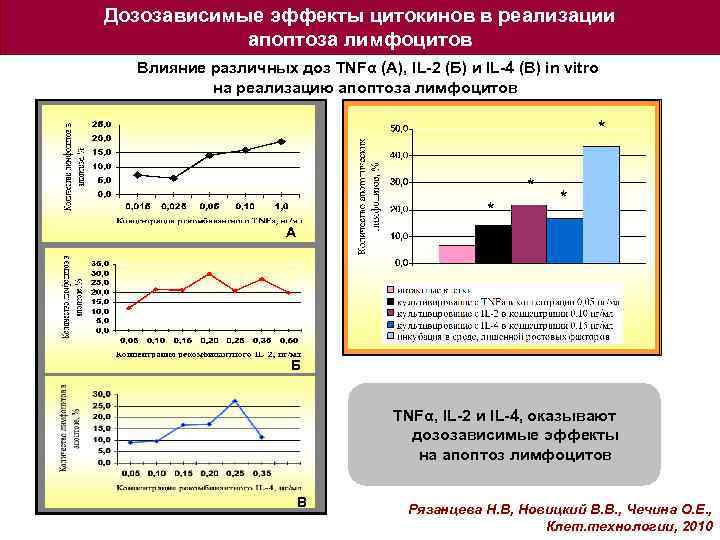 Дозозависимые эффекты цитокинов в реализации апоптоза лимфоцитов Влияние различных доз TNFα (А), IL-2 (Б) и IL-4 (В) in vitro на реализацию апоптоза лимфоцитов * * А Б TNFα, IL-2 и IL-4, оказывают дозозависимые эффекты на апоптоз лимфоцитов В Рязанцева Н. В, Новицкий В. В. , Чечина О. Е. , Клет. технологии, 2010
Дозозависимые эффекты цитокинов в реализации апоптоза лимфоцитов Влияние различных доз TNFα (А), IL-2 (Б) и IL-4 (В) in vitro на реализацию апоптоза лимфоцитов * * А Б TNFα, IL-2 и IL-4, оказывают дозозависимые эффекты на апоптоз лимфоцитов В Рязанцева Н. В, Новицкий В. В. , Чечина О. Е. , Клет. технологии, 2010
 Проблема двойственного эффекта цитокинов в отношении регуляции клеточной гибели The Oncologist, Vol. 11, No. 4, 397 -408, April 2006 TNF- in Cancer Treatment: Molecular Insights, Antitumor Effects, and Clinical Utility Remco van Horssen, Timo L. M. ten Hagen, Alexander M. M. Eggermont Tumor necrosis factor alpha (TNF-а), isolated 30 years ago, is a multifunctional cytokine playing a key role in apoptosis and cell survival as well as in inflammation and immunity. Although named for its antitumor properties, TNF-а is a 17 -k. Da protein consisting of 157 amino acids that is a homotrimer in solution. In humans, the gene is mapped to chromosome 6. Its bioactivity is mainly regulated by soluble TNF-а–binding receptors. TNF-а is mainly produced by activated macrophages, T lymphocytes, and natural killer (NK) cells. Lower expression is known for a variety of other cells, including fibroblasts, smooth muscle cells, and tumor cells. In cells, TNF-а is synthesized as pro-TNF (26 k. Da), which is membrane-bound and is released upon cleavage of its pro domain by TNF-converting enzyme (TACE) [13]. As mentioned above, TNF-а acts via two distinct receptors. Although the affinity for TNF receptor 2 (TNFR-2) is five times higher than that for TNFR-1, the latter initiates the majority of the biological activities of TNF-а. TNFR-1 (p 60) is expressed on all cell types, while TNFR-2 (p 80) expression is mainly confined to immune cells. The major difference between the two receptors is the death domain (DD) of TNFR-1 that is absent in TNFR-2. For this reason, TNFR-1 is an important member of the death receptor family that shares the capability of inducing apoptotic cell death. Besides this apoptotic signaling, TNFR-1 is widely studied because it is a dual role receptor: next to induction of apoptosis, it also has the ability to transduce cell survival signals. Although signaling pathways are well defined nowadays, the life-death signaling regulation is still poorly understood. TNF-а оказывает проапоптотический и антиапоптотический эффекты, индуцируя разные молекулярные пути регуляции жизненного цикла клетки
Проблема двойственного эффекта цитокинов в отношении регуляции клеточной гибели The Oncologist, Vol. 11, No. 4, 397 -408, April 2006 TNF- in Cancer Treatment: Molecular Insights, Antitumor Effects, and Clinical Utility Remco van Horssen, Timo L. M. ten Hagen, Alexander M. M. Eggermont Tumor necrosis factor alpha (TNF-а), isolated 30 years ago, is a multifunctional cytokine playing a key role in apoptosis and cell survival as well as in inflammation and immunity. Although named for its antitumor properties, TNF-а is a 17 -k. Da protein consisting of 157 amino acids that is a homotrimer in solution. In humans, the gene is mapped to chromosome 6. Its bioactivity is mainly regulated by soluble TNF-а–binding receptors. TNF-а is mainly produced by activated macrophages, T lymphocytes, and natural killer (NK) cells. Lower expression is known for a variety of other cells, including fibroblasts, smooth muscle cells, and tumor cells. In cells, TNF-а is synthesized as pro-TNF (26 k. Da), which is membrane-bound and is released upon cleavage of its pro domain by TNF-converting enzyme (TACE) [13]. As mentioned above, TNF-а acts via two distinct receptors. Although the affinity for TNF receptor 2 (TNFR-2) is five times higher than that for TNFR-1, the latter initiates the majority of the biological activities of TNF-а. TNFR-1 (p 60) is expressed on all cell types, while TNFR-2 (p 80) expression is mainly confined to immune cells. The major difference between the two receptors is the death domain (DD) of TNFR-1 that is absent in TNFR-2. For this reason, TNFR-1 is an important member of the death receptor family that shares the capability of inducing apoptotic cell death. Besides this apoptotic signaling, TNFR-1 is widely studied because it is a dual role receptor: next to induction of apoptosis, it also has the ability to transduce cell survival signals. Although signaling pathways are well defined nowadays, the life-death signaling regulation is still poorly understood. TNF-а оказывает проапоптотический и антиапоптотический эффекты, индуцируя разные молекулярные пути регуляции жизненного цикла клетки
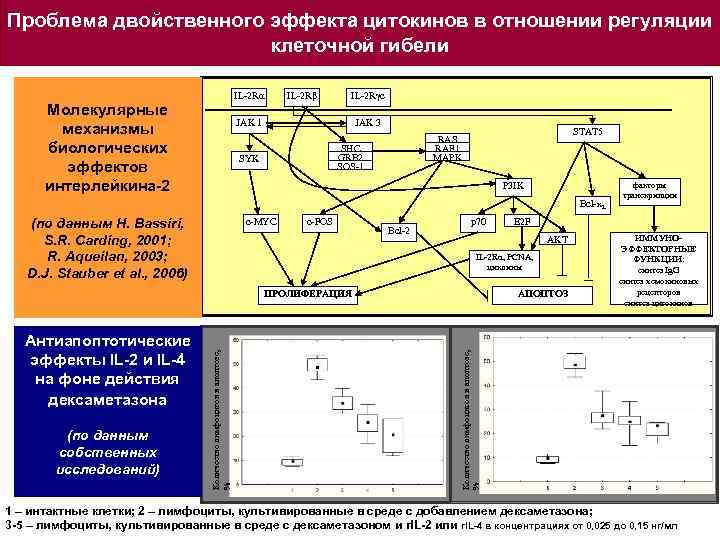 Проблема двойственного эффекта цитокинов в отношении регуляции клеточной гибели IL-2 Rα Молекулярные механизмы биологических эффектов интерлейкина-2 IL-2 Rβ IL-2 Rγc JAK 1 JAK 3 SHC GRB 2 SOS-1 SYK STAT 5 RAS RAF 1 MAPK P 3 IK Bcl-x. L (по данным H. Bassiri, S. R. Carding, 2001; R. Aqueilan, 2003; D. J. Stauber et al. , 2006) c-MYC c-FOS Bcl-2 p 70 IL-2 Rα, PCNA, циклины АПОПТОЗ ИММУНОЭФФЕКТОРНЫЕ ФУНКЦИИ: синтез Ig. G синтез хемокиновых рецепторов синтез цитокинов Количество лимфоцитов в апоптозе, % (по данным собственных исследований) Количество лимфоцитов в апоптозе, % Антиапоптотические эффекты IL-2 и IL-4 на фоне действия дексаметазона E 2 F AKT ПРОЛИФЕРАЦИЯ факторы транскрипции 1 – интактные клетки; 2 – лимфоциты, культивированные в среде с добавлением дексаметазона; 3 -5 – лимфоциты, культивированные в среде с дексаметазоном и r. IL-2 или r. IL-4 в концентрациях от 0, 025 до 0, 15 нг/мл
Проблема двойственного эффекта цитокинов в отношении регуляции клеточной гибели IL-2 Rα Молекулярные механизмы биологических эффектов интерлейкина-2 IL-2 Rβ IL-2 Rγc JAK 1 JAK 3 SHC GRB 2 SOS-1 SYK STAT 5 RAS RAF 1 MAPK P 3 IK Bcl-x. L (по данным H. Bassiri, S. R. Carding, 2001; R. Aqueilan, 2003; D. J. Stauber et al. , 2006) c-MYC c-FOS Bcl-2 p 70 IL-2 Rα, PCNA, циклины АПОПТОЗ ИММУНОЭФФЕКТОРНЫЕ ФУНКЦИИ: синтез Ig. G синтез хемокиновых рецепторов синтез цитокинов Количество лимфоцитов в апоптозе, % (по данным собственных исследований) Количество лимфоцитов в апоптозе, % Антиапоптотические эффекты IL-2 и IL-4 на фоне действия дексаметазона E 2 F AKT ПРОЛИФЕРАЦИЯ факторы транскрипции 1 – интактные клетки; 2 – лимфоциты, культивированные в среде с добавлением дексаметазона; 3 -5 – лимфоциты, культивированные в среде с дексаметазоном и r. IL-2 или r. IL-4 в концентрациях от 0, 025 до 0, 15 нг/мл
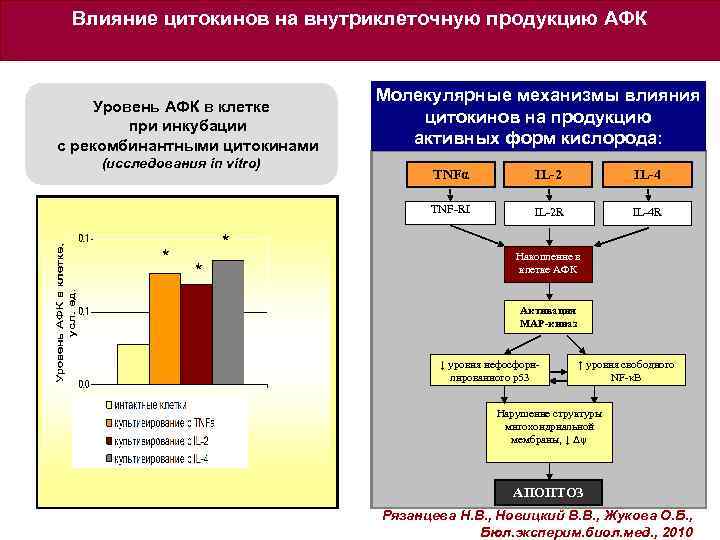 Влияние цитокинов на внутриклеточную продукцию АФК Молекулярные механизмы влияния Уровень АФК в клетке цитокинов на продукцию при инкубации активных форм кислорода: с рекомбинантными цитокинами (исследования in vitro) * * IL-2 IL-4 TNF-RI * TNFα IL-2 R IL-4 R Накопление в клетке АФК Активация МАР-киназ ↓ уровня нефосфорилированного p 53 ↑ уровня свободного NF-κB Нарушение структуры митохондриальной мембраны, ↓ Δψ АПОПТОЗ Рязанцева Н. В. , Новицкий В. В. , Жукова О. Б. , Бюл. эксперим. биол. мед. , 2010
Влияние цитокинов на внутриклеточную продукцию АФК Молекулярные механизмы влияния Уровень АФК в клетке цитокинов на продукцию при инкубации активных форм кислорода: с рекомбинантными цитокинами (исследования in vitro) * * IL-2 IL-4 TNF-RI * TNFα IL-2 R IL-4 R Накопление в клетке АФК Активация МАР-киназ ↓ уровня нефосфорилированного p 53 ↑ уровня свободного NF-κB Нарушение структуры митохондриальной мембраны, ↓ Δψ АПОПТОЗ Рязанцева Н. В. , Новицкий В. В. , Жукова О. Б. , Бюл. эксперим. биол. мед. , 2010
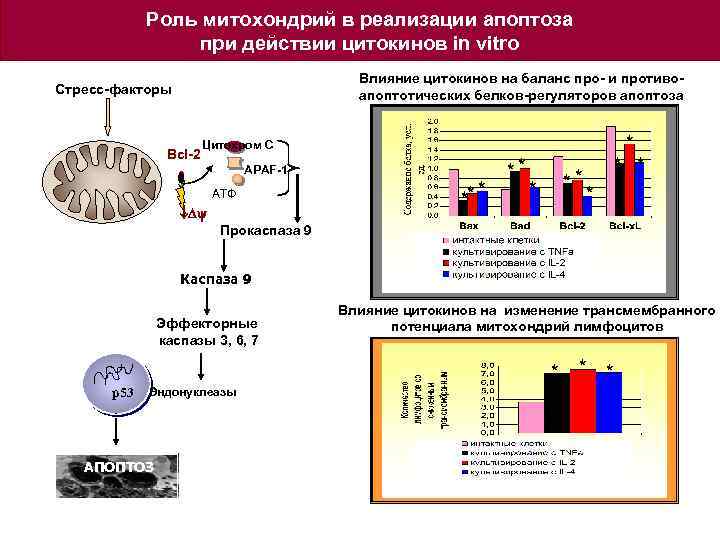 Роль митохондрий в реализации апоптоза при действии цитокинов in vitro Влияние цитокинов на баланс про- и противоапоптотических белков-регуляторов апоптоза Стресс-факторы Bcl-2 Цитохром С APAF-1 АТФ Dy * ** * * * * Прокаспаза 9 Каспаза 9 Эффекторные каспазы 3, 6, 7 Влияние цитокинов на изменение трансмембранного потенциала митохондрий лимфоцитов * * * р53 Эндонуклеазы АПОПТОЗ
Роль митохондрий в реализации апоптоза при действии цитокинов in vitro Влияние цитокинов на баланс про- и противоапоптотических белков-регуляторов апоптоза Стресс-факторы Bcl-2 Цитохром С APAF-1 АТФ Dy * ** * * * * Прокаспаза 9 Каспаза 9 Эффекторные каспазы 3, 6, 7 Влияние цитокинов на изменение трансмембранного потенциала митохондрий лимфоцитов * * * р53 Эндонуклеазы АПОПТОЗ
 Роль транскрипционных факторов в реализации апоптоза при действии цитокинов in vitro Участие транскрипционных факторов в цитокиновой регуляции апоптоза TNFα IL-2 IL-4 TNF-RI IL-2 R Уровень транскрипционных факторов и ингибитора циклинзависимых киназ в клетке при инкубации с рекомбинантными цитокинами IL-4 R ↓ уровня нефосфорилированного p 53 ↑ уровня ингибитора циклин-зависимых киназ p 21 WAF 1/CIP 1 ↑ уровня p. Rb Блок клеточного цикла в G 1 фазе ↑ уровня свободного NF-κB Изменение транскрипции генов индукторов и ингибиторов апоптоза (исследования in vitro) ** ** * * Нарушение структуры митохондриальной мембраны АПОПТОЗ Чечина О. Е. , Рязанцева Н. В, Новицкий В. В. , Иммунология, 2011
Роль транскрипционных факторов в реализации апоптоза при действии цитокинов in vitro Участие транскрипционных факторов в цитокиновой регуляции апоптоза TNFα IL-2 IL-4 TNF-RI IL-2 R Уровень транскрипционных факторов и ингибитора циклинзависимых киназ в клетке при инкубации с рекомбинантными цитокинами IL-4 R ↓ уровня нефосфорилированного p 53 ↑ уровня ингибитора циклин-зависимых киназ p 21 WAF 1/CIP 1 ↑ уровня p. Rb Блок клеточного цикла в G 1 фазе ↑ уровня свободного NF-κB Изменение транскрипции генов индукторов и ингибиторов апоптоза (исследования in vitro) ** ** * * Нарушение структуры митохондриальной мембраны АПОПТОЗ Чечина О. Е. , Рязанцева Н. В, Новицкий В. В. , Иммунология, 2011
 Приоритетные результаты Заключение по разделу «Апоптоз и цитокины» : • Цитокины являются важнейшими внеклеточными регуляторами летальной программы клеток, проявляющими дозозависимый эффект, а также специфичность в отношении выбора разных молекулярных путей регуляции программированной гибели (элементы системы сигнальной трансдукции апоптогенных сигналов МАРкиназы, факторы транскрипции, про- и антиапоптотические белки и др. ) • Результаты настоящего исследования целесообразно учитывать при идентификации побочных эффектов цитокиновой и антицитокиновой терапии, а также при разработке новых технологий коррекции нарушений программы клеточной гибели при заболеваниях, характеризующихся изменениями продукции данных цитокинов (инфекционные, аутоиммунные, опухолевые заболевания и др. ) Реализация проектов • РФФИ, «Разработка способов направленной коррекции дизрегуляции пролиферации и апоптоза нормальных и патологически измененных клеток с помощью регуляторных молекул» (09 -04 -99025 -р_офи) • ФЦП «Исследования и разработки…» , «Работы по проведению проблемноориентированных поисковых исследований и созданию научно-технического задела в области живых систем с участием научных организаций Японии» (ГК № 02. 512. 11. 2285) • Совет по грантам Президента РФ, «Молекулярные механизмы дизрегуляции апоптоза лимфоцитов при дисбалансе Th 1 - и Th 2 -цитокинов» (ГК № 02. 120. 11. 3842 -МД )
Приоритетные результаты Заключение по разделу «Апоптоз и цитокины» : • Цитокины являются важнейшими внеклеточными регуляторами летальной программы клеток, проявляющими дозозависимый эффект, а также специфичность в отношении выбора разных молекулярных путей регуляции программированной гибели (элементы системы сигнальной трансдукции апоптогенных сигналов МАРкиназы, факторы транскрипции, про- и антиапоптотические белки и др. ) • Результаты настоящего исследования целесообразно учитывать при идентификации побочных эффектов цитокиновой и антицитокиновой терапии, а также при разработке новых технологий коррекции нарушений программы клеточной гибели при заболеваниях, характеризующихся изменениями продукции данных цитокинов (инфекционные, аутоиммунные, опухолевые заболевания и др. ) Реализация проектов • РФФИ, «Разработка способов направленной коррекции дизрегуляции пролиферации и апоптоза нормальных и патологически измененных клеток с помощью регуляторных молекул» (09 -04 -99025 -р_офи) • ФЦП «Исследования и разработки…» , «Работы по проведению проблемноориентированных поисковых исследований и созданию научно-технического задела в области живых систем с участием научных организаций Японии» (ГК № 02. 512. 11. 2285) • Совет по грантам Президента РФ, «Молекулярные механизмы дизрегуляции апоптоза лимфоцитов при дисбалансе Th 1 - и Th 2 -цитокинов» (ГК № 02. 120. 11. 3842 -МД )
 3. АПОПТОЗ И БЕЛКИ ТЕПЛОВОГО ШОКА
3. АПОПТОЗ И БЕЛКИ ТЕПЛОВОГО ШОКА
 Эволюция исследований белков теплового шока Функции белков теплового шока • Фолдинг вновь синтезируемых молекул • Рефолдинг или окончательное удаление белков с нарушенной конформацией • Защитная функция • Проведение клеточных сигналов • Транспорт белков • Стимуляция иммунитета • Регуляция апоптоза: зависит ли двойственность и специфичность эффектов от типа клеток-мишеней и их функционального статуса?
Эволюция исследований белков теплового шока Функции белков теплового шока • Фолдинг вновь синтезируемых молекул • Рефолдинг или окончательное удаление белков с нарушенной конформацией • Защитная функция • Проведение клеточных сигналов • Транспорт белков • Стимуляция иммунитета • Регуляция апоптоза: зависит ли двойственность и специфичность эффектов от типа клеток-мишеней и их функционального статуса?
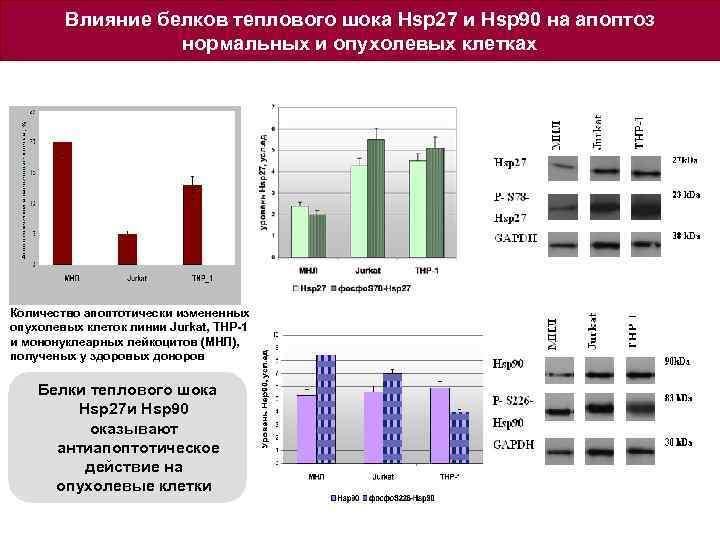 Влияние белков теплового шока Hsp 27 и Hsp 90 на апоптоз нормальных и опухолевых клетках Количество апоптотически измененных опухолевых клеток линии Jurkat, THP-1 и мононуклеарных лейкоцитов (МНЛ), полученых у здоровых доноров Белки теплового шока Hsp 27 и Hsp 90 оказывают антиапоптотическое действие на опухолевые клетки
Влияние белков теплового шока Hsp 27 и Hsp 90 на апоптоз нормальных и опухолевых клетках Количество апоптотически измененных опухолевых клеток линии Jurkat, THP-1 и мононуклеарных лейкоцитов (МНЛ), полученых у здоровых доноров Белки теплового шока Hsp 27 и Hsp 90 оказывают антиапоптотическое действие на опухолевые клетки
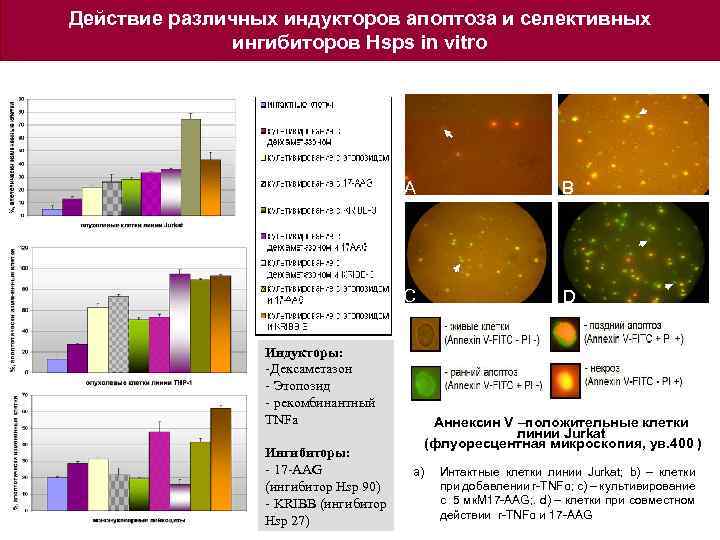 Действие различных индукторов апоптоза и селективных ингибиторов Hsps in vitro A C Индукторы: -Дексаметазон - Этопозид - рекомбинантный TNFa Ингибиторы: - 17 -AAG (ингибитор Hsp 90) - KRIBB (ингибитор Hsp 27) B D Аннексин V –положительные клетки линии Jurkat (флуоресцентная микроскопия, ув. 400 ) a) Интактные клетки линии Jurkat; b) – клетки при добавлении r-TNFα; c) – культивирование с 5 мк. М 17 -AAG; . d) – клетки при совместном действии r-TNFα и 17 -AAG
Действие различных индукторов апоптоза и селективных ингибиторов Hsps in vitro A C Индукторы: -Дексаметазон - Этопозид - рекомбинантный TNFa Ингибиторы: - 17 -AAG (ингибитор Hsp 90) - KRIBB (ингибитор Hsp 27) B D Аннексин V –положительные клетки линии Jurkat (флуоресцентная микроскопия, ув. 400 ) a) Интактные клетки линии Jurkat; b) – клетки при добавлении r-TNFα; c) – культивирование с 5 мк. М 17 -AAG; . d) – клетки при совместном действии r-TNFα и 17 -AAG
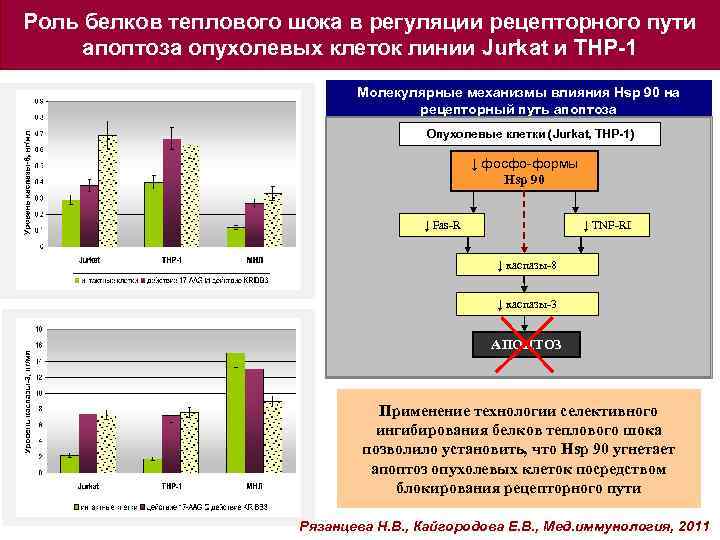 Роль белков теплового шока в регуляции рецепторного пути апоптоза опухолевых клеток линии Jurkat и THP-1 Молекулярные механизмы влияния Hsp 90 на рецепторный путь апоптоза Опухолевые клетки (Jurkat, THP-1) ↓ фосфо-формы Hsp 90 ↓ Fas-R ↓ TNF-RI ↓ каспазы-8 ↓ каспазы-3 АПОПТОЗ Применение технологии селективного ингибирования белков теплового шока позволило установить, что Hsp 90 угнетает апоптоз опухолевых клеток посредством блокирования рецепторного пути Рязанцева Н. В. , Кайгородова Е. В. , Мед. иммунология, 2011
Роль белков теплового шока в регуляции рецепторного пути апоптоза опухолевых клеток линии Jurkat и THP-1 Молекулярные механизмы влияния Hsp 90 на рецепторный путь апоптоза Опухолевые клетки (Jurkat, THP-1) ↓ фосфо-формы Hsp 90 ↓ Fas-R ↓ TNF-RI ↓ каспазы-8 ↓ каспазы-3 АПОПТОЗ Применение технологии селективного ингибирования белков теплового шока позволило установить, что Hsp 90 угнетает апоптоз опухолевых клеток посредством блокирования рецепторного пути Рязанцева Н. В. , Кайгородова Е. В. , Мед. иммунология, 2011
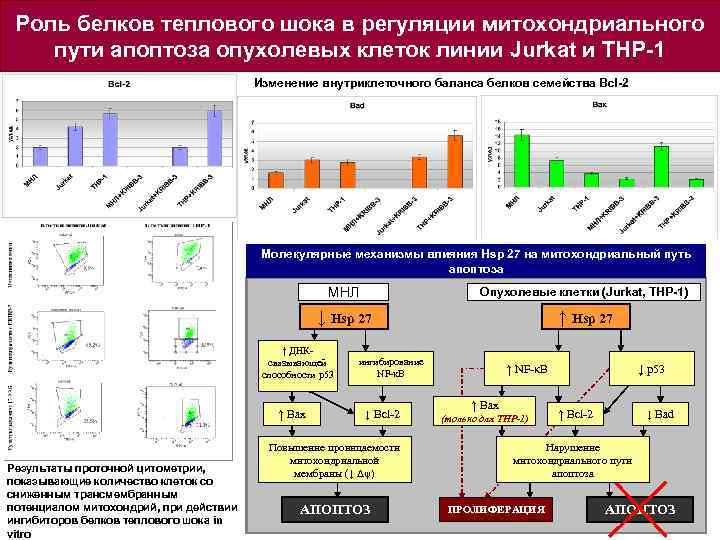 Роль белков теплового шока в регуляции митохондриального пути апоптоза опухолевых клеток линии Jurkat и THP-1 Изменение внутриклеточного баланса белков семейства Bcl-2 Молекулярные механизмы влияния Hsp 27 на митохондриальный путь апоптоза МНЛ Опухолевые клетки (Jurkat, THP-1) ↓ Hsp 27 ↑ ДНКсвязывающей способности p 53 ↑ Bax Результаты проточной цитометрии, показывающие количество клеток со сниженным трансмембранным потенциалом митохондрий, при действии ингибиторов белков теплового шока in vitro ингибирование NF-κB ↓ Bcl-2 Повышение проницаемости митохондриальной мембраны (↓ Δψ) АПОПТОЗ ↑ NF-κB ↑ Bax (только для THP-1) ↓ р53 ↑ Bcl-2 ↓ Bad Нарушение митохондриального пути апоптоза ПРОЛИФЕРАЦИЯ АПОПТОЗ
Роль белков теплового шока в регуляции митохондриального пути апоптоза опухолевых клеток линии Jurkat и THP-1 Изменение внутриклеточного баланса белков семейства Bcl-2 Молекулярные механизмы влияния Hsp 27 на митохондриальный путь апоптоза МНЛ Опухолевые клетки (Jurkat, THP-1) ↓ Hsp 27 ↑ ДНКсвязывающей способности p 53 ↑ Bax Результаты проточной цитометрии, показывающие количество клеток со сниженным трансмембранным потенциалом митохондрий, при действии ингибиторов белков теплового шока in vitro ингибирование NF-κB ↓ Bcl-2 Повышение проницаемости митохондриальной мембраны (↓ Δψ) АПОПТОЗ ↑ NF-κB ↑ Bax (только для THP-1) ↓ р53 ↑ Bcl-2 ↓ Bad Нарушение митохондриального пути апоптоза ПРОЛИФЕРАЦИЯ АПОПТОЗ
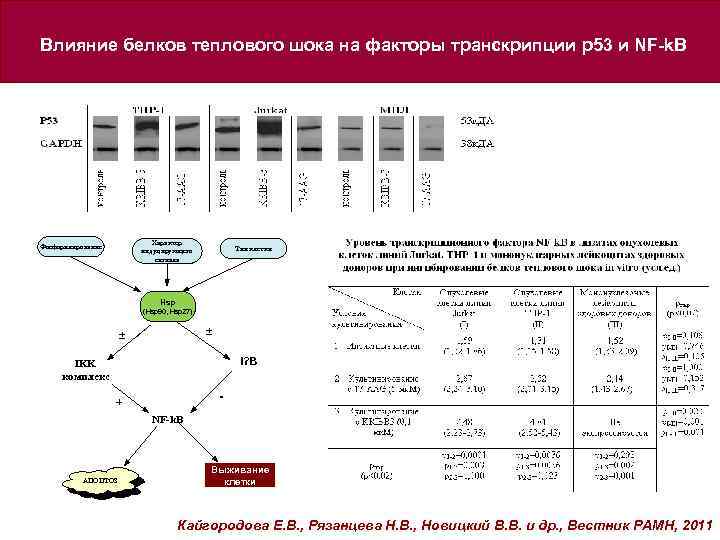 Влияние белков теплового шока на факторы транскрипции p 53 и NF-k. B Характер индуцирующего сигнала Фосфорилирование Тип клетки Hsp (Hsp 90, Hsp 27) ± ± I? B IKK комплекс - + NF-k. B АПОПТОЗ Выживание клетки Кайгородова Е. В. , Рязанцева Н. В. , Новицкий В. В. и др. , Вестник РАМН, 2011
Влияние белков теплового шока на факторы транскрипции p 53 и NF-k. B Характер индуцирующего сигнала Фосфорилирование Тип клетки Hsp (Hsp 90, Hsp 27) ± ± I? B IKK комплекс - + NF-k. B АПОПТОЗ Выживание клетки Кайгородова Е. В. , Рязанцева Н. В. , Новицкий В. В. и др. , Вестник РАМН, 2011
 Реализация проектов Приоритетные результаты Заключение по разделу «Апоптоз и белки теплового шока» : • Белки теплового шока Hsp 90 и Hsp 27 оказывают двойственные эффекты на апоптоз: в опухолевых клетках линии Jurkat и THP-1 они играют антиапоптотическую роль, а также демонстрируют специфичность в отношении выбора разных молекулярных путей регуляции программированной гибели (белок Hsp 90 участвует в регуляции рецепторного пути, белок Hsp 27 – митохондриального пути апоптоза) • Результаты настоящего исследования представляют большой интерес для разработки новых технологий таргетной терапии онкологических заболеваний, путем коррекции нарушений программы клеточной гибели селективными ингибиторами БТШ • ФЦП "Научные и научно-педагогические кадры …. «, «Идентификация молекулярных мишеней коррекций нарушений регуляции апоптоза опухолевых клеток» (ГК П 1203) • Совет по грантам Президента РФ, «Исследование молекулярных механизмов регуляторного влияния белков теплового шока на апоптоз опухолевых клеток» ( ГК № 16. 120. 11. 480 -МК) • ФЦП "Научные и научно-педагогические кадры …. » , «Разработка технологической платформы молекулярной диагностики и лечения социально значимых заболеваний и подготовка на ее основе научноисследовательских кадров для молекулярной медицины» (ГК № 02. 740. 11. 0311).
Реализация проектов Приоритетные результаты Заключение по разделу «Апоптоз и белки теплового шока» : • Белки теплового шока Hsp 90 и Hsp 27 оказывают двойственные эффекты на апоптоз: в опухолевых клетках линии Jurkat и THP-1 они играют антиапоптотическую роль, а также демонстрируют специфичность в отношении выбора разных молекулярных путей регуляции программированной гибели (белок Hsp 90 участвует в регуляции рецепторного пути, белок Hsp 27 – митохондриального пути апоптоза) • Результаты настоящего исследования представляют большой интерес для разработки новых технологий таргетной терапии онкологических заболеваний, путем коррекции нарушений программы клеточной гибели селективными ингибиторами БТШ • ФЦП "Научные и научно-педагогические кадры …. «, «Идентификация молекулярных мишеней коррекций нарушений регуляции апоптоза опухолевых клеток» (ГК П 1203) • Совет по грантам Президента РФ, «Исследование молекулярных механизмов регуляторного влияния белков теплового шока на апоптоз опухолевых клеток» ( ГК № 16. 120. 11. 480 -МК) • ФЦП "Научные и научно-педагогические кадры …. » , «Разработка технологической платформы молекулярной диагностики и лечения социально значимых заболеваний и подготовка на ее основе научноисследовательских кадров для молекулярной медицины» (ГК № 02. 740. 11. 0311).
 4. АПОПТОЗ И ВНУТРИКЛЕТОЧНЫЕ ГАЗОВЫЕ ТРАНСМИТТЕРЫ
4. АПОПТОЗ И ВНУТРИКЛЕТОЧНЫЕ ГАЗОВЫЕ ТРАНСМИТТЕРЫ
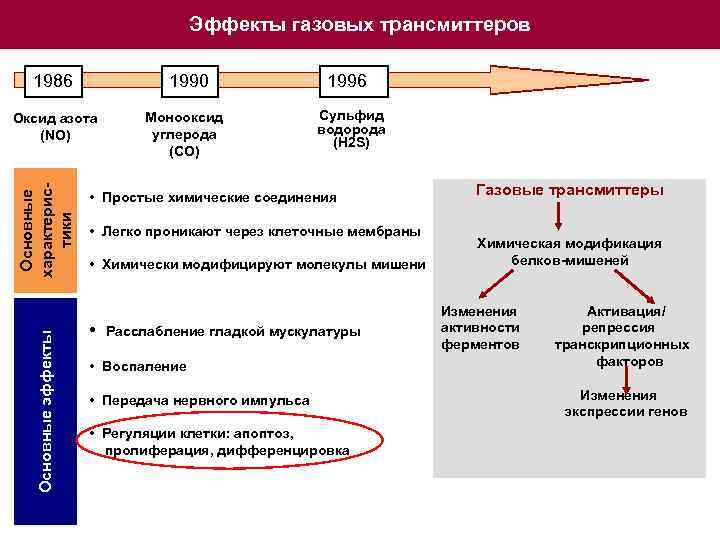 Эффекты газовых трансмиттеров 1986 1990 Основные эффекты Основные характеристики Оксид азота (NO) Монооксид углерода (СО) 1996 Сульфид водорода (H 2 S) • Простые химические соединения • Легко проникают через клеточные мембраны • Химически модифицируют молекулы мишени • Расслабление гладкой мускулатуры • Воспаление • Передача нервного импульса • Регуляции клетки: апоптоз, пролиферация, дифференцировка Газовые трансмиттеры Химическая модификация белков-мишеней Изменения Активация/ активности репрессия ферментов транскрипционных факторов Изменения экспрессии генов
Эффекты газовых трансмиттеров 1986 1990 Основные эффекты Основные характеристики Оксид азота (NO) Монооксид углерода (СО) 1996 Сульфид водорода (H 2 S) • Простые химические соединения • Легко проникают через клеточные мембраны • Химически модифицируют молекулы мишени • Расслабление гладкой мускулатуры • Воспаление • Передача нервного импульса • Регуляции клетки: апоптоз, пролиферация, дифференцировка Газовые трансмиттеры Химическая модификация белков-мишеней Изменения Активация/ активности репрессия ферментов транскрипционных факторов Изменения экспрессии генов
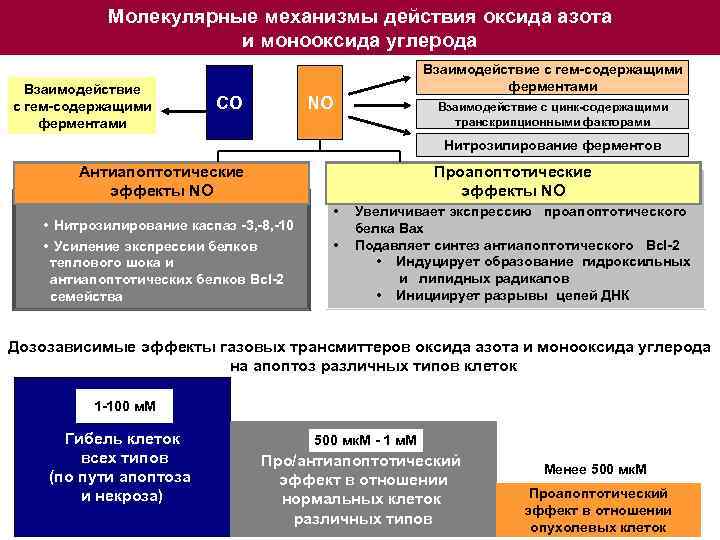 Молекулярные механизмы действия оксида азота и монооксида углерода Взаимодействие с гем-содержащими ферментами СО NO Взаимодействие с гем-содержащими ферментами Взаимодействие с цинк-содержащими транскрипционными факторами Нитрозилирование ферментов Антиапоптотические эффекты NO Проапоптотические эффекты NO • Нитрозилирование каспаз -3, -8, -10 • Усиление экспрессии белков теплового шока и антиапоптотических белков Bcl-2 семейства • Увеличивает экспрессию проапоптотического белка Вах • Подавляет синтез антиапоптотического Bcl-2 • Индуцирует образование гидроксильных и липидных радикалов • Инициирует разрывы цепей ДНК Дозозависимые эффекты газовых трансмиттеров оксида азота и монооксида углерода на апоптоз различных типов клеток 1 -100 м. М Гибель клеток всех типов (по пути апоптоза и некроза) 500 мк. М - 1 м. М Про/антиапоптотический эффект в отношении нормальных клеток различных типов Менее 500 мк. М Проапоптотический эффект в отношении опухолевых клеток
Молекулярные механизмы действия оксида азота и монооксида углерода Взаимодействие с гем-содержащими ферментами СО NO Взаимодействие с гем-содержащими ферментами Взаимодействие с цинк-содержащими транскрипционными факторами Нитрозилирование ферментов Антиапоптотические эффекты NO Проапоптотические эффекты NO • Нитрозилирование каспаз -3, -8, -10 • Усиление экспрессии белков теплового шока и антиапоптотических белков Bcl-2 семейства • Увеличивает экспрессию проапоптотического белка Вах • Подавляет синтез антиапоптотического Bcl-2 • Индуцирует образование гидроксильных и липидных радикалов • Инициирует разрывы цепей ДНК Дозозависимые эффекты газовых трансмиттеров оксида азота и монооксида углерода на апоптоз различных типов клеток 1 -100 м. М Гибель клеток всех типов (по пути апоптоза и некроза) 500 мк. М - 1 м. М Про/антиапоптотический эффект в отношении нормальных клеток различных типов Менее 500 мк. М Проапоптотический эффект в отношении опухолевых клеток
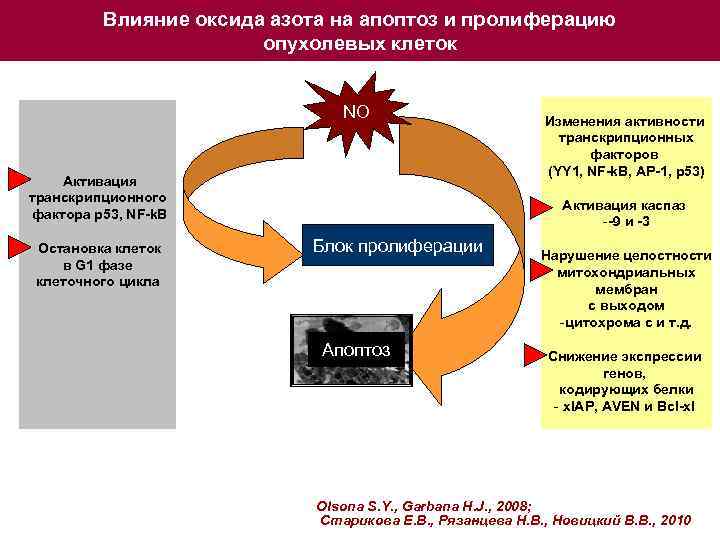 Влияние оксида азота на апоптоз и пролиферацию опухолевых клеток NO Активация транскрипционного фактора р53, NF-k. B Остановка клеток в G 1 фазе клеточного цикла Изменения активности транскрипционных факторов (YY 1, NF-k. B, AP-1, p 53) Активация каспаз --9 и -3 Блок пролиферации Апоптоз Нарушение целостности митохондриальных мембран с выходом -цитохрома с и т. д. Снижение экспрессии генов, кодирующих белки - x. IAP, AVEN и Bcl-xl Olsona S. Y. , Garbana H. J. , 2008; Старикова Е. В. , Рязанцева Н. В. , Новицкий В. В. , 2010
Влияние оксида азота на апоптоз и пролиферацию опухолевых клеток NO Активация транскрипционного фактора р53, NF-k. B Остановка клеток в G 1 фазе клеточного цикла Изменения активности транскрипционных факторов (YY 1, NF-k. B, AP-1, p 53) Активация каспаз --9 и -3 Блок пролиферации Апоптоз Нарушение целостности митохондриальных мембран с выходом -цитохрома с и т. д. Снижение экспрессии генов, кодирующих белки - x. IAP, AVEN и Bcl-xl Olsona S. Y. , Garbana H. J. , 2008; Старикова Е. В. , Рязанцева Н. В. , Новицкий В. В. , 2010
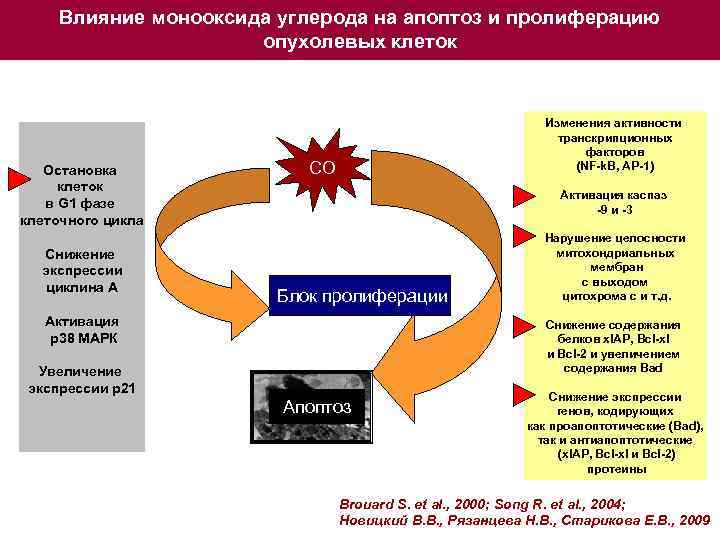 Влияние монооксида углерода на апоптоз и пролиферацию опухолевых клеток Остановка клеток в G 1 фазе клеточного цикла Снижение экспрессии циклина А Изменения активности транскрипционных факторов (NF-k. B, AP-1) СО Активация каспаз -9 и -3 Блок пролиферации Активация р38 МАРК Нарушение целосности митохондриальных мембран с выходом цитохрома с и т. д. Снижение содержания белков x. IAP, Bcl-xl и Bcl-2 и увеличением содержания Bad Увеличение экспрессии р21 Апоптоз Снижение экспрессии генов, кодирующих как проапоптотические (Bad), так и антиапоптотические (x. IAP, Bcl-xl и Bcl-2) протеины Brouard S. et al. , 2000; Song R. et al. , 2004; Новицкий В. В. , Рязанцева Н. В. , Старикова Е. В. , 2009
Влияние монооксида углерода на апоптоз и пролиферацию опухолевых клеток Остановка клеток в G 1 фазе клеточного цикла Снижение экспрессии циклина А Изменения активности транскрипционных факторов (NF-k. B, AP-1) СО Активация каспаз -9 и -3 Блок пролиферации Активация р38 МАРК Нарушение целосности митохондриальных мембран с выходом цитохрома с и т. д. Снижение содержания белков x. IAP, Bcl-xl и Bcl-2 и увеличением содержания Bad Увеличение экспрессии р21 Апоптоз Снижение экспрессии генов, кодирующих как проапоптотические (Bad), так и антиапоптотические (x. IAP, Bcl-xl и Bcl-2) протеины Brouard S. et al. , 2000; Song R. et al. , 2004; Новицкий В. В. , Рязанцева Н. В. , Старикова Е. В. , 2009
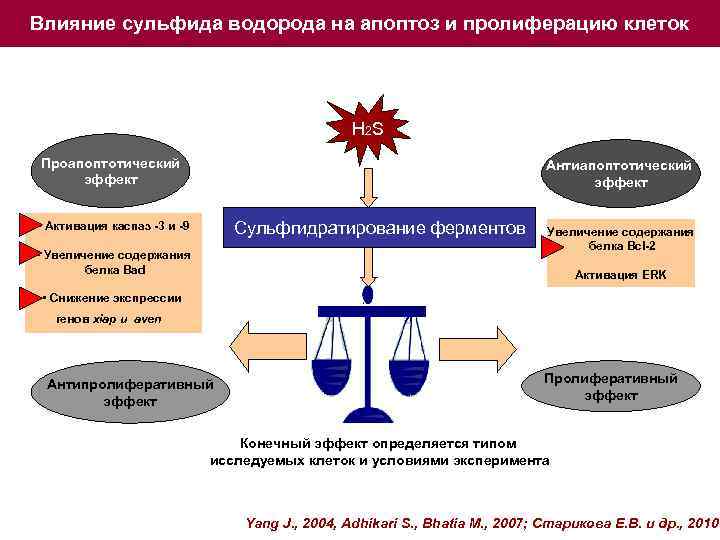 Влияние сульфида водорода на апоптоз и пролиферацию клеток H 2 S Проапоптотический эффект Антиапоптотический эффект Сульфгидратирование ферментов • Активация каспаз -3 и -9 • Увеличение содержания белка Bad Увеличение содержания белка Bcl-2 Активация ERK • Снижение экспрессии генов xiap и aven Антипролиферативный эффект Пролиферативный эффект Конечный эффект определяется типом исследуемых клеток и условиями эксперимента Yang J. , 2004, Adhikari S. , Bhatia M. , 2007; Старикова Е. В. и др. , 2010
Влияние сульфида водорода на апоптоз и пролиферацию клеток H 2 S Проапоптотический эффект Антиапоптотический эффект Сульфгидратирование ферментов • Активация каспаз -3 и -9 • Увеличение содержания белка Bad Увеличение содержания белка Bcl-2 Активация ERK • Снижение экспрессии генов xiap и aven Антипролиферативный эффект Пролиферативный эффект Конечный эффект определяется типом исследуемых клеток и условиями эксперимента Yang J. , 2004, Adhikari S. , Bhatia M. , 2007; Старикова Е. В. и др. , 2010
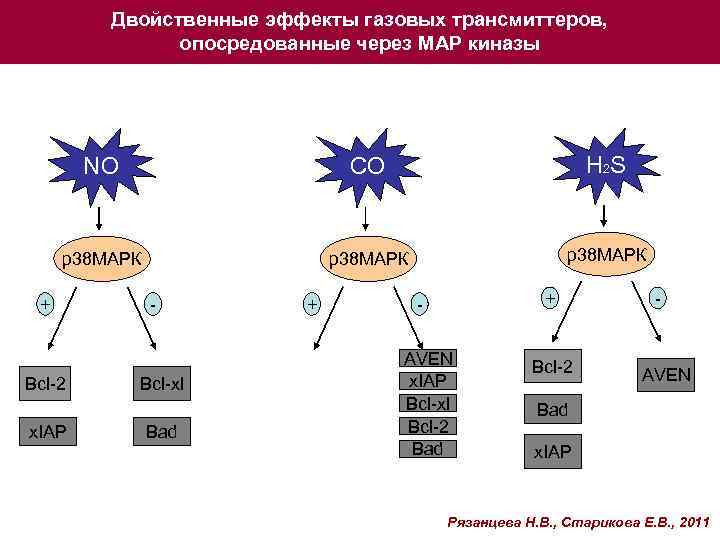 Двойственные эффекты газовых трансмиттеров, опосредованные через МАР киназы NO CO H 2 S р38 МАРК + Bcl-2 x. IAP - Bcl-xl Bad + + AVEN x. IAP Bcl-xl Bcl-2 Bad Bcl-2 - AVEN Bad x. IAP Рязанцева Н. В. , Старикова Е. В. , 2011
Двойственные эффекты газовых трансмиттеров, опосредованные через МАР киназы NO CO H 2 S р38 МАРК + Bcl-2 x. IAP - Bcl-xl Bad + + AVEN x. IAP Bcl-xl Bcl-2 Bad Bcl-2 - AVEN Bad x. IAP Рязанцева Н. В. , Старикова Е. В. , 2011
 Реализация проектов Приоритетные результаты Заключение по разделу «Апоптоз и внутриклеточные газовые трансмиттеры» : • Внутриклеточные газовые трансмиттеры NO, CO и H 2 S следует рассматривать в качестве внутриклеточных регуляторов летальной программы клеток, проявляющих дозозависимый эффект, а также двойственность эффекта (угнетение/индукция апоптоза) в зависимости от функциональных свойств клетки • Внутриклеточные газовые трансмиттеры реализуют свое проапоптотическое действие через различные молекулярные пути регуляции программированной гибели: NO – через митохондриальный путь, H 2 S – через рецепторный и митохондриальный путь, СО – как через митохондриальный, так и через рецепторный • ФЦП "Научные и научно-педагогические кадры …. » , «Селективная модуляция внутриклеточной коммуникации как основа молекулярных технологий управления функциями клеток» (ГК 14. 740. 11. 0932) • ФЦП "Научные и научно-педагогические кадры …. » , «Роль внутриклеточных газовых трансмиттеров в регуляции гомеостаза клетки» (ГК П 1311) • ФЦП "Научные и научно-педагогические кадры …. » , «Разработка технологической платформы молекулярной диагностики и лечения социально значимых заболеваний и подготовка на ее основе научноисследовательских кадров для молекулярной медицины» (ГК № 02. 740. 11. 0311)
Реализация проектов Приоритетные результаты Заключение по разделу «Апоптоз и внутриклеточные газовые трансмиттеры» : • Внутриклеточные газовые трансмиттеры NO, CO и H 2 S следует рассматривать в качестве внутриклеточных регуляторов летальной программы клеток, проявляющих дозозависимый эффект, а также двойственность эффекта (угнетение/индукция апоптоза) в зависимости от функциональных свойств клетки • Внутриклеточные газовые трансмиттеры реализуют свое проапоптотическое действие через различные молекулярные пути регуляции программированной гибели: NO – через митохондриальный путь, H 2 S – через рецепторный и митохондриальный путь, СО – как через митохондриальный, так и через рецепторный • ФЦП "Научные и научно-педагогические кадры …. » , «Селективная модуляция внутриклеточной коммуникации как основа молекулярных технологий управления функциями клеток» (ГК 14. 740. 11. 0932) • ФЦП "Научные и научно-педагогические кадры …. » , «Роль внутриклеточных газовых трансмиттеров в регуляции гомеостаза клетки» (ГК П 1311) • ФЦП "Научные и научно-педагогические кадры …. » , «Разработка технологической платформы молекулярной диагностики и лечения социально значимых заболеваний и подготовка на ее основе научноисследовательских кадров для молекулярной медицины» (ГК № 02. 740. 11. 0311)
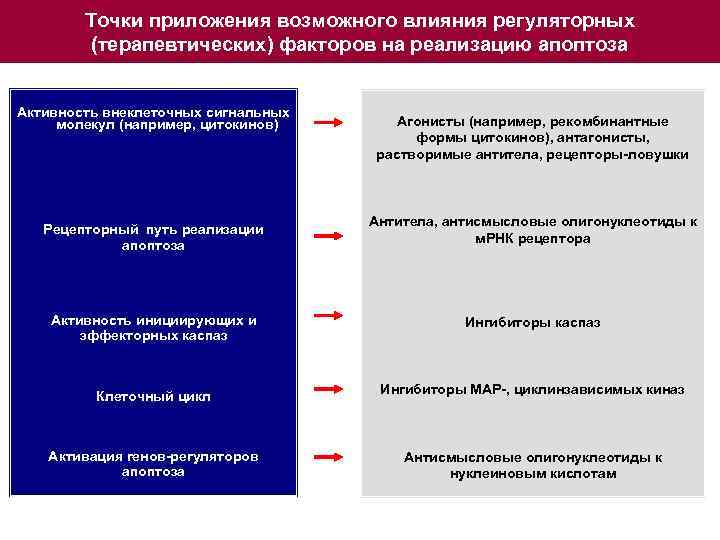 Точки приложения возможного влияния регуляторных (терапевтических) факторов на реализацию апоптоза Активность внеклеточных сигнальных молекул (например, цитокинов) Рецепторный путь реализации апоптоза Агонисты (например, рекомбинантные формы цитокинов), антагонисты, растворимые антитела, рецепторы-ловушки Антитела, антисмысловые олигонуклеотиды к м. РНК рецептора Активность инициирующих и эффекторных каспаз Ингибиторы каспаз Клеточный цикл Ингибиторы МАР-, циклинзависимых киназ Активация генов-регуляторов апоптоза Антисмысловые олигонуклеотиды к нуклеиновым кислотам
Точки приложения возможного влияния регуляторных (терапевтических) факторов на реализацию апоптоза Активность внеклеточных сигнальных молекул (например, цитокинов) Рецепторный путь реализации апоптоза Агонисты (например, рекомбинантные формы цитокинов), антагонисты, растворимые антитела, рецепторы-ловушки Антитела, антисмысловые олигонуклеотиды к м. РНК рецептора Активность инициирующих и эффекторных каспаз Ингибиторы каспаз Клеточный цикл Ингибиторы МАР-, циклинзависимых киназ Активация генов-регуляторов апоптоза Антисмысловые олигонуклеотиды к нуклеиновым кислотам
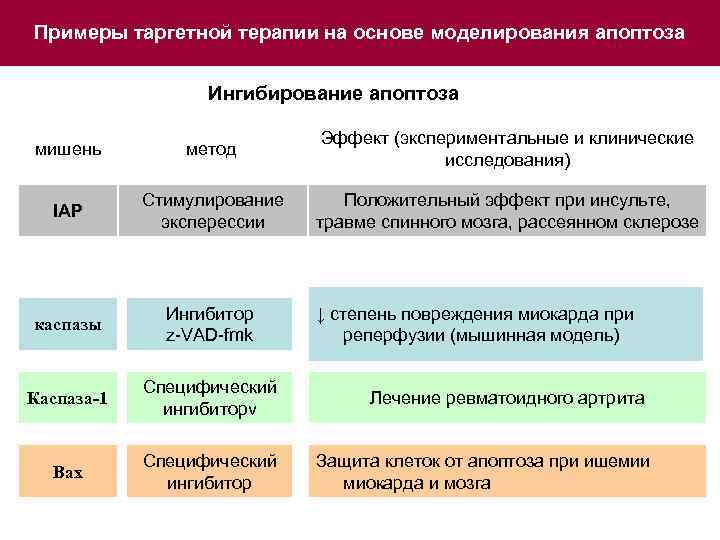 Примеры таргетной терапии на основе моделирования апоптоза Ингибирование апоптоза мишень метод Эффект (экспериментальные и клинические исследования) IAP Стимулирование эксперессии Положительный эффект при инсульте, травме спинного мозга, рассеянном склерозе каспазы Ингибитор z-VAD-fmk Каспаза-1 Специфический ингибиторv Bax Специфический ингибитор ↓ степень повреждения миокарда при реперфузии (мышинная модель) Лечение ревматоидного артрита Защита клеток от апоптоза при ишемии миокарда и мозга
Примеры таргетной терапии на основе моделирования апоптоза Ингибирование апоптоза мишень метод Эффект (экспериментальные и клинические исследования) IAP Стимулирование эксперессии Положительный эффект при инсульте, травме спинного мозга, рассеянном склерозе каспазы Ингибитор z-VAD-fmk Каспаза-1 Специфический ингибиторv Bax Специфический ингибитор ↓ степень повреждения миокарда при реперфузии (мышинная модель) Лечение ревматоидного артрита Защита клеток от апоптоза при ишемии миокарда и мозга
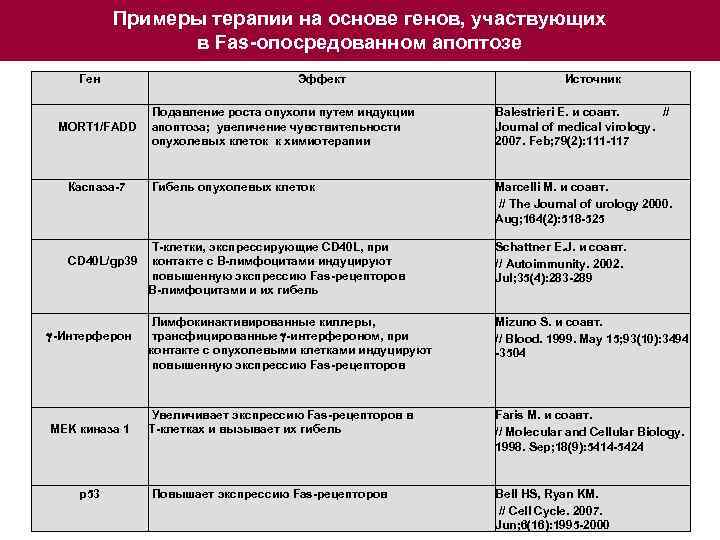 Примеры терапии на основе генов, участвующих в Fas-опосредованном апоптозе Ген Эффект Источник Подавление роста опухоли путем индукции MORT 1/FADD апоптоза; увеличение чувствительности опухолевых клеток к химиотерапии Balestrieri E. и соавт. // Journal of medical virology. 2007. Feb; 79(2): 111 -117 Каспаза-7 Marcelli M. и соавт. // The Journal of urology 2000. Aug; 164(2): 518 -525 Гибель опухолевых клеток Т-клетки, экспрессирующие CD 40 L, при CD 40 L/gp 39 контакте с В-лимфоцитами индуцируют повышенную экспрессию Fas-рецепторов В-лимфоцитами и их гибель -Интерферон MEK киназа 1 p 53 Schattner E. J. и соавт. // Autoimmunity. 2002. Jul; 35(4): 283 -289 Лимфокинактивированные киллеры, трансфицированные -интерфероном, при контакте с опухолевыми клетками индуцируют повышенную экспрессию Fas-рецепторов Mizuno S. и соавт. // Blood. 1999. May 15; 93(10): 3494 -3504 Увеличивает экспрессию Fas-рецепторов в Т-клетках и вызывает их гибель Faris M. и соавт. // Molecular and Cellular Biology. 1998. Sep; 18(9): 5414 -5424 Повышает экспрессию Fas-рецепторов Bell HS, Ryan KM. // Cell Cycle. 2007. Jun; 6(16): 1995 -2000
Примеры терапии на основе генов, участвующих в Fas-опосредованном апоптозе Ген Эффект Источник Подавление роста опухоли путем индукции MORT 1/FADD апоптоза; увеличение чувствительности опухолевых клеток к химиотерапии Balestrieri E. и соавт. // Journal of medical virology. 2007. Feb; 79(2): 111 -117 Каспаза-7 Marcelli M. и соавт. // The Journal of urology 2000. Aug; 164(2): 518 -525 Гибель опухолевых клеток Т-клетки, экспрессирующие CD 40 L, при CD 40 L/gp 39 контакте с В-лимфоцитами индуцируют повышенную экспрессию Fas-рецепторов В-лимфоцитами и их гибель -Интерферон MEK киназа 1 p 53 Schattner E. J. и соавт. // Autoimmunity. 2002. Jul; 35(4): 283 -289 Лимфокинактивированные киллеры, трансфицированные -интерфероном, при контакте с опухолевыми клетками индуцируют повышенную экспрессию Fas-рецепторов Mizuno S. и соавт. // Blood. 1999. May 15; 93(10): 3494 -3504 Увеличивает экспрессию Fas-рецепторов в Т-клетках и вызывает их гибель Faris M. и соавт. // Molecular and Cellular Biology. 1998. Sep; 18(9): 5414 -5424 Повышает экспрессию Fas-рецепторов Bell HS, Ryan KM. // Cell Cycle. 2007. Jun; 6(16): 1995 -2000
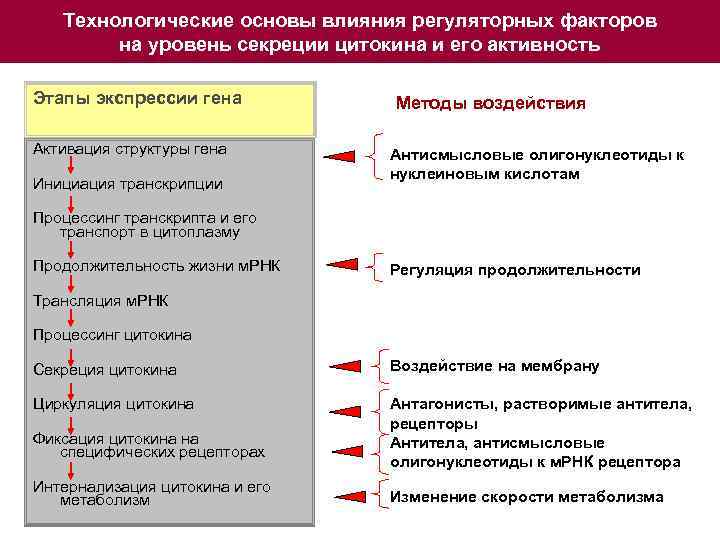 Технологические основы влияния регуляторных факторов на уровень секреции цитокина и его активность Этапы экспрессии гена Активация структуры гена Инициация транскрипции Методы воздействия Антисмысловые олигонуклеотиды к нуклеиновым кислотам Процессинг транскрипта и его транспорт в цитоплазму Продолжительность жизни м. РНК Регуляция продолжительности Трансляция м. РНК Процессинг цитокина Секреция цитокина Воздействие на мембрану Циркуляция цитокина Антагонисты, растворимые антитела, рецепторы Антитела, антисмысловые олигонуклеотиды к м. РНК рецептора Фиксация цитокина на специфических рецепторах Интернализация цитокина и его метаболизм Изменение скорости метаболизма
Технологические основы влияния регуляторных факторов на уровень секреции цитокина и его активность Этапы экспрессии гена Активация структуры гена Инициация транскрипции Методы воздействия Антисмысловые олигонуклеотиды к нуклеиновым кислотам Процессинг транскрипта и его транспорт в цитоплазму Продолжительность жизни м. РНК Регуляция продолжительности Трансляция м. РНК Процессинг цитокина Секреция цитокина Воздействие на мембрану Циркуляция цитокина Антагонисты, растворимые антитела, рецепторы Антитела, антисмысловые олигонуклеотиды к м. РНК рецептора Фиксация цитокина на специфических рецепторах Интернализация цитокина и его метаболизм Изменение скорости метаболизма
 Молекулярные мишени управления апоптозом, пролиферацией и дифференцировкой клеток: роль внутриклеточных и внеклеточных сигнальных систем Благодарю за внимание!
Молекулярные мишени управления апоптозом, пролиферацией и дифференцировкой клеток: роль внутриклеточных и внеклеточных сигнальных систем Благодарю за внимание!
 Глобальные приоритеты научно-технологического развития молекулярной медицины
Глобальные приоритеты научно-технологического развития молекулярной медицины
 Сиб. ГМУ – крупный научно-образовательно-клинический комплекс России 4 место в рейтинге медицинских вузов России в течение последних 6 лет Сиб. ГМУ имеет развитую инновационную инфраструктуру • 8 факультетов, в т. ч. уникальный медико-биологический факультет, 75 кафедр, 2 НИИ, 8 НОЦ, собственные многопрофильные клиники на 830 коек • 4343 студентов, ежегодно проходят обучение 5000 врачей (по 59 специальностям, 115 программам общего и тематического усовершенствования и профессиональной переподготовки). 70% обучающихся – жители других регионов России и зарубежья 20 • Свыше 80% профессорскопреподавательского состава имеют ученые степени и звания (375 докторов наук); 28 • Из Сиб. ГМУ выделились 4 НИИ СО РАМН, где расположены базовые кафедры вуза • Лидер среди медицинских вузов РФ по числу научно-технологических проектов, реализованных в рамках ФЦП (более 40 проектов) 13, 8 Единственный медицинский вуз России, дважды вошедший в финал конкурса НИУ (2009 г. , 2010 г. ) • Центр трансфера технологий • Внедренческий центр Приоритетные направления развития • Молекулярная медицина • Полифункциональные материалы медицинского назначения и регенеративная медицина • Медицинские приборы и информационные системы • Инновационные лекарственные средства • Ядерная медицина • 8 НОЦ междисциплинарной направленности: НОЦ молекулярной медицины, НОЦ биосовместимых материалов и биоинженерии, НОЦ экспериментальной и клинической иммуногенетики, НОЦ ядерной медицины, НОЦ фармации и фармакологии, НОЦ инновационных технологий в морфологии, НОЦ лазерных технологий в медицинской диагностике) • Отдел инновационных проектов и программ • Центр инновационных образовательных технологий и программ • Отдел стратегического планирования и экспертноаналитического обеспечения Сиб. ГМУ - координатор технологической платформы «Медицина будущего»
Сиб. ГМУ – крупный научно-образовательно-клинический комплекс России 4 место в рейтинге медицинских вузов России в течение последних 6 лет Сиб. ГМУ имеет развитую инновационную инфраструктуру • 8 факультетов, в т. ч. уникальный медико-биологический факультет, 75 кафедр, 2 НИИ, 8 НОЦ, собственные многопрофильные клиники на 830 коек • 4343 студентов, ежегодно проходят обучение 5000 врачей (по 59 специальностям, 115 программам общего и тематического усовершенствования и профессиональной переподготовки). 70% обучающихся – жители других регионов России и зарубежья 20 • Свыше 80% профессорскопреподавательского состава имеют ученые степени и звания (375 докторов наук); 28 • Из Сиб. ГМУ выделились 4 НИИ СО РАМН, где расположены базовые кафедры вуза • Лидер среди медицинских вузов РФ по числу научно-технологических проектов, реализованных в рамках ФЦП (более 40 проектов) 13, 8 Единственный медицинский вуз России, дважды вошедший в финал конкурса НИУ (2009 г. , 2010 г. ) • Центр трансфера технологий • Внедренческий центр Приоритетные направления развития • Молекулярная медицина • Полифункциональные материалы медицинского назначения и регенеративная медицина • Медицинские приборы и информационные системы • Инновационные лекарственные средства • Ядерная медицина • 8 НОЦ междисциплинарной направленности: НОЦ молекулярной медицины, НОЦ биосовместимых материалов и биоинженерии, НОЦ экспериментальной и клинической иммуногенетики, НОЦ ядерной медицины, НОЦ фармации и фармакологии, НОЦ инновационных технологий в морфологии, НОЦ лазерных технологий в медицинской диагностике) • Отдел инновационных проектов и программ • Центр инновационных образовательных технологий и программ • Отдел стратегического планирования и экспертноаналитического обеспечения Сиб. ГМУ - координатор технологической платформы «Медицина будущего»
 Научно-образовательный центр молекулярной медицины Сиб. ГМУ НОЦ молекулярной медицины создан в 2005 г. и сегодня имеет развитую инфраструктуру (секторы клеточных исследований, молекулярных основ патологии клетки, генетических исследований). Приоритет – выполнение комплексных проектов в области разработки молекулярных технологий диагностики и лечения социально значимых заболеваний Разработаны и внедрены программы дополнительной элитной подготовки студентов врачебных факультетов (модуль фундаментальных медикобиологических наук, клинический модуль, модуль формирования проектных компетенций), программы обучения студентов и интернов по лабораторной медицине Сибирский государственный медицинский университет На базе НОЦ молекулярной медицины реализованы 28 проектов федерального уровня (из них – 22 проекта в рамках ФЦП), опубликованы 10 монографий, свыше 180 статей в центральных журналах Приоритет НОЦ молекулярной медицины – подготовка исследовательских кадров из числа выпускников МБФ Сиб. ГМУ (подготовлены – 7 докторов наук (из них 5 в возрасте 29 -30 лет), 33 кандидата наук (из них 15 в возрасте до 30 лет), более 50 дипломных и курсовых работ) 51
Научно-образовательный центр молекулярной медицины Сиб. ГМУ НОЦ молекулярной медицины создан в 2005 г. и сегодня имеет развитую инфраструктуру (секторы клеточных исследований, молекулярных основ патологии клетки, генетических исследований). Приоритет – выполнение комплексных проектов в области разработки молекулярных технологий диагностики и лечения социально значимых заболеваний Разработаны и внедрены программы дополнительной элитной подготовки студентов врачебных факультетов (модуль фундаментальных медикобиологических наук, клинический модуль, модуль формирования проектных компетенций), программы обучения студентов и интернов по лабораторной медицине Сибирский государственный медицинский университет На базе НОЦ молекулярной медицины реализованы 28 проектов федерального уровня (из них – 22 проекта в рамках ФЦП), опубликованы 10 монографий, свыше 180 статей в центральных журналах Приоритет НОЦ молекулярной медицины – подготовка исследовательских кадров из числа выпускников МБФ Сиб. ГМУ (подготовлены – 7 докторов наук (из них 5 в возрасте 29 -30 лет), 33 кандидата наук (из них 15 в возрасте до 30 лет), более 50 дипломных и курсовых работ) 51


